فلز قلوي
| هذه المقالة جزء من سلسلة |
| الكيمياء |
|---|
 |
| بوابة |
الفلزات القلوية
| مجموعة | 1 |
| دورة | |
| 2 | 3 Li |
| 3 | 11 Na |
| 4 | 19 K |
| 5 | 37 Rb |
| 6 | 55 Cs |
| 7 | 87 Fr |
الفلزات القلوية هي سلسلة كيميائية للعناصر الموجودة في المجموعة الأولى في الجدول الدوري، باستثناء الهيدروجين وهي : ليثيوم، صوديوم، بوتاسيوم، روبيديوم، سيزيوم، فرنسيوم. وكل هذه العناصر نشيطة كيميائيا ولذا فمن النادر وجود أي عنصر منها في حالته المفردة، فغالباً ما تحفظ في الزيوت المعدنية أوالكيروسين كي لا تتفاعل مع الهواء.[1]
الفلزات القلوية لها لون فضي وهي صلبة كما أنها ذات كثافة قليلة، وتتفاعل بشدة مع الهالوجينات لتكوين ملح أيونى، وتتفاعل مع الماء لتكوين هيدروكسيد قلوي (قاعدي)، ولكن لا يكون ذلك إلا بعد تفجرات عنيفة!. ويكون لكل عناصر هذه السلسة إلكترون في غلافها الخارجي، ولذا فإنها تصل إلى وضع الطاقة الأفضل لها بغلاف إلكتروني ممتلئ عن طريق فقد إلكترون لتكوين أيون له شحنة موجبة قيمتها 1.
تتكون الفلزات القلوية من العناصر الكيميائية الليثيوم (Li) والصوديوم (Na) والبوتاسيوم (K) ، [note 1] الروبيديوم (Rb) والسيزيوم (Cs) ، [note 2] والفرانسيوم (Fr). يشكلون مع الهيدروجين المجموعة 1 ، [note 3] التي تقع في الكتلة s في الجدول الدوري . جميع المعادن القلوية لها إلكترون خارجي في مدار s : ينتج عن هذا التكوين الإلكتروني المشترك وجود خصائص مميزة لها متشابهة جدًا. [note 4] الواقع، تقدم الفلزات القلوية أفضل مثال لاتجاهات المجموعة في الخصائص في الجدول الدوري، مع العناصر التي تظهر سلوكًا متماثلًا متميزًا جيدًا. تُعرف عائلة العناصر هذه أيضًا باسم عائلة الليثيوم بعد
عنصرها الرئيسي.
خصائصها:
جميع المعادن القلوية هي معادن لامعة ولينة وعالية التفاعل عند درجة حرارة وضغط قياسيين وتفقد بسهولة إلكترونها الخارجي لتكوين الأيونات الموجبة (الكيتونات) بشحنة +1. يمكن قطعها جميعًا بسهولة بالسكين نظرًا لنعومتها، مما يؤدي إلى تعريض السطح اللامع الذي يشوه بسرعة في الهواء بسبب الأكسدة بفعل الرطوبة والأكسجين في الغلاف الجوي (وفي حالة الليثيوم والنيتروجين ).
بسبب تفاعلها العالي، يجب تخزينها تحت الزيت لمنع التفاعل مع الهواء، وتوجد بشكل طبيعي في الأملاح فقط وليس كعناصر حرة. السيزيوم، خامس فلز قلوي، هو الأكثر تفاعلًا بين جميع المعادن. تتفاعل جميع الفلزات القلوية مع الماء، حيث تتفاعل المعادن القلوية الأثقل بقوة أكبر من المعادن الأخف.
توجد جميع المعادن القلوية المكتشفة في الطبيعة كمركباتها: بترتيب الوفرة ، يكون الصوديوم هو الأكثر وفرة، يليه البوتاسيوم والليثيوم والروبيديوم والسيزيوم وأخيراً الفرانسيوم، وهو نادر جدًا بسبب نشاطه الإشعاعي العالي للغاية ؛ يحدث الفرانسيوم فقط في آثار دقيقة في الطبيعة كخطوة وسيطة في بعض الفروع الجانبية الغامضة لسلاسل الانحلال الطبيعي. تم إجراء تجارب لمحاولة توليف ununennial (Uue) ، والتي من المحتمل أن تكون العضو التالي في المجموعة ؛ لا شيء كان ناجحا. ومع ذلك، قد لا تكون الفترة الزمنية من الفلزات القلوية بسبب التأثيرات النسبية ، والتي من المتوقع أن يكون لها تأثير كبير على الخصائص الكيميائية للعناصر فائقة الثقل ؛ حتى لو تبين أنه معدن قلوي، فمن المتوقع أن يكون له بعض الاختلافات في الخصائص الفيزيائية والكيميائية من متماثلاته الأخف وزناً.
معظم المعادن القلوية لها العديد من التطبيقات المختلفة. أحد أشهر تطبيقات العناصر النقية هو استخدام الروبيديوم والسيزيوم في الساعات الذرية ، والتي تشكل الساعات الذرية للسيزيوم أساس الثانية . أحد التطبيقات الشائعة لمركبات الصوديوم هو مصباح بخار الصوديوم ، الذي ينبعث منه الضوء بكفاءة عالية. يستخدم ملح الطعام أو كلوريد الصوديوم منذ العصور القديمة. يستخدم الليثيوم كدواء نفسي وكأنود في بطاريات الليثيوم . الصوديوم والبوتاسيوم عنصران أساسيان أيضًا، ولهما أدوار بيولوجية رئيسية مثل الإلكتروليتات ، وعلى الرغم من أن المعادن القلوية الأخرى ليست ضرورية، إلا أن لها أيضًا تأثيرات مختلفة على الجسم، مفيدة وضارة.
الهيدروجين:
عنصر الهيدروجين بإلكترونه الوحيد يوضع في أعلى المجموعة الأولى ولكنه ليس من الفلزات، بالإضافة إلى أنه يوجد في الطبيعة على هيئة غاز ثنائى الذرة. ولإزالة إلكترون الهيدروجين الخارجى يلزم كمية من الطاقة أكبر من الكمية اللازمة لتحريك الإلكترون الخارجي للفلزات. والهيدروجين يماثل الهالوجينات في أنه يحتاج إلى إلكترون لملئ غلاف الطاقة الخارجي له، وعلى هذا فيمكن اعتبار أن الهيدروجين يتصرف مثل الهالوجينات في بعض الظروف وينتج من ذلك شاردة (أيون) الهيدريد.وقد تم تحضير بعض المركبات من الهيدريدات وبعض الفلزات القلوية.تحت ظروف الضغط العالية مثل التي توجد في داخل كوكب المشتري، يمكن للهيدروجين أن يكون في صورة معدنية ويتصرف مثل الفلزات القلوية، راجع الهيدروجين المعدني.
التاريخ


مركبات الصوديوم معروفة منذ العصور القديمة. كان الملح ( كلوريد الصوديوم ) سلعة مهمة في الأنشطة البشرية، كما تشهد بذلك الكلمة الإنجليزية راتب ، في إشارة إلى salarium ، وهو المال الذي يدفع للجنود الرومان لشراء الملح.[6] بينما تم استخدام البوتاس منذ العصور القديمة، لم يكن مفهومًا في معظم تاريخه على أنه مادة مختلفة اختلافًا جوهريًا عن أملاح الصوديوم المعدنية. حصل جورج إرنست ستال على أدلة تجريبية أدت به إلى اقتراح الاختلاف الأساسي بين أملاح الصوديوم والبوتاسيوم في عام 1702 ، [7] وتمكن هنري لويس دوهاميل دو مونسو من إثبات هذا الاختلاف في عام 1736.[8] التركيب الكيميائي الدقيق للمركبات البوتاسيوم والصوديوم، والحالة ك عنصر كيميائي من البوتاسيوم والصوديوم، لم يعرف بعد، وبالتالي أنطوان لافوازييه لم تتضمن أي القلوي في قائمته من العناصر الكيميائية في 1789.[9][10]
تم عزل البوتاسيوم النقي لأول مرة في عام 1807 في إنجلترا بواسطة همفري ديفي ، الذي اشتقه من البوتاس الكاوية (KOH ، هيدروكسيد البوتاسيوم) باستخدام التحليل الكهربائي للملح المصهور مع الكومة الفولتية المبتكرة حديثًا. كانت المحاولات السابقة للتحليل الكهربائي للملح المائي غير ناجحة بسبب تفاعل البوتاسيوم الشديد.[11] :68 كان البوتاسيوم هو أول معدن يتم عزله بواسطة التحليل الكهربائي.[12] في وقت لاحق من نفس العام، أبلغ ديفي عن استخلاص الصوديوم من مادة مماثلة للصودا الكاوية (هيدروكسيد الصوديوم، الغسول) بتقنية مماثلة، مما يدل على أن العناصر، وبالتالي الأملاح، مختلفة.[9][10][13][14]

تم اكتشاف Petalite ( Li Al Si 4 O 10 ) في عام 1800 من قبل الكيميائي البرازيلي José Bonifácio de Andrada في منجم في جزيرة أوتو ، السويد .[15][16][17] ومع ذلك، لم يكن حتى عام 1817 أن اكتشف يوهان أوغست أرفويدسون ، الذي كان يعمل في مختبر الكيميائي يونس جاكوب برزيليوس ، وجود عنصر جديد أثناء تحليل خام البتلات.[18][19] وقد لاحظ أن هذا العنصر الجديد يشكل مركبات مماثلة لتلك الموجودة في الصوديوم والبوتاسيوم، على الرغم من أن كربوناته وهيدروكسيده كانا أقل قابلية للذوبان في الماء وأكثر قلوية من المعادن القلوية الأخرى.[20] أعطى Berzelius المادة غير المعروفة اسم " lithion / lithina " ، من الكلمة اليونانية λιθoς (المترجمة إلى lithos ، بمعنى "الحجر") ، لتعكس اكتشافها في معدن صلب، على عكس البوتاسيوم، الذي تم اكتشافه في رماد النبات، والصوديوم، الذي كان معروفًا جزئيًا بوفرة عالية في دم الحيوان. أطلق على المعدن داخل المادة " الليثيوم ".[16][19][21] كان الليثيوم والصوديوم والبوتاسيوم جزءًا من اكتشاف الدورية ، حيث أنهم من بين سلسلة من ثلاثيات من العناصر في نفس المجموعة التي لاحظها يوهان فولفجانج دوبرينير في عام 1850 على أنها ذات خصائص متشابهة.[22]

كان الروبيديوم والسيزيوم أول العناصر التي تم اكتشافها باستخدام مطياف ، اخترعها روبرت بنسن وجوستاف كيرشوف عام 1859.[23] في العام التالي، اكتشفوا السيزيوم في المياه المعدنية من باد دوركهايم ، ألمانيا. جاء اكتشافهم للروبيديوم في العام التالي في مدينة هايدلبرغ بألمانيا، حيث وجدوه في معدن الليبيدوليت .[24] تأتي أسماء الروبيديوم والسيزيوم من أبرز الخطوط في أطياف الانبعاث : خط أحمر لامع للروبيديوم (من الكلمة اللاتينية روبيديوس وتعني الأحمر الداكن أو الأحمر الفاتح) ، وخط أزرق سماوي للسيزيوم (مشتق من الكلمة اللاتينية rubidus ). كلمة لاتينية قيصرية وتعني السماء الزرقاء).[25][26]
حوالي عام 1865 أنتج جون نيولاندز سلسلة من الأوراق حيث سرد العناصر من أجل زيادة الوزن الذري والخصائص الفيزيائية والكيميائية المماثلة التي تكررت على فترات من ثمانية ؛ لقد شبه مثل هذه الدورية بأوكتاف الموسيقى، حيث تحتوي النوتات الأوكتاف على وظائف موسيقية مماثلة.[27][28] وضعت نسخته جميع الفلزات القلوية المعروفة آنذاك (الليثيوم إلى السيزيوم) ، بالإضافة إلى النحاس والفضة والثاليوم (التي تظهر خاصية حالة الأكسدة +1 المميزة للمعادن القلوية) ، معًا في مجموعة. وضعت طاولته الهيدروجين مع الهالوجينات .[22]
بعد عام 1869 ، اقترح ديمتري مندليف جدوله الدوري بوضع الليثيوم في أعلى مجموعة تحتوي على الصوديوم والبوتاسيوم والروبيديوم والسيزيوم والثاليوم.[29] بعد ذلك بعامين، راجع مندليف جدوله، ووضع الهيدروجين في المجموعة 1 فوق الليثيوم، وكذلك نقل الثاليوم إلى مجموعة البورون . في إصدار 1871 هذا، تم وضع النحاس والفضة والذهب مرتين، مرة كجزء من المجموعة IB ، ومرة واحدة كجزء من "المجموعة الثامنة" التي تشمل مجموعات اليوم من 8 إلى 11.[30] [note 5] بعد إدخال الجدول المكون من 18 عمودًا، تم نقل عناصر المجموعة IB إلى موضعها الحالي في الكتلة d ، بينما تُركت الفلزات القلوية في المجموعة IA . في وقت لاحق تم تغيير اسم المجموعة إلى المجموعة 1 في عام 1988. يأتي الاسم التافه "الفلزات القلوية" من حقيقة أن هيدروكسيدات عناصر المجموعة 1 كلها قلويات قوية عندما تذوب في الماء.[31]
كان هناك ما لا يقل عن أربعة اكتشافات خاطئة وغير كاملة [32][33][34][35] قبل أن تكتشف مارغريت بيري من معهد كوري في باريس بفرنسا الفرانسيوم في عام 1939 عن طريق تنقية عينة من الأكتينيوم 227 ، والتي تم الإبلاغ عنها إلى لديها طاقة اضمحلال 220 keV . ومع ذلك، لاحظ بيري وجود جسيمات تحلل ذات مستوى طاقة أقل من 80 keV. اعتقد بيري أن نشاط الاضمحلال هذا قد يكون ناتجًا عن منتج تسوس غير معروف سابقًا، منتج تم فصله أثناء التنقية، ولكنه ظهر مرة أخرى من الأكتينيوم النقي -227. قضت الاختبارات المختلفة على احتمال أن يكون العنصر غير المعروف هو الثوريوم أو الراديوم أو الرصاص أو البزموت أو الثاليوم . أظهر المنتج الجديد خصائص كيميائية لمعدن قلوي (مثل الترسيب المشترك مع أملاح السيزيوم) ، مما دفع بيري للاعتقاد بأنه العنصر 87 ، الناجم عن تحلل ألفا للأكتينيوم 227.[36] ثم حاول بيري تحديد نسبة تسوس بيتا إلى تسوس ألفا في الأكتينيوم 227. وضع اختبارها الأول تفرع ألفا عند 0.6٪، وهو رقم راجعته لاحقًا إلى 1٪.[37]
22789Ac α (1.38%)→21.77 y 22387Fr β−→22 min 22388Ra α→11.4 d21986Rn
العنصر التالي أدناه الفرانسيوم ( ايكا أن -francium) في الجدول الدوري يكون ununennium (UUE)، العنصر 119.[38] :1729–1730 تمت محاولة توليف ununennial لأول مرة في عام 1985 عن طريق قصف هدف einsteinium -254 مع أيونات الكالسيوم -48 في معجل superHILAC في بيركلي، كاليفورنيا. لم يتم تحديد أي ذرات، مما أدى إلى عائد محدود قدره 300 ن .[39][40]
- 25499Es + 4820Ca → 302119Uue* → no atoms[note 6]
من المستبعد جدًا [39] أن يكون رد الفعل هذا قادرًا على تكوين أي ذرات من ununenth في المستقبل القريب، نظرًا للمهمة الصعبة للغاية المتمثلة في صنع كميات كافية من einsteinium-254 ، والذي يفضل إنتاج العناصر فائقة الثقل نظرًا لكبر حجمه. الكتلة، وعمر نصف طويل نسبيًا يبلغ 270 يومًا، ومدى توافرها بكميات كبيرة من عدة ميكروغرامات، [41] لعمل هدف كبير بما يكفي لزيادة حساسية التجربة إلى المستوى المطلوب ؛ لم يتم العثور على أينشتينيوم في الطبيعة وتم إنتاجه فقط في المختبرات، وبكميات أصغر من تلك اللازمة للتوليف الفعال للعناصر فائقة الثقل. ومع ذلك، نظرًا لأن فترة عدم الألفية هي فقط العنصر الأول من الفترة 8 في الجدول الدوري الممتد ، فقد يتم اكتشافه في المستقبل القريب من خلال ردود فعل أخرى، وفي الواقع، هناك محاولة لتجميعه جارية حاليًا في اليابان.[42] في الوقت الحالي، لم يتم اكتشاف أي من عناصر الفترة 8 حتى الآن، ومن الممكن أيضًا، بسبب عدم استقرار التنقيط ، أن عناصر الفترة الأقل 8 فقط، حتى العنصر 128 ، ممكنة ماديًا.[43][44] لم يتم إجراء أي محاولات لتوليف أي معادن قلوية أثقل: نظرًا لعددها الذري المرتفع للغاية، فإنها تتطلب أساليب وتقنيات جديدة أكثر قوة.[38] :1737–1739
حقائق
في النظام الشمسي
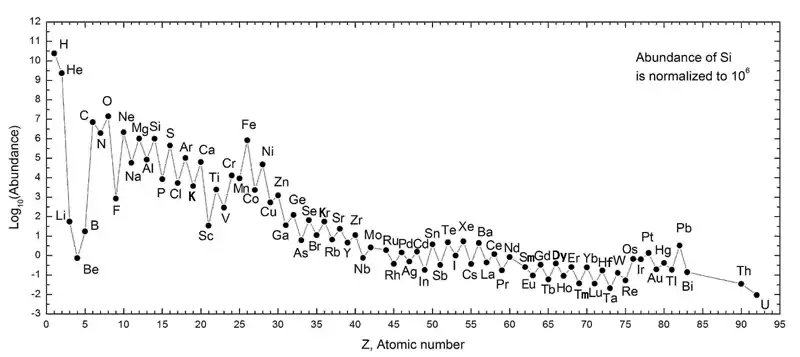
تنص قاعدة Oddo-Harkins على أن العناصر ذات الأعداد الذرية الزوجية أكثر شيوعًا من العناصر التي تحتوي على أعداد ذرية فردية، باستثناء الهيدروجين. تجادل هذه القاعدة بأن العناصر ذات الأعداد الذرية الفردية لها بروتون واحد غير زوجي ومن المرجح أن تلتقط بروتونًا آخر، وبالتالي يزيد عددها الذري. في العناصر ذات الأعداد الذرية الزوجية، يتم إقران البروتونات، حيث يقوم كل عضو من الزوج بتعويض دوران الآخر، مما يعزز الاستقرار.[46][47][48] جميع الفلزات القلوية لها أعداد ذرية فردية وليست شائعة مثل العناصر ذات الأعداد الذرية المجاورة لها ( الغازات النبيلة ومعادن الأرض القلوية ) في النظام الشمسي. المعادن القلوية الأثقل هي أيضًا أقل وفرة من المعادن الأخف، حيث لا يمكن تصنيع الفلزات القلوية من الروبيديوم وما بعده إلا في المستعرات الأعظمية وليس في التركيب النووي النجمي . كما أن الليثيوم أقل وفرة بكثير من الصوديوم والبوتاسيوم حيث يتم تصنيعه بشكل سيئ في كل من التركيب النووي للنجوم Big Bang وفي النجوم: يمكن أن ينتج Big Bang كميات ضئيلة فقط من الليثيوم والبريليوم والبورون بسبب عدم وجود نواة مستقرة ذات 5 أو 8 لا يمكن للنيوكليونات والتخليق النووي النجمي اجتياز عنق الزجاجة إلا من خلال عملية ألفا ثلاثية ، ودمج ثلاث نوى هيليوم لتكوين الكربون ، وتخطي هذه العناصر الثلاثة.[45]
على الارض

تشكلت الأرض من نفس سحابة المادة التي شكلت الشمس، لكن الكواكب اكتسبت تركيبات مختلفة أثناء تكوين وتطور النظام الشمسي . بدوره، تسبب التاريخ الطبيعي للأرض في أن أجزاء من هذا الكوكب لها تركيزات مختلفة من العناصر. تبلغ كتلة الأرض 5.98 ×1024 كلغ. تتكون في الغالب من الحديد (32.1٪) والأكسجين (30.1٪) والسيليكون (15.1٪) والمغنيسيوم (13.9٪) والكبريت (2.9٪) والنيكل (1.8٪) والكالسيوم (1.5٪) والألمنيوم ( 1.4٪) ؛ مع نسبة 1.2٪ المتبقية تتكون من كميات ضئيلة من العناصر الأخرى. بسبب التمايز الكوكبي ، يُعتقد أن المنطقة الأساسية تتكون أساسًا من الحديد (88.8٪) وكميات أصغر من النيكل (5.8٪) والكبريت (4.5٪) وأقل من 1٪ من العناصر النزرة.[49]
المعادن القلوية، بسبب تفاعلها العالي، لا تحدث بشكل طبيعي في شكل نقي في الطبيعة. هم من عشاق الليثوفيل ، وبالتالي يظلون قريبين من سطح الأرض لأنها تتحد بسهولة مع الأكسجين وبالتالي ترتبط بقوة بالسيليكا ، وتشكل معادن منخفضة الكثافة نسبيًا لا تغرق في قلب الأرض. البوتاسيوم والروبيديوم والسيزيوم عناصر غير متوافقة أيضًا بسبب أنصاف أقطارها الأيونية الكبيرة.[50]
يوجد الصوديوم والبوتاسيوم بكثرة في الأرض، وكلاهما من بين العناصر العشرة الأكثر شيوعًا في قشرة الأرض ؛ [51][52] الصوديوم تشكل حوالي 2.6٪ من الأرض القشرة الصورة يقاس الوزن، مما يجعله عنصر سادس الأكثر وفرة عموما [53] والمعدن القلوي الأكثر وفرة. يشكل البوتاسيوم ما يقرب من 1.5٪ من القشرة الأرضية وهو سابع أكثر العناصر وفرة.[53] يوجد الصوديوم في العديد من المعادن المختلفة، وأكثرها شيوعًا هو الملح العادي (كلوريد الصوديوم) ، والذي يوجد بكميات كبيرة مذابة في مياه البحر. تشمل الرواسب الصلبة الأخرى الهاليت والأمفيبول والكرايوليت والنتراتين والزيوليت .[53] تحدث العديد من هذه الرواسب الصلبة نتيجة لتبخر البحار القديمة، والتي لا تزال تحدث الآن في أماكن مثل بحيرة الملح الكبرى في يوتا والبحر الميت .[11] :69 على الرغم من وفرتها شبه المتكافئة في قشرة الأرض، فإن الصوديوم أكثر شيوعًا بكثير من البوتاسيوم في المحيط، لأن حجم البوتاسيوم الأكبر يجعل أملاحه أقل قابلية للذوبان، ولأن البوتاسيوم مرتبط بالسيليكات في التربة وما يتسربه البوتاسيوم يتم امتصاصه بسهولة أكبر. من خلال الحياة النباتية من الصوديوم.[11]
على الرغم من تشابهه الكيميائي، لا يوجد الليثيوم عادةً مع الصوديوم أو البوتاسيوم نظرًا لصغر حجمه.[11] :69 نظرًا لفاعلية منخفضة نسبيًا، يمكن العثور عليها في مياه البحر بكميات كبيرة ؛ تشير التقديرات إلى أن مياه البحر تتراوح من 0.14 إلى 0.25 جزء في المليون (جزء في المليون) [54][55] أو 25 ميكرومولار .[56] غالبًا ما تسمح له علاقته القطرية بالمغنيسيوم باستبدال المغنيسيوم في معادن الحديد والمغنيسيوم، حيث يكون تركيز القشرة حوالي 18 جزء في المليون ، مقارنة بتلك الموجودة في الغاليوم والنيوبيوم . من الناحية التجارية، يعتبر الإسبودومين أهم معادن الليثيوم، والذي يوجد في رواسب كبيرة في جميع أنحاء العالم.[11] :69:69
الروبيديوم وفير تقريبًا مثل الزنك وأكثر وفرة من النحاس. وهو يحدث بشكل طبيعي في المعادن يوسيت ، pollucite ، كارنالايت ، zinnwaldite ، و اللبيدوليت ، [57] على الرغم من أن أيا من هذه تحتوي الوحيد الروبيديوم ولا الفلزات القلوية الأخرى.[11] :70 السيزيوم أكثر وفرة من بعض العناصر المعروفة، مثل الأنتيمون ، والكادميوم ، والقصدير ، والتنغستن ، ولكنه أقل وفرة بكثير من الروبيديوم.[58]
الفرانسيوم -223 ، النظير الطبيعي الوحيد للفرانسيوم، [59][60] هو نتاج اضمحلال ألفا للأكتينيوم -227 ويمكن العثور عليه بكميات ضئيلة في معادن اليورانيوم .[61] في عينة معينة من اليورانيوم، تشير التقديرات إلى وجود ذرة فرانسيوم واحدة فقط لكل 10 18 ذرة يورانيوم.[62][63] تم حساب أن هناك 30 على الأكثر غرامات من الفرانسيوم في القشرة الأرضية في أي وقت، وذلك بسبب قصر عمرها النصفي البالغ 22 دقيقة.[64][65]
الخصائص
الفيزيائية والكيميائية
يمكن تفسير الخصائص الفيزيائية والكيميائية للمعادن القلوية بسهولة من خلال تكوين إلكترون التكافؤ ns 1 ، مما يؤدي إلى ضعف الترابط المعدني . ومن ثم، فإن جميع المعادن القلوية ناعمة وذات كثافة منخفضة، [31] انصهار [31] ونقاط غليان ، [31] بالإضافة إلى درجات حرارة التسامي ، والتبخير ، والتفكك .[11] :74 تتبلور جميعها في الهيكل البلوري المكعب المتمركز حول الجسم ، [11] :73 ولها ألوان شعلة مميزة لأن إلكترونها الخارجي يكون متحمسًا بسهولة.[11] :75 ينتج عن التكوين ns 1 أيضًا أن تحتوي الفلزات القلوية على أنصاف أقطار ذرية وأيونية كبيرة جدًا، بالإضافة إلى توصيل حراري وكهربائي عالي جدًا.[11] :75 يهيمن على كيميائهم فقدان إلكترون التكافؤ الوحيد في المدار s الأبعد لتشكيل حالة الأكسدة +1 ، نظرًا لسهولة تأين هذا الإلكترون وطاقة التأين العالية جدًا في الثانية.[11] :76 تمت ملاحظة معظم الكيمياء فقط للأعضاء الخمسة الأوائل من المجموعة. إن كيمياء الفرانسيوم ليست ثابتة بسبب نشاطها الإشعاعي الشديد.[31] وبالتالي، فإن عرض خصائصه هنا محدود. ما يُعرف القليل عن الفرانسيوم يُظهر أنه قريب جدًا في السلوك من السيزيوم، كما هو متوقع. إن الخواص الفيزيائية للفرانسيوم هي أكثر سلاسة لأنه لم يتم ملاحظة العنصر السائب من قبل ؛ ومن ثم فإن أي بيانات يمكن العثور عليها في الأدبيات هي بالتأكيد استقراء تخميني.[66]
الفلزات القاعديه القلوية تظهر نزعة في اختلاف الخصائص عند التحرك إلى أسفل المجموعة على سبيل المثال، تناقص في السالبية الكهربية ، زيادة النشاط الكيميائي وتناقص في نقطة الانصهار والغليان.وتتميز بانها لينة عن الفلزات الاخرى وانها باهته اللون ولا تلمع وهي أيضا ذات كثافة منخفضة تزداد الكثافة عموما مع وجود استثناء ملحوظ بكون البوتاسيوم أقل كثافة من الصوديوم.
تتفاعل الفلزات القلوية بشكل انفجاري مع الماء حيث يتحرر غاز الهيدروجين. تزداد درجة الانفجار من أعلى المجموعة إلى أسفلها، حيث تكون أعنفها مع السيزيوم. أظهرت الكاميرات فائقة السرعة أن انفجار الفلزات القلوية في الماء صوراً تشير إلى أن التفاعل الانفجاري قد يكون من نمط انفجار كولوم.[67][68]
| الفلز القلوي | الوزن الذري القياسي (و.ك.ذ) | نقطة الانصهار(كلفن) | نقطة الغليان (كلفن) | الكثافة غ/سم3 | الكهرسلبية (مقياس باولينغ) |
| ليثيوم | 6.941 | 453.69 | 1615 | 0.534 | 0.98 |
| صوديوم | 22.990 | 370.87 | 1156 | 0.968 | 0.93 |
| بوتاسيوم | 39.098 | 336.53 | 1032 | 0.89 | 0.82 |
| روبيديوم | 85.468 | 312.46 | 961 | 1.532 | 0.82 |
| سيزيوم | 132.905 | 301.59 | 944 | 1.93 | 0.79 |
| فرانسيوم | (223) | ? 295 | ? 950 | ? 1.87 | 0.7 |
ملاحظة: بيانات الفرانسيوم تخمينية كون العنصر مصطنع مخبرياً.
المعادن القلوية أكثر تشابهًا مع بعضها البعض من العناصر الموجودة في أي مجموعة أخرى مع بعضها البعض.[31] في الواقع ، التشابه كبير لدرجة أنه من الصعب جدًا فصل البوتاسيوم والروبيديوم والسيزيوم ، بسبب تشابه نصف قطرها الأيوني ؛ الليثيوم والصوديوم أكثر تميزًا. على سبيل المثال ، عند التحرك أسفل الجدول ، تُظهر جميع المعادن القلوية المعروفة زيادة في نصف القطر الذري ، [69] تناقص الكهربية ، [69] زيادة التفاعل ، [31] وتناقص نقاط الانصهار والغليان [69] بالإضافة إلى درجات حرارة الاندماج والتبخر .[11] :75 بشكل عام ، تزداد كثافتها عند التحرك أسفل الطاولة ، باستثناء أن البوتاسيوم أقل كثافة من الصوديوم.[69] واحدة من الخصائص القليلة جدًا للمعادن القلوية التي لا تعرض اتجاهًا سلسًا للغاية هي إمكانات الاختزال : قيمة الليثيوم شاذة ، كونها أكثر سلبية من غيرها.[11] :75 هذا لأن أيون Li + يحتوي على طاقة ترطيب عالية جدًا في الطور الغازي: على الرغم من أن أيون الليثيوم يعطل بنية الماء بشكل كبير ، مما يتسبب في تغيير أعلى في الانتروبيا ، فإن طاقة الترطيب العالية هذه كافية لجعل إمكانات الاختزال تشير إليها على أنها هو أكثر المعادن القلوية حساسية للكهرباء ، على الرغم من صعوبة تأينه في الطور الغازي.[11] :75
المعادن القلوية المستقرة كلها معادن فضية اللون باستثناء السيزيوم ، الذي له صبغة ذهبية باهتة:[70] إنه واحد من ثلاثة معادن فقط ملونة بوضوح (الآخران هما النحاس والذهب).[11] :74 بالإضافة إلى ذلك ، فإن المعادن الأرضية القلوية الثقيلة كالسيوم ، والسترونتيوم ، والباريوم ، بالإضافة إلى ثنائي التكافؤ لانثانيدات يوروبيوم وإيتربيوم ، صفراء شاحبة ، على الرغم من أن اللون أقل بروزًا بكثير من السيزيوم.[11] :74 يتلاشى بريقها بسرعة في الهواء بسبب الأكسدة.[31] تتبلور جميعها في الهيكل البلوري المكعب المتمركز حول الجسم ، [11] :73 ولها ألوان شعلة مميزة لأن إلكترونها الخارجي يكون متحمسًا بسهولة. في الواقع ، تعد ألوان اختبار اللهب هذه هي الطريقة الأكثر شيوعًا لتحديدها نظرًا لأن جميع أملاحها ذات الأيونات الشائعة قابلة للذوبان.[11] :75
جميع المعادن القلوية شديدة التفاعل ولا توجد أبدًا في الأشكال الأولية في الطبيعة.[21] لهذا السبب ، يتم تخزينها عادة في زيت معدني أو كيروسين (زيت بارافين).[71] تتفاعل بقوة مع الهالوجينات لتكوين هاليدات الفلزات القلوية ، وهي مركبات بلورية أيونية بيضاء قابلة للذوبان في الماء باستثناء فلوريد الليثيوم ( Li F ).[31] تتفاعل الفلزات القلوية أيضًا مع الماء لتكوين هيدروكسيدات قلوية بقوة وبالتالي يجب التعامل معها بحذر شديد. تتفاعل المعادن القلوية الثقيلة بقوة أكبر من المعادن الأخف ؛ على سبيل المثال ، عند إسقاطه في الماء ، ينتج السيزيوم انفجارًا أكبر من البوتاسيوم إذا تم استخدام نفس عدد مولات كل معدن.[31][58][72] تمتلك الفلزات القلوية أقل طاقات التأين الأولى في فترات كل منها من الجدول الدوري [66] بسبب انخفاض شحنتها النووية الفعالة [31] والقدرة على الوصول إلى تكوين غاز نبيل بفقدان إلكترون واحد فقط.[31] لا تتفاعل الفلزات القلوية مع الماء فحسب ، بل تتفاعل أيضًا مع المتبرعين بالبروتونات مثل الكحولات والفينولات والأمونيا الغازية والألكينات ، وهذا الأخير يوضح الدرجة الهائلة لتفاعلها. إن قوتها العظيمة كعوامل اختزال تجعلها مفيدة جدًا في تحرير المعادن الأخرى من أكاسيدها أو هاليداتها.[11] :76
تكون طاقة التأين الثانية لجميع الفلزات القلوية عالية جدًا [31][66] لأنها في غلاف كامل أقرب أيضًا إلى النواة ؛ [31] وبالتالي ، فإنهم يفقدون دائمًا إلكترونًا واحدًا ، مكونين الكاتيونات.[11] :28 تعتبر القلويات استثناءً: فهي مركبات غير مستقرة تحتوي على معادن قلوية في حالة أكسدة -1 ، وهو أمر غير معتاد كما كان قبل اكتشاف القلويات ، لم يكن من المتوقع أن تكون الفلزات القلوية قادرة على تكوين الأنيونات وكان يُعتقد أنها قادرة على الظهور في الأملاح فقط كاتيونات. وقد شغل الأنيونات alkalide يالي subshells ، والتي تتيح لهم ما يكفي من الاستقرار في الوجود. من المعروف أن جميع الفلزات القلوية المستقرة باستثناء الليثيوم قادرة على تكوين قليدات ، [73][74][75] وللكاليدات الكثير من الاهتمام النظري نظرًا لقياساتها المتكافئة غير العادية وإمكانيات التأين المنخفضة. Alkalides متشابهة كيميائيا لل electrides ، والتي هي أملاح مع المحاصرين الالكترونات تعمل كما الأنيونات.[76] مثال صارخ بشكل خاص على القليدات هو "معكوس هيدريد الصوديوم " ، H + Na - (كلا الأيونات معقد ) ، على عكس هيدريد الصوديوم المعتاد ، Na + H - :[77] إنه غير مستقر بمعزل بسبب وجوده الطاقة العالية الناجمة عن النزوح من إلكترونين من الهيدروجين لالصوديوم، وعلى الرغم من توقع العديد من المشتقات ليكون متبدل الاستقرار أو مستقرة.[77][78]
في محلول مائي ، تشكل أيونات الفلزات القلوية أيونات مائية من الصيغة [M (H 2 O) n ] + ، حيث n هو رقم الذوبان. تتوافق أرقام وأشكال التنسيق الخاصة بهم بشكل جيد مع تلك المتوقعة من أنصاف أقطارها الأيونية. في المحلول المائي ، يقال إن جزيئات الماء المرتبطة مباشرة بأيون المعدن تنتمي إلى أول كرة تنسيق ، تُعرف أيضًا باسم غلاف الإذابة الأول أو الأولي. الرابطة بين جزيء الماء والأيون المعدني هي رابطة تساهمية dative ، حيث تتبرع ذرة الأكسجين بكلا الإلكترونين للرابطة. قد يتم ربط كل جزيء ماء منسق بواسطة روابط هيدروجينية بجزيئات الماء الأخرى. ويقال أن الأخيرة موجودة في مجال التنسيق الثاني. ومع ذلك ، بالنسبة للكاتيونات الفلزية القلوية ، لم يتم تعريف كرة التنسيق الثانية جيدًا لأن الشحنة +1 الموجودة على الكاتيون ليست عالية بما يكفي لاستقطاب جزيئات الماء في غلاف الذوبان الأولي بما يكفي لتشكيل روابط هيدروجينية قوية مع تلك الموجودة في مجال التنسيق الثاني ، ينتج كيانًا أكثر استقرارًا.[79][80] :25 تم تحديد رقم الذوبان لـ Li + بشكل تجريبي ليكون 4 ، مكونًا رباعي السطوح [Li (H 2 O) 4 ] + : بينما تم العثور على أرقام إذابة من 3 إلى 6 لأيونات الليثيوم المائية ، قد تكون أعداد الذوبان الأقل من 4 نتيجة تشكيل أزواج أيونات التلامس ، ويمكن تفسير أرقام الذوبان الأعلى من حيث جزيئات الماء التي تقترب من [Li (H 2 O) 4 ] + من خلال وجه رباعي الوجوه ، على الرغم من أن المحاكاة الديناميكية الجزيئية قد تشير إلى وجود من ثماني السطوح أيون hexaaqua. من المحتمل أيضًا وجود ستة جزيئات ماء في مجال الإذابة الأولي لأيون الصوديوم ، مكونًا الأوكتاهدرا [Na (H 2 O) 6 ] + أيون.[80][81] :126–127 بينما كان يُعتقد سابقًا أن الفلزات القلوية الأثقل تشكل أيضًا أيونات سداسية السداسية ثماني السطوح ، فقد وجد منذ ذلك الحين أن البوتاسيوم والروبيديوم ربما يشكلان [K (H 2 O) 8 ] + و [Rb (H 2 O) 8 ] + أيونات ، والتي لها بنية مربعة مضادة للزرقة ، وأن السيزيوم يشكل 12 إحداثيًا [Cs (H 2 O) 12 ] + أيون.[82]
الليثيوم
تُظهر كيمياء الليثيوم عدة اختلافات عن تلك الخاصة ببقية المجموعة حيث يقوم Li + الموجبة الصغيرة باستقطاب الأنيونات وتعطي مركباتها طابعًا تساهميًا أكثر.[31] الليثيوم والمغنيسيوم لهما علاقة قطرية بسبب تشابه أنصاف أقطارهما الذرية ، [31] بحيث يُظهران بعض أوجه التشابه. على سبيل المثال ، يشكل الليثيوم نيتريدًا ثابتًا ، وهي خاصية مشتركة بين جميع المعادن الأرضية القلوية (مجموعة المغنيسيوم) ولكنها فريدة بين الفلزات القلوية.[83] بالإضافة إلى ذلك ، من بين مجموعاتهم الخاصة ، يشكل الليثيوم والمغنيسيوم فقط مركبات عضوية معدنية ذات طابع تساهمي كبير (على سبيل المثال لي مي و MgMe 2 ).[84]
فلوريد الليثيوم هو هاليد الفلزات القلوية الوحيد الذي لا يذوب بشكل سيئ في الماء ، [31] وهيدروكسيد الليثيوم هو هيدروكسيد الفلزات القلوية الوحيد الذي لا يميل .[31] على العكس من ذلك ، تعتبر فوق كلورات الليثيوم وأملاح الليثيوم الأخرى ذات الأنيونات الكبيرة التي لا يمكن استقطابها أكثر استقرارًا من المركبات المماثلة للمعادن القلوية الأخرى ، ربما لأن Li + لديه طاقة ذوبان عالية.[11] :76 يعني هذا التأثير أيضًا أن معظم أملاح الليثيوم البسيطة يتم مواجهتها بشكل شائع في شكل رطب ، لأن الأشكال اللامائية شديدة الرطوبة : وهذا يسمح باستخدام أملاح مثل كلوريد الليثيوم وبروميد الليثيوم في أجهزة إزالة الرطوبة ومكيفات الهواء .[11] :76
الفرانسيوم
من المتوقع أيضًا أن يُظهر الفرانسيوم بعض الاختلافات بسبب وزنه الذري المرتفع ، مما يتسبب في انتقال إلكتروناته بأجزاء كبيرة من سرعة الضوء وبالتالي جعل التأثيرات النسبية أكثر وضوحًا. على عكس الاتجاه المتمثل في تناقص الطاقة الكهربية وطاقات التأين للمعادن القلوية ، من المتوقع أن تكون كهرسلبية الفرانسيوم وطاقة التأين أعلى من الكيسيوم بسبب التثبيت النسبي للإلكترونات السبعة ؛ أيضًا ، من المتوقع أن يكون نصف قطرها الذري منخفضًا بشكل غير طبيعي. وبالتالي ، على عكس التوقعات ، فإن السيزيوم هو أكثر المعادن القلوية تفاعلًا ، وليس الفرانسيوم.[38][85] :1729 [86] تنحرف جميع الخصائص الفيزيائية المعروفة للفرانسيوم أيضًا عن الاتجاهات الواضحة التي تنتقل من الليثيوم إلى السيزيوم ، مثل طاقة التأين الأولى ، وتقارب الإلكترون ، وقابلية الاستقطاب الأنيون ، على الرغم من ندرة البيانات المعروفة حول الفرانسيوم ، فإن العديد من المصادر تعطي قيمًا مستقراء ، متجاهلة ذلك تجعل التأثيرات النسبية الاتجاه من الليثيوم إلى السيزيوم غير قابل للتطبيق على الفرانسيوم.[86] بعض خصائص الفرانسيوم القليلة التي تم التنبؤ بها مع الأخذ في الاعتبار النسبية هي تقارب الإلكترون (47.2 كيلو جول / مول) [87] والمحتوى الحراري لتفكك جزيء Fr 2 (42.1 كيلو جول / مول).[88] جزيء CsFr مستقطب مثل Cs + Fr - ، مما يدل على أن الجزء الفرعي 7S من الفرانسيوم يتأثر بشدة بالتأثيرات النسبية أكثر من الطبقة الفرعية 6 من السيزيوم.[86] بالإضافة إلى ذلك ، من المتوقع أن يكون لأكسيد الفرانسيوم الفائق (FrO 2 ) خاصية تساهمية كبيرة ، على عكس الأكاسيد الفائقة الفلزية القلوية الأخرى ، بسبب مساهمات الترابط من إلكترونات الفرانسيوم 6p.[86]
النظائر الأولية للمعادن القلوية
| ض
</br> |
الفلزات القلوية
</br> |
مستقر</br> | يتحلل</br> | غير مستقر: مائل نظائر فردية ملونة باللون الوردي | ||
|---|---|---|---|---|---|---|
| 3 | الليثيوم | 2 | - | 7</br> 7</br> | 6</br> 6</br> | |
| 11 | صوديوم | 1 | - | 23</br> 23</br> | ||
| 19 | البوتاسيوم | 2 | 1 | 39</br> 39</br> | 41</br> 41</br> | 40</br> 40</br> |
| 37 | الروبيديوم | 1 | 1 | 85</br> 85</br> | 87</br> 87</br> | |
| 55 | سيزيوم | 1 | - | 133</br> 133</br> | ||
| 87 | فرانسيوم | - | - | لا نظائر بدائية</br> ( 223</br> 223</br> نويدات مشعة ) | ||
| المشعة: 40K, t1/2 1.25 × 109 years; 87Rb, t1/2 4.9 × 1010 years; 223Fr, t1/2 22.0 min. | ||||||
جميع الفلزات القلوية لها أعداد ذرية فردية ؛ ومن ثم ، يجب أن تكون نظائرها إما فردية - فردية (كل من عدد البروتون والنيوترون فردي) أو فردي - زوجي ( رقم البروتون فردي ، لكن عدد النيوترونات زوجي). النوى الفردية والزوجية لها أعداد جماعية زوجية ، في حين أن النوى الفردية والزوجية لها أعداد كتلة فردية. تعد النويدات البدائية الفردية والغريبة نادرة لأن معظم النوى الفردية والغريبة غير مستقرة بدرجة كبيرة فيما يتعلق بتحلل بيتا ، لأن نواتج الاضمحلال تكون زوجية - متساوية ، وبالتالي فهي مرتبطة بقوة أكبر ، بسبب تأثيرات الاقتران النووي .[89]
نظرًا لندرة النوى الفردية والغريبة ، فإن جميع النظائر الأولية للمعادن القلوية تقريبًا هي نظائر فردية - زوجية (الاستثناءات هي النظير المستقر خفيف الليثيوم -6 والنظائر المشعة طويلة العمر البوتاسيوم -40). بالنسبة لرقم كتلة فردي معين ، يمكن أن يكون هناك نوكليدة بيتا مستقرة واحدة فقط ، نظرًا لعدم وجود فرق في طاقة الربط بين زوجي - فردي - فردي - حتى يمكن مقارنته بتلك الموجودة بين زوجي - زوجي - فردي - فردي ، مع ترك نوكليدات أخرى من نفس العدد الكتلي ( الأيزوبارات ) حر في تحلل بيتا باتجاه النويدة الأقل كتلة. تأثير عدم استقرار عدد فردي من أي نوع من النيوكليونات هو أن العناصر ذات الأرقام الفردية ، مثل الفلزات القلوية ، تميل إلى أن تحتوي على نظائر ثابتة أقل من العناصر ذات الأرقام الزوجية. من بين 26 عنصرًا أحادي النظير ليس لها سوى نظير ثابت واحد ، جميعها باستثناء عنصر واحد لها عدد ذري فردي وجميعها تحتوي أيضًا على عدد زوجي من النيوترونات باستثناء عنصر واحد. البريليوم هو الاستثناء الوحيد لكلتا القاعدتين ، نظرًا لقلة عددها الذري.[89]
كل من الفلزات القلوية إلا الليثيوم والسيزيوم ديك واحد على الأقل تحدث بشكل طبيعي النظائر المشعة : الصوديوم-22 والصوديوم 24 هي النظائر المشعة أثر أنتجت cosmogenically ، [90] بوتاسيوم 40 و الروبيديوم-87 يكون طويل جدا نصف العمر وبالتالي يحدث بشكل طبيعي ، [91] وجميع نظائر الفرانسيوم مشعة .[91] كان يعتقد أيضًا أن السيزيوم كان مشعًا في أوائل القرن العشرين ، [92][93] على الرغم من عدم وجود نظائر مشعة طبيعية.[91] (لم يتم اكتشاف الفرانسيوم بعد في ذلك الوقت. ) النظائر المشعة الطبيعية طويلة العمر للبوتاسيوم ، البوتاسيوم -40 ، تشكل حوالي 0.012٪ من البوتاسيوم الطبيعي ، [94] وبالتالي البوتاسيوم الطبيعي مشع بشكل ضعيف. أصبح هذا النشاط الإشعاعي الطبيعي أساسًا للادعاء الخاطئ باكتشاف العنصر 87 (المعدن القلوي التالي بعد السيزيوم) في عام 1925.[32][33] وبالمثل فإن الروبيديوم الطبيعي مشع قليلًا ، حيث يمثل 27.83٪ منه نظيرًا مشعًا طويل العمر الروبيديوم -87.[11] :74
السيزيوم 137 ، بعمر نصفي 30.17 سنوات ، أحد منتجي الانشطار الرئيسيين متوسطي العمر ، إلى جانب السترونشيوم 90 ، المسؤولان عن معظم النشاط الإشعاعي للوقود النووي المستهلك بعد عدة سنوات من التبريد ، حتى عدة مئات من السنين بعد الاستخدام ويشكل معظم النشاط الإشعاعي المتبقي من حادث تشيرنوبيل . يخضع السيزيوم 137 لتحلل بيتا عالي الطاقة ويصبح في النهاية الباريوم 137 . إنه مصدر قوي لإشعاع غاما. يحتوي السيزيوم 137 على معدل منخفض جدًا لالتقاط النيوترونات ولا يمكن التخلص منه عمليًا بهذه الطريقة ، ولكن يجب السماح له بالتحلل.[95] تم استخدام السيزيوم 137 كمتتبع في الدراسات الهيدرولوجية ، على غرار استخدام التريتيوم .[96] تم إطلاق كميات صغيرة من السيزيوم -134 والسيزيوم -137 في البيئة خلال جميع تجارب الأسلحة النووية تقريبًا وبعض الحوادث النووية ، وأبرزها حادث جويانيا وكارثة تشيرنوبيل . اعتبارًا من عام 2005 ، كان السيزيوم 137 هو المصدر الرئيسي للإشعاع في منطقة الاغتراب حول محطة تشيرنوبيل للطاقة النووية .[97] تجعل خواصه الكيميائية كأحد الفلزات القلوية منه أحد أكثر منتجات الانشطار قصيرة إلى متوسطة العمر إشكالية لأنه يتحرك وينتشر بسهولة في الطبيعة بسبب قابلية الذوبان العالية في الماء لأملاحه ، ويتم تناوله بواسطة الجسم الذي يخطئ فيه بسبب متجانساته الأساسية الصوديوم والبوتاسيوم.[98] :114
الاتجاهات الدورية
المعادن القلوية أكثر تشابهًا مع بعضها البعض من العناصر الموجودة في أي مجموعة أخرى مع بعضها البعض.[31] على سبيل المثال ، عند التحرك أسفل الجدول ، تُظهر جميع المعادن القلوية المعروفة زيادة في نصف القطر الذري ، [69] تناقص الكهربية ، [69] زيادة التفاعل ، [31] وتناقص نقاط الانصهار والغليان [69] بالإضافة إلى درجات حرارة الاندماج والتبخر .[11] :75 بشكل عام ، تزداد كثافتها عند التحرك أسفل الطاولة ، باستثناء أن البوتاسيوم أقل كثافة من الصوديوم.[69]
نصف القطر الذري والأيوني

يزداد نصف القطر الذري للمعادن القلوية في أسفل المجموعة.[69] بسبب تأثير التدريع ، عندما تحتوي الذرة على أكثر من غلاف إلكترون واحد ، يشعر كل إلكترون بالتنافر الكهربائي من الإلكترونات الأخرى بالإضافة إلى التجاذب الكهربائي من النواة.[99] في الفلزات القلوية ، يشعر الإلكترون الخارجي فقط بشحنة صافية قدرها +1 ، حيث يتم إلغاء بعض الشحنة النووية (التي تساوي العدد الذري ) بواسطة الإلكترونات الداخلية ؛ عدد الإلكترونات الداخلية للمعدن القلوي دائمًا أقل بواحد من الشحنة النووية. لذلك ، فإن العامل الوحيد الذي يؤثر على نصف القطر الذري للمعادن القلوية هو عدد قذائف الإلكترون. نظرًا لأن هذا الرقم يزيد أسفل المجموعة ، يجب أيضًا زيادة نصف القطر الذري أسفل المجموعة.[69]
نصف القطر الأيوني للمعادن القلوية أصغر بكثير من نصف قطرها الذري. هذا لأن الإلكترون الخارجي للمعادن القلوية موجود في غلاف إلكترون مختلف عن الإلكترونات الداخلية ، وبالتالي عند إزالته ، يكون للذرة الناتجة غلاف إلكترون أقل وأصغر. بالإضافة إلى ذلك ، زادت الشحنة النووية الفعالة ، وبالتالي تنجذب الإلكترونات بقوة أكبر نحو النواة وينخفض نصف القطر الأيوني.[31]
طاقة التأين الأولى
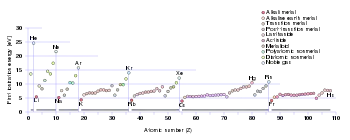
طاقة التأين الأولى لعنصر أو جزيء هي الطاقة اللازمة لتحريك الإلكترون الأكثر مرونة من مول واحد من الذرات الغازية للعنصر أو الجزيئات لتكوين مول واحد من الأيونات الغازية بشحنة كهربائية +1. العوامل التي تؤثر على طاقة التأين الأولى هي الشحنة النووية ، وكمية التدريع بواسطة الإلكترونات الداخلية ، والمسافة من الإلكترون الأكثر رخوة عن النواة ، والذي يكون دائمًا إلكترونًا خارجيًا في عناصر المجموعة الرئيسية . العاملان الأولان يغيران الشحنة النووية الفعالة التي يشعر بها الإلكترون الأكثر مرونة. نظرًا لأن الإلكترون الخارجي للمعادن القلوية يشعر دائمًا بنفس الشحنة النووية الفعالة (+1) ، فإن العامل الوحيد الذي يؤثر على طاقة التأين الأولى هو المسافة من الإلكترون الخارجي إلى النواة. نظرًا لأن هذه المسافة تزداد أسفل المجموعة ، فإن الإلكترون الخارجي يشعر بانجذاب أقل من النواة وبالتالي تقل طاقة التأين الأولى.[69] (تم كسر هذا الاتجاه في الفرانسيوم بسبب الاستقرار النسبي وتقلص المدار 7s ، مما يجعل إلكترون تكافؤ الفرانسيوم أقرب إلى النواة مما هو متوقع من الحسابات غير النسبية. هذا يجعل الإلكترون الخارجي للفرانسيوم يشعر بمزيد من الجاذبية من النواة ، مما يزيد من طاقة التأين الأولى بشكل طفيف بما يتجاوز طاقة السيزيوم. ) [38] :1729
طاقة التأين الثانية للمعادن القلوية أعلى بكثير من الأولى حيث أن ثاني أكثر الإلكترون ضعيفًا هو جزء من غلاف إلكتروني ممتلئ بالكامل وبالتالي يصعب إزالته.[31]
التفاعلية
تزيد تفاعلات الفلزات القلوية مع نزول المجموعة. هذا هو نتيجة مزيج من عاملين: الأول طاقات التأين وطاقات الانحلال للمعادن القلوية. نظرًا لأن طاقة التأين الأولى للمعادن القلوية تتناقص إلى أسفل المجموعة ، فمن الأسهل إزالة الإلكترون الخارجي من الذرة والمشاركة في التفاعلات الكيميائية ، وبالتالي زيادة التفاعل أسفل المجموعة. تقيس طاقة الانحلال قوة الرابطة المعدنية لعنصر ما ، والتي تسقط في المجموعة مع زيادة الذرات في نصف القطر وبالتالي يجب أن يزداد طول الرابطة المعدنية ، مما يجعل الإلكترونات غير الموضعية بعيدة عن جاذبية نوى العنصر الأثقل الفلزات القلوية. تعطي إضافة الانحلال وطاقات التأين الأولى كمية مرتبطة ارتباطًا وثيقًا (ولكن لا تساوي) طاقة التنشيط لتفاعل معدن قلوي مع مادة أخرى. تقل هذه الكمية مع انخفاض المجموعة ، وكذلك طاقة التنشيط ؛ وبالتالي ، يمكن أن تحدث التفاعلات الكيميائية بشكل أسرع ويزيد التفاعل أسفل المجموعة.[100]
كهرسلبية
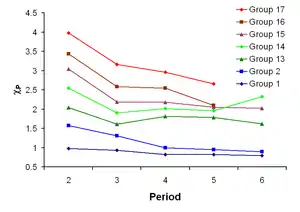
الكهربية هي خاصية كيميائية تصف ميل ذرة أو مجموعة وظيفية لجذب الإلكترونات (أو كثافة الإلكترون ) نحو نفسها.[101] إذا كانت الرابطة بين الصوديوم والكلور في كلوريد الصوديوم تساهمية ، فإن زوج الإلكترونات المشتركة سينجذب إلى الكلور لأن الشحنة النووية الفعالة على الإلكترونات الخارجية هي +7 في الكلور ولكنها تساوي +1 فقط في الصوديوم. ينجذب زوج الإلكترون بالقرب من ذرة الكلور بحيث يتم نقلهما عمليًا إلى ذرة الكلور ( رابطة أيونية ). ومع ذلك ، إذا تم استبدال ذرة الصوديوم بذرة الليثيوم ، فلن تنجذب الإلكترونات بالقرب من ذرة الكلور كما كان من قبل لأن ذرة الليثيوم أصغر ، مما يجعل زوج الإلكترون أكثر انجذابًا إلى الشحنة النووية الأقرب من الليثيوم. ومن ثم ، فإن ذرات المعدن القلوي الأكبر (أسفل المجموعة) ستكون أقل كهرسلبية لأن زوج الترابط أقل انجذابًا نحوها. كما ذكرنا سابقًا ، من المتوقع أن يكون الفرانسيوم استثناءً.[69]
بسبب ارتفاع كهرسلبية الليثيوم ، فإن بعض مركباته لها طابع تساهمي أكثر. على سبيل المثال ، يذوب يوديد الليثيوم ( Li I ) في المذيبات العضوية ، وهي خاصية لمعظم المركبات التساهمية.[69] فلوريد الليثيوم (Li F ) هو هاليد قلوي وحيد غير قابل للذوبان في الماء ، [31] وهيدروكسيد الليثيوم (Li OH ) هو هيدروكسيد الفلزات القلوية الوحيد غير المائل .[31]
نقاط الانصهار والغليان
نقطة انصهار المادة هي النقطة التي تتغير فيها حالتها من الحالة الصلبة إلى السائلة بينما تكون نقطة غليان المادة (في الحالة السائلة) هي النقطة التي يتساوى فيها ضغط بخار السائل مع الضغط البيئي المحيط بالسائل [102][103] وجميع السوائل تتغير حالتها إلى غاز . عندما يتم تسخين المعدن إلى نقطة الانصهار ، تضعف الروابط المعدنية التي تبقي الذرات في مكانها بحيث يمكن للذرات أن تتحرك ، وفي النهاية تنكسر الروابط المعدنية تمامًا عند نقطة غليان المعدن.[69][104] لذلك ، تشير نقاط الانصهار والغليان المتساقطة للمعادن القلوية إلى أن قوة الروابط المعدنية للمعادن القلوية تتناقص أسفل المجموعة.[69] وذلك لأن ذرات المعدن متماسكة عن طريق التجاذب الكهرومغناطيسي من الأيونات الموجبة إلى الإلكترونات غير المحددة.[69][104] مع زيادة حجم الذرات أسفل المجموعة (بسبب زيادة نصف قطرها الذري) ، تتحرك نوى الأيونات بعيدًا عن الإلكترونات غير المحددة وبالتالي تصبح الرابطة المعدنية أضعف بحيث يمكن للمعدن أن يذوب ويغلي بسهولة ، وبالتالي ينخفض نقاط الانصهار والغليان.[69] (الشحنة النووية المتزايدة ليست عاملاً ذا صلة بسبب تأثير التدريع. ) [69]
كثافة
تحتوي جميع المعادن القلوية على نفس التركيب البلوري ( مكعب محوره الجسم ) [11] وبالتالي فإن العوامل الوحيدة ذات الصلة هي عدد الذرات التي يمكن أن تتناسب مع حجم معين وكتلة إحدى الذرات ، حيث يتم تعريف الكثافة على أنها الكتلة لكل وحدة حجم. العامل الأول يعتمد على حجم الذرة وبالتالي نصف القطر الذري ، مما يزيد من نزول المجموعة ؛ وبالتالي ، فإن حجم ذرة فلز قلوي يزداد مع انخفاض المجموعة. تزداد كتلة ذرة فلز قلوي أيضًا في نزول المجموعة. وبالتالي ، فإن الاتجاه لكثافة الفلزات القلوية يعتمد على أوزانها الذرية وأنصاف أقطارها الذرية ؛ إذا كانت الأرقام الخاصة بهذين العاملين معروفة ، فيمكن بعد ذلك حساب النسب بين كثافات الفلزات القلوية. الاتجاه الناتج هو أن كثافة الفلزات القلوية تزداد أسفل الجدول ، باستثناء البوتاسيوم. نظرًا لوجود أقل وزن ذري وأكبر نصف قطر ذري لجميع العناصر في فتراتهم ، فإن الفلزات القلوية هي أقل المعادن كثافة في الجدول الدوري.[69] الليثيوم والصوديوم والبوتاسيوم هي المعادن الثلاثة الوحيدة في الجدول الدوري الأقل كثافة من الماء:[31] في الواقع ، الليثيوم هو أقل المواد الصلبة المعروفة كثافة في درجة حرارة الغرفة .[11] :75
مجمعات سكنية
تشكل الفلزات القلوية سلسلة كاملة من المركبات مع كل الأنيونات المصادفة عادة ، والتي توضح اتجاهات المجموعة جيدًا. يمكن وصف هذه المركبات بأنها تنطوي على فقدان المعادن القلوية للإلكترونات للأنواع المستقبلة وتشكيل أيونات أحادية الموجب.[11] :79 هذا الوصف هو الأكثر دقة للهاليدات القلوية ويصبح أقل دقة مع زيادة الشحنة الموجبة والأنيونية ، وعندما يصبح الأنيون أكبر وأكثر قابلية للاستقطاب. على سبيل المثال ، يفسح الارتباط الأيوني الطريق للرابط المعدني على طول سلسلة NaCl ، Na 2 O ، Na 2 S ، Na 3 P ، Na 3 As ، Na 3 Sb ، Na 3 Bi ، Na.[11] :81
هيدروكسيدات
جميع الفلزات القلوية تتفاعل بقوة أو متفجرات بالماء البارد، انتاج محلول مائي لبشدة الأساسي الفلزات القلوية هيدروكسيد واطلاق غاز الهيدروجين.[100] يصبح هذا التفاعل أكثر قوة في المجموعة: يتفاعل الليثيوم بثبات مع الفوران ، ولكن يمكن أن يشتعل الصوديوم والبوتاسيوم ويغرق الروبيديوم والسيزيوم في الماء ويولد غاز الهيدروجين بسرعة كبيرة بحيث تتشكل موجات الصدمة في الماء التي قد تحطم الحاويات الزجاجية.[31] عندما يتم إسقاط معدن قلوي في الماء ، فإنه ينتج عنه انفجار يتكون من مرحلتين منفصلتين. يتفاعل المعدن مع الماء أولاً ، فيكسر الروابط الهيدروجينية في الماء وينتج غاز الهيدروجين ؛ يحدث هذا بشكل أسرع بالنسبة للمعادن القلوية الثقيلة الأكثر نشاطًا. ثانيًا ، غالبًا ما تؤدي الحرارة الناتجة عن الجزء الأول من التفاعل إلى إشعال غاز الهيدروجين ، مما يؤدي إلى احتراقه بشكل متفجر في الهواء المحيط. ينتج هذا الانفجار الثانوي لغاز الهيدروجين اللهب المرئي فوق وعاء الماء أو البحيرة أو أي جسم مائي آخر ، وليس التفاعل الأولي للمعدن مع الماء (والذي يحدث غالبًا تحت الماء).[72] هيدروكسيدات الفلزات القلوية هي أبسط أنواع الهيدروكسيدات المعروفة.[11] :87

اقترحت الأبحاث الحديثة أن السلوك المتفجر للمعادن القلوية في الماء ناتج عن انفجار كولوم وليس فقط من خلال التوليد السريع للهيدروجين نفسه.[105] تذوب جميع الفلزات القلوية كجزء من التفاعل مع الماء. تؤين جزيئات الماء السطح المعدني العاري للمعدن السائل ، تاركة سطحًا معدنيًا موجب الشحنة وأيونات الماء سالبة الشحنة. سيؤدي التجاذب بين المعدن المشحون وأيونات الماء إلى زيادة مساحة السطح بسرعة ، مما يؤدي إلى زيادة أسية في التأين. عندما تتجاوز قوى التنافر داخل سطح المعدن السائل قوى التوتر السطحي ، فإنها تنفجر بقوة.[105]
هيدروكسيدات أنفسهم هي هيدروكسيدات الأساسية المعروفة، والتفاعل مع الأحماض لإعطاء أملاح ومع الكحول لإعطاء بلازميدة قليلة القسيمات alkoxides . تتفاعل بسهولة مع ثاني أكسيد الكربون لتكوين كربونات أو بيكربونات ، أو مع كبريتيد الهيدروجين لتكوين كبريتيد أو ثنائي كبريتيد ، ويمكن استخدامها لفصل الثيول عن البترول. تتفاعل مع أكاسيد مذبذبة: على سبيل المثال ، تتفاعل أكاسيد الألومنيوم والزنك والقصدير والرصاص مع هيدروكسيدات الفلزات القلوية لإعطاء الألومينات والزنك والستانات والسبكات. ثاني أكسيد السيليكون حامضي ، وبالتالي فإن هيدروكسيدات الفلزات القلوية يمكنها أيضًا مهاجمة زجاج السيليكات .[11] :87
المركبات المعدنية

تشكل الفلزات القلوية العديد من المركبات بين المعادن مع بعضها البعض والعناصر من المجموعات من 2 إلى 13 في الجدول الدوري لقياسات متكافئة مختلفة ، [11] :81 مثل ملغم الصوديوم مع الزئبق ، بما في ذلك Na 5 Hg 8 و Na 3 Hg.[106] بعض هذه الخصائص لها خصائص أيونية: بأخذ السبائك مع الذهب ، أكثر المعادن كهرسلبية ، على سبيل المثال ، NaAu و KAu معدنان ، لكن RbAu و CsAu هما أشباه موصلات.[11] :81 NaK هي سبيكة من الصوديوم والبوتاسيوم مفيدة جدًا لأنها سائلة في درجة حرارة الغرفة ، على الرغم من أنه يجب اتخاذ الاحتياطات نظرًا لتفاعلها الشديد مع الماء والهواء. يذوب الخليط سهل الانصهار عند −12.6 درجة مئوية.[107] سبيكة من 41٪ سيزيوم ، 47٪ صوديوم ، و 12٪ بوتاسيوم لديها أقل نقطة انصهار معروفة لأي معدن أو سبيكة ، −78 درجة مئوية.[23]
مركبات مع عناصر المجموعة 13
المركبات المعدنية للفلزات القلوية ذات المجموعة الأثقل من 13 عنصرًا ( الألومنيوم ، الغاليوم ، الإنديوم ، والثاليوم ) ، مثل NaTl ، هي موصلات رديئة أو أشباه موصلات ، على عكس السبائك العادية التي تحتوي على العناصر السابقة ، مما يعني أن المعدن القلوي المعني به فقدت إلكتروناً لأنيونات الزنتل المتورطة.[108] ومع ذلك ، في حين أن العناصر في المجموعة 14 وما بعدها تميل إلى تكوين مجموعات أنيونية منفصلة ، تميل عناصر المجموعة 13 إلى تكوين أيونات بوليمرية مع الكاتيونات المعدنية القلوية الواقعة بين الشبكة الأيونية العملاقة. على سبيل المثال، NATL يتكون من أنيون البوليمر (-TL - -) ن مع التساهمية مكعب الماس هيكل مع نا + الأيونات الموجودة بين شعرية أنيوني. لا يمكن أن تتلاءم المعادن القلوية الأكبر بشكل مشابه مع شبكة أنيونية وتميل إلى إجبار المجموعة الأثقل 13 عنصرًا على تكوين مجموعات أنيونية.[109]
البورون حالة خاصة ، كونه المادة اللافلزية الوحيدة في المجموعة 13. تميل بوريدات الفلزات القلوية إلى أن تكون غنية بالبورون ، وتتضمن ارتباطًا ملموسًا بالبورون والبورون يتضمن هياكل دلتا السطوح ، [11] :147–8 وهي غير مستقرة حرارياً بسبب المعادن القلوية التي لها ضغط بخار مرتفع للغاية عند درجات حرارة مرتفعة. هذا يجعل التخليق المباشر مشكلة لأن الفلزات القلوية لا تتفاعل مع البورون أقل من 700 درجة مئوية ، وبالتالي يجب أن يتم ذلك في حاويات محكمة الغلق تحتوي على المعدن القلوي الزائد. علاوة على ذلك ، بشكل استثنائي في هذه المجموعة ، يقل التفاعل مع البورون إلى أسفل المجموعة: يتفاعل الليثيوم تمامًا عند 700 درجة مئوية ، ولكن الصوديوم عند 900 درجة مئوية والبوتاسيوم ليس حتى 1200 درجة مئوية ، ويكون التفاعل فوريًا مع الليثيوم ولكنه يستغرق ساعات للبوتاسيوم. لم يتم حتى تمييز بوريدات الروبيديوم والسيزيوم. تُعرف أطوار مختلفة ، مثل LiB 10 و NaB 6 و NaB 15 و KB 6 .[110][111] تحت الضغط العالي ، تتغير رابطة البورون والبورون في بوريدات الليثيوم من اتباع قواعد Wade إلى تكوين أنيونات Zintl مثل باقي المجموعة 13.[112]
مركبات مع مجموعة 14 عنصر


يتفاعل الليثيوم والصوديوم مع الكربون لتكوين أسيتيلات ، Li 2 C 2 و Na 2 C 2 ، والتي يمكن أيضًا الحصول عليها عن طريق تفاعل المعدن مع الأسيتيلين . يتفاعل البوتاسيوم والروبيديوم والسيزيوم مع الجرافيت ؛ يتم تقطيع ذراتها بين طبقات الجرافيت السداسية ، وتشكيل مركبات الجرافيت الإقحام للصيغ MC 60 (رمادي غامق ، أسود تقريبًا) ، MC 48 (رمادي غامق ، أسود تقريبًا) ، MC 36 (أزرق) ، MC 24 (أزرق فولاذي) ، و MC 8 (برونزي) (M = K أو Rb أو Cs). هذه المركبات موصلة للكهرباء أكثر من 200 مرة من الجرافيت النقي ، مما يشير إلى أن إلكترون التكافؤ للمعدن القلوي يتم نقله إلى طبقات الجرافيت (على سبيل المثال M+C8-</br> M+C8-</br> M+C8- ).[81] عند تسخين KC 8 ، ينتج عن التخلص من ذرات البوتاسيوم التحويل بالتسلسل إلى KC 24 و KC 36 و KC 48 وأخيراً KC 60 . KC 8 هو عامل اختزال قوي للغاية وهو قابل للاشتعال وينفجر عند ملامسته للماء.[113][114] في حين أن المعادن القلوية الأكبر (K و Rb و Cs) تشكل مبدئيًا MC 8 ، فإن المعادن الأصغر تشكل مبدئيًا MC 6 ، وتتطلب بالفعل تفاعل المعادن مع الجرافيت عند درجات حرارة عالية حوالي 500 درجة مئوية لتشكيل.[115] وبصرف النظر عن هذا، والفلزات القلوية هي هذه العوامل خفض قوي يتمكنوا حتى الحد بكمنستر لإنتاج الصلب fullerides M ن C 60. يمكن للصوديوم والبوتاسيوم والروبيديوم والسيزيوم تكوين الفوليريد حيث n = 2 أو 3 أو 4 أو 6 ، ويمكن أن يحقق الروبيديوم والسيزيوم بالإضافة إلى ذلك n = 1.[11] :285
عندما تتفاعل الفلزات القلوية مع العناصر الأثقل في مجموعة الكربون ( السيليكون والجرمانيوم والقصدير والرصاص ) ، تتشكل المواد الأيونية ذات الهياكل الشبيهة بالقفص ، مثل مبيدات السيليكون M 4 Si 4 (M = K ، Rb ، أو Cs) ، والذي يحتوي على M + ورباعي السطوح Si44-</br> Si44- أيونات.[81] كيمياء الجيرمانيدات الفلزية القلوية ، بما في ذلك أيون جيرمانيد Ge 4− وأيونات الكتلة الأخرى ( Zintl ) مثل Ge42-</br> Ge42- ، Ge94-</br> Ge94- ، Ge92-</br> Ge92- ، و [(Ge 9 ) 2 ] 6− ، مشابه إلى حد كبير لتلك الخاصة بمبيدات السيليكات المقابلة.[11] :393 ستانيدات الفلزات القلوية معظمها أيوني ، وأحيانًا مع أيون ستانيد ( Sn 4− ) ، [109] وأحيانًا مع أيونات Zintl أكثر تعقيدًا مثل Sn94-</br> Sn94- ، الذي يظهر في رباعي بوتاسيوم نوناستانيد (K 4 Sn 9 ).[116] أيون بلومبيد أحادي الذرة ( Pb 4− ) غير معروف ، وبالتأكيد من المتوقع أن يكون تكوينه غير ملائم للطاقة ؛ تحتوي بلومبيدات المعادن القلوية على أيونات زينتل معقدة ، مثل Pb94-</br> Pb94- . يمكن إنتاج هذه الجرمانيوميدات المعدنية القلوية والستانيدات والبلومبيدات عن طريق تقليل الجرمانيوم والقصدير والرصاص بمعدن الصوديوم في الأمونيا السائلة.[11] :394
النتريد والبنيكتيدات
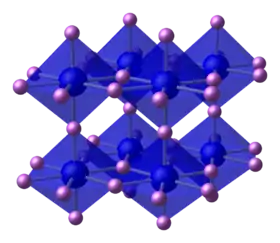
الليثيوم ، أخف الفلزات القلوية ، هو المعدن القلوي الوحيد الذي يتفاعل مع النيتروجين في الظروف القياسية ، ونتريده هو نيتريد الفلزات القلوية الوحيد المستقر. النيتروجين هو غاز غير متفاعل لأن كسر الرابطة الثلاثية القوية في جزيء ثنائي النيتروجين (N 2 ) يتطلب الكثير من الطاقة. من شأن تكوين نيتريد فلز قلوي أن يستهلك طاقة التأين للمعدن القلوي (مكونًا أيونات M + ) ، والطاقة اللازمة لكسر الرابطة الثلاثية في N 2 وتكوين أيونات N 3− ، وكل الطاقة المنبعثة من يتم تكوين نيتريد فلز قلوي من الطاقة الشبكية لنتريد فلز قلوي. يتم تعظيم طاقة الشبكة بواسطة أيونات صغيرة عالية الشحنة لا تشكل الفلزات القلوية أيونات مشحونة بشدة ، وتشكل فقط أيونات بشحنة +1 ، لذلك فقط الليثيوم ، أصغر فلز قلوي ، يمكنه إطلاق طاقة شبكية كافية لجعل التفاعل مع النيتروجين طاردًا للحرارة ، مكونًا نيتريد الليثيوم . تفاعلات الفلزات القلوية الأخرى مع النيتروجين لن تطلق طاقة شبكية كافية وبالتالي ستكون ماصة للحرارة ، لذا فهي لا تشكل نيتريدات في الظروف القياسية.[83] نيتريد الصوديوم (Na 3 N) ونيتريد البوتاسيوم (K 3 N) ، على الرغم من وجودهما ، غير مستقرين للغاية ، وعرضة للتحلل مرة أخرى إلى العناصر المكونة لهما ، ولا يمكن إنتاجهما عن طريق تفاعل العناصر مع بعضها البعض في الظروف القياسية.[118][119] يمنع العائق التعقيم وجود نيتريد الروبيديوم أو السيزيوم.[11] :417 ومع ذلك ، فإن الصوديوم والبوتاسيوم يشكلان أملاح أزيد عديمة اللون تشتمل على N3- الخطي N3-</br> N3- أنيون نظرًا للحجم الكبير للكاتيونات المعدنية القلوية ، فهي مستقرة حرارياً بما يكفي لتذوب قبل التحلل.[11] :417
تتفاعل جميع المعادن القلوية بسهولة مع الفوسفور والزرنيخ لتكوين الفوسفات والزرنيخ بالصيغة M 3 Pn (حيث يمثل M معدنًا قلويًا ويمثل Pn مادة pnictogen - الفوسفور أو الزرنيخ أو الأنتيمون أو البزموت ). ويرجع ذلك إلى الحجم الأكبر لـ P 3− و As 3− أيونات ، لذلك يجب إطلاق طاقة شعرية أقل لتكوين الأملاح.[81] هذه ليست الفوسفات والزرنيخيدات الوحيدة للمعادن القلوية: على سبيل المثال ، يحتوي البوتاسيوم على تسعة أنواع مختلفة من الفوسفيدات المعروفة ، مع الصيغ K 3 P ، K 4 P 3 ، K 5 P 4 ، KP ، K 4 P 6 ، K 3 P 7 و K 3 P 11 و KP 10.3 و KP 15 .[120] في حين أن معظم المعادن تشكل الزرنيخ ، إلا أن الفلزات الأرضية القلوية والقلوية فقط تشكل الزرنيخ الأيوني. هيكل Na 3 As معقد مع مسافات Na-Na قصيرة بشكل غير معتاد من 328-330 ميكرومتر وهي أقصر من معدن الصوديوم ، وهذا يشير إلى أنه حتى مع هذه المعادن الإلكتروضوية ، لا يمكن أن يكون الترابط أيونيًا بشكل مباشر.[11] زرنيخيدات الفلزات القلوية الأخرى غير المطابقة للصيغة M 3 كما هو معروف ، مثل LiAs ، التي لها بريق معدني وموصلية كهربائية تشير إلى وجود بعض الروابط المعدنية .[11] مضادات الأنتيمون غير مستقرة ومتفاعلة حيث أن Sb 3− أيون عامل اختزال قوي ؛ تفاعلها مع الأحماض يشكل ستيبين الغازات السامة وغير المستقرة (SbH 3 ).[121] في الواقع ، لديهم بعض الخصائص المعدنية ، وأنتيمونيدات الفلزات القلوية في القياس المتكافئ MSb تشتمل على ذرات الأنتيمون المرتبطة في هيكل Zintl حلزوني.[122] البزموتيدات ليست حتى أيونية بالكامل ؛ وهي مركبات بين المعادن تحتوي على روابط معدنية جزئية وجزئية أيونية.[123]
أكاسيد وكالكوجينيدات


تتفاعل جميع المعادن القلوية بقوة مع الأكسجين في الظروف القياسية. تشكل أنواعًا مختلفة من الأكاسيد ، مثل الأكاسيد البسيطة (التي تحتوي على O 2 O أيون) ، والبيروكسيدات (التي تحتوي على O22-</br> O22- أيون ، حيث توجد رابطة واحدة بين ذرتي الأكسجين) ، والأكسجين الفائق (يحتوي على O2-</br> O2- أيون) ، وغيرها الكثير. يحترق الليثيوم في الهواء ليشكل أكسيد الليثيوم ، لكن الصوديوم يتفاعل مع الأكسجين لتكوين خليط من أكسيد الصوديوم وبيروكسيد الصوديوم . يشكل البوتاسيوم مزيجًا من بيروكسيد البوتاسيوم وفوق أكسيد البوتاسيوم ، بينما يشكل الروبيديوم والسيزيوم الفائق الأكسيد حصريًا. تزيد تفاعلهم مع مرور الوقت في المجموعة: بينما يحترق الليثيوم والصوديوم والبوتاسيوم في الهواء ، فإن الروبيديوم والسيزيوم يكونان قابلين للاشتعال ( يشتعلان تلقائيًا في الهواء).[83] تميل المعادن القلوية الأصغر إلى استقطاب الأنيونات الكبيرة (البيروكسيد والأكسيد الفائق) نظرًا لصغر حجمها. هذا يجذب الإلكترونات الموجودة في الأنيونات الأكثر تعقيدًا نحو إحدى ذرات الأكسجين المكونة لها ، مكونًا أيون أكسيد وذرة أكسجين. يؤدي هذا إلى تكوين أكسيد الليثيوم حصريًا عند التفاعل مع الأكسجين عند درجة حرارة الغرفة. يصبح هذا التأثير أضعف بشكل كبير بالنسبة للصوديوم والبوتاسيوم الأكبر حجمًا ، مما يسمح لهما بتكوين بيروكسيدات أقل استقرارًا. الروبيديوم والسيزيوم ، في الجزء السفلي من المجموعة ، كبير جدًا لدرجة أنه حتى أقل الأكسيدات الفائقة استقرارًا يمكن أن تتشكل. نظرًا لأن الأكسيد الفائق يطلق أكبر قدر من الطاقة عند تكوينه ، يتم تكوين الأكسيد الفائق بشكل تفضيلي للمعادن القلوية الأكبر حيث لا يتم استقطاب الأنيونات الأكثر تعقيدًا. (توجد أكاسيد وبيروكسيدات هذه الفلزات القلوية ، ولكنها لا تتشكل عند التفاعل المباشر للمعدن مع الأكسجين في الظروف القياسية. ) [83] بالإضافة إلى ذلك ، يساهم الحجم الصغير لأيونات Li + و O 2− في تكوين بنية شبكية أيونية مستقرة. ومع ذلك ، في ظل ظروف خاضعة للرقابة ، من المعروف أن جميع الفلزات القلوية ، باستثناء الفرانسيوم ، تشكل أكاسيدها وبيروكسيداتها وأكسيدها الفائقة. تعتبر بيروكسيدات الفلزات القلوية والأكسدة الفائقة عوامل مؤكسدة قوية. يتفاعل بيروكسيد الصوديوم وفوق أكسيد البوتاسيوم مع ثاني أكسيد الكربون لتكوين كربونات المعدن القلوي وغاز الأكسجين ، مما يسمح باستخدامهما في أجهزة تنقية الهواء تحت الماء ؛ إن وجود بخار الماء ، الموجود بشكل طبيعي في التنفس ، يجعل إزالة ثاني أكسيد الكربون بواسطة فائق أكسيد البوتاسيوم أكثر كفاءة.[81][124] يمكن أن تشكل جميع المعادن القلوية المستقرة باستثناء الليثيوم أوزونيدات حمراء (MO 3 ) من خلال تفاعل درجات الحرارة المنخفضة لمسحوق هيدروكسيد اللامائي مع الأوزون : يمكن بعد ذلك استخراج الأوزون باستخدام الأمونيا السائلة. تتحلل ببطء في الظروف القياسية إلى الأكسيدات الفائقة والأكسجين ، وتتحلل على الفور إلى الهيدروكسيدات عند ملامستها للماء.[11] :85 يشكل البوتاسيوم والروبيديوم والسيزيوم أيضًا sesquioxides M 2 O 3 ، والتي من الأفضل اعتبارها ثنائيات فوق أكسيد البيروكسيد ، [(M+)4(O22-)(O2-)2]</br> [(M+)4(O22-)(O2-)2]</br> [(M+)4(O22-)(O2-)2]</br> [(M+)4(O22-)(O2-)2]</br> [(M+)4(O22-)(O2-)2]</br> [(M+)4(O22-)(O2-)2] .[11] :85
يمكن أن يشكل الروبيديوم والسيزيوم مجموعة كبيرة ومتنوعة من الأكاسيد الفرعية مع المعادن في حالات الأكسدة الرسمية تحت +1.[11] :85 يمكن أن يشكل الروبيديوم Rb 6 O و Rb 9 O 2 (نحاسي اللون) عند الأكسدة في الهواء ، بينما يشكل السيزيوم مجموعة متنوعة هائلة من الأكاسيد ، مثل الأوزون CsO 3 [125][126] والعديد من الأكاسيد الفرعية الملونة الزاهية ، [127] مثل Cs 7 O (برونزي) ، Cs 4 O (أحمر بنفسجي) ، Cs 11 O 3 (بنفسجي) ، Cs 3 O (أخضر داكن) ، [128] CsO ، Cs 3 O 2 ، [129] أيضًا مثل Cs 7 O 2 .[130][131] قد يتم تسخين آخرها تحت فراغ لتوليد Cs 2 O.[58]
يمكن أن تتفاعل الفلزات القلوية أيضًا بشكل مشابه مع الكالكوجينات الأثقل ( الكبريت والسيلينيوم والتيلوريوم والبولونيوم ) ، وجميع مركبات الكالكوجينيدات القلوية معروفة (باستثناء الفرانسيوم). يمكن أن يؤدي التفاعل مع وجود فائض من الكالكوجين بالمثل إلى انخفاض الكالكوجينيدات ، حيث تحتوي أيونات الكالكوجين على سلاسل من ذرات الكالكوجين المعنية. على سبيل المثال ، يمكن أن يتفاعل الصوديوم مع الكبريت لتكوين الكبريتيد ( Na 2 S ) والعديد من polysulfides بالصيغة Na 2 S x ( x من 2 إلى 6) ، التي تحتوي على Sx2-</br> Sx2- أيونات.[81] ويرجع ذلك إلى قاعدية للسي 2- وتي 2- الأيونات، القلوي المعدنية selenides وtellurides القلوية في حل. عندما تتفاعل مباشرة مع السيلينيوم والتيلوريوم ، تتشكل polyselenides الفلزية القلوية و polytellurides جنبًا إلى جنب مع selenides و tellurides مع Sex2-</br> Sex2- و Tex2-</br> Tex2- أيونات.[132] يمكن الحصول عليها مباشرة من العناصر الموجودة في الأمونيا السائلة أو في حالة عدم وجود الهواء ، وهي مركبات عديمة اللون وقابلة للذوبان في الماء يتأكسدها الهواء بسرعة إلى السيلينيوم أو التيلوريوم.[11] :766 إن بولونيدات الفلزات القلوية عبارة عن مركبات أيونية تحتوي على Po 2− أيون ؛ وهي مستقرة كيميائيًا ويمكن إنتاجها بالتفاعل المباشر للعناصر عند حوالي 300-400 درجة مئوية.[11] :766 [133][134]
الهاليدات والهيدرات والهاليدات الكاذبة
الفلزات القلوية هي من بين أكثر كهربي العناصر في الجدول الدوري، وبالتالي تميل إلى السندات ionically لأكثر كهربية العناصر في الجدول الدوري، و الهالوجينات ( الفلور ، الكلور ، البروم ، اليود ، و أستاتين )، وتشكيل الأملاح المعروفة باسم القلويات هاليدات معدنية. يكون رد الفعل قويًا جدًا ويمكن أن يؤدي في بعض الأحيان إلى حدوث انفجارات.[11] :76 جميع هاليدات الفلزات القلوية العشرين المستقرة معروفة ؛ غير المستقرة غير معروفة ، باستثناء أستاتيد الصوديوم ، بسبب عدم الاستقرار الكبير وندرة الأستاتين والفرانسيوم. الأكثر شهرة من بين العشرين هو بالتأكيد كلوريد الصوديوم ، والمعروف باسم الملح الشائع. جميع هاليدات الفلزات القلوية المستقرة لها الصيغة MX حيث M عبارة عن معدن قلوي و X عبارة عن هالوجين. كلها مواد صلبة بلورية أيونية بيضاء لها نقاط انصهار عالية.[31][83] جميع هاليدات الفلزات القلوية قابلة للذوبان في الماء باستثناء فلوريد الليثيوم (LiF) ، وهو غير قابل للذوبان في الماء بسبب المحتوى الحراري الشبكي العالي للغاية. هو المحتوى الحراري عالية شعرية من الليثيوم فلوريد يرجع ذلك إلى أحجام صغيرة من لي + وF - أيونات، مما تسبب في التفاعلات كهرباء بينهما أن تكون قوية:[31] يحدث تأثير مماثل ل المغنيسيوم الفلوريد ، بما يتفق مع العلاقة قطري بين الليثيوم والمغنيسيوم.[11] :76
تتفاعل الفلزات القلوية أيضًا بشكل مشابه مع الهيدروجين لتكوين هيدرات فلزية قلوية أيونية ، حيث يعمل أنيون الهيدريد مثل الهيدريد الكاذب : غالبًا ما تستخدم هذه كعوامل اختزال ، وإنتاج الهيدريدات ، وهيدرات المعادن المعقدة ، أو غاز الهيدروجين.[11] :83 [81] الهاليدات الكاذبة الأخرى معروفة أيضًا ، ولا سيما السيانيد . هذه هي هياكل متساوية للهاليدات الخاصة باستثناء سيانيد الليثيوم ، مما يشير إلى أن أيونات السيانيد قد تدور بحرية.[11] :322 تُعرف أيضًا أكاسيد هاليد الفلزات القلوية الثلاثية ، مثل Na 3 ClO ، و K 3 BrO (أصفر) ، و Na 4 Br 2 O ، و Na 4 I 2 O ، و K 4 Br 2 O.[11] :83 تعد البوليهيدات غير مستقرة إلى حد ما ، على الرغم من استقرار تلك الموجودة في الروبيديوم والسيزيوم إلى حد كبير بسبب قوة الاستقطاب الضعيفة لهذه الكاتيونات الكبيرة للغاية.[11] :835
مجمعات التنسيق
لا تشكل الكاتيونات الفلزية القلوية عادة معقدات تنسيق مع قواعد لويس البسيطة بسبب شحنتها المنخفضة التي تبلغ +1 فقط وحجمها الكبير نسبيًا ؛ وبالتالي فإن أيون Li + يشكل معظم المعقدات وتتشكل أيونات المعادن القلوية الثقيلة أقل وأقل (على الرغم من حدوث استثناءات للمجمعات الضعيفة).[11] :90 يحتوي الليثيوم على وجه الخصوص على كيمياء تنسيق غنية جدًا حيث يعرض أرقام التنسيق من 1 إلى 12 ، على الرغم من أن التنسيق السداسي ثماني السطوح هو وضعه المفضل.[11] :90–1 في محلول مائي ، توجد أيونات الفلزات القلوية كمجمعات سداسي هيدرات ثماني السطوح ([M (H 2 O) 6 )] + ) ، باستثناء أيون الليثيوم ، والذي يشكل مجمعات رباعي الهيدرات بسبب صغر حجمه ([Li (H 2 س) 4 )] + ) ؛ تشكل الفلزات القلوية هذه المعقدات لأن أيوناتها تنجذب بواسطة قوى الجذب الكهروستاتيكية إلى جزيئات الماء القطبية. لهذا السبب ، غالبًا ما تستخدم الأملاح اللامائية التي تحتوي على كاتيونات فلزية قلوية كمجففات .[81] تشكل المعادن القلوية أيضًا معقدات بسهولة مع إيثرات التاج (على سبيل المثال 12-crown-4 لـ Li + و 15-crown-5 لـ Na + و 18-crown-6 لـ K + و 21-crown-7 لـ Rb + ) والأشفار بسبب جاذبية الكهرباء الساكنة.[81]
محاليل الأمونيا
تذوب الفلزات القلوية ببطء في الأمونيا السائلة ، وتشكل محاليل الأمونيا من الكاتيونات المعدنية المذابة M + والإلكترون المذاب e - ، والتي تتفاعل لتكوين غاز الهيدروجين وأميد الفلز القلوي (MNH 2 ، حيث M يمثل فلز قلوي): كان هذا أولاً لاحظه همفري ديفي عام 1809 وأعاد اكتشافه من قبل دبليو ويل عام 1864. يمكن تسريع العملية بواسطة محفز . يتم تشكيل حلول مماثلة من المعادن الثقيلة القلوية الأرضية ثنائية التكافؤ كالسيوم ، السترونتيوم ، الباريوم ، وكذلك اللانثانيدات ثنائية التكافؤ ، اليوروبيوم والإيتربيوم . ملح الأميد غير قابل للذوبان تمامًا ويتسرب بسهولة من المحلول ، تاركًا محاليل الأمونيا شديدة التلوين للمعادن القلوية. في عام 1907 ، حدد تشارلز كراوس أن اللون يرجع إلى وجود إلكترونات مذابة ، والتي تساهم في التوصيل الكهربائي العالي لهذه الحلول. بتركيزات منخفضة (أقل من 3 م) ، يكون المحلول أزرق داكن وله موصلية كلوريد الصوديوم المائي بعشرة أضعاف ؛ بتركيزات أعلى (أعلى من 3 م) ، يكون المحلول نحاسي اللون وله موصلية تقريبية للمعادن السائلة مثل الزئبق .[11][81][135] بالإضافة إلى ملح أميد الفلز القلوي والإلكترونات المذابة ، تحتوي محاليل الأمونيا هذه أيضًا على كاتيون فلز قلوي (M + ) ، ذرة فلز قلوي محايد (M) ، جزيئات فلز قلوي ثنائي الذرة (M 2 ) وأنيونات فلز قلوي (M - ). هذه غير مستقرة وتصبح في نهاية المطاف أكثر المعادن القلوية ثباتًا من الناحية الديناميكية الحرارية أميد وغاز الهيدروجين. الإلكترونات المذابة هي عوامل اختزال قوية وغالبًا ما تستخدم في التخليق الكيميائي.[81]
عضوي
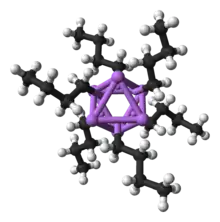
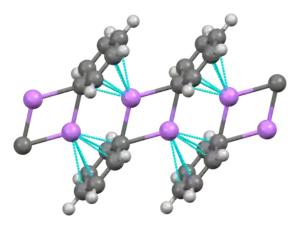
نظرًا لكونه أصغر معدن قلوي ، فإن الليثيوم يشكل أكبر مجموعة متنوعة من المركبات العضوية المعدنية وأكثرها استقرارًا ، والتي ترتبط تساهميًا. المركبات العضوية الليثيوم هي مواد صلبة أو سوائل غير موصلة للكهرباء تذوب في درجات حرارة منخفضة ، وتميل إلى تكوين أوليغومرات مع التركيب (RLi) x حيث R هي المجموعة العضوية. وبما أن طبيعة كهربي من يضع الليثيوم أكثر من كثافة الشحنة من السندات على ذرة الكربون، على نحو فعال خلق أنيون كربوني ، organolithium المركبات هي قوية للغاية قواعد ومحب للنواة . لاستخدامها كقواعد ، غالبًا ما يتم استخدام البيوتيليثيوم ومتاح تجاريًا. مثال على مركب عضوي من الليثيوم هو ميثيل الليثيوم ((CH 3 Li) x ) ، والذي يوجد في شكل رباعي السطوح ( x = 4 ، رباعي السطوح) وسداسي السطوح ( x = 6 ، ثماني السطوح).[81][139] تعتبر مركبات الليثيوم العضوية ، وخاصة n -butyllithium ، كواشف مفيدة في التخليق العضوي ، كما هو متوقع نظرًا لعلاقة الليثيوم القطرية مع المغنيسيوم ، والتي تلعب دورًا مهمًا في تفاعل Grignard .[11] :102 على سبيل المثال ، يمكن استخدام الألكليثيوم والأريليثيوم لتخليق الألدهيدات والكيتونات عن طريق التفاعل مع مركبات الكربونيل المعدنية. التفاعل مع النيكل رباعي الكربونيل ، على سبيل المثال ، يستمر من خلال معقد أسيل نيكل كربونيل غير مستقر والذي يخضع بعد ذلك لاستبدال الإلكتروفيليك لإعطاء الألدهيد المطلوب (باستخدام H + كملف كهربائي) أو كيتون (باستخدام منتج هاليد ألكيل).[11] :105
- LiR + [Ni (CO) 4 ] −CO → Li + [RCONi (CO) 3 ] -
- Li + [RCONi (CO) 3 ] - H+ → المذيب Li + + RCHO + [(المذيب) Ni (CO) 3 ]
- Li + [RCONi (CO) 3 ] - R'Br → المذيب Li + + R'COR + [(المذيب) Ni (CO) 3 ]
Alkyllithiums وaryllithiums قد تتفاعل أيضا مع N، N -disubstituted الاميدات لإعطاء الألدهيدات والكيتونات، والكيتونات متناظرة عن طريق تفاعل مع أول أكسيد الكربون . تتحلل حرارياً للتخلص من هيدروجين بيتا ، وتنتج الألكينات وهيدريد الليثيوم : وهناك طريق آخر هو تفاعل الإيثرات مع الألكيل والأريليثيوم التي تعمل كقواعد قوية.[11] :105 في المذيبات غير القطبية ، تتفاعل الأريليثيوم مثل الكربونات التي تتفاعل معها بشكل فعال ، مما يؤدي إلى تحويل ثاني أكسيد الكربون إلى أحماض كربوكسيلية عطرية (ArCO 2 H) وكيتونات أريل إلى كربنولات من الدرجة الثالثة (Ar ' 2 C (Ar) OH). أخيرًا ، يمكن استخدامها لتخليق مركبات فلزية عضوية أخرى من خلال تبادل المعادن والهالوجين.[11] :106
معادن قلوية أثقل
على عكس مركبات الليثيوم العضوية ، فإن المركبات العضوية المعدنية للمعادن القلوية الثقيلة هي في الغالب أيونية. إن استخدام مركبات الصوديوم العضوية في الكيمياء محدود جزئياً بسبب المنافسة من مركبات الليثيوم العضوية ، المتوفرة تجارياً والتي تظهر تفاعلاً أكثر ملاءمة. مركب الصوديوم العضوي الرئيسي ذو الأهمية التجارية هو سيكلوبنتادينيد الصوديوم . يمكن أيضًا تصنيف tetraphenylborate الصوديوم كمركب عضوي صوديوم حيث يرتبط الصوديوم في الحالة الصلبة بمجموعات الأريل. المركبات العضوية الفلزية من الفلزات القلوية الأعلى تفاعلية أكثر من مركبات الصوديوم العضوية وذات فائدة محدودة. A كاشف الملحوظ هو قاعدة شلوسر ل ، وهي مزيج من ن -butyllithium والبوتاسيوم ثلاثي -butoxide . يتفاعل هذا الكاشف مع البروبين لتكوين مركب الأليل البوتاسيوم (KCH 2 CHCH 2 ). تتوازن رابطة الدول المستقلة -2-بيوتين وعبر -2-بيوتين عند ملامستها للمعادن القلوية. في حين أن الأزمرة سريعة مع الليثيوم والصوديوم ، فهي بطيئة مع المعادن القلوية الثقيلة. تفضل الفلزات القلوية الثقيلة أيضًا التشكل المزدحم جسيميًا .[140] تم الإبلاغ عن العديد من التركيبات البلورية لمركبات البوتاسيوم العضوي ، مما يثبت أنها ، مثل مركبات الصوديوم ، بوليمرية.[141] مركبات الصوديوم العضوية والبوتاسيوم العضوي والأوروبيديوم العضوي ومركبات أورجانيزيوم هي في الغالب أيونية وغير قابلة للذوبان (أو تقريبًا) في المذيبات غير القطبية [81]
تميل مشتقات الألكيل والأريل للصوديوم والبوتاسيوم إلى التفاعل مع الهواء. أنها تسبب انقسام الإيثرات ، وتولد ألكوكسيدات. على عكس مركبات الألكيلليثيوم ، لا يمكن تصنيع ألكيل صوديوم وألكيل بوتاسيوم عن طريق تفاعل المعادن مع هاليدات الألكيل لأن اقتران Wurtz يحدث:[122] :265
- RM + R'X → R – R '+ MX
على هذا النحو ، يجب أن يتم تصنيعها عن طريق تفاعل مركبات ألكيل الزئبق مع معدن الصوديوم أو البوتاسيوم في مذيبات هيدروكربونية خاملة. في حين أن ميثيل الصوديوم يشكل رباعيات مثل ميثيل الليثيوم ، فإن ميثيل بوتاسيوم أيوني أكثر وله بنية زرنيخيد النيكل مع أنيونات الميثيل المنفصلة وكاتيونات البوتاسيوم.[122] :265
تتفاعل الفلزات القلوية وهيدراتها مع الهيدروكربونات الحمضية ، على سبيل المثال البنتادين الحلقي والألكينات الطرفية ، لإعطاء الأملاح. يتم استخدام الأمونيا السائلة أو الإيثر أو المذيبات الهيدروكربونية ، وأكثرها شيوعًا هو رباعي هيدرو الفوران . أهم هذه المركبات هو الصوديوم حلقي البنتادينيد ، NaC 5 H 5 ، وهو مقدمة هامة للعديد من مشتقات البنتادينيل المعدنية الانتقالية.[122] :265 وبالمثل ، تتفاعل الفلزات القلوية مع سيكلوكتاتيترين في رباعي هيدرو فوران لإعطاء فلز قلوي سيكلوكتاتيتراينيدات ؛ على سبيل المثال، dipotassium cyclooctatetraenide (K 2 C 8 H 8) هو السلائف المهم أن العديد من المشتقات cyclooctatetraenyl المعدنية، مثل يورانوسين .[122] يمكن أن تعمل الكاتيونات المعدنية القلوية الكبيرة وذات الاستقطاب الضعيف جدًا على تثبيت الأنيونات الجذرية الكبيرة والعطرية القابلة للاستقطاب ، مثل نفثالينيد الصوديوم الأخضر الداكن ، Na + [C 10 H 8 •] - ، عامل اختزال قوي.[122] :266
ردود الفعل التمثيلية للمعادن القلوية
تفاعل مع الأكسجين
على التفاعل مع الأكسجين، والفلزات القلوية تشكل أكاسيد ، البيروكسيدات ، أكسيد فائق وsuboxides . ومع ذلك ، فإن الثلاثة الأولى أكثر شيوعًا. يوضح الجدول أدناه [142] أنواع المركبات المتكونة بالتفاعل مع الأكسجين. يمثل المركب الموجود بين قوسين المنتج الثانوي للاحتراق.
| الفلزات القلوية | أكسيد | بيروكسيد | الأكسيد الفائق |
| لي | Li 2 O | (لي 2 يا 2 ) | |
| نا | (نا 2 يا) | Na 2 O 2 | |
| ك | KO 2 | ||
| م | RbO 2 | ||
| سي اس | CsO 2 |
بيروكسيدات الفلزات القلوية هي مركبات أيونية غير مستقرة في الماء. يرتبط أنيون البيروكسيد ارتباطًا ضعيفًا بالكاتيون ، ويتحلل بالماء ، مكونًا روابط تساهمية أقوى.
- Na 2 O 2 + 2H 2 O → 2NaOH + H 2 O 2
- كما أن مركبات الأكسجين الأخرى غير مستقرة في الماء.
- 2KO 2 + 2H 2 O → 2KOH + H 2 O 2 + O 2 [143]
- Li 2 O + H 2 O → 2LiOH
تفاعل مع الكبريت
- مع الكبريت ، فإنها تشكل الكبريتيدات وعديد الكبريتيدات.[144]
- 2Na + 1 / 8S 8 → Na 2 S + 1 / 8S 8 → Na 2 S 2 . . . Na 2 S 7 لأن كبريتيدات الفلزات القلوية هي في الأساس أملاح لحمض ضعيف وقاعدة قوية ، فإنها تشكل الحلول الأساسية.
- S 2- + H 2 O → HS - + H O -
- HS - + H 2 O → H 2 S + H O -
التفاعل مع النيتروجين
- الليثيوم هو المعدن الوحيد الذي يتحد مباشرة مع النيتروجين في درجة حرارة الغرفة.
- 3Li + 1 / 3N 2 → Li 3 N
- يمكن أن يتفاعل Li 3 N مع الماء لتحرير الأمونيا.
- Li 3 N + 3H 2 O → 3LiOH + NH 3
تفاعل مع الهيدروجين
مع الهيدروجين ، تشكل الفلزات القلوية هيدرات ملحية تتحلل في الماء.
- Na + H 2 → NaH (في درجات حرارة عالية)
- NaH + H 2 O → NaOH + H 2
التفاعل مع الكربون
الليثيوم هو المعدن الوحيد الذي يتفاعل مباشرة مع الكربون ليعطي أسيتيل الديليثيوم. يمكن أن يتفاعل Na و K مع الأسيتيلين لإعطاء الأسيتيلات.[145]
- 2Li + 2C → Li 2 C 2
- نا + C 2 H 2 → بريدا 2 H + 1 / 2H 2 (في 150 0 C)
- نا + بريدا 2 H → نا 2 C 2 (في 220 0 C)
رد فعل مع الماء
عند التفاعل مع الماء ، فإنها تولد أيونات الهيدروكسيد وغاز الهيدروجين . يكون هذا التفاعل قويًا وطاردًا للحرارة بدرجة عالية ، وقد يشتعل الهيدروجين الناتج في الهواء أو حتى ينفجر في حالة Rb و Cs.[142]
- Na + H 2 O → NaOH + 1/2H 2
التفاعل مع أملاح أخرى
الفلزات القلوية عوامل اختزال جيدة جدا. يمكنها تقليل الكاتيونات المعدنية الأقل حساسية للكهرباء. التيتانيوم ينتج صناعيا عن طريق الحد من رابع كلوريد التيتانيوم مع نا في 400 0 (C العملية فان Arkel ).
- TiCl 4 + 4Na → 4NaCl + Ti
التفاعل مع مركبات الهاليد العضوية
تتفاعل الفلزات القلوية مع مشتقات الهالوجين لتوليد الهيدروكربون عبر تفاعل Wurtz .
- 2CH 3 -Cl + 2Na → H 3 C-CH 3 + 2NaCl
المعادن القلوية في الأمونيا السائلة
تذوب المعادن القلوية في الأمونيا السائلة أو مذيبات مانحة أخرى مثل الأمينات الأليفاتية أو سداسي ميثيل فوسفوراميد لإعطاء المحاليل الزرقاء. يعتقد أن هذه الحلول تحتوي على إلكترونات حرة.[142]
- Na + xNH 3 → Na + + e (NH 3 ) x -
- نظرًا لوجود إلكترونات مذابة ، فإن هذه المحاليل هي عوامل اختزال قوية جدًا تستخدم في التخليق العضوي.
 تفاعلات الاختزال باستخدام الصوديوم في الأمونيا السائلة
تفاعلات الاختزال باستخدام الصوديوم في الأمونيا السائلة- ق 8 + 2e - → S 8 2-
- Fe (CO) 5 + 2e - → Fe (CO) 4 2- + CO
ملحقات

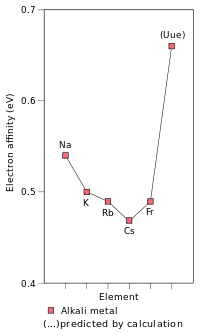
على الرغم من أن الفرانسيوم هو أثقل معدن قلوي تم اكتشافه ، إلا أن هناك بعض الأعمال النظرية التي تتنبأ بالخصائص الفيزيائية والكيميائية للمعادن القلوية الثقيلة الافتراضية. نظرًا لكونه العنصر الأول في الفترة 8 ، فمن المتوقع أن يكون العنصر غير المكتشف (العنصر 119) هو المعدن القلوي التالي بعد الفرانسيوم ويتصرف مثل متجانساته الأخف وزناً ؛ ومع ذلك ، فمن المتوقع أيضًا أن تختلف عن المعادن القلوية الأخف في بعض الخصائص.[38] :1729–1730 من المتوقع أن تكون :1729–1730 أقرب إلى تلك الموجودة في البوتاسيوم [43] أو الروبيديوم [38] :1729–1730 بدلاً من السيزيوم أو الفرانسيوم. هذا أمر غير معتاد حيث أن الاتجاهات الدورية ، فإن تجاهل التأثيرات النسبية من شأنه أن يتنبأ بأن فترة عدم الألفية ستكون أكثر تفاعلًا من السيزيوم والفرنسيوم. يرجع هذا الانخفاض في التفاعل إلى الاستقرار النسبي لإلكترون التكافؤ الخاص بـ ununenen ، مما يؤدي إلى زيادة طاقة التأين الأولى لـ ununence وتقليل نصف القطر المعدني والأيوني ؛ [43] وقد لوحظ هذا التأثير بالفعل بالنسبة للفرانسيوم.[38] :1729–1730 هذا يفترض أن ununennial سوف تتصرف كيميائيًا كمعدن قلوي ، والذي ، على الرغم من احتماله ، قد لا يكون صحيحًا بسبب التأثيرات النسبية.[147] كما أن الاستقرار النسبي لمدار 8s يزيد أيضًا من تقارب الإلكترون الخاص بـ ununennial بما يتجاوز كثيرًا تقارب السيزيوم والفرانسيوم ؛ في الواقع ، من المتوقع أن يكون هناك تقارب إلكتروني أعلى من جميع الفلزات القلوية الأخف منه. تتسبب التأثيرات النسبية أيضًا في انخفاض كبير جدًا في قابلية الاستقطاب في فترة ununence.[38] :1729–1730 من ناحية أخرى ، من المتوقع أن تستمر فترة الاتحاد في اتجاه انخفاض نقاط الانصهار إلى أسفل المجموعة ، ومن المتوقع أن يكون لها نقطة انصهار بين 0 درجة مئوية و 30 درجة مئوية.[38] :1724
إن استقرار إلكترون التكافؤ الخاص بـ ununenth وبالتالي تقلص مدار 8s تسبب في خفض نصف قطرها الذري إلى 240 م ، [38] :1729–1730 قريبة جدًا من روبيديوم (247 م) ، [31] بحيث يجب أن تكون كيمياء الألفاظ في حالة الأكسدة +1 أكثر تشابهًا مع كيمياء الروبيديوم منها بالنسبة لكيمياء الفرانسيوم. من ناحية أخرى ، من المتوقع أن يكون نصف القطر الأيوني لأيون Uue + أكبر من Rb + ، لأن المدارات 7p تتزعزع وبالتالي تكون أكبر من المدارات p للأصداف السفلية. قد تُظهر Ununuence أيضًا حالة الأكسدة +3 ، [38] :1729–1730 التي لا تُرى في أي معدن قلوي آخر ، [11] :28 بالإضافة إلى حالة الأكسدة +1 التي تتميز بها الفلزات القلوية الأخرى وهي أيضًا حالة الأكسدة الرئيسية لجميع المعادن القلوية المعروفة: هذا بسبب عدم استقرار وتمدد السبينور 7p 3/2 ، مما يتسبب في انخفاض طاقة تأين الإلكترونات الخارجية عن ما كان متوقعًا.[11] :28 [38] :1729–1730 في الواقع ، من المتوقع أن يكون للعديد من مركبات غير الألفية طابع تساهمي كبير ، بسبب مشاركة الإلكترونات 7p 3/2 في الترابط.[86]
لم يتم القيام بالكثير من العمل للتنبؤ بخصائص الفلزات القلوية لما بعد الألفية. على الرغم من أن الاستقراء البسيط للجدول الدوري (وفقًا لمبدأ aufbau ) من شأنه أن يضع العنصر 169 ، unhexenary ، تحت ununennial ، فإن حسابات Dirac-Fock تتنبأ بأن العنصر التالي بعد ununenth بخصائص تشبه الفلزات القلوية قد يكون العنصر 165 ، unhexpentium ، والذي من المتوقع أن يكون تكوين الإلكترون [Og] 5g 18 6f 14 7d 10 8s 2 8p 1/2 2 9s 1 .[38] :1729–1730 [146] سيكون هذا العنصر وسيطًا في الخصائص بين فلز قلوي وعنصر مجموعة 11 ، وبينما تكون خواصه الفيزيائية والذرية أقرب إلى الأول ، فإن كيمياءه قد تكون أقرب إلى تلك الخاصة بالعنصر الأخير. تُظهر الحسابات الإضافية أن unhexpentium سيتبع اتجاه زيادة طاقة التأين إلى ما بعد السيزيوم ، مع وجود طاقة تأين مماثلة لطاقة الصوديوم ، وأنه يجب أيضًا أن يستمر في الاتجاه المتمثل في تناقص نصف القطر الذري إلى ما بعد السيزيوم ، مع وجود نصف قطر ذري مماثل لتلك الموجودة في البوتاسيوم .[38] :1729–1730 ومع ذلك ، فإن الإلكترونات 7d من unhexpentium قد تكون أيضًا قادرة على المشاركة في التفاعلات الكيميائية جنبًا إلى جنب مع الإلكترون 9s ، مما قد يسمح بحالات الأكسدة التي تتجاوز +1 ، ومن هنا يكون سلوك المعدن الانتقالي المحتمل لـ unhexpentium.[38] :1732–1733 [148] نظرًا لكون الفلزات الأرضية القلوية والقلوية على حد سواء عناصر كتلة s ، فإن هذه التنبؤات لاتجاهات وخصائص ununennial و unhexpentium أيضًا تحمل أيضًا في الغالب بشكل مشابه تمامًا لمعادن الأرض القلوية المقابلة ، مثل: uninilium (Ubn) و unhexhexium (Uhh).[38] :1729–1733 قد يكون Unsepttrium ، العنصر 173 ، تناظرًا أثقل من ununenth ؛ مع تكوين الإلكترون المتوقع لـ [Usb] 6g 1 ، فإنه يعود إلى الحالة الشبيهة بالمعدن القلوي لامتلاك إلكترون واحد يمكن إزالته بسهولة أعلى بكثير من غلاف p مغلق في الطاقة ، ومن المتوقع أن يكون أكثر تفاعلًا من السيزيوم.[149][150]
لم يتم استكشاف الخصائص المحتملة لمزيد من الفلزات القلوية التي تتجاوز unepttrium حتى عام 2019 ، وقد تكون أو لا تكون قادرة على الوجود.[146] في الفترات 8 وما فوق من الجدول الدوري ، تصبح التأثيرات النسبية وتأثيرات هيكل القشرة قوية جدًا لدرجة أن الاستقراء من المتجانسات الأخف وزناً يصبح غير دقيق تمامًا. بالإضافة إلى ذلك ، فإن التأثيرات النسبية وتأثيرات هيكل القشرة (التي تعمل على استقرار المدارات s وتزعزع الاستقرار وتوسع مدارات d- و f- و g للقذائف الأعلى) لها تأثيرات معاكسة ، مما يسبب فرقًا أكبر بين النسبية وغير النسبية. حسابات خصائص العناصر ذات الأعداد الذرية العالية.[38] :1732–1733 ينبع الاهتمام بالخصائص الكيميائية لـ ununenenium و unhexpentium و unsepttrium من حقيقة أنها تقع بالقرب من المواقع المتوقعة لجزر الاستقرار ، المتمركزة في العناصر 122 ( 306 Ubb) و 164 ( 482 Uhq).[32][151][152]
المعادن القلوية الزائفة
تتشابه العديد من المواد الأخرى مع الفلزات القلوية في ميلها إلى تكوين كاتيونات أحادية الموجة. على غرار الهالوجينات الكاذبة ، يطلق عليها أحيانًا "الفلزات القلوية الزائفة". تتضمن هذه المواد بعض العناصر والعديد من الأيونات متعددة الذرات ؛ تتشابه الأيونات المتعددة الذرات بشكل خاص مع الفلزات القلوية في حجمها الكبير وقوة الاستقطاب الضعيفة.[153]
هيدروجين
عادةً ما يتم وضع عنصر الهيدروجين ، مع إلكترون واحد لكل ذرة محايدة ، في الجزء العلوي من المجموعة 1 من الجدول الدوري للراحة ، ولكن الهيدروجين لا يعتبر عادةً معدنًا قلويًا ؛ [154] عندما يعتبر معدنًا قلويًا ، يكون ذلك بسبب خصائصه الذرية وليس خصائصه الكيميائية.[155] في ظل الظروف النموذجية ، يوجد الهيدروجين النقي كغاز ثنائي الذرة يتكون من ذرتين لكل جزيء (H 2 ) ؛ [156] ومع ذلك ، فإن الفلزات القلوية تشكل جزيئات ثنائية الذرة فقط (مثل الديليثيوم ، Li 2 ) في درجات حرارة عالية ، عندما تكون في الحالة الغازية .[157]
يحتوي الهيدروجين ، مثل الفلزات القلوية ، على إلكترون تكافؤ واحد [122] ويتفاعل بسهولة مع الهالوجينات ، [122] لكن أوجه التشابه تنتهي عند هذا الحد نظرًا لصغر حجم البروتون العاري H + بالمقارنة مع الكاتيونات الفلزية القلوية.[122] يرجع وضعه فوق الليثيوم بشكل أساسي إلى تكوينه الإلكتروني .[154] يتم وضعها أحيانًا فوق الكربون بسبب تشابه سلبيتها الكهربية [158] أو الفلور نظرًا لخصائصها الكيميائية المتشابهة.[158]
طاقة التأين الأولى للهيدروجين (1312.0 كيلوجول / مول ) أعلى بكثير من طاقة الفلزات القلوية.[159][160] نظرًا لأن هناك حاجة إلى إلكترون إضافي واحد فقط لملء الغلاف الخارجي لذرة الهيدروجين ، غالبًا ما يتصرف الهيدروجين مثل الهالوجين ، مكونًا أيون الهيدريد السالب ، وفي بعض الأحيان يعتبر هالوجين على هذا الأساس. (يمكن أن تشكل الفلزات القلوية أيضًا أيونات سالبة ، تُعرف باسم القلويات ، لكنها ليست أكثر من فضول معمل ، كونها غير مستقرة. ) [77][78] والحجة ضد هذا التنسيب هي أن تكوين الهيدريد من الهيدروجين ماص للحرارة ، على عكس التكوين الطارد للحرارة للهاليدات من الهالوجينات. دائرة نصف قطرها من H - أنيون أيضا لا تتناسب مع الاتجاه نحو زيادة حجم نزول الهالوجينات: في الواقع، H - هو منتشر جدا لأن البروتون واحد لا يمكن التحكم بسهولة كل من الإلكترونات.[122] :15–6 كان من المتوقع لبعض الوقت أن يظهر الهيدروجين السائل خصائص معدنية.[158] بينما ثبت أن هذا ليس هو الحال ، في ظل ضغوط عالية للغاية ، مثل تلك الموجودة في قلب المشتري وزحل ، يصبح الهيدروجين معدنيًا ويتصرف مثل معدن قلوي ؛ في هذه المرحلة ، يُعرف باسم الهيدروجين المعدني .[161] إن المقاومة الكهربائية للهيدروجين المعدني السائل عند 3000 كلفن تساوي تقريبًا تلك الخاصة بالروبيديوم السائل والسيزيوم عند 2000 كلفن عند الضغوط ذات الصلة عندما يخضعان لانتقال غير معدني إلى معدن.[162]
إن تكوين الإلكترون 1s 1 للهيدروجين ، بينما يشبه بشكل سطحي تكوين الفلزات القلوية (ns 1 ) ، فريد لأنه لا يوجد قشرة فرعية 1p. ومن ثم يمكن أن يفقد إلكترونًا لتكوين الهيدرون H + ، أو يكتسب واحدًا لتكوين أيون الهيدريد H - .[11] :43 في الحالة الأولى يشبه بشكل سطحي الفلزات القلوية ؛ في الحالة الأخيرة ، الهالوجينات ، ولكن الاختلافات بسبب عدم وجود قشرة فرعية 1p مهمة بما يكفي بحيث لا تناسب أي مجموعة خصائص الهيدروجين جيدًا.[11] :43 تعتبر المجموعة 14 مناسبة أيضًا من حيث الخصائص الديناميكية الحرارية مثل طاقة التأين وتقارب الإلكترون ، لكن الهيدروجين لا يمكن أن يكون رباعي التكافؤ. وبالتالي ، لا تعتبر أي من المواضع الثلاثة مرضية تمامًا ، على الرغم من أن المجموعة 1 هي الموضع الأكثر شيوعًا (إذا تم اختيار أحدها) لأن الهيدرون هو إلى حد بعيد أهم أنواع الهيدروجين أحادي الذرة ، كونه أساس الكيمياء الحمضية القاعدية.[158] كمثال على الخصائص غير التقليدية للهيدروجين الناشئة عن تكوينه الإلكتروني غير المعتاد وصغر حجمه ، فإن أيون الهيدروجين صغير جدًا (نصف قطره حوالي 150 fm مقارنة بـ50-220 حجم pm لمعظم الذرات والأيونات الأخرى) وبالتالي فهو غير موجود في الأنظمة المكثفة بخلاف الارتباط مع الذرات أو الجزيئات الأخرى. في الواقع ، يعتبر نقل البروتونات بين المواد الكيميائية أساس الكيمياء الحمضية القاعدية .[11] :43 كما أن قدرة الهيدروجين على تكوين روابط هيدروجينية فريدة من نوعها ، والتي هي نتيجة انتقال الشحنة ، والكهرباء الساكنة ، والظواهر المرتبطة بالإلكترون.[158] بينما تُعرف روابط الليثيوم المماثلة أيضًا ، إلا أنها في الغالب كهروستاتيكية.[158] ومع ذلك ، يمكن للهيدروجين أن يأخذ نفس الدور الهيكلي الذي تلعبه الفلزات القلوية في بعض البلورات الجزيئية ، وله علاقة وثيقة مع أخف المعادن القلوية (خاصة الليثيوم).[163]
الأمونيوم ومشتقاته

أيون الأمونيوم ( NH4+</br> NH4+ ) لها خصائص مشابهة جدًا للفلزات القلوية الثقيلة ، حيث تعمل كمعدن قلوي وسيط بين البوتاسيوم والروبيديوم ، [153][164] وغالبًا ما تعتبر قريبة.[165][166][167] على سبيل المثال ، معظم أملاح الفلزات القلوية قابلة للذوبان في الماء ، وهي خاصية تشترك فيها أملاح الأمونيوم.[168] من المتوقع أن يتصرف الأمونيوم بثبات كمعدن ( NH4+</br> NH4+ أيونات في بحر من الإلكترونات غير الموضعية) عند ضغوط عالية جدًا (على الرغم من أنها أقل من الضغط النموذجي حيث تحدث التحولات من العزل إلى السلوك المعدني ، 100 GPa ) ، ويمكن أن تحدث داخل عمالقة الجليد أورانوس ونبتون ، والتي قد يكون لها تأثيرات كبيرة على مجالاتها المغناطيسية الداخلية.[166][167] تشير التقديرات إلى أن الانتقال من خليط من جزيئات الأمونيا وثنائي الهيدروجين إلى الأمونيوم المعدني قد يحدث عند ضغوط أقل بقليل من 25 المعدل التراكمي.[166] في ظل الظروف القياسية ، يمكن أن يشكل الأمونيوم ملغمًا معدنيًا مع الزئبق.[169]
تشمل "الفلزات القلوية الزائفة" الأخرى كاتيونات الألكيلامونيوم ، حيث يتم استبدال بعض ذرات الهيدروجين في كاتيون الأمونيوم بمجموعات ألكيل أو أريل. على وجه الخصوص ، كاتيونات الأمونيوم الرباعية ( NR4+</br> NR4+ ) مفيدة جدًا نظرًا لأنها مشحونة بشكل دائم ، وغالبًا ما تستخدم كبديل لـ Cs + باهظة الثمن لتحقيق الاستقرار الكبير جدًا والأنيونات القابلة للاستقطاب بسهولة مثل HI2-</br> HI2- .[11] :812–9 هيدروكسيدات رباعي ألكيل الأمونيوم ، مثل هيدروكسيدات الفلزات القلوية ، هي قواعد قوية جدًا تتفاعل مع ثاني أكسيد الكربون في الغلاف الجوي لتكوين الكربونات.[122] :256 وعلاوة على ذلك، يمكن استبدال ذرة النيتروجين من قبل الفوسفور والزرنيخ والأنتيمون أو ذرة (أثقل اللافلزية مجموعة النتروجين )، وخلق فسفونيوم PH4+</br> PH4+ ) أو حريق ( AsH4+</br> AsH4+ ) الكاتيونات التي يمكن استبدالها بنفس الطريقة ؛ بينما ستيبونيوم ( SbH4+</br> SbH4+ ) نفسها غير معروفة ، تتميز بعض مشتقاتها العضوية.[153]
الكوبالتوسين ومشتقاته
كوبالتوسين ، شركة (C 5 H 5) 2، هو الميتالوسين ، و الكوبالت التناظرية من الفيروسين . إنها مادة صلبة أرجوانية داكنة. يحتوي الكوبالتوسين على 19 إلكترونًا تكافؤًا ، أي أكثر من إلكترون واحد موجود عادة في معقدات الانتقال العضوي ، مثل قريبه المستقر للغاية ، فيروسين ، وفقًا لقاعدة 18 إلكترونًا . يحتل هذا الإلكترون الإضافي مدارًا مضادًا للترابط فيما يتعلق بروابط Co-C. نتيجة لذلك ، تتميز العديد من التفاعلات الكيميائية لـ Co (C 5 H 5 ) 2 بميلها إلى فقد هذا الإلكترون "الإضافي" ، مما ينتج عنه كاتيون 18 إلكترونًا مستقرًا للغاية يُعرف باسم الكوبالتوسينيوم. تشترك العديد من أملاح الكوبالتوسينيوم مع أملاح السيزيوم ، وهيدروكسيد الكوبالتوسينيوم هو قاعدة قوية تمتص ثاني أكسيد الكربون في الغلاف الجوي لتكوين كربونات الكوبالتوسينيوم.[122] :256 مثل الفلزات القلوية ، يعتبر الكوبالتوسين عامل اختزال قوي ، ولا يزال ديكاميثيل كوبالتوسين أقوى بسبب التأثير الحثي المشترك لمجموعات الميثيل العشر.[170] يمكن استبدال الكوبالت بمثيلاته الأثقل من الروديوم لإعطاء الرودوسين ، عامل اختزال أقوى.[171] من المفترض أن يكون إيريدوسين (الذي يتضمن الإريديوم ) أكثر فاعلية ، ولكنه لم تتم دراسته جيدًا بسبب عدم استقراره.[172]
الثاليوم
الثاليوم هو أثقل عنصر ثابت في المجموعة 13 من الجدول الدوري. في أسفل الجدول الدوري ، يكون تأثير الزوج الخامل قويًا جدًا ، بسبب الاستقرار النسبي لمدار 6S وتناقص طاقة الرابطة مع زيادة حجم الذرات بحيث لا تكون كمية الطاقة المنبعثة في تكوين رابطتين أخريين تستحق طاقات التأين العالية للإلكترونات 6s.[11] :226–7 يعرض حالة الأكسدة +1 [11] :28 التي تعرضها جميع المعادن القلوية المعروفة ، [11] :28 ومركبات الثاليوم مع الثاليوم في حالة الأكسدة +1 تشبه إلى حد كبير مركبات البوتاسيوم أو الفضة المتكافئة بسبب الأيونية المماثلة نصف قطر Tl + (164 م ) ، K + (152 م) و Ag + (129 م) الأيونات.[173][174] كان يُعتبر أحيانًا معدنًا قلويًا في أوروبا القارية (لكن ليس في إنجلترا) في السنوات التي أعقبت اكتشافه مباشرةً ، [174] :126 وتم وضعه بعد السيزيوم مباشرةً باعتباره المعدن القلوي السادس في الجدول الدوري لعام 1869 لديمتري مندليف ويوليوس الجدول الدوري لـ Lothar Meyer لعام 1868.[22] (وضع الجدول الدوري لمندلييف 1871 والجدول الدوري لعام 1870 لماير في موقعه الحالي في مجموعة البورون وترك الفراغ الموجود أسفل السيزيوم فارغًا. ) [22] ومع ذلك ، فإن الثاليوم يعرض أيضًا حالة الأكسدة +3 ، [11] :28 والتي لا يوجد معدن قلوي معروف يعرضها [11] :28 (على الرغم من أنه من المتوقع أن يعرض المعدن القلوي السابع غير المكتشف ، غير المكتشف ، أكسدة +3 حالة).[38] :1729–1730 يعتبر الآن المعدن القلوي السادس فرانسيوم.[175] بينما يتم تثبيت Tl + بواسطة تأثير الزوج الخامل ، لا يزال هذا الزوج الخامل من إلكترونات 6s قادرًا على المشاركة كيميائيًا ، بحيث تكون هذه الإلكترونات نشطة في الكيمياء الفراغية في محلول مائي. بالإضافة إلى ذلك ، فإن هاليدات الثاليوم (باستثناء TlF ) غير قابلة للذوبان تمامًا في الماء ، ولدى TlI بنية غير عادية بسبب وجود الزوج الخامل النشط الفراغي في الثاليوم.[176]
النحاس والفضة والذهب
عادةً ما يتم تصنيف معادن المجموعة 11 (أو معادن العملات المعدنية) والنحاس والفضة والذهب ، على أنها معادن انتقالية نظرًا لأنها يمكن أن تشكل أيونات ذات قذائف d غير مكتملة. ماديًا ، لديهم نقاط انصهار منخفضة نسبيًا وقيم كهرسلبية عالية مرتبطة بمعادن ما بعد الانتقال . "إن د المستوى الفرعي شغل وخالية الصورة الإلكترون من النحاس، حج، والاتحاد الأفريقي يساهم في التوصيل الكهربائي والحراري العالية. الفلزات الانتقالية إلى اليسار من مجموعة 11 التفاعلات الخبرات بين الصورة الإلكترونات وليس صحيحا جزئيا د المستوى الفرعي أن التنقل أقل الإلكترون. " [177] كيميائيًا ، تتصرف المجموعة 11 معادن مثل معادن المجموعة الرئيسية في حالات التكافؤ +1 ، وبالتالي فهي مرتبطة إلى حد ما بالمعادن القلوية: هذا هو أحد أسباب تسميتها سابقًا باسم "المجموعة IB" ، بالتوازي مع الفلزات القلوية " المجموعة IA ". يتم تصنيفها في بعض الأحيان على أنها معادن ما بعد التحول.[178] أطيافهم مماثلة لتلك الخاصة بالمعادن القلوية.[30] من أيونات monopositive هي ممغطس وتساهم لا لون لأملاحها، مثل تلك التي من الفلزات القلوية.[179]



في الجدول الدوري لعام 1871 لمندلييف ، تم سرد النحاس والفضة والذهب مرتين ، مرة واحدة تحت المجموعة الثامنة (مع ثلاثي الحديد ومجموعة البلاتين معادن ) ، ومرة واحدة تحت المجموعة IB. تم وضع مجموعة IB مع ذلك بين قوسين للإشارة إلى أنها كانت مؤقتة. كان معيار Mendeleev الرئيسي لتخصيص المجموعة هو حالة الأكسدة القصوى لعنصر: على هذا الأساس ، لا يمكن تصنيف عناصر المجموعة 11 في المجموعة IB ، نظرًا لوجود مركبات النحاس (II) والذهب (III) المعروفة في ذلك زمن.[30] ومع ذلك ، فإن استبعاد المجموعة IB سيجعل المجموعة الأولى هي المجموعة الرئيسية الوحيدة (المجموعة الثامنة تم تصنيفها على أنها مجموعة انتقالية) تفتقر إلى التشعب A – B.[30] بعد ذلك بوقت قصير ، اختار غالبية الكيميائيين تصنيف هذه العناصر في المجموعة IB وإزالتها من المجموعة الثامنة للتماثل الناتج: كان هذا هو التصنيف السائد حتى ظهور الجدول الدوري الحديث متوسط الطول المكون من 18 عمودًا ، والذي فصل القلويات. المعادن والمجموعة 11 معادن.[30] اعتُبرت معادن العملات تقليديًا تقسيمًا فرعيًا لمجموعة الفلزات القلوية ، نظرًا لأنها تشترك في تكوين الإلكترون المميز s 1 للمعادن القلوية (المجموعة 1: p 6 s 1 ؛ المجموعة 11: d 10 s 1 ). ومع ذلك ، فإن أوجه التشابه تقتصر إلى حد كبير على المقاييس المتكافئة لمركبات +1 من كلا المجموعتين ، وليس خواصها الكيميائية.[11] :1177 ينبع هذا من قشرة d المملوءة التي توفر تأثير تدريع أضعف بكثير على الإلكترون الخارجي s مقارنة بالقشرة الفرعية p المملوءة ، بحيث تحتوي معادن العملات المعدنية على طاقات تأين أولى أعلى بكثير وأنصاف أقطار أيونية أصغر من المعادن القلوية المقابلة.[11] :1177 علاوة على ذلك ، لديهم نقاط انصهار أعلى ، وصلابة ، وكثافة ، وانخفاض في التفاعلات وقابلية الذوبان في الأمونيا السائلة ، بالإضافة إلى وجود طابع تساهمي أكبر في مركباتهم.[11] :1177 أخيرًا ، توجد الفلزات القلوية في الجزء العلوي من السلسلة الكهروكيميائية ، في حين أن معادن العملات المعدنية تكون تقريبًا في القاع.[11] :1177 يتم تعطيل غلاف d المملوء بالمعادن المعدنية بسهولة أكبر بكثير من غلاف p المملوء بالمعادن القلوية ، بحيث تكون طاقات التأين الثانية والثالثة أقل ، مما يتيح حالات أكسدة أعلى من +1 وكيمياء تنسيق أكثر ثراءً ، مما يعطي المجموعة 11 المعادن شخصية انتقالية واضحة.[11] :1177 وتجدر الإشارة بشكل خاص إلى المركبات الأيونية المكونة للذهب مع الروبيديوم والسيزيوم ، والتي تشكل فيها أيون الأورايد (Au - ) والذي يحدث أيضًا في صورة مذابة في محلول الأمونيا السائلة: هنا يتصرف الذهب باعتباره الهالوجين الكاذب لأن تكوينه 5d 10 6s 1 يحتوي على إلكترون واحد أقل من تكوين الزئبق شبه المغلق 5d 10 6s 2 .[11] :1177
الإنتاج والعزل
يعتبر إنتاج الفلزات القلوية النقية أمرًا معقدًا إلى حد ما بسبب تفاعلها الشديد مع المواد الشائعة الاستخدام ، مثل الماء.[31][81] من خامات السيليكات ، يمكن الحصول على جميع المعادن القلوية الثابتة بنفس الطريقة: يستخدم حمض الكبريتيك أولاً لإذابة أيون الفلزات القلوية المرغوبة وأيونات الألومنيوم (III) من الخام (الترشيح) ، وعندها يزيل الترسيب الأساسي أيونات الألومنيوم من الخليط عن طريق ترسيبه على شكل هيدروكسيد . ثم يتم ترسيب الكربونات المعدنية القلوية المتبقية غير القابلة للذوبان بشكل انتقائي ؛ ثم يتم إذابة الملح في حمض الهيدروكلوريك لإنتاج الكلوريد. ثم تُترك النتيجة حتى تتبخر ويمكن بعد ذلك عزل المعدن القلوي.[81] عادةً ما يتم عزل الليثيوم والصوديوم من خلال التحليل الكهربائي من كلوريد السائل ، مع إضافة كلوريد الكالسيوم عادةً لخفض درجة انصهار الخليط. ومع ذلك ، يتم عزل الفلزات القلوية الأثقل بشكل نموذجي بطريقة مختلفة ، حيث يتم استخدام عامل الاختزال (عادةً الصوديوم للبوتاسيوم والمغنيسيوم أو الكالسيوم لأثقل المعادن القلوية) لتقليل كلوريد فلز قلوي. ثم يخضع المنتج السائل أو الغازي (المعدن القلوي) لعملية التقطير الجزئي من أجل التنقية.[81] تتطلب معظم الطرق المؤدية إلى الفلزات القلوية النقية استخدام التحليل الكهربائي نظرًا لتفاعلها العالي ؛ واحدة من القلائل التي لا تعتبر الانحلال الحراري لأزيد المعدن القلوي المقابل ، والتي تنتج المعدن للصوديوم والبوتاسيوم والروبيديوم والسيزيوم ونتريد الليثيوم.[122] :77


يجب استخلاص أملاح الليثيوم من مياه الينابيع المعدنية ، وأحواض المياه المالحة ، والترسبات الملحية. يتم إنتاج المعدن كهربائيا من خليط من كلوريد الليثيوم المنصهر وكلوريد البوتاسيوم .[180]
يوجد الصوديوم في الغالب في مياه البحر وقاع البحر المجفف ، [31] ولكنه ينتج الآن من خلال التحليل الكهربائي لكلوريد الصوديوم عن طريق خفض درجة انصهار المادة إلى أقل من 700 درجة مئوية من خلال استخدام خلية هبوط .[181][182] يمكن إنتاج صوديوم نقي للغاية من خلال التحلل الحراري لأزيد الصوديوم .[183] يوجد البوتاسيوم في العديد من المعادن ، مثل سيلفيت ( كلوريد البوتاسيوم ).[31] في السابق ، كان البوتاسيوم يُصنع عمومًا من التحليل الكهربائي لكلوريد البوتاسيوم أو هيدروكسيد البوتاسيوم ، [184] الموجود على نطاق واسع في أماكن مثل كندا وروسيا وبيلاروسيا وألمانيا وإسرائيل والولايات المتحدة والأردن ، بطريقة مشابهة لكيفية إنتاج الصوديوم في أواخر القرن التاسع عشر وأوائل القرن العشرين.[43] كما يمكن إنتاجه من مياه البحر .[31] ومع ذلك ، فإن هذه الطرق تمثل مشكلة لأن فلز البوتاسيوم يميل إلى الذوبان في كلوريده المنصهر ويتبخر بشكل كبير في درجات حرارة التشغيل ، مما قد يؤدي إلى تكوين أكسيد الفائق المتفجر. نتيجة لذلك ، يتم الآن إنتاج معدن البوتاسيوم النقي عن طريق تقليل كلوريد البوتاسيوم المنصهر بمعدن الصوديوم عند 850 درجة مئوية.[11] :74
- Na (g) + KCl (l)
 NaCl (l) + K (g)
NaCl (l) + K (g) - على الرغم من أن الصوديوم أقل تفاعلًا من البوتاسيوم ، إلا أن هذه العملية تعمل لأنه في مثل هذه درجات الحرارة المرتفعة يكون البوتاسيوم أكثر تطايرًا من الصوديوم ويمكن تقطيره بسهولة ، بحيث يتحول التوازن نحو اليمين لإنتاج المزيد من غاز البوتاسيوم ويكاد يكتمل.[11] :74
- لعدة سنوات في الخمسينيات والستينيات من القرن الماضي ، كان أحد المنتجات الثانوية لإنتاج البوتاسيوم المسمى بالكرب مصدرًا رئيسيًا للروبيديوم. احتوى الكرب على 21٪ روبيديوم والباقي بوتاسيوم وجزء صغير من السيزيوم.[185] اليوم ، ينتج أكبر منتجي السيزيوم ، على سبيل المثال منجم تانكو في مانيتوبا ، كندا ، الروبيديوم كمنتج ثانوي من الملوثات .[186] اليوم، طريقة شائعة لفصل الروبيديوم من البوتاسيوم والسيزيوم هو التبلور التجزيئي من الروبيديوم والسيزيوم الشب ( جيم ، الروبيديوم ) آل ( SO 4 ) 2 · 12 H 2 O ، والتي ينتج النقي الشب الروبيديوم بعد ما يقرب من 30 recrystallisations.[186][187] التطبيقات المحدودة ونقص المعدن الغني بالروبيديوم يحد من إنتاج مركبات الروبيديوم إلى 2 إلى 4 أطنان في السنة.[186] ومع ذلك ، لا ينتج السيزيوم من التفاعل أعلاه. بدلاً من ذلك ، يعد تعدين خام الملوثات هو الطريقة الرئيسية للحصول على السيزيوم النقي ، المستخرج من الخام بشكل أساسي بثلاث طرق: الهضم الحمضي ، التحلل القلوي ، والاختزال المباشر.[186][188] يتم إنتاج كلا المعدنين كمنتجات ثانوية لإنتاج الليثيوم: بعد عام 1958 ، عندما زاد الاهتمام بخصائص الليثيوم الحرارية النووية بشكل حاد ، زاد أيضًا إنتاج الروبيديوم والسيزيوم في المقابل.[11] :71 يتم إنتاج معادن الروبيديوم والسيزيوم النقية عن طريق تقليل كلوريدها بمعدن الكالسيوم عند 750 درجة مئوية وضغط منخفض.[11] :74
- نتيجة لندرته الشديدة في الطبيعة ، [64] يتم تصنيع معظم الفرانسيوم في التفاعل النووي 197 Au + 18 O → 210 Fr + 5 n ، مما ينتج عنه الفرانسيوم -209 ، والفرانسيوم -210 ، والفرانسيوم-211 .[189] أكبر كمية من الفرانسيوم تم تجميعها حتى الآن هي حوالي 300000 ذرة متعادلة ، [190] والتي تم تصنيعها باستخدام التفاعل النووي المذكور أعلاه.[190] عندما يكون النظير الطبيعي الوحيد الفرانسيوم 223 مطلوبًا على وجه التحديد ، يتم إنتاجه باعتباره ابنة ألفا للأكتينيوم -227 ، وهو نفسه ينتج صناعياً من الإشعاع النيوتروني للراديوم الطبيعي -226 ، إحدى بنات اليورانيوم الطبيعي 238.[191]
التطبيقات

يحتوي الليثيوم والصوديوم والبوتاسيوم على العديد من التطبيقات ، بينما الروبيديوم والسيزيوم مفيدان جدًا في السياقات الأكاديمية ولكن ليس لهما العديد من التطبيقات حتى الآن.[11] :68 غالبًا ما يستخدم الليثيوم في بطاريات الليثيوم أيون ، ويمكن أن يساعد أكسيد الليثيوم في معالجة السيليكا. ستيرات الليثيوم مادة مثخنة ويمكن استخدامها لصنع شحوم التزليق ؛ يتم إنتاجه من هيدروكسيد الليثيوم ، والذي يستخدم أيضًا لامتصاص ثاني أكسيد الكربون في كبسولات الفضاء والغواصات.[11] :70 يستخدم كلوريد الليثيوم كسبيكة لحام لأجزاء الألومنيوم.[192] يستخدم الليثيوم المعدني في سبائك المغنيسيوم والألمنيوم لإعطاء سبائك قوية وخفيفة للغاية.[11] :70
مركبات الصوديوم لها تطبيقات عديدة ، أشهرها كلوريد الصوديوم مثل ملح الطعام . تستخدم أملاح الصوديوم للأحماض الدهنية كصابون.[193] يحتوي معدن الصوديوم النقي أيضًا على العديد من التطبيقات ، بما في ذلك استخدامه في مصابيح بخار الصوديوم ، والتي تنتج إضاءة فعالة للغاية مقارنة بأنواع الإضاءة الأخرى ، [194][195] ويمكن أن تساعد في تلطيف سطح المعادن الأخرى.[196][197] كونه عامل اختزال قوي ، فإنه غالبًا ما يستخدم لتقليل العديد من المعادن الأخرى ، مثل التيتانيوم والزركونيوم ، من كلوريداتها. علاوة على ذلك ، فهو مفيد جدًا كسائل للتبادل الحراري في المفاعلات النووية سريعة التكاثر نظرًا لانخفاض نقطة انصهاره ولزوجته وقسمه العرضي نحو امتصاص النيوترونات.[11] :74
غالبًا ما تستخدم مركبات البوتاسيوم كأسمدة [11] :73 [198] حيث أن البوتاسيوم عنصر مهم لتغذية النبات. هيدروكسيد البوتاسيوم هو أساس قوي للغاية ، ويستخدم للتحكم في درجة الحموضة للمواد المختلفة.[199][200] غالبًا ما تستخدم نترات البوتاسيوم وبرمنجنات البوتاسيوم كعوامل مؤكسدة قوية.[11] :73 يستخدم فوق أكسيد البوتاسيوم في أقنعة التنفس ، حيث يتفاعل مع ثاني أكسيد الكربون ليعطي كربونات البوتاسيوم وغاز الأكسجين. لا يستخدم معدن البوتاسيوم النقي غالبًا ، ولكن سبائكه مع الصوديوم قد تحل محل الصوديوم النقي في المفاعلات النووية سريعة التكاثر.[11] :74
غالبًا ما يستخدم الروبيديوم والسيزيوم في الساعات الذرية .[201] الساعات الذرية السيزيوم دقيقة للغاية ؛ إذا كانت الساعة قد صنعت في زمن الديناصورات ، فستتوقف بأقل من أربع ثوانٍ (بعد 80 مليون سنة).[58] لهذا السبب ، تستخدم ذرات السيزيوم كتعريف للثاني.[202] غالبًا ما تستخدم أيونات الروبيديوم في الألعاب النارية الأرجواني ، [203] وغالبًا ما يستخدم السيزيوم في سوائل الحفر في صناعة البترول.[58][204]
الفرانسيوم ليس له تطبيقات تجارية ، [62][63][205] ولكن بسبب التركيب الذري البسيط نسبيًا للفرانسيوم ، من بين أمور أخرى ، تم استخدامه في تجارب التحليل الطيفي ، مما أدى إلى مزيد من المعلومات حول مستويات الطاقة وثوابت الاقتران بين الجسيمات دون الذرية .[206] قدمت الدراسات التي أجريت على الضوء المنبعث من أيونات الفرانسيوم 210 المحتجزة بالليزر بيانات دقيقة عن التحولات بين مستويات الطاقة الذرية ، على غرار تلك التي تنبأت بها نظرية الكم .[207]
الدور البيولوجي والاحتياطات
المعادن
المعادن القلوية النقية تتفاعل بشكل خطير مع الهواء والماء ويجب إبعادها عن الحرارة والنار والعوامل المؤكسدة والأحماض ومعظم المركبات العضوية والهالوكربونات والبلاستيك والرطوبة. كما أنها تتفاعل مع ثاني أكسيد الكربون ورابع كلوريد الكربون ، لذا فإن طفايات الحريق العادية تؤدي إلى نتائج عكسية عند استخدامها في حرائق المعادن القلوية.[208] تعتبر بعض طفايات المسحوق الجاف من الفئة D المصممة لحرائق المعادن فعالة ، حيث تحرم النار من الأكسجين وتبريد المعدن القلوي.[209]
تجرى التجارب عادة باستخدام كميات صغيرة فقط من بضعة جرامات في غطاء دخان . يمكن التخلص من كميات صغيرة من الليثيوم عن طريق التفاعل مع الماء البارد ، ولكن يجب إذابة المعادن القلوية الثقيلة في الأيزوبروبانول الأقل تفاعلًا.[208][210] يجب تخزين الفلزات القلوية تحت زيت معدني أو في جو خامل. قد يكون الغلاف الجوي الخامل المستخدم هو الأرجون أو غاز النيتروجين ، باستثناء الليثيوم ، الذي يتفاعل مع النيتروجين.[208] يجب إبقاء الروبيديوم والسيزيوم بعيدًا عن الهواء ، حتى تحت الزيت ، لأن حتى كمية صغيرة من الهواء المنتشرة في الزيت قد تؤدي إلى تكوين البيروكسيد المتفجر بشكل خطير ؛ للسبب نفسه ، لا ينبغي تخزين البوتاسيوم تحت الزيت في جو يحتوي على الأكسجين لمدة تزيد عن 6 أشهر.[211][212]
أيونات
تمت مراجعة الكيمياء الحيوية العضوية لأيونات الفلزات القلوية على نطاق واسع.[213] تم تحديد الهياكل البلورية ذات الحالة الصلبة للعديد من معقدات أيونات المعادن القلوية في الببتيدات الصغيرة ومكونات الأحماض النووية والكربوهيدرات والمجمعات الأيونية.[214]
يوجد الليثيوم بشكل طبيعي فقط في آثار ضئيلة في الأنظمة البيولوجية وليس له دور بيولوجي معروف ، ولكن له تأثيرات على الجسم عند تناوله.[215] تستخدم كربونات الليثيوم كمثبت للمزاج في الطب النفسي لعلاج الاضطراب ثنائي القطب ( الهوس الاكتئابي ) بجرعات يومية من حوالي 0.5 إلى 2 غرام ، على الرغم من وجود آثار جانبية.[215] يتسبب الإفراط في تناول الليثيوم في النعاس والتداخل في الكلام والقيء ، من بين أعراض أخرى ، [215] ويسمم الجهاز العصبي المركزي ، [215] وهو أمر خطير لأن جرعة الليثيوم المطلوبة لعلاج الاضطراب ثنائي القطب أقل قليلاً من الجرعة السامة. .[215][216] الكيمياء الحيوية لها، والطريقة التي يتم التعامل معها من قبل الجسم البشري والدراسات التي تستخدم الفئران والماعز تشير إلى أنه هو ضروري العناصر النزرة ، على الرغم من أن الوظيفة البيولوجية الطبيعية الليثيوم في البشر لم يتم بعد تحديدها.[217][218]
يوجد الصوديوم والبوتاسيوم في جميع الأنظمة البيولوجية المعروفة ، والتي تعمل بشكل عام كإلكتروليتات داخل الخلايا وخارجها.[219][220] الصوديوم عنصر غذائي أساسي ينظم حجم الدم وضغط الدم والتوازن الأسموزي ودرجة الحموضة ؛ الحد الأدنى من المتطلبات الفسيولوجية للصوديوم هو 500 ملليغرام يوميا.[221] كلوريد الصوديوم (المعروف أيضًا باسم الملح الشائع) هو المصدر الرئيسي للصوديوم في النظام الغذائي ، ويستخدم كتوابل ومواد حافظة ، مثل التخليل والتشنج ؛ يأتي معظمها من الأطعمة المصنعة.[222] الكمية الغذائية المرجعية للصوديوم هي 1.5 غرامًا يوميًا ، [223] ولكن معظم الناس في الولايات المتحدة يستهلكون أكثر من 2.3 غرام في اليوم ، [224] الحد الأدنى من الكمية التي تؤدي إلى ارتفاع ضغط الدم ؛ [225] وهذا بدوره يسبب 7.6 مليون حالة وفاة مبكرة في جميع أنحاء العالم.[226]
البوتاسيوم هو الكاتيون الرئيسي (أيون إيجابي) داخل الخلايا الحيوانية ، [219] بينما الصوديوم هو الكاتيون الرئيسي خارج الخلايا الحيوانية.[219][220] تؤدي الاختلافات في تركيز هذه الجسيمات المشحونة إلى اختلاف في الجهد الكهربائي بين داخل وخارج الخلايا ، يُعرف باسم جهد الغشاء . يتم الحفاظ على التوازن بين البوتاسيوم والصوديوم بواسطة بروتينات ناقلة الأيونات في غشاء الخلية .[227] يسمح جهد غشاء الخلية الناتج عن أيونات البوتاسيوم والصوديوم للخلية بتوليد جهد فعل "ارتفاع" في التفريغ الكهربائي. تعد قدرة الخلايا على إنتاج التفريغ الكهربائي أمرًا بالغ الأهمية لوظائف الجسم مثل النقل العصبي وتقلص العضلات ووظيفة القلب.[227] قد يكون اختلال هذا التوازن قاتلاً: على سبيل المثال ، يمكن أن يؤدي تناول كميات كبيرة من مركبات البوتاسيوم إلى فرط بوتاسيوم الدم الذي يؤثر بشدة على نظام القلب والأوعية الدموية.[228][229] يستخدم كلوريد البوتاسيوم في الولايات المتحدة لعمليات الإعدام بالحقن المميتة .[228]

بسبب تشابه نصف قطرها الذري ، فإن الروبيديوم والسيزيوم في الجسم يحاكيان البوتاسيوم ويتم تناولهما بالمثل. ليس للروبيديوم دور بيولوجي معروف ، ولكنه قد يساعد في تحفيز عملية التمثيل الغذائي ، [230][231][232] وعلى غرار السيزيوم ، [230][233] يحل محل البوتاسيوم في الجسم مما يسبب نقص البوتاسيوم .[230][232] الاستبدال الجزئي ممكن تمامًا وغير سام: أ 70 كلغ شخص يحتوي في المتوسط 0.36 g من الروبيديوم ، والزيادة في هذه القيمة بنسبة 50 إلى 100 مرة لم تظهر آثارًا سلبية في الأشخاص المختبرين.[234] يمكن للجرذان البقاء على قيد الحياة حتى 50 ٪ من استبدال البوتاسيوم بالروبيديوم.[232][235] يمكن أن يعمل الروبيديوم (وبدرجة أقل السيزيوم) كعلاج مؤقت لنقص بوتاسيوم الدم ؛ بينما يمكن للروبيديوم أن يحل محل البوتاسيوم من الناحية الفسيولوجية في بعض الأنظمة ، فإن السيزيوم لا يمكنه أبدًا القيام بذلك.[231] لا توجد سوى أدلة محدودة للغاية في شكل أعراض نقص على أن الروبيديوم ربما يكون ضروريًا في الماعز ؛ حتى لو كان هذا صحيحًا ، فإن الكميات النزرة الموجودة عادة في الطعام تكون أكثر من كافية.[236][237]
نادرًا ما يصادف معظم الناس مركبات السيزيوم ، لكن معظم مركبات السيزيوم ذات سمية خفيفة. مثل الروبيديوم ، يميل السيزيوم إلى استبدال البوتاسيوم في الجسم ، لكنه أكبر بكثير وبالتالي فهو بديل فقير.[233] يمكن أن يؤدي السيزيوم الزائد إلى نقص بوتاسيوم الدم ، ونبض القلب ، والسكتة القلبية الحادة ، [238] ولكن هذه الكميات لا تحدث عادة في المصادر الطبيعية.[239] على هذا النحو ، السيزيوم ليس من الملوثات البيئية الكيميائية الرئيسية.[239] تبلغ قيمة الجرعة المميتة المتوسطة (LD 50 ) لكلوريد السيزيوم في الفئران 2.3 غرام لكل كيلوغرام ، وهو ما يمكن مقارنته بقيم LD 50 لكلوريد البوتاسيوم وكلوريد الصوديوم .[240] تم الترويج لكلوريد السيزيوم كعلاج بديل للسرطان ، [241] ولكن تم ربطه بوفاة أكثر من 50 مريضًا ، حيث تم استخدامه كجزء من علاج السرطان غير المؤكد علميًا.[242]
تتطلب النظائر المشعة للسيزيوم احتياطات خاصة: يمكن أن يؤدي التعامل غير السليم مع مصادر أشعة جاما السيزيوم 137 إلى إطلاق هذا النظائر المشعة وإصابات الإشعاع. ربما كانت الحالة الأكثر شهرة هي حادثة جويانيا عام 1987 ، حيث تم التخلص من نظام العلاج الإشعاعي الذي تم التخلص منه بشكل غير صحيح من عيادة مهجورة في مدينة جويانيا بالبرازيل من ساحة للخردة ، وتم بيع ملح السيزيوم المتوهج للفضول ، المشترين غير المتعلمين. وأدى ذلك إلى سقوط أربعة قتلى وإصابات خطيرة نتيجة التعرض للإشعاع. إلى جانب السيزيوم 134 واليود 131 والسترونشيوم 90 ، كان السيزيوم 137 من بين النظائر التي وزعتها كارثة تشيرنوبيل والتي تشكل أكبر خطر على الصحة.[97] من المفترض أن تكون النظائر المشعة للفرانسيوم خطيرة أيضًا بسبب طاقتها العالية التحلل وعمرها النصفي القصير ، ولكن لم يتم إنتاج أي منها بكميات كبيرة بما يكفي لتشكل أي خطر جدي.[191]
ملاحظات
- The symbols Na and K for sodium and potassium are derived from their Latin names, natrium and kalium; these are still the origins of the names for the elements in some languages, such as German and Russian.
- Caesium is the spelling recommended by the الاتحاد الدولي للكيمياء البحتة والتطبيقية (IUPAC).[2] The الجمعية الكيميائية الأمريكية (ACS) has used the spelling cesium since 1921,[3][4] following Webster's Third New International Dictionary.
- In both the old IUPAC and the CAS systems for group numbering, this group is known as group IA (pronounced as "group one A", as the "I" is a أرقام رومانية).[5]
- While hydrogen also has this electron configuration, it is not considered an alkali metal as it has very different behaviour owing to the lack of إلكترون تكافؤ p-orbitals in عناصر الدورة الأولىs.
- In the 1869 version of Mendeleev's periodic table, copper and silver were placed in their own group, aligned with hydrogen and زئبق, while gold was tentatively placed under يورانيوم and the undiscovered غاليوم in the مجموعة البورون.
- The إجامة denotes an حالة مثارة.
المراجع
- H&SM Supplement 21.14 - Safe Handling of Alkali Metals and Their Reactive Compounds نسخة محفوظة 10 يناير 2016 على موقع واي باك مشين.
- قالب:RedBook2005.
- Coghill, Anne M.; Garson, Lorrin R., المحررون (2006). The ACS Style Guide: Effective Communication of Scientific Information (الطبعة 3rd). Washington, D.C.: American Chemical Society. صفحة 127. ISBN 978-0-8412-3999-9. مؤرشف من الأصل في 27 يوليو 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Coplen, T. B.; Peiser, H. S. (1998). "History of the recommended atomic-weight values from 1882 to 1997: a comparison of differences from current values to the estimated uncertainties of earlier values" (PDF). Pure Appl. Chem. 70 (1): 237–257. doi:10.1351/pac199870010237. S2CID 96729044. مؤرشف من الأصل (PDF) في 29 مارس 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Fluck, E. (1988). "New Notations in the Periodic Table" (PDF). Pure Appl. Chem. الاتحاد الدولي للكيمياء البحتة والتطبيقية. 60 (3): 431–436. doi:10.1351/pac198860030431. S2CID 96704008. مؤرشف من الأصل (PDF) في 2 مايو 2019. اطلع عليه بتاريخ 24 مارس 2012. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Harper, Douglas. "salary". قاموس علم اشتقاق الألفاظ. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Marggraf, Andreas Siegmund (1761). Chymische Schriften (باللغة الألمانية). صفحة 167. مؤرشف من الأصل في 25 ديسمبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - du Monceau, H. L. D. de l'Academie royale des Sciences.langEN "Sur la Base de Sel Marine" تحقق من قيمة
|مسار أرشيف=(مساعدة). Mémoires de l'Académie Royale des Sciences (باللغة الفرنسية): 65–68. مؤرشف من الأصل في 31 يوليو 2020. الوسيط|CitationClass=تم تجاهله (مساعدة) - Weeks, Mary Elvira (1932). "The discovery of the elements. IX. Three alkali metals: Potassium, sodium, and lithium". Journal of Chemical Education. 9 (6): 1035. Bibcode:1932JChEd...9.1035W. doi:10.1021/ed009p1035. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Siegfried, R. (1963). "The Discovery of Potassium and Sodium, and the Problem of the Chemical Elements". Isis. 54 (2): 247–258. doi:10.1086/349704. JSTOR 228541. PMID 14147904. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (الطبعة الثانية). Butterworth-Heinemann. ISBN 0-08-037941-9. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Enghag, P. (2004). "11. Sodium and Potassium". Encyclopedia of the elements. Wiley-VCH Weinheim. ISBN 978-3-527-30666-4. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Davy, Humphry (1808). "On some new phenomena of chemical changes produced by electricity, in particular the decomposition of the fixed alkalies, and the exhibition of the new substances that constitute their bases; and on the general nature of alkaline bodies". Philosophical Transactions of the Royal Society of London. 98: 1–44. doi:10.1098/rstl.1808.0001. مؤرشف من الأصل في 2 فبراير 2017. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Shaposhnik, V. A. (2007). "History of the discovery of potassium and sodium (on the 200th anniversary of the discovery of potassium and sodium)". Journal of Analytical Chemistry. 62 (11): 1100–1102. doi:10.1134/S1061934807110160. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Ralph, Jolyon; Chau, Ida (24 August 2011). "Petalite: Petalite mineral information and data". مؤرشف من الأصل في 22 ديسمبر 2020. اطلع عليه بتاريخ 27 نوفمبر 2011. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Winter, Mark. "WebElements Periodic Table of the Elements | Lithium | historical information". مؤرشف من الأصل في 7 أغسطس 2020. اطلع عليه بتاريخ 27 نوفمبر 2011. الوسيط
|CitationClass=تم تجاهله (مساعدة); line feed character في|عنوان=على وضع 50 (مساعدة) - Weeks, Mary (2003). Discovery of the Elements. Whitefish, Montana, United States: Kessinger Publishing. صفحة 124. ISBN 978-0-7661-3872-8. اطلع عليه بتاريخ 10 أغسطس 2009. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Johan Arfwedson". مؤرشف من الأصل في 05 يونيو 2008. اطلع عليه بتاريخ 10 أغسطس 2009. الوسيط
|CitationClass=تم تجاهله (مساعدة) - van der Krogt, Peter. "Lithium". Elementymology & Elements Multidict. مؤرشف من الأصل في 22 يناير 2021. اطلع عليه بتاريخ 05 أكتوبر 2010. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Clark, Jim (2005). "Compounds of the Group 1 Elements". chemguide. مؤرشف من الأصل في 22 ديسمبر 2020. اطلع عليه بتاريخ 10 أغسطس 2009. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Krebs, Robert E. (2006). The History and Use of Our Earth's Chemical Elements: A Reference Guide. Westport, Conn.: Greenwood Press. ISBN 978-0-313-33438-2. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Leach, Mark R. (1999–2012). "The Internet Database of Periodic Tables". meta-synthesis.com. مؤرشف من الأصل في 29 يوليو 2020. اطلع عليه بتاريخ 06 أبريل 2012. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Kaner, Richard (2003). "C&EN: It's Elemental: The Periodic Table – Cesium". American Chemical Society. مؤرشف من الأصل في 22 نوفمبر 2020. اطلع عليه بتاريخ 25 فبراير 2010. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Kirchhoff, G.; Bunsen, R. (1861). "Chemische Analyse durch Spectralbeobachtungen" (PDF). Annalen der Physik und Chemie. 189 (7): 337–381. Bibcode:1861AnP...189..337K. doi:10.1002/andp.18611890702. مؤرشف من الأصل (PDF) في 14 نوفمبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Weeks, Mary Elvira (1932). "The discovery of the elements. XIII. Some spectroscopic discoveries". Journal of Chemical Education. 9 (8): 1413–1434. Bibcode:1932JChEd...9.1413W. doi:10.1021/ed009p1413. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "caesium". قاموس أوكسفورد الإنجليزي (الطبعة الثالثة). مطبعة جامعة أكسفورد. سبتمبر 2005. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Newlands, John A. R. (20 August 1864). "On Relations Among the Equivalents". Chemical News. 10: 94–95. مؤرشف من الأصل في 01 يناير 2011. اطلع عليه بتاريخ 25 نوفمبر 2013. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Newlands, John A. R. (18 August 1865). "On the Law of Octaves". Chemical News. 12: 83. مؤرشف من الأصل في 01 يناير 2011. اطلع عليه بتاريخ 25 نوفمبر 2013. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Mendelejew, Dimitri (1869). "Über die Beziehungen der Eigenschaften zu den Atomgewichten der Elemente". Zeitschrift für Chemie (باللغة الألمانية): 405–406. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Jensen, William B. (2003). "The Place of Zinc, Cadmium, and Mercury in the Periodic Table" (PDF). الجمعية الكيميائية الأمريكية. 80 (8): 952–961. Bibcode:2003JChEd..80..952J. doi:10.1021/ed080p952. مؤرشف من الأصل (PDF) في 11 يونيو 2010. اطلع عليه بتاريخ 06 مايو 2012. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Royal Society of Chemistry. "Visual Elements: Group 1 – The Alkali Metals". Visual Elements. Royal Society of Chemistry. مؤرشف من الأصل في 05 أغسطس 2012. اطلع عليه بتاريخ 13 يناير 2012. الوسيط
|CitationClass=تم تجاهله (مساعدة) - استشهاد فارغ (مساعدة)
- Van der Krogt, Peter (10 January 2006). "Francium". Elementymology & Elements Multidict. مؤرشف من الأصل في 22 يناير 2021. اطلع عليه بتاريخ 08 أبريل 2007. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Education: Alabamine & Virginium". TIME. 15 February 1932. مؤرشف من الأصل في 13 أغسطس 2013. اطلع عليه بتاريخ 01 أبريل 2007. الوسيط
|CitationClass=تم تجاهله (مساعدة) - MacPherson, H. G. (1934). "An Investigation of the Magneto-Optic Method of Chemical Analysis". American Physical Society. 47 (4): 310–315. Bibcode:1935PhRv...47..310M. doi:10.1103/PhysRev.47.310. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Adloff, Jean-Pierre; Kaufman, George B. (25 September 2005). Francium (Atomic Number 87), the Last Discovered Natural Element نسخة محفوظة 4 June 2013 على موقع واي باك مشين.. The Chemical Educator 10 (5). Retrieved 26 March 2007.
- "Francium". McGraw-Hill Encyclopedia of Science & Technology. 7. McGraw-Hill Professional. 2002. صفحات 493–494. ISBN 978-0-07-913665-7. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Hoffman, Darleane C.; Lee, Diana M.; Pershina, Valeria (2006). "Transactinides and the future elements". In Morss; Edelstein, Norman M.; Fuger, Jean (المحررون). The Chemistry of the Actinide and Transactinide Elements (الطبعة 3rd). Dordrecht, The Netherlands: Springer. ISBN 978-1-4020-3555-5. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Lougheed, R. W.; Landrum, J. H.; Hulet, E. K.; Wild, J. F.; Dougan, R. J.; Dougan, A. D.; Gäggeler, H.; Schädel, M.; Moody, K. J. (1985). "Search for superheavy elements using 48Ca + 254Esg reaction". Physical Review C. 32 (5): 1760–1763. Bibcode:1985PhRvC..32.1760L. doi:10.1103/PhysRevC.32.1760. PMID 9953034. الوسيط
|CitationClass=تم تجاهله (مساعدة) - van der Krogt, Peter. "Ununennium". Elementymology & Elements Multidict. مؤرشف من الأصل في 27 يوليو 2020. اطلع عليه بتاريخ 14 فبراير 2011. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Schadel, M.; Brüchle, W.; Brügger, M.; Gäggeler, H.; Moody, K.; Schardt, D.; Sümmerer, K.; Hulet, E.; Dougan, A. (1986). "Heavy isotope production by multinucleon transfer reactions with 254Es". Journal of the Less Common Metals. 122: 411–417. doi:10.1016/0022-5088(86)90435-2. مؤرشف من الأصل في 25 نوفمبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: عرض-المؤلفون (link) - "Hunt for element 119 set to begin". Chemistry World. 12 September 2017. مؤرشف من الأصل في 11 نوفمبر 2020. اطلع عليه بتاريخ 09 يناير 2018. الوسيط
|CitationClass=تم تجاهله (مساعدة) - استشهاد فارغ (مساعدة)
- Emsley, John (2011). Nature's Building Blocks: An A-Z Guide to the Elements (الطبعة New). New York, NY: Oxford University Press. صفحة 593. ISBN 978-0-19-960563-7. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Lodders, Katharina (2003). "Solar System Abundances and Condensation Temperatures of the Elements". The Astrophysical Journal. 591 (2): 1220–1247. Bibcode:2003ApJ...591.1220L. doi:10.1086/375492. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Oddo, Giuseppe (1914). "Die Molekularstruktur der radioaktiven Atome". Zeitschrift für Anorganische Chemie. 87: 253–268. doi:10.1002/zaac.19140870118. مؤرشف من الأصل في 25 يوليو 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Harkins, William D. (1917). "The Evolution of the Elements and the Stability of Complex Atoms. I. A New Periodic System Which Shows a Relation Between the Abundance of the Elements and the Structure of the Nuclei of Atoms". Journal of the American Chemical Society. 39 (5): 856–879. doi:10.1021/ja02250a002. مؤرشف من الأصل في 22 سبتمبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - North, John (2008). Cosmos an illustrated history of astronomy and cosmology (الطبعة Rev. and updated). Univ. of Chicago Press. صفحة 602. ISBN 978-0-226-59441-5. مؤرشف من الأصل في 25 يناير 2021. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Morgan, J. W.; Anders, E. (1980). "Chemical composition of Earth, Venus, and Mercury". Proceedings of the National Academy of Sciences. 77 (12): 6973–6977. Bibcode:1980PNAS...77.6973M. doi:10.1073/pnas.77.12.6973. PMID 16592930. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Albarède, Francis (2003). Geochemistry: an introduction. Cambridge University Press. ISBN 978-0-521-89148-6. مؤرشف من الأصل في 26 أكتوبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Abundance in Earth's Crust". WebElements.com. مؤرشف من الأصل في 28 فبراير 2008. اطلع عليه بتاريخ 14 أبريل 2007. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "List of Periodic Table Elements Sorted by Abundance in Earth's crust". Israel Science and Technology Homepage. مؤرشف من الأصل في 14 نوفمبر 2020. اطلع عليه بتاريخ 15 أبريل 2007. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Lide, D. R., المحرر (2005), CRC Handbook of Chemistry and Physics (الطبعة 86th), Boca Raton (FL): CRC Press, ISBN 0-8493-0486-5 الوسيط
|CitationClass=تم تجاهله (مساعدة); الوسيط|separator=تم تجاهله (مساعدة)CS1 maint: ref=harv (link) - "Lithium Occurrence". Institute of Ocean Energy, Saga University, Japan. مؤرشف من الأصل في 02 مايو 2009. اطلع عليه بتاريخ 13 مارس 2009. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Some Facts about Lithium". ENC Labs. مؤرشف من الأصل في 22 ديسمبر 2020. اطلع عليه بتاريخ 15 أكتوبر 2010. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Schwochau, Klaus (1984). "Extraction of metals from sea water". Inorganic Chemistry. 124/1984. صفحات 91–133. doi:10.1007/3-540-13534-0_3. ISBN 978-3-540-13534-0. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Wise, M. A. (1995). "Trace element chemistry of lithium-rich micas from rare-element granitic pegmatites". Mineralogy and Petrology. 55 (13): 203–215. Bibcode:1995MinPe..55..203W. doi:10.1007/BF01162588. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Butterman, William C.; Brooks, William E.; Reese, Jr., Robert G. (2004). "Mineral Commodity Profile: Cesium" (PDF). United States Geological Survey. مؤرشف من الأصل (PDF) في 22 نوفمبر 2009. اطلع عليه بتاريخ 27 ديسمبر 2009. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Wieser, Michael E.; Berglund, Michael (2009). "Atomic weights of the elements 2007 (IUPAC Technical Report)" (PDF). الاتحاد الدولي للكيمياء البحتة والتطبيقية. 81 (11): 2131–2156. doi:10.1351/PAC-REP-09-08-03. مؤرشف من الأصل (PDF) في 11 مارس 2020. اطلع عليه بتاريخ 07 فبراير 2012. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Wieser, Michael E.; Coplen, Tyler B. (2011). "Atomic weights of the elements 2009 (IUPAC Technical Report)" (PDF). الاتحاد الدولي للكيمياء البحتة والتطبيقية. 83 (2): 359–396. doi:10.1351/PAC-REP-10-09-14. مؤرشف من الأصل (PDF) في 21 ديسمبر 2018. اطلع عليه بتاريخ 11 فبراير 2012. الوسيط
|CitationClass=تم تجاهله (مساعدة) - CRC Handbook of Chemistry and Physics. 4. CRC. 2006. صفحة 12. ISBN 978-0-8493-0474-3. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Emsley, John (2001). Nature's Building Blocks. Oxford: Oxford University Press. صفحات 151–153. ISBN 978-0-19-850341-5. مؤرشف من الأصل في 27 نوفمبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Gagnon, Steve. "Francium". Jefferson Science Associates, LLC. مؤرشف من الأصل في 31 مارس 2007. اطلع عليه بتاريخ 01 أبريل 2007. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Winter, Mark. "Geological information". Francium. The University of Sheffield. مؤرشف من الأصل في 8 نوفمبر 2020. اطلع عليه بتاريخ 26 مارس 2007. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "It's Elemental — The Periodic Table of Elements". Jefferson Lab. مؤرشف من الأصل في 29 أبريل 2007. اطلع عليه بتاريخ 14 أبريل 2007. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Lide, D. R., المحرر (2003). CRC Handbook of Chemistry and Physics (الطبعة 84th). Boca Raton, FL: CRC Press. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Coulomb explosion during the early stages of the reaction of alkali metals with water". Nature Chemistry. 26 Jan 2015. doi:10.1038/nchem.2161. مؤرشف من الأصل في 11 ديسمبر 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Sodium's Explosive Secrets Revealed". Scientific American. 27 Jan 2015. مؤرشف من الأصل في 31 يوليو 2017. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Clark, Jim (2005). "Atomic and Physical Properties of the Group 1 Elements". chemguide. مؤرشف من الأصل في 22 نوفمبر 2020. اطلع عليه بتاريخ 30 يناير 2012. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Gray, Theodore. "Facts, pictures, stories about the element Cesium in the Periodic Table". The Wooden Periodic Table Table. مؤرشف من الأصل في 09 نوفمبر 2020. اطلع عليه بتاريخ 13 يناير 2012. الوسيط
|CitationClass=تم تجاهله (مساعدة) - The OpenLearn team (2012). "Alkali metals". OpenLearn. The Open University. مؤرشف من الأصل في 13 نوفمبر 2020. اطلع عليه بتاريخ 09 يوليو 2012. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Gray, Theodore. "Alkali Metal Bangs". ثيودور غراي. مؤرشف من الأصل في 12 نوفمبر 2020. اطلع عليه بتاريخ 13 مايو 2012. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Dye, James L.; Ceraso, Joseph M.; Lok, Mei; Barnett, B. L.; Tehan, Frederick J. (1974). "Crystalline salt of the sodium anion (Na−)". J. Am. Chem. Soc. 96 (2): 608–609. doi:10.1021/ja00809a060. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Tehan, Frederick J.; Barnett, B. L.; Dye, James L. (1974). "Alkali anions. Preparation and crystal structure of a compound which contains the cryptated sodium cation and the sodium anion". J. Am. Chem. Soc. 96 (23): 7203–7208. doi:10.1021/ja00830a005. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Dye, J. L. (1979). "Compounds of Alkali Metal Anions". Angew. Chem. Int. Ed. Engl. 18 (8): 587–598. doi:10.1002/anie.197905871. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Redko, M. Y.; Huang, R. H.; Jackson, J. E.; Harrison, J. F.; Dye, J. L. (2003). "Barium azacryptand sodide, the first alkalide with an alkaline Earth cation, also contains a novel dimer, (Na2)2−". J. Am. Chem. Soc. 125 (8): 2259–2263. doi:10.1021/ja027241m. PMID 12590555. مؤرشف من الأصل في 25 أبريل 2018. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Redko, M. Y.; Vlassa, M.; Jackson, J. E.; Misiolek, A. W.; Huang, R. H.; Dye, J. L. (2002). ""Inverse sodium hydride": a crystalline salt that contains H+ and Na−". J. Am. Chem. Soc. 124 (21): 5928–5929. doi:10.1021/ja025655+. PMID 12022811. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Sawicka, A.; Skurski, P.; Simons, J. (2003). "Inverse Sodium Hydride: A Theoretical Study" (PDF). J. Am. Chem. Soc. 125 (13): 3954–3958. doi:10.1021/ja021136v. PMID 12656631. مؤرشف من الأصل (PDF) في 22 نوفمبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Burgess, John (1978). Metal Ions in Solution. Chichester: Ellis Horwood. صفحة 20. ISBN 978-0-85312-027-8. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Richens, David. T. (1997). The Chemistry of Aqua Ions. Wiley. ISBN 978-0-471-97058-3. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Averill, Bruce A.; Eldredge, Patricia (2007). "21.3: The Alkali Metals". Chemistry: Principles, Patterns, and Applications with Student Access Kit for Mastering General Chemistry (الطبعة 1st). Prentice Hall. ISBN 978-0-8053-3799-0. اطلع عليه بتاريخ 24 يونيو 2013. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Persson, Ingmar (2010). "Hydrated metal ions in aqueous solution: How regular are their structures?" (PDF). Pure Appl. Chem. 82 (10): 1901–1917. doi:10.1351/PAC-CON-09-10-22. مؤرشف من الأصل (PDF) في 1 يوليو 2017. اطلع عليه بتاريخ 23 أغسطس 2014. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Clark, Jim (2005). "Reaction of the Group 1 Elements with Oxygen and Chlorine". chemguide. مؤرشف من الأصل في 14 نوفمبر 2020. اطلع عليه بتاريخ 27 يونيو 2012. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Shriver, Duward; Atkins, Peter (2006). Inorganic Chemistry. W. H. Freeman. صفحة 259. ISBN 978-0-7167-4878-6. مؤرشف من الأصل في 27 يوليو 2020. اطلع عليه بتاريخ 10 نوفمبر 2012. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Andreev, S.V.; Letokhov, V.S.; Mishin, V.I. (1987). "Laser resonance photoionization spectroscopy of Rydberg levels in Fr". Phys. Rev. Lett. 59 (12): 1274–76. Bibcode:1987PhRvL..59.1274A. doi:10.1103/PhysRevLett.59.1274. PMID 10035190. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Thayer, John S. (2010). "Relativistic Effects and the Chemistry of the Heavier Main Group Elements". Relativistic Methods for Chemists. 10: 81, 84. doi:10.1007/978-1-4020-9975-5_2. ISBN 978-1-4020-9974-8. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Landau, A.; Eliav, E.; Ishikawa, Y.; Kaldor, U. (2001). "Benchmark calculations of electron affinities of the alkali atoms sodium to eka-francium (element 119)". J. Chem. Phys. 115 (6): 2389. Bibcode:2001JChPh.115.2389L. doi:10.1063/1.1386413. مؤرشف من الأصل في 31 يوليو 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Jones, Cameron; Mountford, Philip; Stasch, Andreas; Blake, Matthew P. (22 June 2015). "s-block Metal-Metal Bonds". In Liddle (المحرر). Molecular Metal-Metal Bonds: Compounds, Synthesis, Properties. John Wiley and Sons. صفحات 23–24. ISBN 978-3-527-33541-1. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Various authors (2002). Lide (المحرر). Handbook of Chemistry & Physics (الطبعة 88th). CRC. ISBN 978-0-8493-0486-6. OCLC 179976746. مؤرشف من الأصل في 29 ديسمبر 2018. اطلع عليه بتاريخ 23 مايو 2008. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Universal Nuclide Chart". Nucleonica. Institute for Transuranium Elements. 2007–2012. مؤرشف من الأصل في 11 نوفمبر 2020. اطلع عليه بتاريخ 17 أبريل 2011. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Sonzogni, Alejandro. "Interactive Chart of Nuclides". Brookhaven National Laboratory. مؤرشف من الأصل في 10 أكتوبر 2018. اطلع عليه بتاريخ 04 أكتوبر 2012. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Patton, I. Jocelyn; Waldbauer, L. J. (1926). "The Radioactivity of the Alkali Metals". Chemical Reviews. 3: 81–93. doi:10.1021/cr60009a003. الوسيط
|CitationClass=تم تجاهله (مساعدة) - McLennan, J. C.; Kennedy, W. T. (1908). "On the radioactivity of potassium and other alkali metals". Philosophical Magazine. 16 (93): 377–395. doi:10.1080/14786440908636519. مؤرشف من الأصل في 28 أكتوبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Potassium-40" (PDF). Human Health Fact Sheet. مختبر أرجون الوطني, Environmental Science Division. August 2005. مؤرشف من الأصل (PDF) في 03 ديسمبر 2013. اطلع عليه بتاريخ 07 فبراير 2012. الوسيط
|CitationClass=تم تجاهله (مساعدة) - National Institute of Standards and Technology. "Radionuclide Half-Life Measurements". مؤرشف من الأصل في 12 أغسطس 2016. اطلع عليه بتاريخ 07 نوفمبر 2011. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Radioisotope Brief: Cesium-137 (Cs-137). U.S. National Center for Environmental Health نسخة محفوظة 11 أكتوبر 2019 على موقع واي باك مشين.
- The Radiological Accident in Goiânia. الوكالة الدولية للطاقة الذرية. 1988. مؤرشف من الأصل في 27 يوليو 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Delacroix, D.; Guerre, J. P.; Leblanc, P.; Hickman, C. (2002). Radionuclide and Radiation Protection Data Handbook 2002 (الطبعة 2nd). Nuclear Technology Publishing. ISBN 978-1-870965-87-3. الوسيط
|CitationClass=تم تجاهله (مساعدة) - L. Brown, Theodore; LeMay, Jr., H. Eugene; Bursten, Bruce E.; Burdge, Julia R. (2003). Chemistry: The Central Science (الطبعة 8th). US: Pearson Education. ISBN 978-0-13-061142-0. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Clark, Jim (2005). "Reaction of the Group 1 Elements with Water". chemguide. مؤرشف من الأصل في 27 ديسمبر 2020. اطلع عليه بتاريخ 18 يونيو 2012. الوسيط
|CitationClass=تم تجاهله (مساعدة) - الاتحاد الدولي للكيمياء البحتة والتطبيقية. "Electronegativity". Compendium of Chemical Terminology Internet edition.
- Goldberg, David E. (1988). 3,000 Solved Problems in Chemistry (الطبعة 1st). McGraw-Hill. ISBN 978-0-07-023684-4. الوسيط
|CitationClass=تم تجاهله (مساعدة) Section 17.43, page 321 - Theodore, Louis; Dupont, R. Ryan; Ganesan, Kumar, المحررون (1999). Pollution Prevention: The Waste Management Approach to the 21st Century. CRC Press. صفحة 15 Section 27. ISBN 978-1-56670-495-3. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Clark, Jim (2000). "Metallic Bonding". chemguide. مؤرشف من الأصل في 22 نوفمبر 2020. اطلع عليه بتاريخ 23 مارس 2012. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Mason, Philip E. (26 January 2015). "Coulomb explosion during the early stages of the reaction of alkali metals with water". Nature Chemistry. 7 (3): 250–254. Bibcode:2015NatCh...7..250M. doi:10.1038/nchem.2161. PMID 25698335. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Buszek, Keith R. (2001) "Sodium Amalgam" in Encyclopedia of Reagents for Organic Synthesis, Wiley. doi:10.1002/047084289X.rs040
- "Sodium-Potassium Alloy (NaK)" (PDF). باسف. December 2004. مؤرشف من الأصل (PDF) في 27 سبتمبر 2007. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Sevov, S.C. "Zintl Phases", pp. 113–132 in Intermetallic Compounds, Principles and Practice: Progress, Vol. 3. Westbrook, J.H.; Freisher, R.L.: Eds.; John Wiley & Sons. Ltd., Chichester, England doi:10.1002/0470845856 (ردمك 978-0-470-84585-1) نسخة محفوظة 27 سبتمبر 2020 على موقع واي باك مشين.
- S.M. Kauzlarich, Encyclopedia of Inorganic chemistry, 1994, John Wiley & Sons, (ردمك 0-471-93620-0)
- Hagen, A. P. (17 September 2009). Inorganic Reactions and Methods, The Formation of Bonds to Group-I, -II, and -IIIB Elements. John Wiley & Sons. صفحات 204–5. ISBN 978-0-470-14549-4. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Matkovich, V. I. (6 December 2012). Boron and Refractory Borides. Springer. صفحات 262–92. ISBN 978-3-642-66620-9. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Hermann, Andreas; McSorley, Alexandra; N. W., Ashcroft; Hoffmann, Roald (2012). "From Wade–Mingos to Zintl–Klemm at 100 GPa: Binary Compounds of Boron and Lithium" (PDF). Journal of the American Chemical Society. 2012 (134): 18606–18. doi:10.1021/ja308492g. PMID 23066852. مؤرشف من الأصل (PDF) في 27 سبتمبر 2020. اطلع عليه بتاريخ 21 أغسطس 2016. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Housecroft, Catherine E.; Sharpe, Alan G. (2008). "Chapter 14: The group 14 elements". Inorganic Chemistry, 3rd Edition. Pearson. صفحة 386. ISBN 978-0-13-175553-6. الوسيط
|CitationClass=تم تجاهله (مساعدة) - NIST Ionizing Radiation Division 2001 – Technical Highlights. physics.nist.gov نسخة محفوظة 3 يناير 2020 على موقع واي باك مشين.
- Emery, N.; et al. (2008). "Review: Synthesis and superconducting properties of CaC6". Sci. Technol. Adv. Mater. 9 (4): 044102. Bibcode:2008STAdM...9d4102E. doi:10.1088/1468-6996/9/4/044102. PMID 27878015. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Hoch, Constantin; Wendorff, Marco; Röhr, Caroline (2002). "Tetrapotassium nonastannide, K4Sn9". Acta Crystallographica Section C. 58 (4): I45–I46. doi:10.1107/S0108270102002032. PMID 11932511. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Gregory, Duncan H.; O'Meara, Paul M.; Gordon, Alexandra G.; Hodges, Jason P.; Short, Simine; Jorgensen, James D. (2002). "Structure of Lithium Nitride and Transition-Metal-Doped Derivatives, Li3−x−yMxN (M= Ni, Cu): A Powder Neutron Diffraction Study". Chem. Mater. 14 (5): 2063–2070. doi:10.1021/cm010718t. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Fischer, D.; Jansen, M. (2002). "Synthesis and structure of Na3N". Angew Chem. 41 (10): 1755–1756. doi:10.1002/1521-3773(20020517)41:10<1755::AID-ANIE1755>3.0.CO;2-C. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Fischer, D.; Cancarevic, Z.; Schön, J. C.; Jansen, M. Z. (2004). "Synthesis and structure of K3N". Z. Anorg. Allg. Chem. 630 (1): 156–160. doi:10.1002/zaac.200300280. الوسيط
|CitationClass=تم تجاهله (مساعدة). 'Elusive Binary Compound Prepared' Chemical & Engineering News 80 No. 20 (20 May 2002) - H.G. Von Schnering, W. Hönle Phosphides – Solid-state Chemistry Encyclopedia of Inorganic Chemistry Ed. R. Bruce King (1994) John Wiley & Sons (ردمك 0-471-93620-0)
- Kahlenberg, Louis (2008). Outlines of Chemistry – A Textbook for College Students. READ BOOKS. صفحات 324–325. ISBN 978-1-4097-6995-8. الوسيط
|CitationClass=تم تجاهله (مساعدة) - King, R. Bruce (1995). Inorganic Chemistry of Main Group Elements. Wiley-VCH. ISBN 978-0-471-18602-1. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Welcome to Arthur Mar's Research Group". University of Alberta. University of Alberta. 1999–2013. مؤرشف من الأصل في 22 نوفمبر 2020. اطلع عليه بتاريخ 24 يونيو 2013. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Lindsay, D. M.; Garland, D. A. (1987). "ESR spectra of matrix-isolated lithium superoxide". The Journal of Physical Chemistry. 91 (24): 6158–61. doi:10.1021/j100308a020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Vol'nov, I. I.; Matveev, V. V. (1963). "Synthesis of cesium ozonide through cesium superoxide". Bulletin of the Academy of Sciences, USSR Division of Chemical Science. 12 (6): 1040–1043. doi:10.1007/BF00845494. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Tokareva, S. A. (1971). "Alkali and Alkaline Earth Metal Ozonides". Russian Chemical Reviews. 40 (2): 165–174. Bibcode:1971RuCRv..40..165T. doi:10.1070/RC1971v040n02ABEH001903. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Simon, A. (1997). "Group 1 and 2 Suboxides and Subnitrides – Metals with Atomic Size Holes and Tunnels". Coordination Chemistry Reviews. 163: 253–270. doi:10.1016/S0010-8545(97)00013-1. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Tsai, Khi-Ruey; Harris, P. M.; Lassettre, E. N. (1956). "The Crystal Structure of Tricesium Monoxide". Journal of Physical Chemistry. 60 (3): 345–347. doi:10.1021/j150537a023. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Okamoto, H. (2009). "Cs-O (Cesium-Oxygen)". Journal of Phase Equilibria and Diffusion. 31: 86–87. doi:10.1007/s11669-009-9636-5. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Band, A.; Albu-Yaron, A.; Livneh, T.; Cohen, H.; Feldman, Y.; Shimon, L.; Popovitz-Biro, R.; Lyahovitskaya, V.; Tenne, R. (2004). "Characterization of Oxides of Cesium". The Journal of Physical Chemistry B. 108 (33): 12360–12367. doi:10.1021/jp036432o. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Brauer, G. (1947). "Untersuchungen über das System Cäsium-Sauerstoff". Zeitschrift für Anorganische Chemie. 255 (1–3): 101–124. doi:10.1002/zaac.19472550110. الوسيط
|CitationClass=تم تجاهله (مساعدة) - House, James E. (2008). Inorganic chemistry. Academic Press. صفحة 524. ISBN 978-0-12-356786-4. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Moyer, Harvey V. (1956). "Chemical Properties of Polonium". In Moyer (المحرر). Polonium. Oak Ridge, Tenn.: United States Atomic Energy Commission. صفحات 33–96. doi:10.2172/4367751. TID-5221. مؤرشف من الأصل في 26 يوليو 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Bagnall, K. W. (1962). "The Chemistry of Polonium". Adv. Inorg. Chem. Radiochem. 4: 197–229. doi:10.1016/S0065-2792(08)60268-X. ISBN 978-0-12-023604-6. مؤرشف من الأصل في 25 يناير 2021. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Cotton, F. A.; Wilkinson, G. (1972). Advanced Inorganic Chemistry. John Wiley and Sons Inc. ISBN 978-0-471-17560-5. الوسيط
|CitationClass=تم تجاهله (مساعدة) - T. Kottke, D. Stalke (September 1993). "Structures of Classical Reagents in Chemical Synthesis: (nBuLi)6, (tBuLi)4, and the Metastable (tBuLi · Et2O)2". Angew. Chem. Int. Ed. Engl. 32 (4): 580–582. doi:10.1002/anie.199305801. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Elschenbroich, C. "Organometallics" (2006) Wiley-VCH: Weinheim. (ردمك 3-527-29390-6).
- Dinnebier, R. E.; Behrens, U.; Olbrich, F. (1998). "Lewis Base-Free Phenyllithium: Determination of the Solid-State Structure by Synchrotron Powder Diffraction". Journal of the American Chemical Society. 120 (7): 1430–1433. doi:10.1021/ja972816e. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Brown, T. L.; Rogers, M. T. (1957). "The Preparation and Properties of Crystalline Lithium Alkyls". Journal of the American Chemical Society. 79 (8): 1859–1861. doi:10.1021/ja01565a024. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Schlosser, Manfred (1988). "Superbases for organic synthesis" (PDF). Pure Appl. Chem. 60 (11): 1627–1634. doi:10.1351/pac198860111627. مؤرشف من الأصل (PDF) في 27 سبتمبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Clegg, William; Conway, Ben; Kennedy, Alan R.; Klett, Jan; Mulvey, Robert E.; Russo, Luca (2011). "Synthesis and Structures of \(Trimethylsilyl)methyl]sodium and -potassium with Bi- and Tridentate N-Donor Ligands". European Journal of Inorganic Chemistry. 2011 (5): 721–726. doi:10.1002/ejic.201000983. مؤرشف من الأصل في 1 أغسطس 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Inorganic Chemistry" by Gary L. Miessler and Donald A. Tar, 6th edition, Pearson
- Kumar De, Anil (2007). A Text Book of Inorganic Chemistry. New Age International. p. 247. (ردمك 978-8122413847).
- "The chemistry of the Elements" by Greenwood and Earnshaw, 2nd edition, Elsevier
- "Inorganic Chemistry" by Cotton and Wilkinson
- Pyykkö, Pekka (2011). "A suggested periodic table up to Z ≤ 172, based on Dirac–Fock calculations on atoms and ions". Physical Chemistry Chemical Physics. 13 (1): 161–8. Bibcode:2011PCCP...13..161P. doi:10.1039/c0cp01575j. PMID 20967377. مؤرشف من الأصل في 31 يوليو 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Gäggeler, Heinz W. (5–7 November 2007). "Gas Phase Chemistry of Superheavy Elements" (PDF). Lecture Course Texas A&M. مؤرشف من الأصل (PDF) في 20 فبراير 2012. اطلع عليه بتاريخ 26 فبراير 2012. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Fricke, Burkhard (1975). "Superheavy elements: a prediction of their chemical and physical properties". Recent Impact of Physics on Inorganic Chemistry. 21: 89–144. doi:10.1007/BFb0116498. ISBN 978-3-540-07109-9. مؤرشف من الأصل في 27 نوفمبر 2020. اطلع عليه بتاريخ 04 أكتوبر 2013. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Fricke, Burkhard (1977). "Dirac-Fock-Slater calculations for the elements Z = 100, fermium, to Z = 173" (PDF). Recent Impact of Physics on Inorganic Chemistry. 19: 83–192. Bibcode:1977ADNDT..19...83F. doi:10.1016/0092-640X(77)90010-9. مؤرشف من الأصل (PDF) في 22 مارس 2016. اطلع عليه بتاريخ 25 فبراير 2016. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Kul'sha, A. V. "Есть ли граница у таблицы Менделеева?" [Is there a boundary to the Mendeleev table?] (PDF). www.primefan.ru (باللغة الروسية). مؤرشف من الأصل (PDF) في 17 أكتوبر 2020. اطلع عليه بتاريخ 08 سبتمبر 2018. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Nuclear scientists eye future landfall on a second 'island of stability'. EurekAlert! (2008-04-06). Retrieved on 2016-11-25. نسخة محفوظة 2020-11-09 على موقع واي باك مشين.
- Grumann, Jens; Mosel, Ulrich; Fink, Bernd; Greiner, Walter (1969). "Investigation of the stability of superheavy nuclei around Z=114 and Z=164". Zeitschrift für Physik. 228 (5): 371–386. Bibcode:1969ZPhy..228..371G. doi:10.1007/BF01406719. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Dietzel, P. D.; Kremer, R. K.; Jansen, M. (8 January 2007). "Superoxide compounds of the large pseudo-alkali-metal ions tetramethylammonium, -phosphonium, and -arsonium". Chemistry – an Asian Journal. 2 (1): 66–75. doi:10.1002/asia.200600306. PMID 17441140. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "International Union of Pure and Applied Chemistry > Periodic Table of the Elements". IUPAC. مؤرشف من الأصل في 31 يناير 2020. اطلع عليه بتاريخ 01 مايو 2011. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Folden, Cody (31 January 2009). "The Heaviest Elements in the Universe" (PDF). Saturday Morning Physics at Texas A&M. مؤرشف من الأصل (PDF) في 10 أغسطس 2014. اطلع عليه بتاريخ 09 مارس 2012. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Emsley, J. (1989). The Elements. Oxford: Clarendon Press. صفحات 22–23. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Winter, Mark J. (1994) Chemical Bonding, Oxford University Press, (ردمك 0-19-855694-2)
- Cronyn, Marshall W. (August 2003). "The Proper Place for Hydrogen in the Periodic Table" (PDF). Journal of Chemical Education. 80 (8): 947–951. Bibcode:2003JChEd..80..947C. doi:10.1021/ed080p947. مؤرشف من الأصل (PDF) في 25 سبتمبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Huheey, J.E.; Keiter, E.A. and Keiter, R.L. (1993) Inorganic Chemistry: Principles of Structure and Reactivity, 4th edition, HarperCollins, New York, USA.
- James, A.M. and Lord, M.P. (1992) Macmillan's Chemical and Physical Data, Macmillan, London, UK.
- Wigner, E.; Huntington, H. B. (1935). "On the possibility of a metallic modification of hydrogen". Journal of Chemical Physics. 3 (12): 764. Bibcode:1935JChPh...3..764W. doi:10.1063/1.1749590. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Nellis, W. J.; Weir, S. T.; Mitchell, A. C. (1999). "Metallization of fluid hydrogen at 140 GPa (1.4 Mbar) by shock compression". Shock Waves. 9 (5): 301–305. Bibcode:1999ShWav...9..301N. doi:10.1007/s001930050189. مؤرشف من الأصل في 22 نوفمبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Cousins, David M.; Davidson, Matthew G.; García-Vivó, Daniel (2013). "Unprecedented participation of a four-coordinate hydrogen atom in the cubane core of lithium and sodium phenolates". Chem. Commun. 49 (100): 11809–11811. doi:10.1039/c3cc47393g. PMID 24217230. مؤرشف من الأصل في 29 يوليو 2020. اطلع عليه بتاريخ 07 أغسطس 2014. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Leach, Mark R. "2002 Inorganic Chemist's Periodic Table". مؤرشف من الأصل في 25 سبتمبر 2020. اطلع عليه بتاريخ 16 أكتوبر 2012. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Holleman, Arnold Frederik; Wiberg, Egon (2001), Wiberg, Nils (المحرر), Inorganic Chemistry, تُرجم بواسطة Eagleson, Mary; Brewer, William, San Diego/Berlin: Academic Press/De Gruyter, ISBN 0-12-352651-5 الوسيط
|CitationClass=تم تجاهله (مساعدة); الوسيط|separator=تم تجاهله (مساعدة)CS1 maint: ref=harv (link) - Stevenson, D. J. (20 November 1975). "Does metallic ammonium exist?". Nature Publishing Group. 258 (5532): 222–223. Bibcode:1975Natur.258..222S. doi:10.1038/258222a0. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Bernal, M. J. M.; Massey, H. S. W. (3 February 1954). "Metallic Ammonium". Wiley-Blackwell for the الجمعية الفلكية الملكية. 114 (2): 172–179. Bibcode:1954MNRAS.114..172B. doi:10.1093/mnras/114.2.172. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Solubility Rules!". chem.sc.edu. مؤرشف من الأصل في 27 نوفمبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Reedy, J. H. (1 October 1929). "Lecture demonstration of ammonium amalgam". Journal of Chemical Education. 6 (10): 1767. Bibcode:1929JChEd...6.1767R. doi:10.1021/ed006p1767. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Connelly, Neil G.; Geiger, William E. (1996). "Chemical Redox Agents for Organometallic Chemistry". Chemical Reviews. 96 (2): 877–910. doi:10.1021/cr940053x. PMID 11848774. الوسيط
|CitationClass=تم تجاهله (مساعدة) - El Murr, N.; Sheats, J. E.; Geiger, W. E.; Holloway, J. D. L. (1979). "Electrochemical Reduction Pathways of the Rhodocenium Ion. Dimerization and Reduction of Rhodocene". Inorg. Chem. 18 (6): 1443–1446. doi:10.1021/ic50196a007. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Keller, H. J.; Wawersik, H. (1967). "Spektroskopische Untersuchungen an Komplexverbindungen. VI. EPR-spektren von (C5H5)2Rh und (C5H5)2Ir". J. Organomet. Chem. (باللغة الألمانية). 8 (1): 185–188. doi:10.1016/S0022-328X(00)84718-X. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Shannon, R. D. (1976). "Revised effective ionic radii and systematic studies of interatomic distances in halides and chalcogenides" (PDF). Acta Crystallogr A. 32 (5): 751–767. Bibcode:1976AcCrA..32..751S. doi:10.1107/S0567739476001551. مؤرشف من الأصل (PDF) في 14 أغسطس 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Crookes, William (1864). "On Thallium". Harrison & Sons. 17: 112–152. doi:10.1039/js8641700112. مؤرشف من الأصل في 25 ديسمبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - International Union of Pure and Applied Chemistry (2005). Nomenclature of Inorganic Chemistry (IUPAC Recommendations 2005). Cambridge (UK): Royal Society of Chemistry–International Union of Pure and Applied Chemistry (IUPAC). (ردمك 0-85404-438-8). نسخة إلكترونية باللغة الإنجليزية..
- Mudring, Anja-Verena (2007). "Thallium Halides – New Aspects of the Stereochemical Activity of Electron Lone Pairs of Heavier Main-Group Elements". European Journal of Inorganic Chemistry. 2007 (6): 882–890. doi:10.1002/ejic.200600975. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Russell AM & Lee KL (2005) Structure-property relations in nonferrous metals. Wiley-Interscience, New York. p. 302. (ردمك 0-471-64952-X) نسخة محفوظة 22 نوفمبر 2020 على موقع واي باك مشين.
- Deming HG (1940) Fundamental Chemistry, John Wiley & Sons, New York, pp. 705–7
- Bailar, J. C. (1973) Comprehensive inorganic chemistry, vol. 3, p. 16. (ردمك 1-57215-291-5)
- Ober, Joyce A. "Lithium" (PDF). هيئة المساحة الجيولوجية الأمريكية. صفحات 77–78. مؤرشف من الأصل (PDF) في 11 يوليو 2007. اطلع عليه بتاريخ 19 أغسطس 2007. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Pauling, Linus. General Chemistry (الطبعة 1970). Dover Publications. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Los Alamos National Laboratory – Sodium". مؤرشف من الأصل في 14 نوفمبر 2020. اطلع عليه بتاريخ 08 يونيو 2007. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Merck Index, 9th ed., monograph 8325
- Winter, Mark. "WebElements Periodic Table of the Elements | Potassium | Essential information". Webelements. مؤرشف من الأصل في 24 نوفمبر 2020. اطلع عليه بتاريخ 27 نوفمبر 2011. الوسيط
|CitationClass=تم تجاهله (مساعدة); line feed character في|عنوان=على وضع 50 (مساعدة) - "Cesium and Rubidium Hit Market". Chemical & Engineering News. 37 (22): 50–56. 1959. doi:10.1021/cen-v037n022.p050. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Butterman, William C.; Brooks, William E.; Reese, Jr., Robert G. (2003). "Mineral Commodity Profile: Rubidium" (PDF). United States Geological Survey. مؤرشف من الأصل (PDF) في 6 يناير 2021. اطلع عليه بتاريخ 04 ديسمبر 2010. الوسيط
|CitationClass=تم تجاهله (مساعدة) - bulletin 585. United States. Bureau of Mines. 1995. مؤرشف من الأصل في 25 يناير 2021. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Burt, R. O. (1993). "Caesium and cesium compounds". Kirk-Othmer encyclopedia of chemical technology. 5 (الطبعة 4th). New York: John Wiley & Sons, Inc. صفحات 749–764. ISBN 978-0-471-48494-3. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Stancari, G.; Veronesi, S.; Corradi, L.; Atutov, S. N.; Calabrese, R.; Dainelli, A.; Mariotti, E.; Moi, L.; Sanguinetti, S. (2006). "Production of Radioactive Beams of Francium". Nuclear Instruments and Methods in Physics Research Section A: Accelerators, Spectrometers, Detectors and Associated Equipment. 557 (2): 390–396. Bibcode:2006NIMPA.557..390S. doi:10.1016/j.nima.2005.11.193. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Orozco, Luis A. (2003). "Francium". Chemical and Engineering News. 81 (36): 159. doi:10.1021/cen-v081n036.p159. مؤرشف من الأصل في 21 يوليو 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Price, Andy (20 December 2004). "Francium". مؤرشف من الأصل في 22 يناير 2021. اطلع عليه بتاريخ 19 فبراير 2012. الوسيط
|CitationClass=تم تجاهله (مساعدة) - USGS (2011). "Lithium". مؤرشف من الأصل (PDF) في 29 يوليو 2020. اطلع عليه بتاريخ 04 ديسمبر 2011. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Soaps & Detergents: Chemistry". مؤرشف من الأصل في 24 نوفمبر 2020. اطلع عليه بتاريخ 20 يوليو 2015. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Lindsey, Jack L (1997). Applied illumination engineering. صفحة 112. ISBN 978-0-88173-212-2. مؤرشف من الأصل في 22 نوفمبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Kane, Raymond; Sell, Heinz (2001). Revolution in lamps: A chronicle of 50 years of progress. صفحة 241. ISBN 978-0-88173-351-8. مؤرشف من الأصل في 22 نوفمبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Stampers, National Association of Drop Forgers and (1957). Metal treatment and drop forging. مؤرشف من الأصل في 25 يناير 2021. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Harris, Jay C (1949). Metal cleaning bibliographical abstracts. صفحة 76. مؤرشف من الأصل في 14 نوفمبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Cordel, Oskar (1868). Die Stassfurter Kalisalze in der Landwirthschalt: Eine Besprechung ... (باللغة الألمانية). L. Schnock. مؤرشف من الأصل في 23 نوفمبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Toedt, John; Koza, Darrell; Cleef-Toedt, Kathleen Van (2005). "Personal Cleansing Products: Bar Soap". Chemical composition of everyday products. Greenwood Publishing Group. ISBN 978-0-313-32579-3. مؤرشف من الأصل في 26 يوليو 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Schultz, H.; et al. (2006). "Potassium compounds". Ullmann's Encyclopedia of Industrial Chemistry. A22. صفحة 95. doi:10.1002/14356007.a22_031.pub2. ISBN 978-3-527-30673-2. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Cesium Atoms at Work". Time Service Department—U.S. Naval Observatory—Department of the Navy. مؤرشف من الأصل في 23 فبراير 2015. اطلع عليه بتاريخ 20 ديسمبر 2009. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "The NIST reference on Constants, Units, and Uncertainty". National Institute of Standards and Technology. مؤرشف من الأصل في 09 يونيو 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Koch, E.-C. (2002). "Special Materials in Pyrotechnics, Part II: Application of Caesium and Rubidium Compounds in Pyrotechnics". Journal Pyrotechnics. 15: 9–24. مؤرشف من الأصل في 13 يوليو 2011. اطلع عليه بتاريخ 03 نوفمبر 2011. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Heiserman, David L. (1992). Exploring Chemical Elements and their Compounds. McGraw-Hill. صفحات 201–203. ISBN 978-0-8306-3015-8. مؤرشف من الأصل في 26 يوليو 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Winter, Mark. "Uses". Francium. The University of Sheffield. مؤرشف من الأصل في 31 مارس 2007. اطلع عليه بتاريخ 25 مارس 2007. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Gomez, E.; Orozco, L. A.; Sprouse, G. D. (7 November 2005). "Spectroscopy with trapped francium: advances and perspectives for weak interaction studies". Rep. Prog. Phys. 69 (1): 79–118. Bibcode:2006RPPh...69...79G. doi:10.1088/0034-4885/69/1/R02. مؤرشف من الأصل في 26 يوليو 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Peterson, I. (11 May 1996). "Creating, cooling, trapping francium atoms" (PDF). Science News. 149 (19): 294. doi:10.2307/3979560. JSTOR 3979560. مؤرشف من الأصل (PDF) في 27 يوليو 2020. اطلع عليه بتاريخ 11 سبتمبر 2009. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Lerner, Michael M. (2013). "Standard Operating Procedure: Storage and Handling of Alkali Metals". جامعة ولاية أوريغون. مؤرشف من الأصل في 1 نوفمبر 2020. اطلع عليه بتاريخ 26 أغسطس 2016. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Solomon, Robert E. (2002). Fire and Life Safety Inspection Manual. Jones & Bartlett Learning. صفحة 459. ISBN 978-0-87765-472-8. مؤرشف من الأصل في 26 أغسطس 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Angelici, R. J. (1999). Synthesis and Technique in Inorganic Chemistry. Mill Valley, CA: University Science Books. ISBN 978-0-935702-48-4. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Martel, Bernard; Cassidy, Keith (2004-07-01). "Rubidium". Chemical risk analysis: a practical handbook. صفحة 215. ISBN 978-1-903996-65-2. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Wray, Thomas K. "Danger: peroxidazable chemicals" (PDF). Environmental Health & Public Safety (جامعة ولاية كارولاينا الشمالية). مؤرشف من الأصل (PDF) في 08 يونيو 2011. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Astrid, Sigel; Helmut, Sigel; Roland K.O., Sigel, المحررون (2016). The Alkali Metal Ions: Their Role in Life. 16. Springer. doi:10.1007/978-3-319-21756-7. ISBN 978-3-319-21755-0. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Katsuyuki, Aoki; Kazutaka, Murayama; Hu, Ning-Hai (2016). "Chapter 3. Solid State Structures of Alkali Metal Ion Complexes Formed by Low-Molecular-Weight Ligands of Biological Relevance". In Astrid, Sigel; Helmut, Sigel; Roland K.O., Sigel (المحررون). The Alkali Metal Ions: Their Role in Life. 16. Springer. صفحات 27–101. doi:10.1007/978-3-319-21756-7_3. ISBN 978-3-319-21755-0. PMID 26860299. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Winter, Mark. "WebElements Periodic Table of the Elements | Lithium | biological information". Webelements. مؤرشف من الأصل في 29 أكتوبر 2020. اطلع عليه بتاريخ 15 فبراير 2011. الوسيط
|CitationClass=تم تجاهله (مساعدة); line feed character في|عنوان=على وضع 50 (مساعدة) - Gray, Theodore. "Facts, pictures, stories about the element Lithium in the Periodic Table". theodoregray.com. مؤرشف من الأصل في 27 نوفمبر 2020. اطلع عليه بتاريخ 09 يناير 2012. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Howland, Robert H. (September 2007). "Lithium: Underappreciated and Underused?". Psychiatric Annals. 37 (9). doi:10.3928/00485713-20070901-06. PMID 17848039. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Zarse, Kim; Terao, Takeshi; Tian, Jing; Iwata, Noboru; Ishii, Nobuyoshi; Ristow, Michael (August 2011). "Low-dose lithium uptake promotes longevity in humans and metazoans". European Journal of Nutrition. 50 (5): 387–9. doi:10.1007/s00394-011-0171-x. PMID 21301855. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Winter, Mark. "WebElements Periodic Table of the Elements | Potassium | biological information". WebElements. مؤرشف من الأصل في 29 أكتوبر 2020. اطلع عليه بتاريخ 13 يناير 2012. الوسيط
|CitationClass=تم تجاهله (مساعدة); line feed character في|عنوان=على وضع 50 (مساعدة) - Winter, Mark. "WebElements Periodic Table of the Elements | Sodium | biological information". WebElements. مؤرشف من الأصل في 27 أكتوبر 2020. اطلع عليه بتاريخ 13 يناير 2012. الوسيط
|CitationClass=تم تجاهله (مساعدة); line feed character في|عنوان=على وضع 50 (مساعدة) - "Sodium" (PDF). Northwestern University. مؤرشف من الأصل (PDF) في 23 أغسطس 2011. اطلع عليه بتاريخ 21 نوفمبر 2011. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Sodium and Potassium Quick Health Facts". مؤرشف من الأصل في 27 نوفمبر 2020. اطلع عليه بتاريخ 07 نوفمبر 2011. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Dietary Reference Intakes: Water, Potassium, Sodium, Chloride, and Sulfate". Food and Nutrition Board, الأكاديمية الوطنية للطب، United States National Academies. 11 February 2004. مؤرشف من الأصل في 06 أكتوبر 2011. اطلع عليه بتاريخ 23 نوفمبر 2011. الوسيط
|CitationClass=تم تجاهله (مساعدة) - U.S. Department of Agriculture; U.S. Department of Health and Human Services (December 2010). Dietary Guidelines for Americans, 2010 (PDF) (الطبعة 7th). صفحة 22. ISBN 978-0-16-087941-8. OCLC 738512922. مؤرشف من الأصل (PDF) في 27 أكتوبر 2011. اطلع عليه بتاريخ 23 نوفمبر 2011. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Geleijnse, J. M.; Kok, F. J.; Grobbee, D. E. (2004). "Impact of dietary and lifestyle factors on the prevalence of hypertension in Western populations". European Journal of Public Health. 14 (3): 235–239. doi:10.1093/eurpub/14.3.235. PMID 15369026. مؤرشف من الأصل في 01 أغسطس 2018. اطلع عليه بتاريخ 30 أغسطس 2017. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Lawes, C. M.; Vander Hoorn, S.; Rodgers, A.; International Society of Hypertension (2008). "Global burden of blood-pressure-related disease, 2001" (PDF). Lancet. 371 (9623): 1513–1518. doi:10.1016/S0140-6736(08)60655-8. PMID 18456100. مؤرشف من الأصل (PDF) في 28 يناير 2012. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Hellgren, Mikko; Sandberg, Lars; Edholm, Olle (2006). "A comparison between two prokaryotic potassium channels (KirBac1.1 and KcsA) in a molecular dynamics (MD) simulation study". Biophys. Chem. 120 (1): 1–9. doi:10.1016/j.bpc.2005.10.002. PMID 16253415. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Schonwald, Seth (2004). "Potassium Chloride and Potassium Permanganate". Medical toxicology. Lippincott Williams & Wilkins. صفحات 903–5. ISBN 978-0-7817-2845-4. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Markovchick, Vincent J.; Pons, Peter T. (2003). Emergency medicine secrets. Elsevier Health Sciences. صفحة 223. ISBN 978-1-56053-503-4. مؤرشف من الأصل في 20 سبتمبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Winter, Mark. "WebElements Periodic Table of the Elements | Rubidium | biological information". Webelements. مؤرشف من الأصل في 7 أغسطس 2020. اطلع عليه بتاريخ 15 فبراير 2011. الوسيط
|CitationClass=تم تجاهله (مساعدة); line feed character في|عنوان=على وضع 50 (مساعدة) - Relman, A. S. (1956). "The Physiological Behavior of Rubidium and Cesium in Relation to That of Potassium". The Yale Journal of Biology and Medicine. 29 (3): 248–62. PMID 13409924. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Meltzer, H. L. (1991). "A pharmacokinetic analysis of long-term administration of rubidium chloride". Journal of Clinical Pharmacology. 31 (2): 179–84. doi:10.1002/j.1552-4604.1991.tb03704.x. PMID 2010564. مؤرشف من الأصل في 09 يوليو 2012. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Winter, Mark. "WebElements Periodic Table of the Elements | Caesium | biological information". WebElements. مؤرشف من الأصل في 7 أغسطس 2020. اطلع عليه بتاريخ 13 يناير 2012. الوسيط
|CitationClass=تم تجاهله (مساعدة); line feed character في|عنوان=على وضع 50 (مساعدة) - Fieve, Ronald R.; Meltzer, Herbert L.; Taylor, Reginald M. (1971). "Rubidium chloride ingestion by volunteer subjects: Initial experience". Psychopharmacologia. 20 (4): 307–14. doi:10.1007/BF00403562. PMID 5561654. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Follis, Richard H., Jr. (1943). "Histological Effects in rats resulting from adding Rubidium or Cesium to a diet deficient in potassium". American Journal of Physiology. Legacy Content. 138 (2): 246. doi:10.1152/ajplegacy.1943.138.2.246. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Gottschlich, Michele M. (2001). The Science and Practice of Nutrition Support: A Case-based Core Curriculum. Kendall Hunt. صفحة 98. ISBN 978-0-7872-7680-5. مؤرشف من الأصل في 31 يوليو 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Insel, Paul M.; Turner, R. Elaine; Ross, Don (2004). Nutrition. Jones & Bartlett Learning. صفحة 499. ISBN 978-0-7637-0765-1. مؤرشف من الأصل في 29 أكتوبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Melnikov, P.; Zanoni, L. Z. (June 2010). "Clinical effects of cesium intake". Biological Trace Element Research. 135 (1–3): 1–9. doi:10.1007/s12011-009-8486-7. PMID 19655100. مؤرشف من الأصل في 26 نوفمبر 2016. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Pinsky, Carl; Bose, Ranjan; Taylor, J. R.; McKee, Jasper; Lapointe, Claude; Birchall, James (1981). "Cesium in mammals: Acute toxicity, organ changes and tissue accumulation". Journal of Environmental Science and Health, Part A. 16 (5): 549–567. doi:10.1080/10934528109375003. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Johnson, Garland T.; Lewis, Trent R.; Wagner, D. Wagner (1975). "Acute toxicity of cesium and rubidium compounds". Toxicology and Applied Pharmacology. 32 (2): 239–245. doi:10.1016/0041-008X(75)90216-1. PMID 1154391. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Sartori, H. E. (1984). "Cesium therapy in cancer patients". Pharmacol Biochem Behav. 21 (Suppl 1): 11–13. doi:10.1016/0091-3057(84)90154-0. PMID 6522427. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Wood, Leonie. "'Cured' cancer patients died, court told". The Sydney Morning Herald. 20 November 2010. مؤرشف من الأصل في 1 أغسطس 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة)
- بوابة العناصر الكيميائية
- بوابة كيمياء تحليلية
- بوابة الكيمياء