حديد
الحديد هو عنصر كيميائي وفلزي، وهو أحد أقدم المعادن اكتشافا. رمزه Fe (من اللاتينية :ferrum) وعدده الذري (26) يقع بالمجموعة الثامنة والدورة الرابعة من الجدول الدوري.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| المظهر | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
رمادي فلزي الخطوط الطيفية للحديد | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الخواص العامة | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الاسم، العدد، الرمز | حديد، 26، Fe | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| تصنيف العنصر | فلز انتقالي | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| المجموعة، الدورة، المستوى الفرعي | 8، 4، d | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الكتلة الذرية | 55.845 غ·مول−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| توزيع إلكتروني | Ar]; 3d6 4s2] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| توزيع الإلكترونات لكل غلاف تكافؤ | 2, 8, 14, 2 (صورة) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الخواص الفيزيائية | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الطور | صلب | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الكثافة (عند درجة حرارة الغرفة) | 7.874 غ·سم−3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| كثافة السائل عند نقطة الانصهار | 6.98 غ·سم−3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نقطة الانصهار | 1811 ك، 1538 °س، 2800 °ف | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نقطة الغليان | 3134 ك، 2862 °س، 5182 °ف | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| حرارة الانصهار | 13.81 كيلوجول·مول−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| حرارة التبخر | 340 كيلوجول·مول−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| السعة الحرارية (عند 25 °س) | 25.10 جول·مول−1·كلفن−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ضغط البخار | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الخواص الذرية | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الكهرسلبية | 1.83 (مقياس باولنغ) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| طاقات التأين | الأول: 762.5 كيلوجول·مول−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الثاني: 1561.9 كيلوجول·مول−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الثالث: 2957 كيلوجول·مول−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نصف قطر ذري | 126 بيكومتر | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نصف قطر تساهمي | (لف مغزلي منخفض) 132±3،
(لف مغزلي مرتفع) 152±6 بيكومتر | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| خواص أخرى | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| البنية البلورية | مكعب مركزي الجسم | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| المغناطيسية | مغناطيسية حديدية | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1043 كلفن | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| مقاومة كهربائية | 96.1 نانوأوم·متر (20 °س) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الناقلية الحرارية | 80.4 واط·متر−1·كلفن−1 (300 كلفن) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| التمدد الحراري | 11.8 ميكرومتر·متر−1·كلفن−1 (25 °س) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| سرعة الصوت (سلك رفيع) | (درجة حرارة الغرفة) 5120 متر·ثانية−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| معامل يونغ | 211 غيغاباسكال | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| معامل القص | 82 غيغاباسكال | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| معامل الحجم | 170 غيغاباسكال | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نسبة بواسون | 0.29 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| صلادة موس | 4 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| صلادة فيكرز | 608 ميغاباسكال | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| صلادة برينل | 490 ميغاباسكال | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| رقم CAS | 7439-89-6 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| النظائر الأكثر ثباتاً | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| المقالة الرئيسية: نظائر الحديد | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
هو ضروري لحياة الإنسان والحيوان كونه يدخل في تركيب خضاب الدم، وكذلك لحياة النباتات كونه أحد العناصر الضرورية لتكوين الكلوروفيل[1]، ويدخل في كل شيء تقريبًا.
هو رابع العناصر تواجدًا في القشرة الأرضية، غالباً ما يتواجد في الطبيعة في صورة أكاسيد. في هيئته العنصرية هو فلز قابل للطرق والسحب. ويعتبر الحديد وسبائكه أكثر المواد المعدنية استخدامًا على الإطلاق. كما يُعتبر الحديد أكثر العناصر الكيميائية استقرارًا على الإطلاق بسبب توازن القوة الكهرومغناطيسية والقوة النووية القوية داخل نواة الذرة، فالعناصر الأخفّ وزنًا يمكنها من خلال الاندماج النووي - والعناصر الأثقل وزنًا من خلال الانشطار النووي - أن يصبحوا أقرب في صفاتهم للحديد. تحتوي النيازك الساقطة على الأرض على كميات من الحديد قد تصل إلى 90% من كتلة النيازك أو الشهب.
الحديد في الأصل فضي اللون، إلا أنه يتأكسد في الهواء. ويعد الحديد أقوى الفلزات على الإطلاق وأكثرها أهمية للأغراض الهندسية شرط حمايته من الصدأ (أي التفاعل مع الأكسجين). وهناك عدة طرق لحماية الحديد من الصدأ وأبسطها على الإطلاق منع تماس الأكسجين أو الرطوبة عن الحديد وذلك بتغليف الحديد بمادة عازلة مثل استخدام الأصباغ أو عوازل PVC مثلاً. ومن أفضل الطرق المستخدمة لحمايته هي استخدام نظام الحماية الكاثودية لحماية الحديد من الصدأ والتآكل.
الحديد في حالته النقية أكثر ليونة من الألومنيوم، وتزداد صلادته بإضافة بعض العناصر السبائكية كالكربون بنسب معينة، فيتكون سبيكة الصلب، وهي أقوى ألف مرة من الحديد النقي. يتراوح تكافؤ الحديد بين (2-) و(6+)، إلا أنه في أشهر حالاته يكون تكافؤه (2+) أو (3+).
تاريخ
العصر الحديدي
حصل إنسان ما قبل التاريخ على الحديد من النيازك، ومن ثَمّ استخدمه في صناعة العُدَد والأسلحة ومكونات أخرى. وكلمة حديد تعني في العديد من اللغات القديمة فلز من السماء. ولقد استُخدم حديد النيازك في فترات قديمة جدًا يعتقد أنها تصل إلى أربعة آلاف عام قبل الميلاد. ولكن لا توجد أي أدلة مؤكدة تبين بداية استخدام الحديد المستخلص بالصهر والاختزال من الخامات الأرضية، أو تشير إلى المكان الذي بدأ استخلاص الحديد فيه لأول مرة.
ويُعتقد أن الحيثيين هم أول من عرف الحديد بكميات ضخمة. وقد عاشوا فيما يعرف الآن باسم تركيا. وفي ((عام 1400 ق.م.)) اكتشف الحيثيون كيفية تصنيع الحديد وأساليب تصليد العُدد والأسلحة الحديدية. وحول هذه الفترة نفسها تقريبًا طوّر سكان كل من الصين والهند طرقًا وأساليب لاستخلاص الحديد. وعندما وصل العالم إلى القرن العاشر قبل الميلاد كانت معظم الحضارات القديمة حينذاك قد توصلت إلى تقنيات تصنيع الحديد، وهكذا بدأ العصر الحديدي.
اتسمت أفران استخلاص الحديد الأولية بالضحالة وعدم العمق. وكانت مجمراتها تشبه الطبق، وكان يُسخّن خام الحديد مع الفحم النباتي في مجمرة الفرن. وبعد مرور عدة ساعات على بدء التسخين يفقد خام الحديد أكسجينه إلى الكربون الساخن المحيط به، ويتحول الخام إلى فلز الحديد في صورة لامعة. ولم يكن يُستخدم فلز الحديد الناتج مباشرة، ولكن يعاد تسخينه مرارًا وفي كل مرة يُطرق للتخلص من بقية الشوائب القصيفة الصلدة وعل الأخص الكربون الذي يجعل الحديد هشا. وتمكن صُنَّاع الحديد نحو عام 1200م من إعادة تسخين وتشكيل وتبريد الحديد المستخلص لإنتاج وتصنيع الحديد المطاوع. وقد كانت خواص الحديد المطاوع الناتج تشبه إلى حد بعيد خواص الفولاذ الكربوني المنتج في العصور الحديثة حيث يحتوي على كمية قليلة من الكربون.
وسرعان ما تعلم صناع الحديد أن نفث الهواء خلال قصبات أو ودنات إلى الفرن، ترفع إلى حد كبير درجة الحرارة، وكان لذلك الاكتشاف أثره الكبير في تحسين نوعية الحديد المنتج. وفيما بعد استخدم صنّاع الحديد أداة أو جهازًا أطلق عليه الكير يقوم بدفع الهواء خلال القصبات إلى الفرن. وتمكن صناع الحديد نحو عام (700م) في منطقة كتالونيا ـ وهي تقع الآن في شمال شرقي إسبانيا ـ من التوصل إلى أفضل صورة لمجمرة فرن استخلاص الحديد. وعرف ذلك الفرن عندئذ باسم كوركتلان، وكان الهواء يضغط عند قاعدة الفرن ويدفع إلى الداخل باستخدام الطاقة المائية. وبلغت طاقة إنتاج كوركتلان حوالي (160 كجم ) من الحديد المليف كل خمس ساعات. وهذا الإنتاج أكبر بكثير من إنتاج الأفران السابقة.
حضّر يعقوب بن إسحاق الكندي (ت 260هـ، 873م) أنواعًا من الحديد الفولاذ بأسلوب المزج والصهر، فقد مزج كمية من الحديد المطاوع، وكان يسمى الزماهن، وكمية أخرى من الحديد الصلب (الشبرقان) وصهرهما معًا ثم سخنهما إلى درجة حرارة معلومة بحيث نتج عن ذلك حديد يحتوي على نسبة من الكربون تتراوح بين (0,5 و 1,5%). وعندما تحدث ابن سينا (ت 428هـ، 1037م) عن النيازك قسمها إلى نوعين حجري، وحديدي وهو نفس التقسيم المتبع في الوقت الراهن.
أما في أوروبا لم تتطور طرق وأساليب تشكيل الحديد المنصهر في صورة منتجات استهلاكية مناسبة بصورة مرضية حتى حلول عام (1500م). وفي بداية القرن الثامن عشر الميلادي بدأ صناع الحديد البريطانيون في استخدام الكوك بدلاً من الفحم النباتي في الأفران العالية نظرًا لنقص الأخشاب، وهي المصدر الأساسي للفحم النباتي.
يُعد ابراهام داربي أول من تمكن من تكويك الفحم الحجري وإنتاج الكوك، ومن ثَمّ استخدم الكوك في إنتاج الحديد عام (1709م) في بلدة كولبروكديل في مقاطعة شروبشاير في إنجلترا. وفي أواخر القرن الثامن عشر تمكن كل من ابن أبراهام داربي وحفيده من تحسين أسلوب التكويك الذي بدأه رب الأسرة. وقد أدت أعمال هذه العائلة إلى قيام الثورة الصناعية التي بدأت في بريطانيا بإنتاج الحديد الزهر ومن ثم استخدامه في المباني والآلات. وقد نقل المهاجرون الأوروبيون هذه الصناعات ونشروها بعد ذلك في أرجاء العالم.
أول إنتاج من الفولاذ
أُنتجت أول كمية من الفولاذ في العصر الحديدي، ولو أن الكمية المنتجة كانت صغيرة. وعلى سبيل المثال فقد صنع مواطنو منطقة هيا التي تقع في شرق السودان الفولاذ في أفران أسطوانية خاصة. كما صنعت في الهند نحو (عام 300 قبل الميلاد) كتل ضخمة من الحديد الإسفنجي التي أعيد تشكيلها ثم تسخينـها لإنتـاج مايسـمى بفولاذ ووتز. ومع بداية القــرن الخامس الميلادي تمكن الصينيون أيضًا من إنتاج الفولاذ.
وفي العصور الوسطى أنتج الأوروبيون كميات صغيرة من الفولاذ، لكن الكميات كانت شحيحة بدرجة كبيرة إضافة إلى ارتفاع التكلفة. وفي ((عام 1740م)) تمكن صانع ساعات بريطاني يدعى بنجامين هنتسمان من اختراع أسلوب البوتقة لصناعة الفولاذ، وهي تشبه إلى حد بعيد الأسلوب الذي كان متبعًا في إنتاج فولاذ ووتز. وقام هونتسمان بإعادة صهر وتنقية قضبان من الحديد المطاوع عالية النوعية في بواتق (مراجل صهر). وكانت طريقة هنتسمان لإنتاج الفولاذ بطيئة، وتتطلب قدرًا كبيرًا من العمل الشاق، إضافة إلى أن أضخم البواتق لا يمكنها إنتاج أكثر من ( 45 كجم ) من الفولاذ في المرة الواحدة.
ميلاد صناعة الفولاذ الحديثة
لم تطبق أولى الطرق الحديثة لإنتاج الفولاذ بكميات كبيرة وبتكلفة مقبولة إلا في منتصف القرن التاسع عشر. وعرفت هذه الطريقة باسم طريقة بسمر، وذلك على اسم مخترعها ومطورها هنري بسمر، وهو صانع فولاذ بريطاني. ولقد تمكن صانع حديد أمريكي اسمه وليم كلي، في الفترة نفسها تقريبًا، من تطوير أسلوب مماثل لأسلوب بسمر في إنتاج الفولاذ دون علم بنتائج أبحاث بسمر. وعلى الرغم من نجاح كل من بسمر وكيلي في إنتاج الفولاذ، إلا أن جهودهما لم يكن ليكللها النجاح دون الاستفادة من اختراع روبرت موشيه الذي توصل إليه في عام 1857م. وموشيه عالم فلزات بريطاني، وجد أن إضافة سبيكة الحديد ـ الكربون ـ المنجنيز المعروفة باسم تماسيح الحديد المنجنيزي، أثناء عملية تنقية الحديد تساعد على إزالة الأكسجين وضبط نسبة الكربون في الفولاذ المنتج.
قامت طريقة بسمر لتصنيع الفولاذ على صب حديد التمساح المنصهر الناتج من الفرن العالي في وعاء كمثري الشكل يعرف باسم المحول، ثم حقن الهواء في الحديد المنصهر من خلال قصبات مثبتة في قاع المحول. وبمجرد تلامس الهواء المدفوع في المحول مع الحديد المنصهر، فإن أكسجين الهواء يتفاعل بسرعة مع شوائب الحديد. وتؤدي تفاعلات الأكسجين مع الشوائب، بالإضافة إلى مفعول تماسيح الحديد المنجنيزي إلى تحويل حديد التمساح إلى فولاذ.
وقد سُجلت براءة اختراع تصنيع الفولاذ بأسلوب «بسمر» باسم مخترعها في بريطانيا عام 1860م. وفي عام 1870م بدأ إنتاج الفولاذ فعليًا بهذه الطريقة في جميع أنحاء أوروبا والولايات المتحدة الأمريكية.
ظهرت طريقة فرن المجمرة المكشوفة لإنتاج وتصنيع الفولاذ بعد انتشار طريقة بسمر مباشرة. ففي عام 1856م تمكن اثنان من العلماء، ألمانيّا المولد ولكنهما نشآ وعاشا في بريطانيا، هما الأخوان وليم وفريدريك سيمنز، من اختراع فرن إعادة توليد الغاز. ويستخدم هذا الفرن المخلفات الغازية لتسخين كل من الوقود والهواء قبل دخولهما إلى الفرن. وفي عام 1864م تمكن أخوان فرنسيان هما بيير وأميل مارتن، من تصنيع وإنتاج الفولاذ في فرن بناه مهندسو شركة سيمنز، ولهذا يطلق على أسلوب إنتاج الفولاذ بهذه الكيفية طريقة سيمنز ـ مارتن لتصنيع الفولاذ، وهي الطريقة التي عرفت بعد ذلك باسم فرن المجمرة المكشوفة. وقد تميزت طريقة المجمرة المكشوفة لإنتاج الفولاذ عن طريقة بسمر لإنتاج الفولاذ، بعدد من السمات أهمها إمكانية استخدامها لإنتاج الفولاذ من الخردة، بالإضافة إلى إمكانية التحكم بدرجة كبيرة في التركيب الكيميائي للفولاذ الناتج. ونتيجة لمميزات طريقة فرن المجمرة المكشوفة لإنتاج الفولاذ، فقد بدأ عدد وحدات محولات بسمر في التناقص منذ عام 1910م وأصبحت محدودة العدد، وإن ظلت الوحدات التي أنشئت قديمًا في الإنتاج حتى الستينيات من القرن العشرين.
وفي عام 1878م أثبت وليم سيمنز إمكانية إنتاج الفولاذ في فرن القوس الكهربائي. ونظرًا لأن كمية الكهرباء المتوفرة في ذلك الوقت كانت محدودة كما أنها كانت باهظة التكلفة، فلم يُستخدم هذا الأسلوب لتصنيع الفولاذ بكميات تجارية في ذلك الوقت. وفي عام 1899م أنشأ بول هيرولت في فرنسا أول وحدة لإنتاج الفولاذ فعليًا بصورة تجارية من أفران القوس الكهربائي.
نمو صناعة الفولاذ
بعد ظهور طريقتي بسمر وفرن المجمرة المكشوفة لتصنيع وإنتاج الفولاذ، توسعت صناعة الفولاذ ونمت بسرعة كبيرة. ولأن بريطانيا كانت تمتلك ترسبات غنية من خام الحديد، فقد كانت أكبر دول العالم في صناعة الحديد والفولاذ، في منتصف القرن التاسع عشر، كما أنها كانت أكثر دول العالم في التقدم التقني في هذا المجال.
ومع بداية الثمانينيات من القرن التاسع عشر وحتى الآن، بدأت بعض الدول الأخرى في الظهور في مجال بناء صناعة الفولاذ، حيث اكتشف الجيولوجيون في منتصف القرن التاسع عشر الميلادي ترسبات غنية من خامات الحديد في منطقة البحيرات العظمى في الولايات المتحدة الأمريكية. وأدى ذلك الاكتشاف إلى تطور ضخم في صناعة الفولاذ في الولايات المتحدة. وقد أنشأ أندرو كارنيجي في عام 1873م أول مصنع ضخم لإنتاج الفولاذ في الولايات المتحدة الأمريكية، كما بدأت كل من فرنسا وألمانيا وروسيا وبعض الدول الأوروبية الأخرى في بناء مصانع كبيرة لإنتاج الفولاذ. وبحلول بدايات القرن العشرين كانت كل من الولايات المتحدة الأمريكية وألمانيا تتصدران دول العالم المنتجة للفولاذ، وكان إنتاج كل دولة منهما أكثر من إنتاج بريطانيا.
وبحلول عام 1901م ظهرت دول أخرى منتجة للفولاذ في كل من آسيا والأمريكتين كما بدأت أستراليا عام 1915م في إنتاج الفولاذ.
استخدم معظم الفولاذ المنتج في نهاية القرن التاسع عشر في صناعة قضبان السكك الحديدية. وفي بداية القرن العشرين زاد إنتاج الفولاذ كثيرًا لمقابلة الزيادة في الطلب عليه ونجاحه في صناعة السيارات التي نمت بسرعة كبيرة بالإضافة إلى حاجة الكثير من المنتجات الأخرى إلى الفولاذ. وصاحب زيادة إنتاج الفولاذ تطوير طرق حديثة لإنتاجه روعي فيها زيادة الإنتاجية. كما شمل التطور أيضًا التوصل إلى طرق جديدة لعمليات الدلفنة وتشكيل الفولاذ إضافة إلى استنباط العديد من سبائك الفولاذ الجديدة ذات الخواص المتفوقة.
وأثناء الحرب العالمية الثانية (1939-1945م)، دُمِّرت معظم مصانع الفولاذ في العالم فيما عدا مصانع الولايات المتحدة الأمريكية. ونتيجة لذلك احتكرت شركات الفولاذ الأمريكية إنتاج الفولاذ وأسواقه في العالم كله لفترة بعد انتهاء الحرب العالمية الثانية. وعلى الرغم من ذلك فقد أعادت اليابان وأيضًا الكثير من الدول الأوروبية بناء مصانعها لإنتاج الفولاذ في الخمسينيات من القرن العشرين. وتميزت وحدات الفولاذ حديثة الإنشاء باستخدام أحدث التقنيات لإنتاج الفولاذ بما فيها أسلوب الأكسجين القاعدي واستخدام طريقة صبات الجديلة. ونتيجة تحديث مصانع الفولاذ التي أنشئت حديثًا تفوقت المصانع اليابانية ومصانع دول وسط أوروبا في نوعية وكمية الإنتاج على مصانع الفولاذ في الولايات المتحدة الأمريكية وبريطانيا اللتين استمرتا في استخدام الأساليب القديمة والمعدات متدنية الكفاءة.
وتقلصت صناعة الفولاذ في بريطانيا بصورة كبيرة على الرغم من أنها كانت الدولة المطورة لأساليب إنتاج الفولاذ والمصنعة له بكميات كبيرة قبل أي دولة أخرى في العالم. وتتحكم الحكومة البريطانية في هيئة الفولاذ البريطانية، والأخيرة هي المالك الأساسي لصناعة الفولاذ في بريطانيا. وقد أغلقت الهيئة في بداية الثمانينيات من القرن العشرين عددًا كبيرًا من المصانع الضخمة لإنتاج الفولاذ. وفي الفترة نفسها تقريبًا، فقدت بريطانيا أيضًا أفضل ترسبات خامات الحديد بعد استنزافها. وعلى الرغم من المصاعب التي تواجه صناعة الفولاذ في بريطانيا، إلا أن هيئة الفولاذ البريطانية بدأت في فترة الثمانينيات من القرن العشرين تحديث أساليب واستخدام أفضل التقنيات لإنتاج الفولاذ تمهيدًا لنقل ملكية صناعة الفولاذ إلى القطاع الخاص تحت اسم الفولاذ البريطاني. وعلى الرغم من كل هذه المصاعب إلا أن الفولاذ لا يزال يؤدي دورًا بالغ الأهمية ويمثل جزءًا مهمًا من حجم التجارة البريطانية.
التطورات الحديثة في صناعة الفولاذ
انخفض معدل إنتاج الفولاذ في الدول المتقدمة بشدة في السبعينيات من القرن العشرين نتيجة الكساد الاقتصادي العالمي في هذه الفترة. ورغم المصاعب التي واجهت إنتاج الفولاذ في الدول المتقدمة، إلا أن الإنتاج العالمي من الفولاذ استمر في الزيادة، ويرجع ذلك أساسًا إلى توسع الدول النامية في إقامة مصانع الفولاذ والتوسع في إنتاجه في كل من أمريكا الجنوبية وآسيا.
وقبل منتصف الخمسينيات من القرن العشرين، كانت جميع الدول النامية في العالم تستورد جميع حاجاتها من الفولاذ من الولايات المتحدة الأمريكية ومن بعض الدول الصناعية الكبرى الأخرى. ولكن مع بداية خمسينيات القرن العشرين أنشأت كثير من الدول النامية مصانعها الخاصة لإنتاج ما تحتاجه من الفولاذ. ولقد أثر نمو صناعة الفولاذ بلا شك، على الدول النامية تأثيرًا كبيرًا، وبخاصة الدول التي تمتلك احتياطيًا كبيرًا من الغاز الطبيعي وخامات الحديد، ومن أمثلة ذلك المكسيك و فنزويلا ومصر. فقد أقامت الدول التي تمتلك احتياطيًا كبيرًا من الغاز الطبيعي وخامات الحديد الغنية مصانع لإنتاج الحديد بطرق الاختزال المباشر، ومن ثَمّ أنتجت الفولاذ من ذلك الحديد باستخدام أفران القوس الكهربائي. وحتى الدول الفقيرة التي لاتمتلك خامات حديد، ساهمت حكوماتها في إنشاء مصانع حديثة لإنتاج الفولاذ.
وتميزت مصانع الفولاذ التي أُنشئت في الثمانينيات من القرن العشرين بالآلية التامة كما أنها مجهزة بمعدات ذات إنتاجية عالية تتحكم في تشغيلها مختلف أنواع الحواسيب الآلية. وقد جاء تطوير المعدات الحديثة المتقدمة المستخدمة في مصانع الفولاذ نتيجة للتزاوج بين كفاءة علماء الفلزات والمهندسين والمتخصصين في الأجهزة، ومبرمجي الحاسوب. كما عمل الباحثون في صناعة الفولاذ على تطوير طرق جديدة واستنباط أساليب حديثة لتحويل الفحم الحجري إلى كوك. ويأمل الباحثون أيضًا أن تثمر جهودهم للتوصل إلى أساليب جديدة للاختزال المباشر وتطوير طرق تؤدي إلى استخدام الفحم الحجري في إنتاج غاز الاختزال حتى يصبح الفحم بديلاً عن الغاز الطبيعي. وبالإضافة إلى هذه الجهود ما زال العلماء والمهندسون مستمرين في جهودهم وأبحاثهم لتطوير طرق أفضل لصناعة الفولاذ واستنباط سبائك جديدة من الفولاذ.
معادن الحديد
مغنتيت أو مگنتيت (Magnetite )هو معدن حديدي المغناطيسية وصيغته الكيميائية (Fe3O4)، وهو أحد اكسيدات حديد متعددة وعضو في مجموعة spinel group. اسم ايوپاك له هو iron(II،III) oxide والاسم الكيميائي الشائع له هو اكسيد الحديدوز-حديديك. صيغة المگنتيت يمكن أيضاً كتابتها كالتالي FeO·Fe2O3، وهي جزء wüstite (FeO) والجزء الآخر هماتيت (FeO·Fe2O3). وهذا يشير إلى المراحل المختلفة من أكسدة الحديد في نفس البنية، ولا يعني أنه محلول صلب.
المگنتيت (FeO·Fe2O4)هو أحد الخامات التي يستخلص منها الحديد. ويستخدم في صناعة المغنطيسات الدائمة وهناك خامات أخرى يستخلص منها الحديد مثل الهيماتيت والسيدرايت.
الهـماتيت معدن لونه أسود إلى صلبي (فضي-رمادي)، بني إلى بني محمرّ، أو أحمر. ويُستخرج بصفته الخام الرئيسي للحديد. أصنافه تتضمن خام الكِلـْية، مارْتيت (pseudomorphs اخذوا اسمهم من المگنتيت)، زهرة الحديد و specularite (specular hematite). وبينما تختلف صيغ الهماتيت، إلا أنهم جميعاً يشتركون في أن لديهم تعريق صدأ-أحمر. والهماتيت أشد صلادة من الحديد النقي، إلا أنه أشد انقصافاً.
وقد عـُثر على رواسب هائلة من الهماتيت في ( banded iron formations). الهماتيت الرمادي عادة ما يوجد في الأماكن التي بها مياه ساكنة أو ينابيع مياه دافئة معدنية، كما هو الحال في يلوستون. ويمكن للمعدن أن يترسب خارج الماء ويتجمع في طبقات في قاع بحيرة، نبع، أو أي مياه ساكنة أخرى. ويمكن للهماتيت أن يتواجد أيضاً بدون الماء، إلا أنه في تلك الحالة عادة ما يكون نتيجة نشاط بركاني.
كيفية تكونه

يتكوّن الحديد في داخل النجوم العملاقة عند نهاية دورة حياتها، في عملية تسمى بعملية احتراق السيليكون. تبدأ العملية عندما تندمج نواة ذرة كالسيوم مستقرة مع نواة ذرة هليوم، لتتكون ذرة تيتانيوم غير مستقرة. وقبل أن تتحلل ذرة التيتانيوم الغير مستقرة، تندمج مع ذرة هليوم أخرى، لتتكون ذرة كروم غير مستقرة. ثم قبل أن تتحلل ذرة الكروم الغير مستقرة، تتحد مع ذرة هليوم أخرى، لتكوين ذرة حديد غير مستقرة. وقبل أن تتحلل ذرة الحديد الغير مستقرة، تتحد مع ذرة هليوم أخرى، لتكوين ذرة نيكل غير مستقرة.
تتحلل ذرة النيكل الغير مستقرة إلى ذرة كوبالت غير مستقرة، والتي تتحلل أخيراً إلى ذرة حديد مستقرة 56Fe. وعندئذ لا تندمج ذرات الحديد المستقرة مع أي عنصر آخر، فتشكل بذلك قلب النجم، ويبدأ النجم عندئذ بالتجمد ويتجه للاستقرار.
الإنتاج الصناعي
- سبائك حديدية:
السبائك الحديدية)Ferrous Alloys(هي عائلة السبائك التي تعتمد علي عنصر الحديد كالمكون الرئيسي لها أو العنصر الغالب فيها، وتضم هذه العائلة عدد كبير من السبائك، وتنقسم الي مجموعتين رئيسيتين وهما سبائك الصلب (Steels) وسبائك الحديد الزهر (Cast Iron).
- سبائك الصلب:
مقدمة الصلب Steel هو سبيكة تصنع أساساً من الحديد بمحتوى كربون يتراوح بين 0.2 و 2.04% بالوزن (ك:1000–10,8.67حد), حسب الدرجة. والكربون هو أكثر العناصر السبائكية فاعلية من حيث التكلفة في سبائك الحديد، إلا أنه تُستعمل العديد من العناصر السابكة الأخرى مثل المنگنيز، الكروم، الڤناديوم، والتنگستن.[1] ويعمل الكربون والعناصر الأخرى كعوامل تصليد (تقسية), لمنع الانخلاعات في العقد البلوري لذرات الحديد من الانزلاق أمام بعضهم البعض. ويتحكم مقدار العناصر السابكة وشكل وجودهم في الصلب (solute elements, precipitated phase) في صفات مثل الصلادة، والمطيلية ومقاومة الشد للصلب الناتج. فالصلب ذو المحتوى المرتفع من الكربون يمكن أن يـُصنع ليكون أكثر صلادة وأقوى من الحديد، إلا أنه أكثر قصافة.
قابلية الذوبان العظمى للكربون في الحديد (في منطقة الأوستنتيت) هي 2.14% بالوزن، تحدث عند درجة حرارة 1149 °م; التركزات الأعلى من الكربون أو درجات الحرارة الأقل ستنتج سمنتيت.
السبائك ذات محتوى الكربون الأعلى من ذلك تـُعرف باسم حديد زهر بسبب درجة انصهارهم الأقل وقابليتهم للصب.[1] ويجب أيضاً تمييز الصلب عن الحديد المطاوع المحتوي فقط على كمية ضئيلة جداً من العناصر الأخرى، إلا أنه يحتوي على 1–3% بالوزن من خبث في صيغة حبيبات مستطالة في اتجاه واحد، مما يعطي الحديد «grain» مميزة. فهو أكثر مقاومة للصدأ من الصلب ويُمكن لحمه بسهولة.
ومن الشائع اليوم الحديث عن 'صناعة الحديد والصلب' كما لو كانت شيئاً واحداً, ولكنهما تاريخياً كانا منتجـَين منفصلـَين.
بالرغم من أن الصلب كان يـُنتـَج بالعديد من الطرق غير الفعالة قبل عصر النهضة بوقت طويل، فإن استعماله أصبح أكثر شيوعاً بعد تطوير طرق أكثر فاعلية لإنتاجه في القرن السابع عشر. وباختراع عملية بسمر في منتصف القرن التاسع عشر، أصبح الصلب سلعة تـُنتـَج بكميات كبيرة بتكلفة أرخص نسبياً. التحسينات اللاحقة على العملية، مثل basic oxygen steelmaking, خفضت تكلفة الإنتاج بدرجة أكبر بينما رفعت من جودة المعدن.
واليوم، الصلب هو أحد أكثر المواد شيوعاً في العالم وهو مكوِّن رئيسي في المباني والمعدات والسيارات، والأجهزة المنزلية الرئيسية. الصلب المعاصر يتم تمييزه عموماً حسب درجات الصلب المتعددة التي توصـِّفها هيئات التوصيف القياسى.
- تصنيف سبائك الصلب (يسمى أيضا الفولاذ) :
يسمى الصلب أيضا الفولاذ ويفهم من بعض الكتابات العربية أن الفولاذ هو لفظ يطلق على الأصلاب السبائكية خلافاً وتمييزاً لها عن الأصلاب الكربونية العادية.
تعتبر سبائك الصلب (الأصلاب) أكثر المواد الفلزية انتشارا واستخداما نظرا لرخص تكلفة إنتاجها بالإضافة إلى إمكانية إنتاجها طبقا لمواصفات مختلفة وكذلك القدرة الكبيرة علي التحكم في تركيباتها الكيميائية.
وتنقسم الأصلاب عامة إلى عدة فئات تتباين في خو اصها الميكانيكية والوظيفية وقابليتها للتصنيع واللحام والمعالجة الحرارية ومقاومتها للتآكل تباينا كبيرا ملبية لطيف واسع من المتطلبات والاستخدامات التي لا تتوافر لغيرها من المواد الهندسية.
- أصلاب كربونية (Carbon Steels)
- أصلاب سبائكية (Alloy Steels)
- أصلاب منخفضة السبائكية عالية المقاومة (High-Strength Low-Alloy Steels)
- أصلاب العدد (Tool Steels)
- أصلاب تقسى بتعتيق المرتنزيت (Maraging Steels)
- أصلاب المنجنيز الأوستنيتية (Austenitic Manganese Steels)
- أصلاب مقاومة للصدأ (Stainless Steels)
- حديد زهر :
الحديد الزهر يسمى أيضا حديد السبك أو حديد الصب (Cast Iron)، ويعرف بحسب مجمع اللغة العربية بالقاهرة كما يلى:
- الحديد الناتج من صهر الخام في الأفران العالية وهو حديد غير نقي سهل الكسر ولا يقبل التشكيل، يبدأ في الانصهار عند 1270 درجة مئوية.
- أشابة من الحديد معدة للصب، تشتمل على بعض العناصر الأخرى.
- الحديد الناتج من الأفران العالية وتبلغ كثافته 7.86 جم/سم3، ودرجة انصهاره ما بين 1275 إلى 1505ْم، وهو سهل الكسر ولا يقبل التشكيل.
- حديد يحتوي على نسبة كربون تفوق حد ذوبانه في طور الأوستنيت عند درجة حرارة اليوتكتي فينفصل الكربون في صورة قشور أو شبه كريات (حديد زهر رمادي) أو قد يكوّن سمنتيتاً (حديد زهر أبيض).
- نوع من الحديد غير النقى ينتج بصهر حديد الزهر مع الجير ثم صبه في قوالب، وهو قصيف ولكنه يتميز بصلادته.
خصائص الحديد
الخواص الميكانيكية
تُفيّم الخواص الميكانيكية للحديد وسبائكه باستخدام مجموعة متنوعة من الاختبارات، مثل اختبار برينل واختبار روكويل وكلاهما لقياس صلادة الحديد، واختبار قوة الشد وغيرها؛ نتائج هذه الاختبارات على الحديد دقيقة للغاية، بما يسمح باستخدام الحديد لمعايرة أو الربط بين نتائج الاختبارات المختلفة.[2][3] تعتمد نتائج تلك الاختبارات على درجة نقاء الحديد: فبللورات الحديد في صورته النقية أكثر ليونة من الألمونيوم، ومع إضافة بعض أجزاء من المليون من وزن سبيكة الحديد من عنصر الكربون، فإنها تضاعف من قوة الحديد.[4] تزداد صلادة الحديد بسرعة بزيادة محتوى الكربون في سبيكة الحديد حتى تصل نسبته إلى 0.2 ٪ من وزن السبيكة، وبعد ذلك يتزايد بمعدلات أقل ويصل إلى الذروة عندما يصل محتوى الكربون إلى 0.6 ٪ تقريبا من وزن السبيكة.[5] الحديد النقي المنتج صناعياً (حوالي 99.99 ٪) لديه صلادة تقدر بـ 20-30 HB.[6]
التآصل في الحديد
 مقالة مفصلة: التآصل في الحديد
مقالة مفصلة: التآصل في الحديد
يمثل الحديد أفضل مثال لظاهرة التآصل في المعادن، فالحديد يتواجد في ثلاثة أطوار تآصلية وهي (α-Fe، γ-Fe، δ-Fe). يعد فهم ظاهرة التآصل في الحديد هو المفتاح لإنتاج سبائك صلب ذات خصائص محددة للأغراض المختلفة.
أولها تكوّناً عندما يتجمد الحديد من حالته السائلة عند 1538 درجة مئوية هو (δ-Fe)، يعد الفيريت (α-Fe) هو الطور الأكثر استقرارا للحديد في درجات الحرارة العادية.[7] أما 912 درجة مئوية وحتى 1400 درجة مئوية، يتحول الحديد تدريجياً من طور الفيريت إلى طور الأوستنيت (γ-Fe)، ويستخدم هذا الطور من الحديد في إنتاج الصلب الذي لا يصدأ، والذي يستخدم في صناعة أدوات المائدة والمستشفيات ومعدات الصناعات الغذائية.[8]
نظائر الحديد
 مقالة مفصلة: نظائر الحديد
مقالة مفصلة: نظائر الحديد
يوجد الحديد في الطبيعة في هيئة أربعة نظائر مستقرة، تكون موزعة كالآتي 5.845% 54Fe و 91.754% 56Fe و 2.119% 57Fe و 0.282% 58Fe. من المتوقع أن يخضع النظير 54Fe لعملية تحلل بيتا المزدوج، لكن هذه العملية لم تلاحظ بالتجربة بالنسبة لهذه الجسيمات. وحده النظير 57Fe من بين النظائر المستقرة للحديد لديه لف مغزلي ومقداره (−1/2).
يعد نظير الحديد 56Fe أكثر نظائر الحديد وفرة وأكثرها ثباتاً. من غير الممكن إجراء عملية انشطار أو اندماج نووي لهذا النظير مع حدوث إصدار للطاقة. يتشكل هذا النظير من نظير النيكل 56Ni الذي يتشكل من نوى أخف من خلال عملية ألفا داخل المستعرات العظمى (اقرأ عملية احتراق السيليكون). يشكل النظير 56 للنيكل نهاية سلسلة تفاعل الاندماج النووي داخل النجوم العملاقة، لأن إضافة جسيم ألفا آخر سيشكل الزنك-60، والذي يتطلب تشكيله طاقة عالية جداً، لذلك فإن النيكل-56، والذي عمر النصف له 6 أيام، يوجد بكثرة في هذه النجوم. أثناء عملية اضمحلال المستعر الأعظم إلى بقايا، تحدث للنيكل-56 عمليتي إصدار بوزيتروني متلاحقتين، يتحول من خلالها أولاً إلى الكوبالت-56، ومن ثم إلى الحديد-56 المستقر، مما يفسر الوفرة الكبيرة للحديد في الكون مقارنة مع فلزات أخرى مقاربة في الكتلة الذرية. يوجد نظير الحديد-56 في قلب العملاق الأحمر وفي النيازك الحديدية وفي جوف الكرة الأرضية.
هنالك نظير مشع منقرض للحديد 60Fe له عمر نصف كبير يبلغ 2.6 مليون سنة.[9] إن أغلب الدراسات السابقة حول قياس نسبة نظائر الحديد كانت مركزة حول تحديد نسبة الاختلافات في النظير 60Fe، وذلك نتيجة للعمليات المرافقة لحدوث التخليق النووي وفي تشكل الخامات. ساعد التطور الكبير والمتسارع في تقنية مطيافية الكتلة على كشف وتحديد نسب النظائر المستقرة للحديد، وذلك نتيجة وجود العديد من الفروع العلمية المهتمة بهذا المجال، من بينها علوم الأرض وعلم الكواكب بالإضافة إلى التطبيقات الحيوية والصناعية.[10]
أظهرت الدراسات لبعض النيازك الحديدية أن العلاقة بين تركيز النيكل-60، والذي يمثل ناتج اضمحلال للحديد-60، ووفرة نظائر الحديد المستقرة يمكن أن تعطي دلالة على وجود الحديد-60 60Fe أثناء تشكل وتطور النظام الشمسي. من المحتمل أن تكون الطاقة المتحررة أثناء اضمحلال نظير الحديد-60، بالإضافة إلى الطاقة المتحررة عن نظير الألومنيوم المشع 26Al، قد ساهمت في حدوث إعادة انصهار وإعادة تشكيل وتمايز الكويكيبات قبل نشوئها من 4.6 مليار سنة.
تمتاز نوى نظائر الحديد بأن لها طاقة ارتباط عالية لكل نوية، ولا يفوقها بذلك إلا نظير النيكل 62Ni، والذي يتشكل في تفاعلات الاندماج النووي في النجوم. أما بالنسبة لتوزع عنصري الحديد والنيكل، فإن نسبة نظائر الحديد في الكرة الأرضية تفوق نظائر النيكل، ومن المتوقع أنها تفوقها أيضاً أثنائ تشكل العناصر في المستعرات العظمى.[11]

مركبات الحديد
تكافؤ مركبات الحديد غالباً ما يكون +2 أو +3، ويطلق على مركبات الحديد ثنائية التكافؤ (حديدوز) مثل أكسيد الحديدوز (FeO)، وعلى مركبات الحديد ثلاثية التكافؤ (حديديك) مثل أكسيد الحديديك (Fe2O3). قد يصبح تكافؤ مركبات الحديد سداسي التكافؤ كحالة رابع حديدات البوتاسيوم (K2FeO4). كما أن مركبات الحديد التي تشارك في تفاعلات الأكسدة البيوكيميائية، رباعية التكافؤ.[12][13] كما تتواجد مركبات عضوية معدنية للحديد ذات تكافؤ أحادي موجب أو أحادي سالب أو ثنائي سالب. بل ويتواجد الحديد أحياناً في حالته العنصرية داخل جسم الإنسان.
كما يتواجد مركبات للحديد يكون فيها الحديد ذا تكافؤ ثنائي وثلاثي في الوقت ذاته كأكسيد الحديد الأسود (الماغنتيت) ومركب أزرق بروسيا (Fe4(Fe[CN]6)3)،[13] والذي يستخدم بعض أنواع أوراق الطباعة التي تستخدم في بعض الرسومات الهندسية.[14]
الحديدوز 2+Fe (بالإنجليزية : Ferrous ) ، في علم الكيمياء ، تُشير إلى مركبات الحديد ثنائية التكافؤ (حالة الأكسدة +2) ، المغاير للحديديك (بالإنجليزية : Ferric ) ، والذي يُشير إلى مركبات الحديد ثلاثية التكافؤ (حالة الأكسدة +3).[15]
خارج نطاق علم الكيمياء ، الحديدوز صفة تستخدم للإشارة إلى وجود الحديد .[15] لفظة حديدوز مشتقة من كلمة لاتينية (باللاتينية : Ferrum ) " الحديد " .[16] تتضمن معادن الحديدوز الفولاذ والحديد الخام ( مع نسبة
محتوى كربون ضئيلة ) و سبائك الحديد مع معادن أخرى ( مثل ستانلس ستيل ) .
يستخدم مصطلح اللا-حديدوز للإشارة إلى معادن أخرى باستثناء الحديد والسبائك والتي لا تحتوي على كميات ملموسة من الحديد .[17]
تعد كبريتات الحديدوز المائية (FeSO4•7H2O) وكلوريد الحديديك (FeCl3) من أكثر مركبات الحديد إنتاجاً صناعياً. وتعتبر كبريتات الحديدوز المائية من أكثر المصادر المتاحة للحصول على أكسيد الحديدوز (FeO)، لكنه أكثر عرضة للتأكسد في الهواء من ملح موهر ((NH4)2Fe(SO4)2•6H2O)، وبصفة عامة تميل مركبات الحديد ثنائية التكافؤ للتأكسد في الهواء لتصبح مركبات حديد ثلاثية التكافؤ.[13]
_chloride_hexahydrate.jpg.webp)
أكاسيده وكبريتيداته
يتفاعل الحديد مع الأكسجين في الهواء مكوناً أكاسيد الحديد وأشهرها: أكسيد الحديد الأسود (Fe3O4) وأكسيد الحديديك (Fe2O3) وأكسيد الحديدوز (FeO)، وإن كان غير مستقر في درجات الحرارة العادية. هذه الأكاسيد هي الخامات الأساسية لإنتاج الحديد. أما أشهر كبريتيدات الحديد فهو البيريت (FeS2) والذي يعرف بـ الذهب الكاذب.[13]
هاليداته
عرفت هاليدات الحديد الثنائية والثلاثية منذ القدم باستثناء يوديد الحديديك، وهي تنشأ عن طريق تفاعل معدن الحديد مع حامض هالوجيني لكي ينتج عن ذلك التفاعل أحد الأملاح المائية.[13]
- Fe + 2 HX → FeX2 + H2
يتفاعل الحديد مع الفلور الكلور البروم وينتج عن ذلك هاليدات الحديديك، وأشهرها كلوريد الحديديك:
- 2 Fe + 3 X2 → 2 FeX3 (X = F, Cl, Br)
سيانيداته
يدخل الحديد في العديد من مركبات السيانيد. من أشهر مركبات السيانيد التي يدخل فيها الحديد مسحوق أزرق بروسيا (Fe4(Fe[CN]6)3)، وفيروسيانيد البوتاسيوم وفيريك-سيانيد البوتاسيوم.
كما يستخدم مسحوق أزرق بروسيا كترياق من سموم الثاليوم السيزيوم المشعة[18][19]، كما يستخدم كصبغة زرقاء لإزالة اصفرار الماء نتيجة وجود رواسب من أملاح الحديد.[20]
الحديد عبر التاريخ

يرجع استخدام الإنسان للحديد إلى ما قبل التاريخ. كما يرجع تاريخ أقدم المنتجات الحديدية، للألفية الخمسة قبل الميلاد في إيران والألفية الثانية قبل الميلاد في الصين، وكانت مصنوعة من النيازك.[21] ومن غير المعروف متى أو أين بدأ صهر الحديد من خاماته، ولكن هناك دلائل تشير إلى إنتاجه عن طريق صهر خاماته قرب نهاية الألفية الثانية قبل الميلاد في الهند وجنوب الصحراء الكبرى في أفريقيا.[22]
كما يرجع تاريخ أقدم الأدوات المصنوعة من الهيماتيت إلى حوالي عام 35,000 ق.م.[23] واستخدم السومريون والمصريون الحديد النيزكي لأغراض الزينة وكرؤوس للحراب،[24] وفي الطقوس الاحتفالية، وكان أثمن من الذهب. كما تشير الاكتشافات إلى أن الحثيين أنتجوا الحديد منذ حوالي عام 2,000 ق.م،[25] كما قايضوا الحديد مقابل الفضة مع الآشوريين في القرن الرابع عشر قبل الميلاد.[21]
اختلف انتقال بلدان العالم القديم للعصر الحديدي، فبلاد ما بين النهرين عام 900 ق.م كانت قد انتقلت كلياً للعصر الحديدي. وعلى الرغم من أن مصر كانت قد بدأت تنتج الحديد منذ وقت مبكر، إلا أن العصر البرونزي ظل مسيطراً عليها حتى الغزو الآشوري لها في عام 663 ق.م. وبدأ العصر الحديدي في وسط أوروبا حوالي عام 500 ق.م، وفي الهند والصين في وقت ما بين 1200 ق.م و 500 ق.م.[26] وحوالي عام 500 ق.م، أصبحت النوبة منتج ومصدر رئيسي للحديد.[27]
اكتشف الحيثيون[28] أنتاج الحديد قديماً في أفران تستخدم فيها منفاخ لضخ الهواء من خلال كومة من الحديد الخام والمدفون في الفحم. يختزل أول أكسيد الكربون الناتج من حرق الفحم خامة الحديد لينتج الحديد. لم تكن الحرارة الناتجة كافية لصهر الحديد، لذا فإن الجزء السفلي من المعدن الناتج يكون على شكل كتلة إسفنجية، تعج بالمسام الممتلئة بالرماد والخبث. يعاد تسخين الحديد الناتج لتليينه وصهر الخبث، ومن ثم يُطرق مراراً وتكراراً لإزالة الخبث المنصهر. ناتج هذه العملية الطويلة والشاقة هو الحديد المطاوع، وهو سبيكة مرنة ولكن ضعيفة نوعاً ما.
ومع الوقت، أكتشف الحدادون في الشرق الأوسط، أن الحديد المطاوع يمكن أن يتحول إلى منتج أقوى بكثير عن طريق تسخينه في وعاء يحتوي على الفحم النباتي لبعض الوقت، ومن ثم غمره في الماء أو الزيت حتى يخمد. نتج عن هذه الطريقة تكون طبقة خارجية للقطعة من الصلب، وهي سبيكة من الحديد وكربيد الحديد، والتي كانت أكثر صلادة وأقل هشاشة من البرونز وبدأت تحل محله. وقبل عام 200 ق.م، استطاع الهنود إنتاج صلب عالي الجودة في جنوب الهند بصهر الحديد الخام والفحم والزجاج في بواتق حتى ينصهر الحديد ويذيب الكربون.[29] انتقلت تلك الفكرة من الهند إلى الصين بحلول القرن الخامس الميلادي.[30]
في القرن الحادي عشر، صنع الصينيون الصلب بطريقة تشبه إلى حد ما طريقة بسمر، عن طريق إزالة الكربون جزئياً بطرق الحديد بصورة متكررة مع نفخ الهواء البارد.[31] مما استدعى إزالة مساحات كبيرة من الغابات لتفي بحاجة صناعة الحديد من الفحم.[32]
تقدمت صناعة الحديد أكثر وأكثر باختراعات المسلمين، خلال العصر الذهبي للإسلام. شمل ذلك إقامة مصانع لإنتاج المعادن. وبحلول القرن الحادي عشر، انتشرت تلك المصانع في كل الولايات الإسلامية من الأندلس وشمال أفريقيا غرباً إلى آسيا الوسطى شرقاً.[33] كما أن هناك دلائل تشير إلى استخدام ما يشبه الفرن العالي في عصر الدولة الأيوبية المماليك.[34]
اخترع المسلمون أحد أشهر أنواع الصلب في العصور الوسطى وهو الصلب الدمشقي، واستخدموة في صناعة السيوف، في الفترة من عام 900 إلى عام 1750. أنتج هذا الصلب باستخدام بواتق بطريقة تشبه الطريقة الهندية، ولكنه يحتوي على الكربيدات مما يجعل السيوف أكثر كفاءة في القطع.[35]
الحديد في القرآن الكريم
وردت كلمة حديد في عدة مواضع في القرآن الكريم، وهناك سورة في القرآن هي سورة الحديد ورد فيها إنزال الحديد من السماء، قال تعالى: ﴿لَقَدْ أَرْسَلْنَا رُسُلَنَا بِالْبَيِّنَاتِ وَأَنْزَلْنَا مَعَهُمُ الْكِتَابَ وَالْمِيزَانَ لِيَقُومَ النَّاسُ بِالْقِسْطِ وَأَنْزَلْنَا الْحَدِيدَ فِيهِ بَأْسٌ شَدِيدٌ وَمَنَافِعُ لِلنَّاسِ وَلِيَعْلَمَ اللَّهُ مَنْ يَنْصُرُهُ وَرُسُلَهُ بِالْغَيْبِ إِنَّ اللَّهَ قَوِيٌّ عَزِيزٌ ﴾ [57:25]
يؤمن المسلمين، بموجب هذه الآية أن الحديد أنزل من السماء، ويربطون ذلك بما ورد في النظريات العلمية الحديثة بأن الحديد لم يكن موجوداً على الأرض إطلاقا قبل ملايين السنين، بل وصل الأرض عبر النيازك وذلك خلال فترات تكوين الأرض.[36]
الحديد في الأحياء
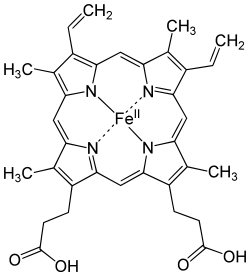
يدخل الحديد كعنصر حيوي أساسي في تركيب العديد من المركبات العضوية والإنزيمات في الكائنات الحية جميعها، من أبسطها من الناحية التطورية (العتائق) وحتى البشر ويدخل في مجموعة المركبات العضوية الفلزية التي لها أدوار حيوية ضرورية. بعض مركباته العضوية الفلزية:
- خضاب الدم الذي يتكون من سلسلة الهيم، والذي بدوره يحوي على حلقة عضوية في مركزها ذرة الحديد (
 الصورة).
الصورة). - ميوغلوبين والذي يشبه في تركيبه تركيب الهيم، ولكنه يدخل في تركيب الألياف العضلية.
- سيتوكروم أو خضاب الخلية، وهو يحوي الهيم ويدخل في التنفس الخلوي وفي عمليات الأكسدة العضوية.
- نتروجيناز، إنزيم تستعمله بعض الكائنات في تثبيت النتروجين.
القبط والتخزين
يجري تنظيم دقيق للحديد داخل الخلايا، حيث لا يوجد حديد حر فيها. من أهم عناصر تنظيم الحديد البروتين ترانسفيرين الذي يربط الحديد الذي يُمتصّ في الإثني عشري ويحمله إلى الخلايا.[37] عند الحيوانات والنباتات والفطريات الحديد عادةً هو الأيون المضمّن في مركّب الهيم، والهيم مكوّنة أساسية لبروتينات السيتوكروم التي تتواسط في تفاعلات الأكسدة والاختزال، وكذلك للبروتينات الناقلة للأكسجين مثل الهيموغلوبين والميوغلوبين والليغيموغلوبين. يساهم الحديد اللاعضوي أيضاً في تفاعلات الأكسدة والاختزال في عناقيد الحديد والكبريت في الكثير من الأنزيمات، مثل النتروجيناز والهيدروجيناز. تشمل الأمثلة على البروتينات غير المعتمدة على الهيم مختزلة الريبونوكليوتيد (تحول الريبوز إلى ديوكسي ريبوز) وفسفتاز حمضية.
يخضع توزع الحديد في الثدييات إلى تنظيم صارم، ويعود ذلك جزئياً إلى سميته المحتملة.[38]
يمكن أن يشكل الحصول على الحديد مشكلةً بالنسبة للكائنات الهوائية لأن الحديد ثلاثي التكافؤ ذوبانيته قليلة في الوسط المعتدل؛ وقد تطور لدى بعض البكتيريا والفطريات والنباتات عوامل احتجاز الحديد ذات ألفة عالية تسمى حاملات الحديد.[39][40][41]
مصادر الحديد
 مقالة مفصلة: التمثيل الغذائي للحديد في جسم الانسان
مقالة مفصلة: التمثيل الغذائي للحديد في جسم الانسان
 مقالة مفصلة: فقر الدم بعوز الحديد
مقالة مفصلة: فقر الدم بعوز الحديد
الحديد موجود في مواد كثيرة. تشمل أغنى مواد الغذاء بالحديد : اللحوم الحمراء وبالطبع الكبد ، والبقول كالعدس ، والحمص والفول، ولحوم الدواجن والسمك ، والخضار مثل السبانخ والباذنجان والخرشوف . ويكون امتصاص حديد اللحوم (حديد الهيم) أسهل مقارنةً مع الحديد من النباتات.[42]
تشير دراسات عديدة أن الهيم أو الهيموغلوبين من اللحوم الحمراء قد يزيد اختطار سرطان القولون[43][44]، إلا أن هذا الأمر موضع لبعض الخلاف[45]، وتوحي بضعة دراسات أن البيّنات الموجودة غير كافية لإثبات هذا الادعاء.[46]
وفي النباتات يؤدي عوز الحديد إلى اصفرار الأوراق لأن الحديد ضروري في عملية اصطناع الكلوروفيل، فهو يدخل في تركيب إنزيم يساهم في تركيب حمض أمينوليفولينيك، وهذا الحمض هو طليعة الكلوروفيل والهيم.[47]
الحديد في الطبيعة
 مقالة مفصلة: خام حديد
مقالة مفصلة: خام حديد

الحديد هو السادس من حيث وفرة من العناصر الكيميائية في الكون، وهو يتكون خلال الخطوة الأخيرة من عملية احتراق السيليكون في النجوم العملاقة. ونادراً ما يتواجد الحديد في حالته كعنصر (Fe) على سطح الأرض لأنه يميل إلى التأكسد، ولكن أكاسيده منتشرة وتمثل خاماته الأولية. بالرغم من أنه يمثل نحو 5 ٪ من القشرة الأرضية، إلا أنه يعتقد أن سبيكة من الحديد والنيكل في باطن الأرض تمثل 35 ٪ من كتلة الأرض ككل. لذا، فالحديد هو العنصر الأكثر وفرة على سطح الأرض، لكنه العنصر الرابع الأكثر وفرة في القشرة الأرضية.[48][49]
معظم الحديد في القشرة الأرضية متحد مع الأكسجين مكوناً أكاسيد الحديد والتي تمثل خامات الحديد في الطبيعة كالهيماتيت الماغنتيت. يتواجد الحديد بوفرة في بعض التكوينات الحجرية. هذه التكوينات الجيولوجية هي نوع من الصخور التي تتكون من طبقات رقيقة من أكاسيد الحديد، إما من الماغنيتيت (Fe3O4) أو الهيماتيت (Fe2O3)، بالتناوب مع طبقات فقيرة بالحديد من الحجارة والطمي. تشكلت هذه التكوينات منذ 3700 إلى 1800 مليون عام.[50][51] كما أن هناك صور أخرى لخامات الحديد مثل الليمونيت البيريت والإلمينيت والسيدريت.
نحو 1 من كل 20 حجر نيزكي تتكون من معادن غنية بالحديد والنيكل كالتاينيت (35–80% حديد)، والكاماسيت (90-95 % حديد). وبالرغم من ندرتها، إلا أن نيازك الحديد هي المصدر الرئيس للحديد على سطح الأرض.[52]
وقد ثبت باستخدام مطياف موس باوير، أن اللون الأحمر لسطح المريخ هو طبقة غنية بأكاسيد الحديد.[53]
 البيريت (الذهب الكاذب)
البيريت (الذهب الكاذب)
إنتاج الحديد

إنتاج الحديد أو الصلب هو عملية تتضمن مرحلتين أساسيتين، ما لم يكن المنتج المطلوب هو الحديد الزهر. المرحلة الأولى هي إنتاج الحديد الخام في الفرن العالي، أو بالاختزال المباشر، والمرحلة الثانية هي جعل إنتاج الحديد المطاوع أو الصلب من الحديد الغفل من خلال عمليات أخرى.
في بعض الأحيان مثل لإنتاج المغناطيس الكهربي، ويُنتج الحديد النقي بواسطة التحليل الكهربائي للزاج الأخضر.[20]
طريقة الفرن اللافح
 مقالة مفصلة: فرن لافح
مقالة مفصلة: فرن لافح
صناعياً، ينتج الحديد في الفرن اللافح عن طريق اختزال خامات الحديد وخاصة الهيماتيت (Fe2O3) والماغنتيت (Fe3O4) بالكربون عند 2000 درجة مئوية.
في الفرن اللافح، تلقى خامات الحديد، والكربون في هيئة فحم كوك، والحجر الجيري (الذي يعمل كـمخبث ويستخدم لإزالة شوائب ثاني أكسيد السيليكون التي قد تتسبب في انسداد الفرن) من أعلى الفرن، وفي ذاته يتم الدفع بـ 4 أطنان هواء ساخن لكل طن من خامات الحديد من أسفل الفرن.[54] يدخل تيار من الهواء الساخن عبر أنابيب النفخ الواقعة أسفله حيث يتفاعل الأكسجين مع الكوك مكونا أول أكسيد الكربون
- 2 C + O2 → 2 CO
يختزل أول أكسيد الكربون الهيماتيت لينتج حديد منصهر وثاني أكسيد الكربون:
- Fe2O3 + 3 CO → 2 Fe + 3 CO2
ويختزل بعض الهيماتيت مباشرة بالكوك قرب قاعدة الفرن اللافح مستغلاً الحرارة العالية لهذه المنطقة
- 2 Fe2O3 + 3 C → 4 Fe + 3 CO2
يعمل المخبث (الحجر الجيري الدولوميت) على إزالة الشوائب المتمثلة في الرمل والسيليكات الأخرى. تتسبب حرارة الفرن في تحلل الحجر الجيري إلى أكسيد الكالسيوم وثاني أكسيد الكربون.
- CaCO3 → CaO + CO2
ثم يتحد أكسيد الكالسيوم مع الرمل ليكون الخبث.
- CaO + SiO2 → CaSiO3
يطفوا الخبث على سطح الحديد المنصهر، نظراً لأن كثافته أقل من كثافة الحديد. يزال بعد ذلك كل من الحديد والخبث من فتحات جانبية في الفرن. يسمى الحديد الناتج بالحديد الغفل والذي يستخدم كخام للحديد في مراحل تصنيع الحديد التالية، بينما يستخدم الخبث في رصف الطرق أو كمادة مخصبة لبعض التربات الفقيرة بالمعادن وفي صناعة الاسمنت.[54] ينتج عن الفرن اللافح غازات كثيفة بمعدل 4000 م3/طن.
طبقاً لإحدى الإحصائيات البريطانية، فإن الصين هي أكبر منتج لخامات الحديد (نحو ربع الإنتاج العالمي) تليها البرازيل وأستراليا والهند.
إنتاج الحديد بالاختزال المباشر
بسبب المخاوف البيئية، أصبح هناك اتجاهاً للحد من استخدام فحم الكوك. ظهرت أساليب بديلة لمعالجة الحديد، أحدها هو اختزال الحديد مباشر باستخدام الغاز الطبيعي.[54] تختزل خامة الحديد إلى مادة تشبه المسحوق تسمى الحديد الاسفنجي، التي تستخدم في صناعة الصلب. تتكون العملية من تفاعلين رئيسيين:
- أولاً: أكسدة الغاز الطبيعي بمساعدة عامل محفز وحرارة.
- 2 CH4 + O2 → 2 CO + 4 H2
- ثانياً: هذه الغازات تدفع إلى فرن مشحون بخامة الحديد، عند درجة حرارة بين 800-900 درجة مئوية، لينتج الحديد الإسفنجي.
- Fe2O3 + CO + 2 H2 → 2 Fe + CO2 + 2 H2O
تزال السيليكا بإضافة مخبث كالحجر الجيري في خطوة تالية.
ومع نهاية ثمانينات القرن العشرين، وصل إنتاج حديد الاختزال المباشر إلى حوالي 50 مليون طن/سنة. تمتاز هذه الطريقة في إنتاج الحديد بأنها:
- لا تحتاج إلى فحم الكوك غالي الثمن والغير متوافر.
- تكلفة إنشائها أقل بكثير من تكلفة إنشاء الفرن اللافح.
- تقنيته بسيطة ويسهل استخدامها.
- الحديد الناتج من هذه العملية خال من الكربون بينما الحديد الغفل الناتج عن الفرن اللافح يحتوي تقريبا على 4% كربون.
طرق أخرى
من المعروف أن الحديد الغفل حديد غير نقي، حيث أنه يحتوي على 4-5 ٪ كربون مع كميات صغيرة من الشوائب الأخرى مثل الكبريت الماغنيسيوم الفوسفور المنغنيز، غير أنه هش لزيادة نسبة الكربون به. يصب هذا النوع من الحديد، والمعروف أيضا باسم الحديد الزهر، في المسابك لإنتاج الأنابيب والواقيات من المواد المشعة والقضبان وغيرها من المسبوكات الأخرى.
كما يمكن إنتاج الصلب أو الحديد المطاوع من الحديد الغفل. استخدمت لذلك عدة طرق منها أفران التسويط ومحولات بسمر وأفران المجمرة المكشوفة وفرن القوس الكهربي. تهدف هذه الطرق لأكسدة بعض أو كل الكربون وغيره من الشوائب، ومن ناحية أخرى، إضافة المعادن الأخرى لإنتاج سبائك الصلب.
وهناك طرق بديلة لإنتاج الحديد، وبعض هذه العمليات تنتج الصلب مباشرة في خطوة واحدة بدلاً من إنتاج الحديد ثم تنقيته لإنتاج الصلب. أهم هذه الطرق ما يعرف باسم الصهر، والاختلاف الأساسي بين الاختزال المباشر والصهر، أن الناتج في الحالة الثانية يكون سائلا، بينما في الأولى ينتج الحديد في صورة جامدة وتتم هذه العملية في فرن الصهر أو قد يكون الصهر والاختزال باستخدام البلازما.
فرن قوس البلازما يشبه إلى حد بعيد فرن القوس الكهربي، ولكن بدلاً من أقطاب الجرافيت، يتم تثبيت شعلات البلازما. هذه الشعلات تبرد بالماء من خلال غلاف معدني يغلفها. يمر من خلال الغلاف أنابيب لتغذية الغاز المتأين (سواء النيتروجين أو الأرجون)، وقطب إسطواني قابل للذوبان من الجرافيت.
يتم الصهر على مرحلتين باستخدام البلازما الأولى: اختزال خام الحديد جزئيا بنسبة 50% إلى 60%، قبل أن يتم خلطها مع الفحم والحجر الجيري وفي الثانية: الاختزال النهائي والصهر وهو يشبه إلى حد كبير الاختزال في الفرن العالي والفارق الأساسي هو وجود البلازما.
المعالجات الحرارية للمنتجات الحديدية
تتوقف صلادة الصلب على محتوى الكربون فيها، فكلما ارتفعت نسبة الكربون، كلما ازدادت صلادته وقلت قابلية للتشكيل. رغم ذلك، هناك عدة طرق للتحكم في صلادة الصلب، منها:
- التخمير: يتم بتسخين الصلب إلى 700-800 درجة مئوية لعدة ساعات، ومن ثم التبريد ببطء في الفرن. تؤدي هذه العملية إلى تقليل صلادة الصلب وجعله أكثر ليونة وعملي أكثر.
- تشغيل الصلب على البارد: تتم هذه العملية بطرق الصلب وتشكيله في درجة حرارة منخفضة (أقل من 150 درجة مئوية). من أشكالها، الطرق على البارد والدرفلة على البارد والسحب على البارد.
- التقسية: تتم بتسخين الصلب إلى الإحمرار ثم تبريده في الماء، فيصبح الصلب أكثر صلادة وأكثر هشاشة. ولمعالجة ذلك يعاد تسخين الصلب، ولكن لدرجة حرارة أقل ثم تركه ليبرد ببطء، وبذلك تقل هشاشة الصلب.[54]
- التقسية السطحية: أحياناً يكون من المطلوب إنتاج صلب به خواص المتانة الصلادة، وعندئذ يسخن الصلب إلى حوالي 900 درجة مئوية في وسط من الفحم أو النيتروجين. ينتشر الكربون أو النيتروجين في سطح الصلب، مما يزيد من صلادة السطح. يبرد السطح بسرعة، بينما يبرد قلب الصلب ببطء، مما يجعل من السطح صلد والقلب مرن وذو متانة.
منتجات الحديد الرئيسية
نظراً لانخفاض تكلفة إنتاجه وقوته، أصبح إستخدامه لا غنى عنه في التطبيقات الهندسية مثل أجسام الماكينات والسيارات وهياكل السفن والهياكل المعدنية للأبنية العملاقة. لا يستخدم الحديد الخالص نظراً لأنه لين جداً، لذا فهو غالباً ما تستخدم أشهر سبائكه وهي سبائك صلب.
يصنف الحديد تجارياً على أساس درجة نقائه ووفرة العناصر السبائكية به. يحتوي الحديد الغفل على 3.5-4.5 % كربون،[55] ويحتوي على كميات مختلفة من الشوائب، مثل الكبريت والسيليكون والفوسفور. الحديد الغفل ليس منتجاً نهائياً قابلاً للبيع، وإنما هو خطوة وسيطة في إنتاج الحديد الزهر والصلب من خامات الحديد. الحديد الزهر يحتوي على 2-4 ٪ كربون و 1-6 ٪ سيليكون وكميات صغيرة من المنغنيز. تؤثر الشوائب الموجودة في الحديد الغفل مثل الكبريت والفسفور سلباً على خصائص المنتج النهائي، لذا يتم تخفيضها إلى مستوى مقبول. لكلا العنصرين درجات انصهار بين 1150-1200 درجة مئوية، وهي أقل من أي من العنصرين الرئيسيين في سبائك الحديد (الحديد والكربون)، لذا فإنهما ينصهرا أولاً، ويسهل إزالة أغلبهما. تتأثر الخصائص الميكانيكية للسبائك الحديدية كثيراً، بالهيئة التي يتخذها الكربون في السبيكة.
يأخذ الكربون في "الحديد الزهر الأبيض" شكل سمنتيت أو كربيد الحديد (Fe3C). يتسبب هذا المركب الهش من الكربيدات في جعل الحديد الزهر الأبيض غير مقاوم للصدمات. أما في الحديد الزهر الرمادي فيتواجد الكربون حراً في شكل رقائق دقيقة من الجرافيت، مما يجعله أيضا هشاً لتركز الإجهادات عند الأطراف المدببة لرقائق الجرافيت. هناك نوع آخر من الحديد الزهر هو الحديد الزهر المرن، وهو أحد أشكال الحديد الزهر الرمادي المعالجة بإضافة كميات ضئيلة من الماغنيسيوم، لتحويل شكل الجرافيت من الشكل الرقائقي إلى أشباه كرات أو عقيدات، والتي تزيد من متانة وقوة للمادة.
يحتوي الحديد المطاوع على أقل من 0.25% كربون،[55] وهو متين ومرن، ولكنه أقل قابلية للانصهار من الحديد الغفل. يتميز الحديد المطاوع باحتوائه على بقايا خبث داخل المعدن، كما أنه أكثر مقاومة للصدأ من الصلب. قل استخدامه الآن وأصبح يستبدل بالصلب منخفض الكربون. بالرغم من أن الصلب منخفض الكربون أكثر عرضة للتآكل من الحديد المطاوع، إلا أن رخص ثمنه جعله أكثر استخداماً.
الصلب الكربوني هو الصلب الذي يحتوي على 2% كربون أو أقل[56] مع كميات قليلة من المنغنيز والكبريت والفوسفور والسيليكون. بينما الصلب السبائكي فيحتوي على نسب متفاوتة من الكربون، فضلا عن المعادن الأخرى، مثل الكروم والفاناديوم والموليبدنوم والنيكل والتنجستن وغيرها. يرفع محتوى العناصر السبائكية في هذا النوع من الصلب من ثمنه، لذا لا يستخدم إلا في أغراض خاصة. أشهر سبائك هذا النوع هي سبائك الصلب الذي لا يصدأ. أدخل علماء المعادن الحديدية الآن بعض التحسينات على الصلب السبائكي، فأنتجوا منه نوعاً جديداً يمتاز بالقوة رغم احتوائه على محتوى قليل من العناصر السبائكية، مما يزيد من متانة الصلب الناتج وبتكلفة أقل.
كما يستخدم الحديد أحياناً كمادة واقية من الإشعاعات المؤينة، لأنه أخف وأقوى بكثير ميكانيكيا من أشهر مادة في هذا المجال وهي عنصر الرصاص.
من أبرز استخدامات الحديد ما يلي:
- استخدامات الحديد الزهر : يستخدم في صناعة الأدوات التي لا تتعرض للصدمات مثل : أنابيب المياه وأنابيب الغاز.
- استخدامات الحديد المطاوع : ويستخدم في صنع المغناطيسيات الكهربائية المؤقتة المستخدمة في الأجهزة الكهربائية، كما يستخدم في قضبان التسليح المستخدمة في البناء.
- استخدامات الصلب : يستخدم في صناعة السفن وقضبان سكك الحديد والجسور والسيارات.
يعيب سبائك الحديد والصلب تعرضها بشدة للصدأ، إذا لم تكن محمية بشكل أو بآخر. الطلاء والجلفنة والتخميل والغطاء البلاستيكي هي طرق تستخدم جميعها لحماية الحديد من الصدأ من خلال إبعاد الماء والأكسجين عن سطح المعدن، كما أن هناك طريقة أخرى تستخدم غالباً في حماية أجسام السفن الخارجية وحماية أنابيب نقل النفط وسخانات المياة، وهي باستخدام طريقة القطب المضحى به والذي يضحى به ليتآكل بدلاً من الجسم الأساسي.
استخدامات مركبات الحديد
مركبات الحديد منتشرة في الصناعة، وتستخدم في العديد من الاستخدامات المتخصصة. تستخدم مركبات الحديد عادة كعامل محفز في عملية هابر-بوش لإنتاج الأمونيا وعملية فيشر-تروبش لتحويل أول أكسيد الكربون إلى هيدروكربونات لإنتاج الوقود ومواد التشحيم.[57]
يستخدم كلوريد الحديد الثلاثي في تنقية المياه ومعالجة مياه الصرف الصحي، وفي صبغ القماش وكعامل لتلوين الطلاء، كما يضاف لأعلاف الحيوانات، ويستخدم أيضاً لتنظيف النحاس في صناعة لوحات الدوائر المطبوعة.[58] كما يتحلل في الكحول ليستخدم كصبغة.[20] أما الهاليدات فيتوقف استخدامها على بعض الاستخدامات المختبرية المحدودة.
يستخدم كبريتات الحديد الثنائي لاختزال أملاح الكرومات في صناعة الاسمنت، كما يستخدم لعلاج افتقار الدم لعنصر الحديد. أما كبريتات الحديد الثلاثي فيستخدم في ترسيب الجسيمات الدقيقة في مياة الصهاريج. بينما يستخدم كلوريد الحديد الثنائي كعامل مختزل في بعض الصناعات العضوية.
الأعباء البيئية لصناعة الحديد
تلوث البيئة المحيطة بالمنطقة الصناعية نتيجة:
- انبعاث غازات سامة من الافران إلى الجو الخارجي التي تؤدي إلى:
- آثار ضارة على صحة العاملين.
- التأثير القاتل على المحاصيل الزراعية.
- ارتفاع درجة حرارة الجو.
- تلوث مياه المجاري نتيجة المياه المنصرفة من المصانع.
- تصاعد الأتربة من قمة الفرن عند صب الحديد.
الحد من التلوث

- الاستفادة من الغازات الضارة المتصاعدة من قمم الافران بعملية استرجاع لها واعادة شحنها مرة ثانية.
- معالجة مياه وحدات التصنيع حيث يمكن اعادة استعمالها أو صرفها.
- تجميع الاتربة المتصاعدة.
- إمكانية استرجاع المواد الجامدة ذات النفع وإعادة استخدامها في التصنيع..
- الاستفادة من غاز ثاني أكسيد الكبريت في تصنيع حمض الكبريتيك، أو إنتاج عنصر الكبريت.
- كثيرا ما تنطلق الغازات عند درجات حرارة عالية أي أنها تحمل طاقة مخزونة فيها، ومن المحبذ استرجاع الطاقة بدلا من فقدها.
- تجميع أول أكسيد الكربون واستخدامه وقودا في المواقد.
انظر أيضاً
هوامش ومراجع
- Koenig, Rich and Kuhns, Mike: Control of Iron Chlorosis in Ornamental and Crop Plants. (جامعة ولاية يوتا, Salt Lake City, August 1996) p.3 نسخة محفوظة 03 أغسطس 2016 على موقع واي باك مشين.
- Kuhn, Howard and Medlin, Dana (prepared under the direction of the ASM International Handbook Committee), المحرر (2000). ASM Handbook – Mechanical Testing and Evaluation (PDF). 8. ASM International. صفحة 275. ISBN 0871703890. مؤرشف من الأصل (PDF) في 9 فبراير 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المحررون (link) - "Hardness Conversion Chart". Maryland Metrics. مؤرشف من الأصل في 31 أغسطس 2018. اطلع عليه بتاريخ 23 مايو 2010. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Kohl, Walter H. (1995). Handbook of materials and techniques for vacuum devices. Springer. صفحات 164–167. ISBN 1563963876. مؤرشف من الأصل في 25 مارس 2017. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Raghavan, V. (2004). Materials Science and Engineering. PHI Learning Pvt. Ltd. صفحة 218. ISBN 8120324552. مؤرشف من الأصل في 17 يناير 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Takaji, Kusakawa; Toshikatsu, Otani. "Properties of Various Pure Irons : Study on pure iron I". Tetsu-to-Hagane. 50 (1): 42–47. مؤرشف من الأصل في 6 أبريل 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Martin, John Wilson (2007). Concise encyclopedia of the structure of materials. Elsevier. صفحة 183. ISBN 0080451276. مؤرشف من الأصل في 17 يناير 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Bramfitt, B. L.; Benscoter, Arlan O. (2002). "The Iron Carbon Phase Diagram". Metallographer's guide: practice and procedures for irons and steels. ASM International. صفحات 24–28. ISBN 9780871707482. مؤرشف من الأصل في 17 ديسمبر 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Georges, Audi (2003). "The NUBASE Evaluation of Nuclear and Decay Properties". Nuclear Physics A. Atomic Mass Data Center. 729: 3–128. doi:10.1016/j.nuclphysa.2003.11.001. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Dauphas, N.; Rouxel, O. (2006). "Mass spectrometry and natural variations of iron isotopes" (PDF). Mass Spectrometry Reviews. 25 (4): 515–550. doi:10.1002/mas.20078. PMID 16463281. مؤرشف من الأصل (PDF) في 11 يونيو 2012. اطلع عليه بتاريخ أكتوبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ الوصول=(مساعدة) - "Iron and Nickel Abundances in H~II Regions and Supernova Remnants". June 14, 1995. مؤرشف من الأصل في 18 مارس 2008. اطلع عليه بتاريخ 23 مايو 2010. الوسيط
|CitationClass=تم تجاهله (مساعدة). - Nam, Wonwoo (2007). "High-Valent Iron(IV)–Oxo Complexes of Heme and Non-Heme Ligands in Oxygenation Reactions". Accounts of Chemical Research. 40 (7): 522–531. doi:10.1021/ar700027f. PMID 17469792. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Holleman, Arnold F.; Wiberg, Egon; Wiberg, Nils; (1985). "Iron". Lehrbuch der Anorganischen Chemie (باللغة الألمانية) (الطبعة 91–100). Walter de Gruyter. صفحات 1125–1146. ISBN 3110075113. الوسيط
|CitationClass=تم تجاهله (مساعدة)CS1 maint: extra punctuation (link) - Ware, Mike (1999). "An introduction in monochrome". Cyanotype: the history, science and art of photographic printing in Prussian blue. NMSI Trading Ltd. صفحات 11–19. ISBN 9781900747073. مؤرشف من الأصل في 18 يناير 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - أ ب Ferrous، ميريام وبستر، retrieved 19 April 2008 نسخة محفوظة 13 أغسطس 2017 على موقع واي باك مشين.
- Etymology (Meaning of Words) ،30 November 2007,retrieved 19 April 2008 نسخة محفوظة 25 سبتمبر 2011 على موقع واي باك مشين.
- Non ferrous ، ميريام وبستر، retrieved 19 April 2008 نسخة محفوظة 13 أغسطس 2017 على موقع واي باك مشين.
- "Questions and Answers on Prussian Blue". مؤرشف من الأصل في 4 نوفمبر 2017. اطلع عليه بتاريخ 06 يونيو 2009. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Thompson, D. F (2004). "Soluble or Insoluble Prussian Blue for Radiocesium and Thallium Poisoning?". Annals of Pharmacotherapy. 38: 1509–1514. doi:10.1345/aph.1E024. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Iron." Microsoft® Student 2009 [DVD]. Redmond, WA: Microsoft Corporation, 2008.
- E. Photos, 'The Question of Meteoritic versus Smelted Nickel-Rich Iron: Archaeological Evidence and Experimental Results' World Archaeology Vol. 20, No. 3, Archaeometallurgy (Feb., 1989), pp. 403-421. Online version accessed on 2010-02-08. نسخة محفوظة 31 ديسمبر 2016 على موقع واي باك مشين.
- Duncan E. Miller and N.J. Van Der Merwe, 'Early Metal Working in Sub Saharan Africa' Journal of African History 35 (1994) 1-36; Minze Stuiver and N.J. Van Der Merwe, 'Radiocarbon Chronology of the Iron Age in Sub-Saharan Africa' Current Anthropology 1968.
- Minnesota State University EMuseum: Ancient Egyptian Culture: Paleolithic Egypt. Retrieved 6 April 2010. نسخة محفوظة 15 مارس 2011 على موقع واي باك مشين. [وصلة مكسورة]
- R. F. Tylecote, A History of Metallurgy (2nd edn, 1992), 3
- "Excavation in Turkey Set to Rewrite History of Iron Age," Asahi Shimbun, 27 March 2009.
- Marco Ceccarelli (2000). International Symposium on History of Machines and Mechanisms: Proceedings HMM Symposium. Springer. ISBN 0-7923-6372-8. pp 218
- Collins, Rober O. and Burns, James M. The History of Sub-Saharan Africa. New York:Cambridge University Press, p. 37. ISBN 978-0-521-68708-9.
- Muhly, James D. 'Metalworking/Mining in the Levant' pp. 174-183 in Near Eastern Archaeology ed. Suzanne Richard (2003), pp. 179-180.
- G. Juleff (1996). "An ancient wind powered iron smelting technology in Sri Lanka". نيتشر (مجلة). 379 (3): 60–63. doi:10.1038/379060a0. الوسيط
|CitationClass=تم تجاهله (مساعدة)CS1 maint: ref=harv (link) - Needham, Volume 4, Part 1, 282.
- Robert Hartwell, 'Markets, Technology and the Structure of Enterprise in the Development of the Eleventh Century Chinese Iron and Steel Industry' Journal of Economic History 26 (1966). pp. 53-54
- Ebrey, 158.
- Adam Robert Lucas (2005), "Industrial Milling in the Ancient and Medieval Worlds: A Survey of the Evidence for an Industrial Revolution in Medieval Europe", Technology and Culture 46 (1): 1-30 [10-1 & 27]
- R. L. Miller (October 1988). "Ahmad Y. Al-Hassan and Donald R. Hill, Islamic technology: an illustrated history". Medical History. 32 (4): 466–7. الوسيط
|CitationClass=تم تجاهله (مساعدة)CS1 maint: ref=harv (link) - Kochmann, W. (2004). "Nanowires in ancient Damascus steel". Journal of Alloys and Compounds. 372: L15–L19. doi:10.1016/j.jallcom.2003.10.005. ISSN 0925-8388. الوسيط
|CitationClass=تم تجاهله (مساعدة)CS1 maint: ref=harv (link)
Levin, A. A. (2005). "Microstructure of a genuine Damascus sabre" (PDF). Crystal Research and Technology. 40 (9): 905–916. doi:10.1002/crat.200410456. مؤرشف من الأصل (PDF) في 19 مارس 2009. الوسيط|CitationClass=تم تجاهله (مساعدة)CS1 maint: ref=harv (link) - مصدر الحديد - في حديث للشيخ عبد المجيد الزنداني لقناة الجزيرة حول الإعجاز العلمي في القرآن نسخة محفوظة 31 مايو 2011 على موقع واي باك مشين. [وصلة مكسورة]
- Rouault T.A. (2003). "How mammals acquire and distribute iron needed for oxygen-based metabolism". PLoS Biology. 1 (1): e9. doi:10.1371/journal.pbio.0000079. PMC 212690. PMID 14551907. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Nanami N.; et al. (2005). "Tumor necrosis factor-α-induced iron sequestration and oxidative stress in human endothelial cells". Arteriosclerosis, thrombosis, and vascular biology. 25 (12): 2495–2501. doi:10.1161/01.ATV.0000190610.63878.20. PMID 16224057. مؤرشف من الأصل في 21 نوفمبر 2018. الوسيط
|CitationClass=تم تجاهله (مساعدة); Explicit use of et al. in:|مؤلف=(مساعدة) - Neilands J.B. (1995). "Siderophores: structure and function of microbial iron transport compounds". The Journal of biological chemistry. 270 (45): 26723–6. doi:10.1074/jbc.270.45.26723 (غير نشط 2010-05-25). PMID 7592901. مؤرشف من الأصل في 20 يونيو 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Neilands J.B. (1981). "Microbial iron compounds". Annual Review of Biochemistry. 50: 715. doi:10.1146/annurev.bi.50.070181.003435. PMID 6455965. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Boukhalfa H. & Crumbliss A.L. (2002). "Chemical aspects of siderophore mediated iron transport". BioMetals. 15 (4): 325. doi:10.1023/A:1020218608266. PMID 12405526. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Food Standards Agency - Eat well, be well - Iron deficiency نسخة محفوظة 28 نوفمبر 2010 على موقع واي باك مشين.
- Sesink A.L.; et al. (1999). "Red meat and colon cancer: the cytotoxic and hyperproliferative effects of dietary heme". Cancer Research. 59 (22): 5704. PMID 10582688. مؤرشف من الأصل في 25 أغسطس 2009. الوسيط
|CitationClass=تم تجاهله (مساعدة); Explicit use of et al. in:|مؤلف=(مساعدة) - Glei M.; et al. (2006). "Hemoglobin and hemin induce DNA damage in human colon tumor cells HT29 clone 19A and in primary human colonocytes". Mutation Research. 594 (1–2): 162–171. doi:10.1016/j.mrfmmm.2005.08.006. PMID 16226281. الوسيط
|CitationClass=تم تجاهله (مساعدة); Explicit use of et al. in:|مؤلف=(مساعدة) - Sandhu M.S.; et al. (2001). "Systematic review of the prospective cohort studies on meat consumption and colorectal cancer risk: a meta-analytical approach". Cancer Epidemiology, Biomarkers & Prevention. 10 (5): 439. PMID 11352852. مؤرشف من الأصل في 10 يونيو 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة); Explicit use of et al. in:|مؤلف=(مساعدة) - "Eating red meat will not increase colorectal cancer risk, study suggests". ScienceDaily. June 13, 2007. مؤرشف من الأصل في 18 نوفمبر 2018. اطلع عليه بتاريخ 01 أكتوبر 2010. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Kumar A.M. & Söll D. (2000). "Antisense HEMA1 RNA expression inhibits heme and chlorophyll biosynthesis in arabidopsis". Plant Physiology. 122 (1): 49–56. doi:10.1104/pp.122.1.49. PMID 10631248. مؤرشف من الأصل في 24 أكتوبر 2007. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Iron: geological information". WebElements. مؤرشف من الأصل في 28 سبتمبر 2018. اطلع عليه بتاريخ 23 مايو 2010. الوسيط
|CitationClass=تم تجاهله (مساعدة). - John W. Morgan*and Edward Anders. "Chemical composition of Earth, Venus, and Mercury". Proc. Nat. Acad. Sci. 77 (12): 6973–6977. مؤرشف من الأصل في 15 أكتوبر 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Lyons, T. W.; Reinhard, CT (2009). "Early Earth: Oxygen for heavy-metal fans". Nature. 461 (7261): 179–181. doi:10.1038/461179a. PMID 19741692. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Cloud, P. (1973). "Paleoecological Significance of the Banded Iron-Formation". Economic Geology. 68: 1135–1143. doi:10.2113/gsecongeo.68.7.1135. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Emiliani, Cesare (1992). "Planet earth: cosmology, geology, and the evolution of life and environment". Cambridge University Press: 152. ISBN 9780521409490. مؤرشف من الأصل في 18 يناير 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة); Cite journal requires|journal=(مساعدة);|chapter=تم تجاهله (مساعدة) - Klingelhöfer, G.; Morris, R. V.; Souza, P. A.; Rodionov, D.; Schröder, C. (2007). "Two earth years of Mössbauer studies of the surface of Mars with MIMOS II". Hyperfine Interactions. 170: 169–177. doi:10.1007/s10751-007-9508-5. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Biddle, Verne; Parker, Gregory. Chemistry, Precision and Design. A Beka Book, Inc. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Camp, James McIntyre; Francis, Charles Blaine (1920). The Making, Shaping and Treating of Steel. Pittsburgh: Carnegie Steel Company. صفحات 173–174. مؤرشف من الأصل في 11 نوفمبر 2015. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Classification of Carbon and Low-Alloy Steels". مؤرشف من الأصل في 23 أكتوبر 2008. اطلع عليه بتاريخ 05 يناير 2008. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Kolasinski, Kurt W. (2002). "Where are Heterogenous Reactions Important". Surface science: foundations of catalysis and nanoscience. John Wiley and Sons. ISBN 9780471492443. مؤرشف من الأصل في 17 يناير 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Wildermuth, Egon; Stark, Hans; Friedrich, Gabriele; Ebenhöch, Franz Ludwig; Kühborth, Brigitte; Silver, Jack; Rituper, Rafael (2000). "Iron Compounds". doi:10.1002/14356007.a14_591. الوسيط
|CitationClass=تم تجاهله (مساعدة); Cite journal requires|journal=(مساعدة)
- بوابة صيدلة
- بوابة العناصر الكيميائية
- بوابة علم المواد
- بوابة الكيمياء
 صور وملفات صوتية من كومنز
صور وملفات صوتية من كومنز



-nitrate-nonahydrate-sample.jpg.webp)
-oxide-sample.jpg.webp)




