ألومنيوم
الألومنيوم هو عنصر كيميائي رمزه Al وعدده الذري 13؛ وهو يقع ضمن عناصر الدورة الثالثة وفي المرتبة الثانية في المجموعة الثالثة عشرة (المجموعة الثالثة وفق ترقيم المجموعات الرئيسية) في الجدول الدوري. الألومنيوم فلز خفيف ذو لون أبيض فضي يتميز بانخفاض كثافته؛ وهو قابل للسحب والطرق. وهو من أكثر الفلزات وفرة في القشرة الأرضية، فترتيبه الثالث من بين أكثر العناصر الكيميائية وفرة في القشرة الأرضية بعد الأكسجين والسيليكون؛ حيث يشكل الألومنيوم حوالي 8% من كتلة سطح الأرض الصلب. لهذا الفلز نظير مستقر وحيد، وهو النظير ألومنيوم-27 27Al.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| المظهر | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
رمادي فلزي الخطوط الطيفية للألومنيوم | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الخواص العامة | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الاسم، العدد، الرمز | ألومنيوم، 13، Al | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| تصنيف العنصر | فلز | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| المجموعة، الدورة، المستوى الفرعي | 13، 3، p | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الكتلة الذرية | 26.9815386 غ·مول−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| توزيع إلكتروني | Ne] 3s2 3p1] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| توزيع الإلكترونات لكل غلاف تكافؤ | 2, 8, 3 (صورة) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الخواص الفيزيائية | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الطور | صلب | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الكثافة (عند درجة حرارة الغرفة) | 2.70 غ·سم−3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| كثافة السائل عند نقطة الانصهار | 2.375 غ·سم−3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نقطة الانصهار | 933.47 ك، 660.32 °س، 1220.58 °ف | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نقطة الغليان | 2792 ك، 2519 °س، 4566 °ف | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| حرارة الانصهار | 10.71 كيلوجول·مول−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| حرارة التبخر | 294.0 كيلوجول·مول−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| السعة الحرارية (عند 25 °س) | 24.200 جول·مول−1·كلفن−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ضغط البخار | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الخواص الذرية | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| أرقام الأكسدة | 3, 2, 1 (أكسيد مذبذب) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الكهرسلبية | 1.61 (مقياس باولنغ) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| طاقات التأين | الأول: 577.5 كيلوجول·مول−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الثاني: 1816.7 كيلوجول·مول−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الثالث: 2744.8 كيلوجول·مول−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نصف قطر ذري | 143 بيكومتر | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نصف قطر تساهمي | 4±121 بيكومتر | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نصف قطر فان دير فالس | 184 بيكومتر | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| خواص أخرى | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| البنية البلورية | مكعب مركزي الوجه | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| المغناطيسية | مغناطيسية مسايرة[1] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| مقاومة كهربائية | 28.2 نانوأوم·متر (20 °س) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الناقلية الحرارية | 237 واط·متر−1·كلفن−1 (300 كلفن) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| التمدد الحراري | 23.1 ميكرومتر·متر−1·كلفن−1 (25 °س) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| سرعة الصوت (سلك رفيع) | (درجة حرارة الغرفة) (ملفوف) 5,000 متر·ثانية−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| معامل يونغ | 70 غيغاباسكال | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| معامل القص | 26 غيغاباسكال | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| معامل الحجم | 76 غيغاباسكال | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نسبة بواسون | 0.35 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| صلادة موس | 2.75 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| صلادة فيكرز | 167 ميغاباسكال | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| صلادة برينل | 245 ميغاباسكال | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| رقم CAS | 7429-90-5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| النظائر الأكثر ثباتاً | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| المقالة الرئيسية: نظائر الألومنيوم | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
عادة ما يشكل الألومنيوم مركباته الكيميائية في حالة الأكسدة +3؛ ولهذا الفلز ألفة كيميائية كبيرة تجاه الأكسجين، مما يؤدي إلى تشكل طبقة من الأكسيد على سطحه تعمل على تخميله. أعلن هانز كريستيان أورستد اكتشاف الألومنيوم سنة 1825؛ في حين عمل هنري إتيان سانت كلير ديفيل على تأسيس الإنتاج الصناعي لهذا الفلز سنة 1856؛ بالمقابل ساهمت عملية هول-هيرو المطوَّرَة سنة 1886 في تخفيض تكاليف الإنتاج. إن المصدر الرئيسي للألومنيوم هو معدن خام البوكسيت؛ وأنتج منه عالمياً سنة 2016 حوالي 115 مليون طن؛ ومن جهة أخرى، بلغ معدل إعادة تدوير الألومنيوم عالمياً حوالي 40%.
يمتاز الألومنيوم بمقاومته للتآكل وبانخفاض كثافته؛ مما جعله محط اهتمام في مجال صناعة الطائرات؛ إذ للعناصر البنيوية والهياكل المصنوعة من الألومنيوم وسبائكه دور فعال في الصناعة الفضائية؛ وهي مهمة جداً في مجالات أخرى مثل النقل والبناء؛ كما أن طبيعته التفاعلية جعلته مفيداً في مجال التحفيز الكيميائي. من جهة أخرى، لا يوجد دور حيوي معروف للألومنيوم عند الكائنات الحية، ولكن لا يزال ذلك الأمر محط اهتمام وموضوع دراسات مستمرة.
التاريخ وأصل التسمية
 مقالة مفصلة: تاريخ الألومنيوم
مقالة مفصلة: تاريخ الألومنيوم


كانت أملاح الشب هي أولى أملاح الألومنيوم التي جرى التعامل معها، على الرغم من أن تركيبها لم يكن معروفاً في البداية؛ حيث دونه هيرودوت في سجلاته التي تعود إلى القرن الخامس قبل الميلاد.[2] كانت أملاح الشب تستخدم في ترسيخ ألوان الصبغات،[2] ووجدت لها أهمية في الصناعات النسيجية؛[3] فأصبحت سلعة تجارية مهمة،[4] وكانت تصدر إلى أوروبا من دول وممالك شرقي المتوسط حتى أواسط القرن الخامس عشر.[5] حاول علماء القرن السادس عشر معرفة تركيب أملاح الشب، مثل باراسيلسوس،[6] وأندرياس ليبافيوس؛[7] وفي سنة 1722 أعلن فريدريش هوفمان أن ملح الشب تربة متمايزة عن غيرها.[8] في سنة 1754 قام أندرياس سيغيسموند مارغراف باصطناع الألومينا (أكسيد الألومنيوم) من غلي الصلصال (الغضار) في حمض الكبريتيك ثم بإضافة البوتاس لاحقاً.[8]
تعود المحاولات الأولى للحصول على فلز الألومنيوم إلى حوالي سنة 1760؛[9] إلا أن أول محاولة ناجحة في عزل هذا الفلز كانت من إنجاز الكيميائي هانز أورستد، والذي قام بمفاعلة كلوريد الألومنيوم اللامائي مع ملغمة البوتاسيوم، مما أدى إلى الحصول على كتلة من فلز يشبه القصدير.[10][11][12] في العام التالي نشر أورستد نتائجه وعرض عينة من الفلز الجديد على العموم.[13][14] كرر فريدرش فولر سنة 1827 التجارب التي قام بها أورستد لعدة مرات؛[15][16] إلى نجح في الحصول على مسحوق من الألومنيوم.[12] وفي سنة 1845 تمكن من الحصول على قطع من هذا الفلز، وقدم وصفاً علمياً للخواص الفيزيائية له.[16] بسبب هذه الإنجازات اعتبر فولر لعدة سنوات من قبل البعض على أنه مكتشف الألومنيوم.[17] كانت الطرق التي اكتشف فيها الألومنيوم غير تجارية ولم يكن من الممكن الحصول عليه بأسلوب صناعي، لذلك كانت الكميات المستحصلة منه قليلة، مما أدى إلى ارتفاع سعره، حتى أصبح أثمن من الذهب.[15]
ظهرت محاولات لإنتاج الألومنيوم سنة 1856 بجهود من هنري إتيان سانت كلير ديفيل وزملائه؛[18] حيث اكتشف كيف يمكن أن اختزال ثلاثي كلوريد الألومنيوم باستخدام الصوديوم الأوفر اقتصادياً بديلاً عن البوتاسيوم، الذي استخدمه فولر.[19] بالرغم من ذلك لم يكن الألومنيوم المستحصل ذو نقاوة جيدة، كما كان هناك تفاوت في خواص العينات.[20] كانت أولى المحاولات الناجحة للحصول على الألومنيوم على مستوى صناعي في سنة 1886، حين تمكن كل من بول هيرو وتشارلز هول، وبشكل مستقل ومنفصل، من تطوير عملية إنتاج هذا الفلز، والتي تعرف اليوم باسم عملية هول-هيرو.[21] تعتمد هذه العملية على اختزال الألومينا (أكسيد الألومنيوم). تمكن الكيميائي كارل يوزف باير بعد ذلك في سنة 1889 من اكتشاف أسلوب لتنقية البوكسيت للحصول على الألومينا، وتعرف العملية باسم عملية باير.[22] يعتمد الإنتاج الحديث للألومنيوم على هاتين العمليتين.[23]
ساهم تطور الإنتاج الصناعي من فلز الألومنيوم في تخفيض أسعاره في السوق، وفي دخوله في عديد من التطبيقات، وخاصة في إمكانية تشكيله للسبائك ذات الخواص المميزة.[24] مع اندلاع الحربين العالميتين الأولى والثانية كان للألومنيوم محط اهتمام نظراً لإمكانية استخدامه في صناعة الطائرات.[25][26][27][28]
في أواسط القرن العشرين وجد الألومنيوم تطبيقات في إنتاج معدات الحياة اليومية،[29] مثل الرقائق والعبوات،[30] حتى تفوق في ذلك على تطبيقات فلز النحاس؛[31] مما جعله أكثر الفلزات اللاحديدية إنتاجاً، حيث دخل الألومنيوم بشكل تدريجي في مجال الإنشاءات الهندسية؛[32] وفي مجال صناعات العربات.[33] مع بداية عصر الفضاء دخل الألومنيوم في تركيب الأقمار الاصطناعية.[23] ازداد إنتاج الألومنيوم في القرن العشرين بشكل متسارع؛[34] حتى دخل في سبعينيات القرن العشرين بورصة لندن للمعادن سلعةً للتداول،[23] وصل الإنتاج العالمي من هذا الفلز 50 مليون طن متري سنة 2013.[34]
أصل التسمية
يطلق على هذا العنصر في أغلب دول العالم اسم «ألومنيوم aluminium»، أما في الولايات المتحدة وكندا فيسمى «ألومنوم aluminum». تشتق كلتا التسميتين من الكلمة «alumine»، وهي تسمية متقادمة للألومينا «alumina» (وهو أكسيد الألومنيوم).[35] إن كلمة «alumine» مستعارة من اللغة الفرنسية، وهي بدورها مشتقة من «alumen»، وهي تسمية لاتينية كلاسيكية تشير إلى «alum» (وهي تعني بالعربية ملح الشب)، وهو ملح واسع الانتشار والاستخدام.[36] وكلمة «alumen» اللاتينية مشتقة من الجذر «-alu*» الهندي الأوروبي البدائي، والذي يعني «مرّ».[37]
ينسب الفضل في إطلاق تسمية هذا العنصر إلى الكيميائي همفري ديفي، والذي أجرى العديد من التجارب لعزله على شكل فلز حر. ففي سنة 1808 اقترح ديفي في بحث نشره في المداولات الفلسفية للجمعية الملكية اسم العنصر على الشكل «alumium»؛[38] إلا أن التسمية لاقت اعتراضاً من الكيميائيين في فرنسا وألمانيا والسويد، والذين أشاروا أن الفلز ينبغي أن يسمى نسبة إلى أكسيده «alumina» والذي يستحصل منه الفلز، وليس نسبة إلى «alum»؛[39] على الرغم من أن التصريف يظهر النسبة غلى نفس الجذر اللاتيني.
قام الكيميائي يونس ياكوب بيرسيليوس لاحقاً سنة 1811 بنشر بحث باللغة الفرنسية [ملاحظة 1] استخدم فيه اسم «aluminium» للإشارة إلى هذا الفلز؛[40] وظهرت تلك التسمية أيضاً في ملخص لإحدى محاضرات ديفي في الجمعية الملكية سنة 1811؛[41] وفي السنة اللاحقة نشر ديفي كتاباً تعليمياً للكيمياء استخدم فيه لفظ «ألومنوم aluminum»؛[42] ومنذ ذلك الحين تداخل استخدام التسميتين لهذا العنصر؛ ولكن حالياً يقتصر استخدام تسمية «ألومنوم aluminum» في الولايات المتحدة وكندا، في حين أن اسم «ألومنيوم aluminium» ينتشر في باقي بلدان العالم.[43] في سنة 1925 اعتمدت الجمعية الكيميائية الأمريكية تسمية «ألومنوم aluminum»؛[43] أما تسمية «ألومنيوم aluminium» الشائعة فاعتمدها الاتحاد الدولي للكيمياء البحتة والتطبيقية (أيوباك [ملاحظة 2]) سنة 1990؛[44] وفي سنة 1993 اعترف الأيوباك بتسمية ألومنوم كبديل مقبول.[44][45]
الوفرة الطبيعية
في الكون
يأتي الألومنيوم في المرتبة الثانية عشرة من حيث ترتيب العناصر في المجموعة الشمسية؛[46] وهو الثالث من بين العناصر ذات عددٍ ذرّي فردي بعد الهيدروجين والنتروجين.[46] يعد التظير الوحيد والمستقر للألومنيوم (ألومنيوم-27 27Al) النظير الثامن عشر من حيث وفرة النويدات في الكون، وهو ينشأ بشكل شبه كامل من اندماج الكربون في النجوم العملاقة والتي ستصبح لاحقاً مستعر أعظم من النوع الثاني. يولد ذلك الاندماج نوى مغنسيوم-26 26Mg، والتي تلتقط بروتونات ونيوترونات الحرة لتصبح نوى ألومنيوم. تنتج كميات أصغر من 27Al في محيط تفاعلات الانصهار النجمي للنجوم الوليدة، حيث يمكن لنوى المغنيسيوم 26Mg أن تلتقط بروتونات حرة أيضاً.[47]
كان النظير ألومنيوم-26 26Al موجوداً في المجموعة الشمسية بوفرة مقدارها 0.005% بالنسبة إلى النظير 27Al، إلا أن قصر عمر النصف النسبي (728,000 سنة) بالنسبة لعمر الكون كي تبقى موجودة، لذلك يعد النظير ألومنيوم-26 26Al نويدة مشعة منقرضة.[47] على العكس من 27Al فإن تفاعلات الانصهار النجمي (حرق الهيدروجين) هي المصدر الرئيسي للنظير 26Al عندما يلتقط النظير 25Mg بروتوناً حراً؛ وعندما يتشكل على هيئة نظير مشع نادر فإنه يصدر أشعة غاما في الوسط بين النجمي.[47]
على الأرض
يدخل الألومنيوم في تركيب كوكب الأرض بنسبة 1.59% كتلةً (السابع بالوفرة من حيث الكتلة)؛[48] لكن الألومنيوم يتركز في القشرة الأرضية، فهو من أكثر العناصر وفرةً في القشرة الأرضية بعد الأكسجين والسيليكون [49] وهو بذلك أكثر الفلزات انتشاراً في القشرة الأرضية، بنسبة مقدارها 8.23% كتلةً.[50] بالمقابل فإن الألومنيوم يوجد في وشاح الأرض بنسبة 2.38% كتلةً.[51] لا يوجد فلز الألومنيوم في الطبيعة بشكله النقي الحر، ويعود ذلك إلى إلفته القوية للأكسجين؛[52] أما الفلزات الأقل نشاطاً فتترسب إلى نواة الأرض.[47] يوجد الألومنيوم في ماء البحر بنسبة 2 ميكروغرام/كيلوغرام.[50] يمكن لمعدن الألومنيوم الأصلي أن يوجد كحالة ثانوية في البيئات منخفضة الأكسجين، مثل داخل بعض البراكين.[53]
يوجد الألومنيوم في العديد من المعادن مثل معادن الأكاسيد أو السيليكات؛ وهو يدخل في تركيب الفلسبار، وهي أكثر مجموعات المعادن شيوعاً في القشرة الأرضية، على شكل ألومينوسيليكات. تدخل الألومينوسيليكات في تركيب الصلصال (الغضار) وصخور النايس والغرانيت. يوجد الألومنيوم على سبيل المثال في معادن البيريل والكريوليت والغارنيت والإسبينل والفيروز.[54] يوجد أكسيد الألومنيوم Al2O3 (الألومينا) طبيعياً على شكل معادن معروفة،[55][56] مثل السامور (أو القرند)، وهو من المعادن الصلبة مرتفعة درجة الانصهار. عندما يكون القرند مشوباً بآثار من فلزات انتقالية مثل الكروم أو الحديد يتشكل حينها الياقوت الأحمر والأزرق، على الترتيب.[57][56] توجد أيضاً أكسيدات هيدروكسيدية للألومنيوم (AlO(OH، والمعدنان الرئيسيان الحاويان على هاته الصيغة هما البوميت والدياسبور؛ أما أشهر معادن الهيدروكسيدات الثلاثية الرئيسية فهو الجبسيت، والذي يوجد على أشكال متعددة.[56]
مع أن الألومنيوم هو فلز شائع ومنتشر وعلى نطاق واسع، إلا أن ليس كل معادن الألومنيوم تعتبر مصادراً اقتصادية للمعدن. ينتج فلز الألومنيوم بشكل شبه كامل تقريباً من معدن خام البوكسيت AlOx(OH)3-2x. يوجد البوكسيت نتيجة تجوية أديم الأرض التي تحتوي على نسبة قليلة من الحديد والسيليكا في ظروف مناخية مدارية.[58] وتوجد كميات كبيرة من البوكسيت في أستراليا، والبرازيل، وغينيا، وجامايكا ولكن مناجم المعدن الخام الرئيسية هي في غانا، واندونيسيا، وجامايكا، وروسيا، وسورينام[59]. ويصهر المعدن الخام أساسا في أستراليا والبرازيل وكندا والنرويج وروسيا والولايات المتحدة. ونظراً لأن عملية الصهر هي عملية كثيفة الاستخدام للطاقة، فإن المناطق التي يزيد فيها إمدادات الغاز الطبيعي (مثل دولة الإمارات العربية) أصبحت أماكن تكرير للألومنيوم.
الإنتاج
| البلد | الإنتاج (بآلاف الأطنان) |
|---|---|
| الصين | 36,000 |
| الهند | 3,700 |
| روسيا | 3,600 |
| كندا | 2,900 |
| الإمارات العربية المتحدة | 2,700 |
| أستراليا | 1,600 |
| البحرين | 1,400 |
| النرويج | 1,300 |
| الولايات المتحدة | 1,100 |
| السعودية | 900 |
| آيسلندا | 850 |
| الإجمالي العالمي | 64,000 |
يستحصل الألومنيوم صناعياً من أكسيده، حيث يختزل إلى الفلز عند درجات حرارة مرتفعة. تعد عملية إنتاج الألومنيوم عملية مستهلكة جداً للطاقة الكهربائية؛ لذلك يعمد المنتجون إلى انتقاء مواقع الصهر بحيث تكون مصادر الطاقة وفيرة وزهيدة الثمن نسبياً.[61] وفق بيانات سنة 2019 تتصدر الصين الدول المنتجة للألومنيوم، تليها الهند وروسيا وكندا والإمارات العربية المتحدة.[60]
حسب تقييمات دولية فإن الاستهلاك العالمي من الألومنيوم يقدر بحوالي 80 كغ بالنسبة لكل فرد؛ ويتمثل ذلك الاستهلاك على هيئة سيارات أو إنشاءات معدنية أو بالإلكترونيات إلخ؛ وهو يتفاوت بين الدول المتقدمة (350-500 كغ) عن تلك التي في طور التقدم (35 كغ).[62]
عملية باير
تتضمن عملية باير تجويل البوكسيت إلى الألومينا (أكسيد الألومنيوم)؛ حيث يجانس ويطحن، ثم تمزج الردغة (الروبة) الناتجة مع محلول ساخن من هيدروكسيد الصوديوم؛ ثم يترك المزيج الناتج ليتفاعل تحت الضغط والحرارة مما يؤدي إلى حل هيدروكسيد الألومنيوم في البوكسيت، ليستحصل على محلول تركيبه بشكل أساسي من [−Al(OH)4]؛ في حين أن الشوائب المتبقية تفصل على شكل مركبات راسبة غير منحلة.[63]
بعد التفاعل تترك الروبة الناتجة، لتبرد ويخفف عنها الضغط وتفصل الرواسب وتطرح؛ ثم تضاف كميات صغيرة من نوى بلورات هيدروكسيد الألومنيوم إلى الوسط، مما يسبب ترسب هيدروكسيد الألومنيوم:
تجمع البلورات الصغيرة من هيدروكسيد الألومنيوم كي تستخدم كنوى تبلور فيما بعد؛ أما البلورات الكبيرة الخشنة فتحول إلى الألومينا بالتسخين:
أما المحلول المتبقي فيبخر، ثم ينقى إن اقتضت الحاجة، ويعاد تدويره.[63]
عملية هول-هيرو

تتصمن عملية هول-هيرو تحويل الألومينا المستحصلة وفق عملية باير إلى فلز الألومنيوم؛ حيث تذاب في مزيج من مصهور الكريوليت Na3AlF6 مع فلوريد الكالسيوم عند درجات حرارة تتراوح بين 950-980°س؛ ثم يخضع المزيج إلى عملية تحليل كهربائي. نتيجة لسلسلة الخطوات تلك يترسب مصهور الألومنيوم إلى القعر حيث يزال ويصب في قوالب على شكل كتل من الألومنيوم الخام، غالباً على شكل قضبان، من أجل المعالجات اللاحقة.[64] تكون المصاعد (الأنودات) في خلايا التحليل الكهربائي مصنوعة من الغرافيت النقي، وهي بذلك مقاومة للتآكل الذي تسببه الفلوريدات، كما تخضع تلك المصاعد غالباً إلى معالجة حرارية قبل الاستخدام؛ أما المهابط (الكاثودات) فهي مصنوعة من الأنثراسيت. ينبغي أن تستبدل الأقطاب الكهربائية عند استهلاكها، وعادة ما يبلغ العمر الافتراضي للخلايا بين 2-6 سنوات.[64]
يكون الألومنيوم الناتج وفق عملية هول-هيرو مرتفع النقاوة (أكثر من 99%)؛ ورغم ذلك يمكن أن تجرى عمليات تنقية كهربائية لاحقة وفق عملية هوبس [ملاحظة 3]، والتي تتضمن التحليل الكهربائي لمصهور الألومنيوم مع كهرل من فلوريدات الألومنيوم والصوديوم والباريوم، بحيث يستحصل في النهاية على ألومنيوم ذي نقاوة أكثر من 99.99%.[64][65]
تستهلك القدرة الكهربائية حوالي 20-40% من تكاليف إنتاج الألومنيوم، وذلك حسب موقع الإنتاج؛ وتستهلك العملية في الولايات المتحدة الأمريكية حوالي 5% من الطاقة الكهربائية المولدة.[44] إذ يحتاج كل كيلوغرام من الألومنيوم الخام ما بين 12.9 إلى 17.7 كيلوواط ساعي من الطاقة الكهربائية.[66] هناك سعي للبحث عن بدائل أوفر، ولكن ذاك لم يكلل بالنجاح.[64] فعلى سبيل المثال، جرى اقتراح استخراج أكسيد الألومنيوم من معادن الألومينوسيليكات، إلا أن الجدوى الاقتصادية لم تكن مرتفعة.[67]
إعادة التدوير
من الممكن أن يخضع الألومنيوم إلى عمليات إعادة تدوير، وتلك أضحت من العمليات المهمة صناعياً التي بدأت تزداد أهميتها مع مرور الوقت. فلم تكن لعمليات إعادة التدوير الألومنيوم أهمية في بدايات إنتاجه، ولكن مع ازدياد الاستهلاك في أواخر ستينيات القرن العشرين، وخاصة على شكل عبوات للمشروبات الغازية، ارتفعت دراية ووعي أهمية إعادة التدوير لدى العامة.[68] تتضمن عمليات إعادة تدوير الألومنيوم إجراء صهر للخردة، وهي عملية تتطلب في هذه الحالة مجرد 5% من الطاقة اللازمة لإنتاج الألومنيوم من خاماته، على الرغم من أن جزءاً مهماً، يقارب حوالي 15% من الكمية المعاد تدويرها، يفقد على هيئة رماد يدعى زغل (أو كدارة)؛[69] ولكن يمكن التقليل من تلك النفايات الناتجة إلى نسبة دون 1% باستخدام مصهر مكدّس [ملاحظة 4].[70] تستخدم نفايات الألومنيوم تلك على شكل مادة مالئة في الأسفلت والخرسانة.[71]
النظائر
عملياً يوجد هنالك نظير واحد مستقر للألومنيوم، وهو النظير ألومنيوم-27 27Al، والذي يشكل حوالي 99% من الوفرة الطبيعية لهذا العنصر في الطبيعة؛ بالتالي يمكن اعتبار الألومنيوم بأنه عنصر أحادي النويدة. لنظير الألومنيوم 27Al فائدة كبيرة في تقنية الرنين المغناطيسي النووي (NMR)، إذ أن له حساسية مرتفعة.[56]
يوجد هنالك نظير طبيعي مشع للألومنيوم، وهو ألومنيوم-26 26Al والذي لديه عمر نصف مقداره 7.2 × 105 سنة، ولكنه نادر الوجود في الأرض، لأنه اضمحل إشعاعياً قبل تشكل المجموعة الشمسية.[72] يمكن أن تتشكل كميات ضئيلة من النظير 26Al انطلاقاً من الآرغون في غلاف الأرض الجوي من التشظي الذي تسببه بروتونات الأشعة الكونية. تفيد النسبة بين 26Al إلى نظير البيريليوم 10Be في التأريخ الإشعاعي للعمليات الجيولوجية، التي تقع فتراتها الزمنية في مجال يتراوح بين 105 إلى 106 سنة، وخاصة في عمليات النقل والترسب والطمر والتعرية.[73] يظن الكثير من الباحثين في مجال الأحجار النيزكية أن الطاقة المتحررة من اضمحلال 26Al مانت مسؤولةً عن انصهار وتباين بعض الكويكبات بعد تشكلها قبل 4.5 بليون سنة خلت.[74]
بخلاف النظير ألومنيوم-26، فإن باقي نظائر الألومنيوم المشعة لها عمر نصف أقل من سبع دقائق، ومعظمها أقل من ثانية واحدة؛ فعلى سبيل المثال يضمحل النظير ألومنيوم-23 بعمر نصف مقداره 0.13 ثانية.[75] على العموم فإن للألومنيوم اثنان وثلاثون نظيراً معروفاً؛ تتراوح أعداد الكتلة لها من 22Al إلى 43Al ، مع وجود أربعة متصاوغات نووية.[76]
الخواص الفيزيائية

البنية الذرية
يوجد في ذرة الألومنيوم 13 إلكترون، وهي موزعة على الشكل Ne] 3s2 3p1]؛[77] مع وجود ثلاثة إلكترونات تكافؤ في الغلاف السطحي. وفقاُ لذلك، فإن مجموع طاقات التأين الثلاث الأولى للألومنيوم أقل بكثير من قيمة طاقة التأين الرابعة لوحدها.[78] من السهل على الألومنيوم أن يتخلى عن الإلكترونات في الغلاف السطحي ليشكل أيون الألومنيوم ثلاثي التكافؤ. تبلغ قيمة كهرسلبية الألومنيوم 1.61 على مقياس باولنغ.[79] يبلغ نصف القطر الذري للألومنيوم 143 بيكومتر؛[80] وعند نزع إلكترونات التكافؤ يتم الحديث عن نصف القطر الأيوني، والذي يبلغ مقدار 39 بيكومتر بالنسبة لذرة رباعية التناسق، و53.5 بيكومتر بالنسبة لذرة سداسية التناسق.[80]
عند ظروف قياسية من الضغط ودرجة الحرارة تترتب ذرات الألومنيوم وفق نظام بلوري مكعب مركزي الوجه، وتكون مترابطة وفق رابطة فلزية تؤمنها الإلكترونات الخارجية.[81] يلاحظ هذا التكوين البلوري في العديد من الفلزات الأخرى مثل الرصاص والنحاس؛ ويناظر حجم وحدة الخلية في الألومنيوم ما يوجد في الفلزات الأخرى.[81] تبلغ قيمة ثابت الشبكة البلورية في الألومنيوم مقدار 0.404 نانومتر؛[82] وذلك يعادل أربع وحدات صيغة في كل وحدة خلية.[83] تظهر عيوب فراغية في البنية البلورية عند ارتفاع درجات الحرارة إلى حوالي 500 °س؛ وهي تزداد عندما يروى الألومنيوم بشكل مفاجئ.[84] لا يشاطر الألومنيوم الخواص البنيوية مع باقي عناصر مجموعته؛ فطاقات التأين في البورون مرتفعة بالشكل الذي يحد من الفلزنة؛ والثاليوم لديه بنية سداسية ذات تعبئة متراصة؛ في حين أن بنية الإنديوم والغاليوم مختلفة عن سابقتيهما وغير متراصة. يما أن الإلكترونات المتوفرة للرابطة الفلزية قليلة، فإن فلز الألومنيوم طري ولديه نقطة انصهار منخفضة نسبياً ولديه مقاومة كهربائية منخفضة، وتلك ميزات مشتركة في الفلزات بعد الانتقالية.[85]
الخواص الفلزية
الألومنيوم فلز خفيف الوزن وذو مظهر يتراوح بين الفضي والرمادي الداكن بحسب خشونة السطح؛ وهو أحد المعادن القليلة التي تحافظ على انعكاسها الفضي الكامل عندما تكون بشكل مسحوق دقيق، مما يجعله مكوناً هاماً جداً في الطلاءات الفضية. كما يمكن لطبقة رقيقة من الألومنيوم أن تعكس جزءاً أعظمياً من الضوء المرئي؛[86] وهي تعكس أكثر من 98% من طيف الأشعة تحت الحمراء في المجال المتوسط والبعيد.[87] بالإضافة إلى ذلك، فإن لمرآة الألومنيوم أعلى انعكاس من أي فلز عند أطوال موجات (200-400 نانومتر) (في مجال الأشعة فوق البنفسجية) وعند 3000- 10000 نانومتر (في مجال الأشعة تحت الحمراء)، في حين أن القصدير والفضة فقط يتفوقان عليه في انعكاس مجال الضوء المرئي 400-700 نانومتر.[88] الألومنيوم هو عاكس جيد للإشعاع الشمسي، وخاصة عندما تتشكل الطبقة الأكسيدية المخملة على سطحه.[89]
إن الألومنيوم فلز قابل للسحب والطرق؛[50] وهو سهل التشغيل، والسبك، والبثق، ويمكن قولبته بشكل سهل نسبياً.[90] تبلغ كثافة الألومنيوم مقدار 2.70 غ/سم3،[91] وهي ثلث كثافة الفولاذ، وهي أخف بكثير من كثافة أغلب الفلزات المعروفة، كما أن الفلزات ذات الكثافة الأخف من اللومنيوم هي من مجموعة الفلزات القلوية والفلزات القلوية الترابية، وتلك أغلبها ذات نشاط كيميائي كبير مما يصعب التعامل بها.[92] إن كثافة الألومنيوم المنخفضة ومتانته يسهل من تمييز القطع المصنوعة منه عن غيرها لخفتها؛[93] كما أن تلك الميزات جعلت منه فلزاً مهماً في بناء الهياكل المعدنية وفي العديد من الصناعات التطبيقية.[94] الألومنيوم هو موصل جيد للحرارة والكهرباء، وموصليته حوالي 60% من موصلية النحاس؛ إلا أن لديه مجرد 30% من كثافته.[95] يمكن للألومنيوم أن يكون موصلاً فائقاً، مع درجة حرارة حرجة للتوصيل الفائق 1.2 كلفن، ومجال مغناطيسي حرج حوالي 100 غاوس.[96] للألومنيوم مغناطيسية مسايرة، أي أنه لا يتأثر بالحقول المغناطيسية الساكنة. لكن الموصلية الكهربائية المرتقعة له تجعله قابلاً للتأثر بالحقول المغناطيسية المتغيرة عبر حث التيارات الدوامية.[97]
تعود قدرة الألومنيوم الممتازة على مقاومة التآكل إلى الطبقة السطحية الرقيقة غير النفوذة والمتماسكة من أكسيد الألومنيوم التي تتشكل عندما يتعرض الفلز للهواء، مما يمنع استمرار عملية الأكسدة. أقوى سبائك الألومنيوم تكون أقل مقاومة للتآكل بسبب التفاعلات الجلفانية مع سبائك النحاس.[98] وهذه المقاومة للتآكل عادة ماتنخفض انخفاضاً كبيراً عندما يوجد عدة محاليل ملحية، لا سيما بوجود معادن مختلفة. إن الألومنيوم النقي طري نسبياً، لذلك تستخدم سبائك الألومنيوم عادة في النطبيقات الصناعية بسبب ارتفاع قيم المتانة والجساءة والصلادة لديها.[99] تبلغ قيمة مقاومة الشد للألومنيوم 45 نيوتن/مم²، في حين أن معامل القص يبلغ 25 كيلو نيوتن/مم²؛[100] أما مقاومة الخضوع للألومنيوم النقي فتبلغ مقدار 7-11 ميغا باسكال، في حين أن قيمتها لسبائك الألومنيوم تتراوح من 200 إلى 600 ميغاباسكال.[101]

سبائك الألومنيوم
من السهل على الألومنيوم أن يشكل سبائك مع العديد من الفلزات الأخرى، وأشهر تلك العناصر التي يسبك معها هي النحاس والزنك والمنغنيز والمغنيسيوم والسيليكون.[102] ولذلك توجد عدد معتبر من سبائك الألومنيوم، إذ أن سبكه يحسن بشكل واضح من خواصه الميكانيكية، خاصة بعد المعالجة الحرارية. كما يشكل الألومنيوم العديد من المركبات بين الفلزية.[103] تسهل المعالجة الميكانيكية لسبائك الألومنيوم، حيث يمكن أن تخضع للدرفلة والتطريق؛ كما يسهل قولبتها.[91][104] ولذلك فإن أغلب تطبيقات الألومنيوم هي لسبائكه، مثلما هو الحال في رقائق الألومنيوم وعبوات المشروبات.[105] من الأمثلة أيضاً على سبائك الألومنيوم كل من دورالومين وكذلك السبائك التالية المذكورة وفق رموز عناصرها: AlCu و AlMn و AlMg و AlMgSi و AlCuMg و AlZnMg.
الخواص الكيميائية
يجمع الألومنيوم بين خواص الفلزات قبل وبعد الانتقالية. فمن حيث البنية يشبه الفلزات قبل الانتقالية من وجود عدد محدود من الإلكترونات المتوفرة من أجل نشكيل الرابطة الفلزية؛ ولكنه مثل العناصر الأثقل في مجموعته فإن الخواص الفيزيائية تكون شبيهة بالفلزات بعد الانتقالية، بوجود مسافات بين ذرية أطول من المتوقع.[85] يميل أيون الألومنيوم 3+Al إلى تشكبل روابط تساهمية؛[106] وهذا السلوك يشبه ما لأيون البيريليوم 2+Be، وذلك مثال واضح على العلاقة القطرية.[107]
لا يحوي الألومنيوم على إلكترونات d داخلية على العكس من العناصر الأثقل في مجموعته، بالتالي تحجب الإلكترونات الداخلية إلكترونات التكافؤ بشكل شبه كامل تقريباً؛ ولذلك فإن الألومنيوم هو العنصر الأكثر كهرجابية في مجموعة البورون.[106] لا توجد صفات تشاركية كبيرة مع البورون فالأخير شبه فلز، ولكن مركبات AlX3 متساوية إلكترونياً مع مركبات BX3، وتشترك معها بأنها أحماض لويس وتشكل نواتج إضافة بسهولة.[108] بالإضافة إلى ذلك، فإن ما يميز كيمياء البورون هو تشكيله لبنى متعددة السطوح، وتلك يشكلها الألومنيوم أيضاً في سبائكه شبه البلورية، بما فيها Al–Zn–Mg class.[109]
للألومنيوم ألفة كيميائية مرتفعة تجاه الأكسجين، مما يجعل استخدامه ملائماً على شكل مختزل في تفاعل الثرميت. يستطيع مسحوق ناعم من الألومنيوم أن يتفاعل بعنف عند التماس مع الأكسجين السائل. في الأحوال العادية يشكل الألومنيوم طبقة من الأكسيد على السطح، تبلغ سماكتها حوالي 5 نانومتر عند درجة حرارة الغرفة؛[110] وهي تقيه من حدوث تفاعلات تآكل لاحقة بسبب الأكسجين أو الماء أو الأحماض الممدة، وتدعى نلك الظاهرة بالتخميل.[106][111] تمنح هاته الخاصة الألومنيوم العديد من الميزات، مثل استخدام مساحيقه في الطلاءات فضية اللون؛[112] وفي صناعة حاويات الأحماض المخبرية الممددة.[64]
يتفاعل الألومنيوم في حمض الهيدروكلوريك المركز مع الماء مما يؤدي إلى انطلاق غاز الهيدروجين؛ كما يتفاعل مع محاليل هيدروكسيد الصوديوم أو هيدروكسيد البوتاسيوم المائية ليشكل الألومينات الموافقة.[113] ينحل الألومنيوم في الماء الملكي؛[64] وهو يتآكل بسبب الكلوريدات المنحلة؛[113] وذلك وفق المعادلة:
ويحدث التآكل خاصة في المناطق التي تكون فيها طبقة الأكسيد متضررة، حيث يحفز ذلك على ظهور تنقر على السطح.
كما تتأثر طبقة الأكسيد الواقية على الألومنيوم بالتماس مع الزئبق حيث تتشكل ملغمة؛ وكذلك تتأثر بأملاح بعض الفلزات الكهرجابية.[106] لذلك فإن أقوى سبائك الألومنيوم هي أقل مقاومة لتفاعلات الجلفنة عندما يكون مسبوكاً مع النحاس.[101] يتفاعل الألومنيوم مع أغلب اللافلزات عند التسخين، مشكلاً مركبات مثل نتريد الألومنيوم AlN وكبريتيد الألومنيوم Al2S3 وهاليدات الألومنيوم AlX3؛ كما يشكل الألومنيوم طيفاً واسعاً من المركبات بين الفلزية.[106]
اللاعضوية
في الأغلبية العظمى من مركباته الكيميائية يكون الألومنيوم في حالة الأكسدة +3؛ أما العدد التناسقي فهو متفاوت فيها، ولكن غالباً ما يكون الأيون 3+Al إما سداسي أو رباعي التناسق. من ناحية أخرى، فإن أغلب مركبات الألومنيوم الثلاثي هي عديمة اللون.[106] هناك عدد قليل من المركبات الكيميائية التي يكون فيها الألومنيوم بحالة أكسدة +1، وهي غالباً هاليدات أحادية مثل أحادي فلوريد الألومنيوم AlF، وأحادي كلوريد الألومنيوم AlCl وكذلك أحادي البروميد AlBr وأحادي اليوديد AlI؛ وتلك المركبات توجد فقط في الطور الغازي؛[114] وهي غير مستقرة.[115]
يوجد أيون الألومنيوم 3+Al في المحاليل المائية على الشكل 3+[Al(H2O)6]، والذي تبلغ قيمة ثابت تفكك الحمض pKa لديه مقدار 10−5 تقريباً.[56] تكون تلك المحاليل حمضية، لأن الكاتيون فيها يكون قادراً على أن يمنح بروتونات وأن يتحلمه لاحقاً إلى أن يتشكل راسب من هيدروكسيد الألومنيوم Al(OH)3. يكون هذا الأمر مفيداً في أحواض الترسيب في محطات معالجة المياه، حيث تتجمع نوى الرواسب على شكل مستعلق مما يسهل من إزالتها. عند زيادة قيمة pH الوسط فإن ذلك يؤدي إلى انحلال الهيدروكسيد بسبب تشكل أيون الألومينات −[Al(H2O)2(OH)4].
لمركب هيدروكسيد الألومنيوم Al(OH)3 خواص مذبذبة (أمفوتيرية)، فهو قادر على أن ينحل في الأحماض والقواعد؛[106] وتلك سمة للكاتيونات القاعدية الضعيفة القادرة على تشكيل هيدروكسيدات غير منحلة، ويكون للأنواع الكيميائية المميهة القدرة على منح بروتوناتها. بالتالي ووفق هذا السياق فإن أملاح الألومنيوم تعطي عند تفاعلها مع الأحماض الضعيفة مركب الهيدروكسيد المميه وهيدريد اللافلز الموافق، فعلى سبيل المثال يعطي كبريتيد الألومنيوم مركب كبريتيد الهيدروجين؛ كما أنه لا يمكن الحصول على كربونات الألومنيوم على شكل ملح صلب مستقر؛ كما لا تحدث عملية حلمهة كاملة لأملاح الألومنيوم مع الأحماض القوية. لذلك لا يمكن الحصول على الأملاح اللامائية من مجرد تسخين الهيدرات الموافقة، فعلى سبيل المثال، فإن كلوريد الألومنيوم المائي سداسي الهيدرات لا يوجد على الشكل النمطي AlCl3·6H2O، ولكن على الشكل Al(H2O)6]Cl3]، حيث تكون الروابط Al–O قوية لدرجة أن التسخين يكون غير كافياً لتكسير الروابط وإتاحة الفرصة لتشكيل روابط Al–Cl بدلاً عنها.[106]
إن جميع هاليدات الألومنيوم الثلاثية معروفة؛ ولكن في فلوريد الألومنيوم AlF3، وعلى العكس من بنى ثلاثيات الهاليد الأثقل، يكون الألومنيوم سداسي التناسق، الأمر الذي يشرح عدم تطايره وعدم انحلاليته، بالإضافة إلى ارتفاع قيمة الحرارة القياسية للتكوين. ينصهر AlF3 عند 1290 °س، ويحضر من تفاعل أكسيد الألومنيوم مع فلوريد الهيدروجين عند حوالي 700 °س.[114] تحضر الهاليدات الأثقل للألومنيوم من تفاعل الفلز مع الهالوجين الموافق؛ ويكون فيها العدد التناسقي للألومنيوم رباعياً، وتكون بنيتها ثنائية أو متعددة الوحدات. فلمركب كلوريد الألومنيوم AlCl3 بنية بوليميرية ذات طبقات عندما يكون دون نقطة انصهاره 192.4 °س؛ أما عند درجات حرارة أعلى تصبح البنية على هيئة جزيئات منفردة من AlCl3 ذات بنية مستوية ثلاثية شبيهة ببنية ثلاثي كلوريد البورون BCl3؛ في حين يوجد كل من بروميد الألومنيوم ويوديد الألومنيوم على الشكل الثنائي Al2X6 في الأطوار الثلاثة للمادة، ولا يظهر تحول في خواص البنية عند تغير الطور.[114] تتميز هاليدات الألومنيوم بأنها من أحماض لويس، وهي قادرة على تشكيل نواتج إضافة، لذلك يكثر استخدامها على شكل حفازات في تفاعلات صناعية مهمة مثل تفاعل فريدل-كرافتس وغيره من تفاعلات التحضير الصناعية.[114]
للألومنيوم أكسيد واحد مستقر Al2O3، وهو يعرف بالاسم الشائع «ألومينا».[116] ومن الكالكوجينيدات المستقرة له كل من كبريتيد الألومنيوم Al2S3 وسيلينيد الألومنيوم Al2Se3 وكذلك تيلوريد الألومنيوم Al2Te3؛ وتحضر هذه المركبات الأخيرة من تفاعل العناصر المكونة الموافقة عند درجات حرارة تتجاوز 1000 °س. أما مع عناصر مجموعة النتروجين فيشكل الألومنيوم كل من نتريد الألومنيوم AlN وفوسفيد الألومنيوم AlP وزرنيخيد الألومنيوم AlAs، بالإضافة إلى إثميد الألومنيوم AlSb؛ وهي مركبات معروفة وتتميز بخواصها شبه الموصلة؛ وهي تتشكل أيضاً من تفاعل العناصر الموافقة عند درجات حرارة مرتفعة.[117]
هناك أيضاً مركب هيدريد الألومنيوم، وهو مركب ذو بنية بوليميرية AlH3)n؛[118] ولا توجد له تطبيقات كثيرة؛ وذلك على العكس من مركب هيدريد ألومنيوم الليثيوم LiAlH4، والذي يصنف ضمن الكواشف الكيميائية المهمة، حيث أنه من المختزلات الجيدة في الكيمياء العضوية.؛ وهو يحضر من تفاعل هيدريد الليثيوم مع كلوريد الألومنيوم.[118]
العضوية
يوجد للألومنيوم عدد من المركبات العضوية؛ والتي يحمل منها الصيغة العامة AlR3 وكذلك Al2R3Cl3.[119] تعد مركبات ثلاثي ألكيلات وثلاثي أريلات الألومنيوم من المركبات المتطايرة وذات تفاعلية كيميائية كبيرة، بحيث من السهل عليها أن تحترق وأن تتفاعل مع الماء. عادة ما تكون مركبات الألومنيوم العضوية على شكل ثنائيات وحدات، مثل مركب ثلاثي ميثيل الألومنيوم؛ في حين أن ثلاثي إيزوبوتيل الألومنيوم يوجد على هيئة مزيج متوازن كيميائياً بين أحادي (مونومير) وثنائي الوحدات (ديمير).[120][121] تعد مركبات الألومنيوم العضوية من أحماض لويس القاسية، وهي قادرة على أن تشكل نواتج إضافة بسهولة. لذلك تستخدم هذه المركبات في الصناعة من أجل تفاعلات إقحام الألكين على هيئة حفاز تسيغلر-ناتا، والتي تؤمن تشكيل كحولات وألكينات أولية طويلة السلسلة وغير متفرعة، وكذلك في بلمرة الإيثيلين والبروبيلين. توجد أيضاً مركبات حلقية غير متجانسة للألومنيوم وكذلك معقدات تناسقية عنقودية تتضمن وجود روابط Al–N فيها.[120]
التحليل الكيميائي
توجد عدة وسائل تحليلية تقليدية للكشف عن أملاح الألومنيوم، منها:
- عن طريق أزرق الكوبالت
يمكن الكشف عن أملاح الألومنيوم بأسلوب تقليدي عن طريق تعريضها للهب مع محلول ممدد من نترات الكوبالت الثنائي Co(NO3)2 على قضيب من أكسيد المغنيسيوم (المغنيسيا)؛ حيث يتشكل حينها خضاب أزرق الكوبالت.
- عن طريق الكريوليت
لإجراء الكشف وفق هذا الأسلوب يجعل محلول العينة الحاوية على الألومنيوم قلوياً، كي يترسب هيدروكسيد الألومنيوم Al(OH)3. بعد ذلك يرشح الراسب ثم تضاف عليه بضعة قطرات من الفينول فثالين، ثم يغسل بحيث لا تبقى أية آثار من اللون الأحمر التي سببها الفينول فثالين. عند إضافة مسحوق فلوريد الصوديوم NaF الصلب على الراسب، تسبب أيونات الهيدروكسيد، التي تحررت جراء تشكل الكريوليت [Na3[AlF6، ظهور اللون الأحمر مجدداً.
- عن طريق المورين
لإجراء الكشف وفق هذا الأسلوب يعالج محلول العينة الحاوية على الألومنيوم مع حمض الهيدروكلوريك؛ ثم تضاف كميات فائضة من هيدروكسيد البوتاسيوم بحيث يصبح الوسط قلوياً. تضاف بعد ذلك إلى كمية من المحلول كمية مكافئة من محلول صباغ المورين؛ ثم يحمض الوسط بواسطة حمض الخليك المركز، مما يؤدي إلى ظهور خاصة تفلور أخضر تحت الأشعة فوق البنفسجية عند طول موجة 366 نانومتر. ويمكن التاكد من عملية الكشف تلك لدى اختفاء ظاهرة التفلور عند إضافة حمض الهيدروكلوريك مجدداً.[122]
الدور الحيوي
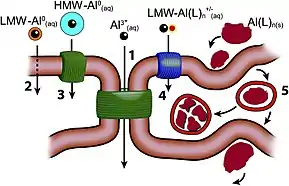
على الرغم من الانتشار الواسع للألومنيوم في القشرة الأرضية؛ إلا أنه لا يعرف له أي دور حيوي.[64] عند قيمة pH تتراوح بين 6–9، وهي قيمة pH توافق أغلب المياه الطبيعية، فإن الألومنيوم يوجد على شكل هيدروكسيد، وهو راسب غير منحل، لذلك فإنه لا يكون متوفراً، وتلك سمة تشترك بها أغلب العناصر التي لا يكون لها دور حيوي.[124]
في جسم الإنسان
يوجد في جسم الإنسان وسطياً حوالي 50-150 مغ من الألومنيوم؛[125] والكمية موزعة بشكل منتظم؛ وهو لا يصنف بالنسبة للإنسان ضمن العناصر الشحيحة الأساسية للوظائف الحيوية فيه.[126] يطرح جسم الإنسان القسم الأعظمي من الألومنيوم الذي قد يكون موجوداً في الغذاء، ولا يمتص في الجهاز الهضمي إلا بنسبة تتراوح بين 1-3 بالألف؛ ومنه يتوزع إلى الأنسجة بشكل رئيسي عبر بروتينات الترانسفرين.[60] يمكن أن ينقل الألومنيوم مثلاً على شكل أيون مشحون على شكل معقد مع الفوسفات؛[127] وتبلغ قيمة عمر النصف لأيونات الألومنيوم في الدم حوالي 8 ساعات.[60]
في النباتات
يصل الألومنيوم إلى النباتات عادة عن طريق الرشح من تربة القشرة الأرضية بفعل الأمطار؛ ويزداد ذلك الأمر خاصة بتأثير المطر الحمضي.[128] تعد ظاهرة تحمض التربة من العوامل المساعدة على ازدياد رشح الألومنيوم، إذ عندما تصبح قيمة pH الوسط أقل من 5 يمتص الألومنيوم من جذور النباتات على هيئة أيونات 3+Al؛ وهو أمر يؤذي نمو الجذور الدقيقة، خاصة عندما لا يكون للنبات القدرة على تحمل الألومنيوم فإنه يقع تحت إجهاد،[129] وذلك يؤثر سلباً على نمو الجذر ودوره الوظيفي.[130][131][132] من جهة أخرى، توجد بعض الأنواع النباتية المعدلة وراثياً مثل رشاد الصخر والسورغم والقادرة على تحمل ارتفاع نسبة الألومنيوم في التربة.[133][134][135][136]
| الغذاء | المحتوى[137][138] مغ/كغ |
|---|---|
| شاي (مجفف) | 385 |
| ورق الزعتر البري | 212 |
| الكاكاو والشوكولاتة | 100 |
| ورقيات السلطة | 28.5 |
| البقليات | 22.5 |
| الحبوب | 13.7 |
في الغذاء
توجد آثار زهيدة من الألومنيوم في الغذاء، وهي تتفاوت حسب المنشأ،[138] وتصل كميتها في المأكولات الطازجة بأقل من 5 ميليغرام لكل كيلوغرام (مغ/كغ).[139] بالمقابل قد يصل محتوى الألومنيوم في أوراق الشاي الأسود إلى 1042 مغ/كغ.[140]
قد يؤدي طهي الأغذية أو حفظها في أوعية من الألومنيوم أو رقائقه إلى زيادة أعظمية من امتصاص الألومنيوم تصل إلى 3.5 مغ/اليوم/الشخص؛ وهي قد تزداد في الأغذية الحمضية، مثل الملفوف المخمر، وذلك وفق تقييمات المعهد الألماني لتقييم المخاطر؛[ملاحظة 5][141] ولذلك يوصي بعدم استخدام الأوعية المصنوعة من الألومنيوم في طهي أو حفظ الأغذية الحمضية.[142]
من جهة أخرى، فإن المشروبات تحوي نسبة أعظمية من الألومنيوم تتراوح بين 0.2-0.4 مغ/ل؛ وهي بذلك لا تعد مصدراً للألومنيوم غذائياً.[139][141] عينت الهيئة الأوروبية لسلامة الأغذية مقدار 1 مغ لكل كغ من وزن الجسم بأنه الحد الأسبوع المسموح من الألومنيوم في الغذاء.[139][138] بالمقابل، فإن الألومنيوم قد يستخدم في بعض الأحيان ضمن الإضافات الغذائية، وهو يملك رقم إي E173، ولكن ذلك محصور في مجال تزيين الحلويات.[143]
الأثر البيئي


من الآثار البيئية المترتبة من إنتاج الألومنيوم هو ظهور مساحات كبيرة بعد استخراج البوكسيت، والتي تحتاج إلى إعادة إنبات بعد ذلك؛ إذ لإنتاج طن واحد من الألومنيوم يلزم حوالي 4 أطنان من البوكسيت؛ وحفره يعطي عشرة أطنان من الغطاء الفوقي.[144] تؤدي عملية باير إلى تراكم مخلفات خام البوكسيت القلوية، والتي تعرف أيضاً باسم «الطمي الأحمر».[145] تأتي الإشكالية أنه من الصعب الاستفادة من تلك المخلفات، وهي تسبب مشاكل بيئية بحد ذاتها. من جهة أخرى، تعد عملية إنتاج الألومنيوم من العمليات المستهلكة جداً للطاقة؛ إذ تتطلب عملية التحليل الكهربائي لإنتاج كيلوغرام واحد من الألومنيوم استهلاك حوالي 12.9-17.7 كيلوواط ساعي.[66] كما تنتج العملية حوالي 10 كغ من غاز ثنائي أكسيد الكربون CO2. تساعد عمليات إعادة تدوير الألومنيوم على التخفيف من أثر مخلفات هذا الفلز، وهي في ازدياد مستمر؛ كما يساعد استخدام تركيبات خفيفة من الألومنيوم، على شكل رغوة على سبيل المثال، في التخفيف من انبعاثات من استهلاك المواد والطاقة.
يمكن أن يرتفع مستوى الألومنيوم بالقرب من مواقع التعدين بسبب عمليات الإنتاج؛ كما يمكن أن تتسرب كميات صغيرة من الألومنيوم إلى البيئة عند مواقع توليد الطاقة العاملة على الفحم أو بالقرب من مرمدات النفايات.[146] عادة ما يغسل الألومنيوم العالق في الهواء بالمطر أو أن يترسب إلى الأرض، ولكن هناك احتمالية أن تبقى بعض الجسيمات معلقة في الهواء لفترة طويلة.[146]
يعد الهطول الحمضي العامل الرئيسي الطبيعي الذي يحرك الألومنيوم من مصادره الطبيعية،[147] وهو كذلك أيضاً المسبب الرئيسي للآثار البيئية للألومنيوم؛[148] على الرغم من ذلك، فإن المسبب الرئيسي لوجود الألومنيوم في المياه العذبة والمالحة هو العمليات الصناعية التي تحرر الألومنيوم إلى الهواء.[147] يكون لوجود الألومنيوم في الماء أثراً ساماً على السمك، عندما يكون الماء حمضياً، إذ يمكن للألومنيوم أن يترسب على الخياشيم؛[149] الأمر الذي يسبب خللاً في التنظيم الأسموزي (التناضحي) لديها.[148] من الممكن نظرياً أن تخل معقدات الألومنيوم العضوية باستقلاب الحيوانات والطيور لدى امتصاصها؛ إلا أن هذا الأمر من النادر حدوثه عملياً.[148]
لا يؤثر وجود الألومنيوم في التربة المعتدلة على نمو النباتات؛ إلا أن ارتفاع تركيز أيونات الألومنيوم 3+Al في التربة الحمضية يعد ساماً ومن العوامل الرئيسية التي تحد من نمو النبات، حيث يؤثر على نمو الجذر ودوره الوظيفي.[150] من التبعات البيئية الأخرى المتعلقة بإنتاج الألومنيوم ارتفاع انبعاثات الغازات الدفيئة إلى المحيط الحيوي؛[151] وأخطر تلك الغازات هي الفلوروكربونات المنبعثة من عمليات الصهر؛[151] كما يساعد غاز ثنائي أكسيد الكبريت على تشكل المطر الحمضي.[151]
الاستخدامات
بلغ الإنتاج العالمي من اللألومنيوم سنة 2016 58.8 مليون طن متري، وهو بذلك يأتي في المرتبة الثانية من الفلزات المعدنية بعد الحديد من حيث كمية الإنتاج (1.231 مليون طن متري).[152][153]
تشمل التطبيقات الرئيسية للألومنيوم كل من صناعة وسائل النقل المختلفة على أنواعها من الطائرات والعربات والسيارات والدراجات إلى غير ذلك؛ بالإضافة إلى صناعة العبوات والرقائق للصناعات الغذائية؛ وكذلك في الإنشاءات المعدنية لصناعة النوافذ والأبواب؛ وفي الصناعات الميكانيكية والإلكترونية.[154]
صناعة الهياكل المعدنية

للألومنيوم صلابة بنيوية نوعية مرتفعة، بالمقارنة مع الفولاذ فإن الأجزاء الصناعية المصنوعة من الألومنيوم والتي لها نفس الصلابة تكون أقل وزناً بحوالي النصف، ولكنها ذات حجم أكبر، لأن كثافتها أخفض.[155] لذلك السبب يكثر استخدام الألومنيوم وسبائكه في صناعة الهياكل المعدنية المستخدمة في وسائل النقل، وخاصة صناعة الطائرات والمركبات الفضائية؛ وكذلك في صناعة هياكل السيارات والدراجات الهوائية. شكل قطاع صناعة العربات ووسائل النقل سنة 2010 حوالي 35% من الاستخدام العالمي للألومنيوم.[156][157]
- السيارات
يستخدم الألومنيوم وسبائكه بشكل كبير في صناعة قطع السيارات، ذلك بسبب خواصها الحرارية والميكانيكية (مثل قابلية السبك) الجيدة. يدخل الألومنيوم في تركيب هيكل السيارة ومكوناته مثل الأجنحة (الرفراف) وغطاء المحرك؛ وكذلك أيضاً في تركيب هيكل المحرك وقطعه مثل المكبس والأسطوانات ورأسها بالإضافة إلى هياكل علبة السرعة؛ وكذلك في تركيب مجموعة الحركة والموجهات العرضية وغيرها.[158] يستخدم الألومنيوم أيضاً في تركيب المنصات الذيلية الرافعة في مركبات الخدمة التجارية.[158]
- المقطورات
يدخل الألومنيوم أيضاً في تركيب المقطورات على السكك الحديدية، مما ساعد على التخفيف من وزن المقطورات التي تصنع بشكل رئيسي من الصلب (الفولاذ)، خاصة مع تطور وسائل اللحام القوسي مثل لحام الغاز الخامل-تنغستن واللحام قوسي بالمعدن والغاز.[159]
- الطائرات
تستخدم أنواع مختلفة من سبائك الألومنيوم، مثل مغناليوم ودورالومين، في صناعة هياكل الطائرات، بحيث أن حوالي 60% من كتلة الطائرة يتركب من الألومنيوم. وعادة ما تثبت القطع المصنوعة من الألومنيوم الداخلة في تركيب الطائرات بواسطة أساليب ميكانيكية (تثبيت بالبرشام)، ويتجنب استخدام اللحام لذلك الغرض.[160]
الصناعات الإلكترونية
- التوصيل الكهربائي

يصنف الألومنيوم ضمن الموصلات الكهربائية الجيدة، فهو يأتي في المرتبة الرابعة بعد الفضة والذهب والنحاس من حيث التوصيل الكهربائي. وهو غالباً ما يستخدم في التطبيقات التي يمثل فيها الوزن الكبير مشكلة، مثل خطوط الجهد العالي والمحطات الفرعية.[161] كما تستخدم الأسلاك المصنوعة من الألومنيوم المكسوة بالنحاس في التمديدات الكهربائية؛ من جهة أخرى يفضل النحاس على الألومنيوم في تركيب الأسلاك العلوية لأن قدرة التماس والانسحاب على السطح لدى النحاس أفضل.
- الصناعات الإلكترونية
للألومنيوم تطبيقات في الصناعات الإلكترونية نظراً للخواص الإلكترونية والحرارية الجيدة. فهو يدخل في تركيب الدارات المتكاملة والترانزستورات؛[162] إلى جانب المقاومية الضعيفة للألومنيوم خواص مميزة أخرى تشمل سهولة التصنيع باستخدام التنميش الجاف وكذلك الانتشار الضعيف للتيار في المواد العازلة. إلا أن النحاس يفضل على الألومنيوم أيضاً في مثل هذه التطبيقات.[162]
التعبئة والتغليف
في مجال التعبئة والتغليف يوجد للألومنيوم العديد من التطبيقات، فهو يستخدم في صناعة عبوات المشروبات والأغذية المعلبة، بالإضافة إلى صناعة رقائق الألومنيوم؛ وهو مفضل لمثل تلك التطبيقات بسبب خفة وزنه ومتانته وسهولة تصفيحه، وبسبب قدرته على تشكيل حاجز آمن عن العوامل الخارجية مثل الهواء والضوء.[163] يستخدم الألومنيوم أحياناً في صناعة الأواني والأوعية المختلفة، مثل إبريق الموكا لتحضير القهوة. يشكل مجال التعبئة والتغليف في أوروبا سنة 2017 حوالي 17% من استهلاك الألومنيوم.[164]
الإنشاءات الهندسية
يستخدم مسحوق ومعجون الألومنيوم في تصنيع الخرسانة خفيفة الوزن؛[165] كما تستخدم مركبات الألومنيوم اللاعضوية المختلفة مثل هيدروكسي كبريتات الألومنيوم، أو هيدروكسي فورميات الألومنيوم أو هيدروكسيد الألومنيوم اللابلوري من أجل تسريع تصلب الخرسانة.[166]
ينتشر استخدام الألومنيوم وسبائكه في الإنشاءات الهندسية، وذلك في هياكل النوافذ والأبواب؛ وكذلك بشكل رئيسي في واجهات المباني؛ ومن الأمثلة على ذلك متحف الحرب الإمبراطوري الشمالي في مدينة مانشستر الإنجليزية.

تطبيقات أخرى
- يستخدم الألومنيوم نظراً للانعكاسية المرتفعة له في بعض التطبيقات التي تتطلب وجود مرآة معدنية عاكسة، مثل الماسح الضوئي (السكانر) والكاميرات العاكسة وكذلك في المصابيح الأمامية للسيارات؛ وغيرها.
- يستخدم مسحوق الألومنيوم في تركيب المادة الدافعة في الصواريخ ذات الوقود الصلب؛[167] كما يدخل في تركيب الألعاب النارية.
- نظراً لقدرة الألومنيوم على الاختزال عند درجات حرارة مرتفعة تستخدم تفاعلات الألومنيوم الطاردة للحرارة من أجل استحصال الفلزات الأخرى في الصناعات التعدينية؛ وكذلك في مجال اللحام الطارد للحرارة.
- يكثر دخول الألومنيوم في تصنيع سبائك مختلفة ذات تطبيقات خاصة، مثل سبيكة مع التيتانينوم.[168]
المخاطر
تتميز أملاح الألومنيوم اللاعضوية بأنها غير غير سامة بشكل واضح، فعلى سبيل المثال تبلغ قيمة الجرعة المميتة الوسطية LD50 لمركب كبريتات الألومنيوم مقدار 6207 مغ/كغ (فئران، فموي)، والتي تكافئ 435 غ لشخص وزنه 70 كغ.[64] لا يصنف الألومنيوم ضمن الفلزات الثقيلة؛ كما لا تصنفه وزارة الصحة والخدمات الإنسانية الأمريكية ضمن المسرطنات.[147] لا توجد دلائل كافية تبين أن التعرض العادي للألومنيوم قد يمثل خطراً على صحة وسلامة الشخص البالغ؛[169] كما أن الدلائل المتوفرة لا تظهر وجود تأثير سمي للألومنيوم إذا لم تتجاوز الجرعة 40 مغ/اليوم لكل كيلوغرام من وزن جسم الإنسان.[147] تعد نسبة 10 ميكروغرام/الليتر من أيونات الألومنيوم في الدم من النسب المقبولة والتي لا تمثل خطورة؛ أما عندما يكون تركيز تلك الأيونات حوالي 60 ميكروغرام/الليتر فذلك يمثل خطورة على الجسم؛ في حين أن تركيز 200 ميكروغرام/الليتر يعد ذا تأثير سمي.[170] إن أغلب الألومنيوم المستهلك يغادر الجسم في البراز؛ وأغلب الجزء المتبقي الذي يدخل مجرى الدم يطرح عن طريق البول.[171]
يمكن للألومنيوم في حالات نادرة أن يسبب تلين العظام المقاوم للفيتامين د، وكذلك فقر الدم صغير الكريات المقاوم للإريثروبويتين، وخاصة لدى المرضى الذين لهم قصور كلوي.[147] يمكن أن يؤدي التناول المزمن لسيليكات الألومنيوم المميهة (للتحكم بالحموضة المعدية المفرطة) إلى ارتباط الألومنيوم بمحتويات الأمعاء وأن ينافس عناصر غذائية معدنية أخرى ويزيد من طرحها، مثل الحديد والزنك؛ بحيث أن جرعات مرتفعة تزيد عن 50 غ/اليوم يمكن أن تسبب فقر الدم.[147][172] هناك عدد من المخاطر المقترنة بارتفاع تركيز الألومنيوم في الدم؛ فهناك شك بوجود صلة وصل بين الألومنيوم وبين مرض آلزهايمر؛[173] ولكن الأبحاث المستمرة على عدة عقود لم تستطع إثبات وجود دليل على علاقة سببية بينهما.[174][175] من جهة أخرى، وجد أن الألومنيوم يزيد من التعبير الجيني المتعلق بالإستروجين في خلايا سرطان الثدي البشرية المنماة مخبرياً.[176] كما يترافق وجود الألومنيوم بتراكيز مرتفعة جداً مع حدوث تغير وظيفي في أداء الحاجز الدموي الدماغي.[177]
يؤدي التعرض المستمر إلى مسحوق الألومنيوم أو أبخرة لحام الألومنيوم إلى حدوث تليف رئوي؛[178] ناهيك عن المخاطر التي يمكن أن يسببها مسحوق الألومنيوم الناعم من حيث سهولة الاحتراق والتسبب بحدوث مخاطر مهنية.[179][180]
طالع أيضاً
هوامش
- Essai sur la Nomenclature chimique
- IUPAC
- Hoopes process
- stack melter
- Bundesinstitut für Risikobewertung BfR
المراجع
- Magnetic susceptibility of the elements and inorganic compounds, in Handbook of Chemistry and Physics 81st edition, CRC press.
- Drozdov 2007، صفحة 12.
- Clapham, John Harold; Power, Eileen Edna (1941). The Cambridge Economic History of Europe: From the Decline of the Roman Empire. CUP Archive. صفحة 207. ISBN 978-0-521-08710-0. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Drozdov 2007، صفحة 16.
- Setton, Kenneth M. (1976). The papacy and the Levant: 1204-1571. 1 The thirteenth and fourteenth centuries. American Philosophical Society. ISBN 978-0-87169-127-9. OCLC 165383496. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Drozdov 2007، صفحة 25.
- Weeks, Mary Elvira (1968). Discovery of the elements. 1 (الطبعة 7). Journal of chemical education. صفحة 187. ISBN 9780608300177. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Richards 1896، صفحة 2.
- Richards 1896، صفحة 3.
- Örsted, H. C. (1825). Oversigt over det Kongelige Danske Videnskabernes Selskabs Forhanlingar og dets Medlemmerz Arbeider, fra 31 Mai 1824 til 31 Mai 1825 [Overview of the Royal Danish Science Society's Proceedings and the Work of its Members, from 31 May 1824 to 31 May 1825] (باللغة الدنماركية). صفحات 15–16. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Royal Danish Academy of Sciences and Letters (1827). Det Kongelige Danske Videnskabernes Selskabs philosophiske og historiske afhandlinger [The philosophical and historical dissertations of the Royal Danish Science Society] (باللغة الدنماركية). Popp. صفحات xxv–xxvi. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Wöhler, Friedrich (1827). "Ueber das Aluminium". Annalen der Physik und Chemie. 11 (9): 146–161. Bibcode:1828AnP....87..146W. doi:10.1002/andp.18270870912. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Drozdov 2007، صفحة 36.
- Fontani, Marco; Costa, Mariagrazia; Orna, Mary Virginia (2014). The Lost Elements: The Periodic Table's Shadow Side. Oxford University Press. صفحة 30. ISBN 978-0-19-938334-4. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Venetski, S. (1969). "'Silver' from clay". Metallurgist. 13 (7): 451–453. doi:10.1007/BF00741130. S2CID 137541986. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Drozdov 2007، صفحة 38.
- Holmes, Harry N. (1936). "Fifty Years of Industrial Aluminum". The Scientific Monthly. 42 (3): 236–239. Bibcode:1936SciMo..42..236H. JSTOR 15938. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Drozdov 2007، صفحة 39.
- Sainte-Claire Deville, H.E. (1859). De l'aluminium, ses propriétés, sa fabrication. Paris: Mallet-Bachelier. مؤرشف من الأصل في 30 أبريل 2016. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Drozdov 2007، صفحة 46.
- Drozdov 2007، صفحات 55–61.
- Drozdov 2007، صفحة 74.
- "Aluminium history". All about aluminium. اطلع عليه بتاريخ 07 نوفمبر 2017. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Drozdov 2007، صفحات 64–69.
- Ingulstad, Mats (2012). "'We Want Aluminum, No Excuses': Business-Government Relations in the American Aluminum Industry, 1917–1957". In Ingulstad, Mats; Frøland, Hans Otto (المحررون). From Warfare to Welfare: Business-Government Relations in the Aluminium Industry. Tapir Academic Press. صفحات 33–68. ISBN 978-82-321-0049-1. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Seldes, George (1943). Facts and Fascism (الطبعة 5). In Fact, Inc. صفحة 261. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Thorsheim, Peter (2015). Waste into Weapons. Cambridge University Press. صفحات 66–69. ISBN 978-1-107-09935-7. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Weeks, Albert Loren (2004). Russia's Life-saver: Lend-lease Aid to the U.S.S.R. in World War II. Lexington Books. صفحة 135. ISBN 978-0-7391-0736-2. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Drozdov 2007، صفحات 69–70.
- Drozdov 2007، صفحة 135.
- Gregersen, Erik. "Copper". Encyclopedia Britannica (باللغة الإنجليزية). اطلع عليه بتاريخ 04 يونيو 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Drozdov 2007، صفحات 165–166.
- Drozdov 2007، صفحة 85.
- "Aluminum". Historical Statistics for Mineral Commodities in the United States (Report) (باللغة الإنجليزية). United States Geological Survey. 2017. اطلع عليه بتاريخ 09 نوفمبر 2017. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "aluminium, n." Oxford English Dictionary, third edition. Oxford University Press. December 2011. اطلع عليه بتاريخ 30 ديسمبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة)«Origin: Formed within English, by derivation. Etymons: aluminen., -ium suffix, aluminum n.» - "alumine, n." Oxford English Dictionary, third edition. Oxford University Press. December 2011. اطلع عليه بتاريخ 30 ديسمبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة)«Etymology: < French alumine (L. B. Guyton de Morveau 1782, Observ. sur la Physique 19 378) < classical Latin alūmin- , alūmen alum n.1, after French -ine -ine suffix4.» - Pokorny, Julius (1959). "alu- (-d-, -t-)". Indogermanisches etymologisches Wörterbuch [Indo-European etymological dictionary] (باللغة الألمانية). A. Francke Verlag. صفحات 33–34. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Davy, Humphry (1808). "Electro Chemical Researches, on the Decomposition of the Earths; with Observations on the Metals obtained from the alkaline Earths, and on the Amalgam procured from Ammonia". Philosophical Transactions of the Royal Society. 98: 353. Bibcode:1808RSPT...98..333D. doi:10.1098/rstl.1808.0023. اطلع عليه بتاريخ 10 ديسمبر 2009. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Richards 1896، صفحات 3–4.
- Berzelius, J. J. (1811). "Essai sur la nomenclature chimique". Journal de Physique. 73: 253–286. الوسيط
|CitationClass=تم تجاهله (مساعدة). - "Philosophical Transactions of the Royal Society of London. For the Year 1810. — Part I". The Critical Review: Or, Annals of Literature. (باللغة الإنجليزية). XXII: 9. January 1811. hdl:2027/chi.36013662. الوسيط
|CitationClass=تم تجاهله (مساعدة)«Potassium, acting upon alumine and glucine, produces pyrophoric substances of a dark grey colour, which burnt, throwing off brilliant sparks, and leaving behind alkali and earth, and which, when thrown into water, decomposed it with great violence. The result of this experiment is not wholly decisive as to the existence of what might be called aluminium and glucinium» - Davy, Humphry (1812). "Of metals; their primary compositions with other uncompounded bodies, and with each other". Elements of Chemical Philosophy: Part 1. 1. Bradford and Inskeep. صفحة 201. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "aluminium, n." Oxford English Dictionary, third edition. Oxford University Press. December 2011. اطلع عليه بتاريخ 30 ديسمبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Emsley, John (2011). Nature's Building Blocks: An A–Z Guide to the Elements. OUP Oxford. صفحات 24–30. ISBN 978-0-19-960563-7. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Connelly, Neil G.; Damhus, Ture, المحررون (2005). Nomenclature of inorganic chemistry. IUPAC Recommendations 2005 (PDF). RSC Publishing. صفحة 249. ISBN 978-0-85404-438-2. مؤرشف من الأصل (PDF) في 22 ديسمبر 2014. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Lodders, K. (2003). "Solar System abundances and condensation temperatures of the elements" (PDF). The Astrophysical Journal. 591 (2): 1220–1247. Bibcode:2003ApJ...591.1220L. doi:10.1086/375492. ISSN 0004-637X. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Clayton, D. (2003). Handbook of Isotopes in the Cosmos : Hydrogen to Gallium. Leiden: Cambridge University Press. صفحات 129–137. ISBN 978-0-511-67305-4. OCLC 609856530. الوسيط
|CitationClass=تم تجاهله (مساعدة) - William F McDonough The composition of the Earth. quake.mit.edu, archived by the Internet Archive Wayback Machine.
- Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (الطبعة الثانية). Butterworth-Heinemann. ISBN 0-08-037941-9. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Cardarelli, François (2008). Materials handbook : a concise desktop reference (الطبعة 2nd). London: Springer. صفحات 158–163. ISBN 978-1-84628-669-8. OCLC 261324602. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Palme, H.; O'Neill, Hugh St. C. (2005). "Cosmochemical Estimates of Mantle Composition" (PDF). In Carlson, Richard W. (المحرر). The Mantle and Core. Elseiver. صفحة 14. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Wade, K.; Banister, A.J. (2016). The Chemistry of Aluminium, Gallium, Indium and Thallium: Comprehensive Inorganic Chemistry. Elsevier. صفحة 1049. ISBN 978-1-4831-5322-3. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Aluminum Mineral Data". مؤرشف من الأصل في 26 أبريل 2019. اطلع عليه بتاريخ 09 يوليو 2008. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Downs, A.J. (1993). Chemistry of Aluminium, Gallium, Indium and Thallium (باللغة الإنجليزية). Springer Science & Business Media. ISBN 978-0-7514-0103-5. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Roscoe, Henry Enfield; Schorlemmer, Carl (1913). A treatise on chemistry (باللغة الإنجليزية). Macmillan. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Greenwood & Earnshaw 1997، صفحات 242–252.
- Kotz, John C.; Treichel, Paul M.; Townsend, John (2012). Chemistry and Chemical Reactivity. Cengage Learning. صفحة 300. ISBN 978-1-133-42007-1. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Guilbert, John M. and Carles F. Park (1986). The Geology of Ore Deposits. Freeman. صفحات 774–795. ISBN 0-7167-1456-6. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Emsley, John (2001). "Aluminium". Nature's Building Blocks: An A-Z Guide to the Elements. Oxford, UK: Oxford University Press. صفحة 24. ISBN 0198503407. مؤرشف من الأصل في 23 فبراير 2017. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "USGS Minerals Information: Mineral Commodity Summaries" (PDF). minerals.usgs.gov (باللغة الإنجليزية). doi:10.3133/70194932. اطلع عليه بتاريخ 17 ديسمبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Brown, T.J. (2009). World Mineral Production 2003–2007. British Geological Survey. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Graedel, T.E.; et al. (2010). Metal stocks in Society – Scientific Synthesis (PDF) (Report). International Resource Panel. صفحة 17. ISBN 978-92-807-3082-1. اطلع عليه بتاريخ 18 أبريل 2017. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Hudson, L. Keith; Misra, Chanakya; Perrotta, Anthony J.; et al. (2005). "Aluminum Oxide". Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Frank, W.B. (2009). "Aluminum". Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH. doi:10.1002/14356007.a01_459.pub2. ISBN 978-3-527-30673-2. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Totten, G.E.; Mackenzie, D.S. (2003). Handbook of Aluminum. Marcel Dekker. صفحة 40. ISBN 978-0-8247-4843-2. مؤرشف من الأصل في 15 يونيو 2016. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Matthias Dienhart: Ganzheitliche Bilanzierung der Energiebereitstellung für die Aluminiumherstellung. نسخة محفوظة 3 ديسمبر 2013 على موقع واي باك مشين. Rheinisch-Westfälischen Technischen Hochschule Aachen, Juni 2003, S. 7.
- Rudolf Debar: Die Aluminium-Industrie. 2. Auflage. Springer 1925, S. 55.
- Schlesinger, Mark (2006). Aluminum Recycling. CRC Press. صفحة 248. ISBN 978-0-8493-9662-5. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Benefits of Recycling". Ohio Department of Natural Resources. مؤرشف من الأصل في 24 يونيو 2003. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Theoretical/Best Practice Energy Use in Metalcasting Operations" (PDF). مؤرشف من الأصل (PDF) في 31 أكتوبر 2013. اطلع عليه بتاريخ 28 أكتوبر 2013. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Dunster, A.M.; et al. (2005). "Added value of using new industrial waste streams as secondary aggregates in both concrete and asphalt" (PDF). Waste & Resources Action Programme. مؤرشف من الأصل في 02 أبريل 2010. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Aluminium". The Commission on Isotopic Abundances and Atomic Weights. اطلع عليه بتاريخ 20 أكتوبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Dickin, A.P. (2005). "In situ Cosmogenic Isotopes". Radiogenic Isotope Geology. Cambridge University Press. ISBN 978-0-521-53017-0. مؤرشف من الأصل في 6 ديسمبر 2008. اطلع عليه بتاريخ 16 يوليو 2008. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Dodd, R.T. (1986). Thunderstones and Shooting Stars. Harvard University Press. صفحات 89–90. ISBN 978-0-674-89137-1. الوسيط
|CitationClass=تم تجاهله (مساعدة) - George E. Totten, D. Scott MacKenzie: Handbook of Aluminum Band 1: Physical Metallurgy and Processes. Marcel Dekker, Yew York, Basel. 2003, S. 33–34.
- IAEA – Nuclear Data Section (2017). "Livechart – Table of Nuclides – Nuclear structure and decay data". www-nds.iaea.org. International Atomic Energy Agency. اطلع عليه بتاريخ 31 مارس 2017. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Dean 1999، صفحة 4.2.
- Dean 1999، صفحة 4.6.
- Dean 1999، صفحة 4.29.
- Dean 1999، صفحة 4.30.
- Enghag, Per (2008). Encyclopedia of the Elements: Technical Data – History – Processing – Applications. John Wiley & Sons. صفحات 139, 819, 949. ISBN 978-3-527-61234-5. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Ralph W. G. Wyckoff: Crystal Structures. 2. Auflage. Band 1. John Wiley & Sons, New York, London, Sydney 1963, S. 3
- Hugo Strunz, Ernest H. Nickel: Strunz Mineralogical Tables. Chemical-structural Mineral Classification System. 9. Auflage. E. Schweizerbart’sche Verlagsbuchhandlung (Nägele u. Obermiller), Stuttgart 2001, ISBN 3-510-65188-X, S. 35.
- Friedrich Ostermann: Anwendungstechnologie Aluminium. 3. Auflage. Springer, 2014, S. 71–78.
- Greenwood and Earnshaw, pp. 222–4
- Pozzobon, V.; Levasseur, W.; Do, Kh.-V.; et al. (2020). "Household aluminum foil matte and bright side reflectivity measurements: Application to a photobioreactor light concentrator design". Biotechnology Reports (باللغة الإنجليزية). 25: e00399. doi:10.1016/j.btre.2019.e00399. PMC 6906702. PMID 31867227. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Craig, W.; Leonard, A. (2019). Manufacturing Engineering & Technology (باللغة الإنجليزية). Scientific e-Resources. صفحة 215. ISBN 978-1-83947-242-8. الوسيط
|CitationClass=تم تجاهله (مساعدة) - H. A. Macleod (2001). Thin-film optical filters. CRC Press. صفحات 158–159. ISBN 0750306882. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Rugescu, Radu (2012). Solar Power (باللغة الإنجليزية). InTech. صفحات 79–80. ISBN 978-953-51-0014-0. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Davis 1999، صفحة 4.
- Friedrich Ostermann: Anwendungstechnologie Aluminium. 3. Auflage. Springer, 2014, S. 212.
- Puchta, Ralph (2011). "A brighter beryllium". Nature Chemistry. 3 (5): 416. Bibcode:2011NatCh...3..416P. doi:10.1038/nchem.1033. PMID 21505503. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Lide 2004، صفحة 4-3.
- Davis 1999، صفحات 1–3.
- Davis 1999، صفحات 2–3.
-
Cochran, J.F.; Mapother, D.E. (1958). "Superconducting Transition in Aluminum". Physical Review. 111 (1): 132–142. Bibcode:1958PhRv..111..132C. doi:10.1103/PhysRev.111.132. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Schmitz 2006، صفحة 161.
- Davis 1999، صفحة 2.
- Wolfgang Weißbach: Werkstoffkunde Strukturen, Eigenschaften, Prüfung. Springer-Verlag, 2012, ISBN 978-3-8348-8318-6, S. 196
- Polmear, I.J. (1995). Light Alloys: Metallurgy of the Light Metals (الطبعة 3). Butterworth-Heinemann. ISBN 978-0-340-63207-9. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Lyle, J.P.; Granger, D.A.; Sanders, R.E. (2005). "Aluminum Alloys". Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH. doi:10.1002/14356007.a01_481. ISBN 978-3-527-30673-2. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Downs, A. J. (1993). Chemistry of Aluminium, Gallium, Indium and Thallium (باللغة الإنجليزية). Springer Science & Business Media. صفحة 218. ISBN 978-0-7514-0103-5. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Aluminium-Taschenbuch – Band 1, 16. Auflage, Aluminium-Verlag, Düsseldorf 2002, S. 98–99, 167–168.
- Millberg, L.S. "Aluminum Foil". How Products are Made. مؤرشف من الأصل في 13 يوليو 2007. اطلع عليه بتاريخ 11 أغسطس 2007. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Greenwood & Earnshaw 1997، صفحات 224–227.
- Greenwood & Earnshaw 1997، صفحات 112–113.
- King 1995، صفحة 241.
- King 1995، صفحات 235–236.
- Hatch, John E. (1984). Aluminum : properties and physical metallurgy. Aluminum Association., American Society for Metals. Metals Park, Ohio: American Society for Metals. صفحة 242. ISBN 978-1-61503-169-6. OCLC 759213422. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Vargel, Christian (2004) [French edition published 1999]. Corrosion of Aluminium. Elsevier. ISBN 978-0-08-044495-6. مؤرشف من الأصل في 21 مايو 2016. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Macleod, H.A. (2001). Thin-film optical filters. CRC Press. صفحة 158159. ISBN 978-0-7503-0688-1. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Beal, Roy E. (1999). Engine Coolant Testing : Fourth Volume. ASTM International. صفحة 90. ISBN 978-0-8031-2610-7. مؤرشف من الأصل في 24 أبريل 2016. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Greenwood & Earnshaw 1997، صفحات 233–237.
- Dohmeier, C.; Loos, D.; Schnöckel, H. (1996). "Aluminum(I) and Gallium(I) Compounds: Syntheses, Structures, and Reactions". Angewandte Chemie International Edition. 35 (2): 129–149. doi:10.1002/anie.199601291. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Eastaugh, Nicholas; Walsh, Valentine; Chaplin, Tracey; Siddall, Ruth (2008). Pigment Compendium (باللغة الإنجليزية). Routledge. ISBN 978-1-136-37393-0. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Greenwood & Earnshaw 1997، صفحات 252–257.
- Greenwood & Earnshaw 1997، صفحات 227–232.
- Elschenbroich, C. (2006). Organometallics. Wiley-VCH. ISBN 978-3-527-29390-2. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Greenwood & Earnshaw 1997، صفحات 257–67.
- Smith, Martin B. (1970). "The monomer-dimer equilibria of liquid aluminum alkyls". Journal of Organometallic Chemistry. 22 (2): 273–281. doi:10.1016/S0022-328X(00)86043-X. الوسيط
|CitationClass=تم تجاهله (مساعدة) - J. Strähle, E. Schweda: Jander · Blasius – Lehrbuch der analytischen und präparativen anorganischen Chemie, 16. Auflage, Hirzel, Stuttgart 2006, ISBN 3-7776-1388-6, S. 626.
-
"Environmental Applications. Part I. Common Forms of the Elements in Water". Western Oregon University. Western Oregon University. اطلع عليه بتاريخ 30 سبتمبر 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Römpp Online. "Aluminium". Georg Thieme Verlag. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Udo M. Spornitz: Anatomie und Physiologie. Lehrbuch und Atlas für Pflege- und Gesundheitsfachberufe. Springer, Berlin 2010, ISBN 978-3-642-12643-7.
- Ternes, Waldemar (2013). Biochemie der Elemente: Anorganische Chemie biologischer Prozesse. Springer. صفحة 215. ISBN 978-3-8274-3019-9. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Wilfried Puwein: Das „Waldsterben“ in Österreich und seine ökonomischen Folgen. Nr. 11, 1989 (wifo.ac.at PDF; 792 kB).
- Sanjib Kumar Panda, Frantisek Baluska, Hideaki Matsumoto (2009). "Aluminum stress signaling in plants". Plant Signaling & Behaviour. 4 (7): 592–597. doi:10.4161/psb.4.7.8903. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Andersson, Maud (1988). "Toxicity and tolerance of aluminium in vascular plants". Water, Air, & Soil Pollution. 39 (3–4): 439–462. doi:10.1007/BF00279487. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Horst, Walter J. (1995). "The role of the apoplast in aluminium toxicity and resistance of higher plants: A review". Zeitschrift für Pflanzenernährung und Bodenkunde. 158 (5): 419–428. doi:10.1002/jpln.19951580503. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Ma, Jian Feng (2001). "Aluminium tolerance in plants and the complexing role of organic acids". Trends in Plant Science. 6 (6): 273–278. doi:10.1016/S1360-1385(01)01961-6. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Hideaki Matsumoto (2000). "Cell biology of aluminum toxicity and tolerance in higher plants". International Review of Cytology. 200: 1–46. doi:10.1016/S0074-7696(00)00001-2. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Bunichi Ezaki et al. (2001). "Different mechanisms of four aluminum (Al)-resistant transgenes for Al toxicity in Arabidopsis". Plant Physiology. 127 (3): 918–927. doi:10.1104/pp.010399. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Charlotte Poschenrieder et al. (2008). "A glance into aluminum toxicity and resistance in plants". Science of the Total Environment. 400 (1–3): 356–368. doi:10.1016/j.scitotenv.2008.06.003. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Magalhaes, J.V.; Garvin, D.F.; Wang, Y.; Sorrells, M.E.; Klein, P.E.; Schaffert, R.E.; Li, L.; Kochian, L.V. (2004). "Comparative Mapping of a Major Aluminum Tolerance Gene in Sorghum and Other Species in the Poaceae". Genetics. 167 (4): 1905–1914. doi:10.1534/genetics.103.023580. PMC 1471010. PMID 15342528. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Bundesverband der Lebensmittelchemiker/-innen im öffentlichen Dienst e.V. (BLC): Aluminium in Lebensmitteln.
- Sabine Greßler und René Fries. "Studie: "Aluminium-Toxikologie und gesundheitliche Aspekte körpernaher Anwendungen"". Bundesministerium für Arbeit, Soziales, Gesundheit und Konsumentenschutz. اطلع عليه بتاريخ 07 أغسطس 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Aluminium in Lebensmitteln: lebensmittel.org.قالب:DE
- Bundesinstituts für Risikobewertung (BfR). "Reduzierung der Aluminiumaufnahme kann mögliche Gesundheitsrisiken minimieren" (PDF). Stellungnahme Nr. 045/2019 des Bundesinstituts für Risikobewertung (BfR). اطلع عليه بتاريخ 18 نوفمبر 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Aluminium in der Datenbank für Lebensmittelzusatzstoffe.
- Uwe Kerkow, Jens Martens, Axel Müller (2012). Vom Erz zum Auto (PDF). Aachen/ Bonn/ Stuttgart. ISBN 978-3-943126-07-5. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Manfred Sietz, Stefan Seuring: Ökobilanzierung in der betrieblichen Praxis. Eberhard Blottner, Taunusstein 1997, S. 103 .
- "ATSDR – Public Health Statement: Aluminum". www.atsdr.cdc.gov (باللغة الإنجليزية). اطلع عليه بتاريخ 28 يوليو 2018. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Dolara, Piero (21 July 2014). "Occurrence, exposure, effects, recommended intake and possible dietary use of selected trace compounds (aluminium, bismuth, cobalt, gold, lithium, nickel, silver)". International Journal of Food Sciences and Nutrition. 65 (8): 911–924. doi:10.3109/09637486.2014.937801. ISSN 1465-3478. PMID 25045935. S2CID 43779869. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Rosseland, B.O.; Eldhuset, T.D.; Staurnes, M. (1990). "Environmental effects of aluminium". Environmental Geochemistry and Health. 12 (1–2): 17–27. doi:10.1007/BF01734045. ISSN 0269-4042. PMID 24202562. S2CID 23714684. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Baker, Joan P.; Schofield, Carl L. (1982). "Aluminum toxicity to fish in acidic waters". Water, Air, and Soil Pollution (باللغة الإنجليزية). 18 (1–3): 289–309. doi:10.1007/BF02419419. ISSN 0049-6979. S2CID 98363768. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Belmonte Pereira, Luciane; Aimed Tabaldi, Luciane; Fabbrin Gonçalves, Jamile; Jucoski, Gladis Oliveira; Pauletto, Mareni Maria; Nardin Weis, Simone; Texeira Nicoloso, Fernando; Brother, Denise; Batista Teixeira Rocha, João; Chitolina Schetinger, Maria Rosa Chitolina (2006). "Effect of aluminum on δ-aminolevulinic acid dehydratase (ALA-D) and the development of cucumber (Cucumis sativus)". Environmental and Experimental Botany. 57 (1–2): 106–115. doi:10.1016/j.envexpbot.2005.05.004. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Brown, T.J.; Idoine, N.E.; Raycraft, E.R.; et al. (2018). World Mineral Production: 2012–2016. British Geological Survey. ISBN 978-0-85272-882-6. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Aluminum". Encyclopædia Britannica. مؤرشف من الأصل في 12 مارس 2012. اطلع عليه بتاريخ 06 مارس 2012. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Davis 1999، صفحات 17–24.
- D. R. Askeland: Materialwissenschaft. Spektrum, Heidelberg 1996, S. 364.
- world-aluminium.org: The Global Aluminium Industry 40 years from 1972 (PDF; 308 kB), abgerufen am 17. November 2013.
- Der Gesamtverband der Aluminiumindustrie e.V. (GDA). "Absatzmärkte". Der Gesamtverband der Aluminiumindustrie e.V. (GDA). اطلع عليه بتاريخ 03.03.2021. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ الوصول=(مساعدة) - Friedrich Ostermann: Anwendungstechnologie Aluminium. 3. Auflage. Springer, 2014, S. 34–39.
- Friedrich Ostermann: Anwendungstechnologie Aluminium. 3. Auflage. Springer, 2014, S. 39–41.
- Friedrich Ostermann: Anwendungstechnologie Aluminium. 3. Auflage. Springer, 2014, S. 52–57.
- Wolf, Stanley (1990). Silicon Processing for the VLSI Era. Volume 2: Process Integration. Sunset Beach, Calif.: Lattice Press. ISBN 0-9616721-4-5. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Friedrich Ostermann: Anwendungstechnologie Aluminium. 3. Auflage. Springer, 2014, S. 63–64.
- Janina Seit. "How Environmentally Friendly is The European Aluminium Industry?". Vogel Communications Group. اطلع عليه بتاريخ 07.03.2021. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ الوصول=(مساعدة) - Joachim Achtziger, Günter Pfeifer, Rolf Ramcke, Konrad Zilch (2013). Mauerwerk Atlas. Walter de Gruyter. ISBN 9783955531652. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - K. Zilch, C. J. Diederichs, R. Katzenbach, K. J. Beckmann (2012). Handbuch für Bauingenieure. Technik, Organisation und Wirtschaftlichkeit (الطبعة 2). Springer. ISBN 978-3-642-14449-3. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Bernd Leitenberger. "Chemische Raketentreibstoffe Teil 1". Bernd Leitenberger. اطلع عليه بتاريخ 07.03.2021. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ الوصول=(مساعدة) - Eberhard Roos, Karl Maile: Werkstoffkunde für Ingenieure, 4. bearbeitete Auflage, 2011, Springer, S. 252.
- Physiology of Aluminum in Man. Aluminum and Health. CRC Press. 1988. صفحة 90. ISBN 0-8247-8026-4. مؤرشف من الأصل في 19 مايو 2016. الوسيط
|CitationClass=تم تجاهله (مساعدة) - H. Lüllmann, K. Mohr, M. Wehling, L. Hein: Pharmakologie und Toxikologie, Thieme Verlag, 2016, ISBN 978-3-13-368518-4, S. 622–623.
- "ATSDR – Public Health Statement: Aluminum". www.atsdr.cdc.gov (باللغة الإنجليزية). اطلع عليه بتاريخ 18 يوليو 2018. الوسيط
|CitationClass=تم تجاهله (مساعدة) - H. E. Müller, W. Dünnleder, W. Mühlenberg, R. Ruckdeschel: Legionellen – ein aktives Problem der Sanitärhygiene. 3. Auflage. expert-Verlag, ISBN 978-3-8169-2725-9, S. 14.
- Lucija Tomljenovic (2010). "Aluminum and Alzheimer's Disease: After a Century of Controversy, Is there a Plausible Link?". Journal of Alzheimer's disease: JAD. 23 (4): 567–598. doi:10.3233/JAD-2010-101494. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Aluminum and dementia: Is there a link?". Alzheimer Society Canada. 24 August 2018. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Santibáñez, Miguel; Bolumar, Francisco; García, Ana M (2007). "Occupational risk factors in Alzheimer's disease: a review assessing the quality of published epidemiological studies". Occupational and Environmental Medicine. 64 (11): 723–732. doi:10.1136/oem.2006.028209. ISSN 1351-0711. PMC 2078415. PMID 17525096. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Darbre, P.D. (2006). "Metalloestrogens: an emerging class of inorganic xenoestrogens with potential to add to the oestrogenic burden of the human breast". Journal of Applied Toxicology. 26 (3): 191–197. doi:10.1002/jat.1135. PMID 16489580. S2CID 26291680. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Banks, W.A.; Kastin, A.J. (1989). "Aluminum-induced neurotoxicity: alterations in membrane function at the blood–brain barrier". Neurosci Biobehav Rev. 13 (1): 47–53. doi:10.1016/S0149-7634(89)80051-X. PMID 2671833. S2CID 46507895. الوسيط
|CitationClass=تم تجاهله (مساعدة) - al-Masalkhi, A.; Walton, S.P. (1994). "Pulmonary fibrosis and occupational exposure to aluminum". The Journal of the Kentucky Medical Association. 92 (2): 59–61. ISSN 0023-0294. PMID 8163901. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "CDC – NIOSH Pocket Guide to Chemical Hazards – Aluminum". www.cdc.gov. مؤرشف من الأصل في 30 مايو 2015. اطلع عليه بتاريخ 11 يونيو 2015. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "CDC – NIOSH Pocket Guide to Chemical Hazards – Aluminum (pyro powders and welding fumes, as Al)". www.cdc.gov. مؤرشف من الأصل في 30 مايو 2015. اطلع عليه بتاريخ 11 يونيو 2015. الوسيط
|CitationClass=تم تجاهله (مساعدة)
المصادر
- Davis, J. R. (1999). Corrosion of Aluminum and Aluminum Alloys (باللغة الإنجليزية). ASM International. ISBN 978-1-61503-238-9. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Dean, J. A. (1999). Lange's handbook of chemistry (الطبعة 15). McGraw-Hill. ISBN 978-0-07-016384-3. OCLC 40213725. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Drozdov, A. (2007). Aluminium: The Thirteenth Element. RUSAL Library. ISBN 978-5-91523-002-5. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Greenwood, N. N.; Earnshaw, A. (1997). Chemistry of the Elements (الطبعة 2nd). Butterworth-Heinemann. ISBN 978-0-08-037941-8. الوسيط
|CitationClass=تم تجاهله (مساعدة) - King, R. B. (1995). Inorganic Chemistry of Main Group Elements. Wiley-VCH. ISBN 978-0-471-18602-1. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Lide, D. R., المحرر (2004). Handbook of Chemistry and Physics (الطبعة 84). CRC Press. ISBN 978-0-8493-0566-5. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Nappi, C. (2013). The global aluminium industry 40 years from 1972 (PDF) (Report). International Aluminium Institute. اطلع عليه بتاريخ 10 نوفمبر 2017. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Richards, J. W. (1896). Aluminium: Its history, occurrence, properties, metallurgy and applications, including its alloys (الطبعة 3). Henry Carey Baird & Co. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Schmitz, C. (2006). Handbook of Aluminium Recycling (باللغة الإنجليزية). Vulkan-Verlag GmbH. ISBN 978-3-8027-2936-2. الوسيط
|CitationClass=تم تجاهله (مساعدة)
 صور وملفات صوتية من كومنز
صور وملفات صوتية من كومنز دروس من ويكي الجامعة.
دروس من ويكي الجامعة.
- بوابة علم المواد
- بوابة العناصر الكيميائية
- بوابة الكيمياء
- بوابة صيدلة
- بوابة علم الأحجار الكريمة والمجوهرات
- بوابة علم طبقات الأرض

