مطر حمضي
المطر الحمضي هو مطر أو أي شكل آخر من أشكال الترسيب يكون حمضيًا بشكل غير عادي ، مما يعني أنه يحتوي على مستويات مرتفعة من أيونات الهيدروجين (درجة حموضة منخفضة). يمكن أن يكون لها آثار ضارة على النباتات والحيوانات المائية والبنية التحتية. ينتج المطر الحمضي عن انبعاثات ثاني أكسيد الكبريت وأكسيد النيتروجين ، والتي تتفاعل مع جزيئات الماء في الغلاف الجوي لإنتاج الأحماض. بذلت بعض الحكومات جهودًا منذ السبعينيات للحد من إطلاق ثاني أكسيد الكبريت وأكسيد النيتروجين في الغلاف الجوي مع نتائج إيجابية. يمكن أيضًا إنتاج أكاسيد النيتروجين بشكل طبيعي عن طريق الصواعق ، وينتج ثاني أكسيد الكبريت عن طريق الثورات البركانية. ثبت أن للأمطار الحمضية آثارًا سلبية على الغابات والمياه العذبة والتربة ، مما يؤدي إلى قتل الحشرات وأشكال الحياة المائية ، مما يتسبب في تقشير الطلاء ، وتآكل الهياكل الفولاذية مثل الجسور ، وتجوية المباني الحجرية والتماثيل بالإضافة إلى التأثيرات. على صحة الإنسان.
مصادر المطر الحمضي
المصدران الرئيسيان للمطر الحامض هما ثاني اكسيد الكبريت (SO2) واكسيد النيتروجين (NO2).
إن هذه الغازات منتجات ثانوية لعمليات احتراق بدرجات حرارة عالية (دخان السيارات والمصانع وحرق الغابات) والصناعات الكيماوية مثل إنتاج الأسمدة. وتشكل العمليات الطبيعية مثل تأثير البكتيريا على التربة وحرائق الغابات والنشاط البركاني والبرق 5 في المائة من اكسيد النيتروجين المنبعث، أما المواصلات فتشكل 43 في المائة بينما تشكل عمليات الاحتراق الناجمة عن المصانع 32 في المائة.
ثاني أكسيد الكبريت
ينبعث ثاني أكسيد الكبريت (غاز عديم اللون) كمنتج ثانوي ناجم عن الوقود الاحفوري المحترق الذي يحتوي على الكبريت. وينتج هذا الغاز عن عدة عمليات صناعية مثل إنتاج الحديد والصلب والمصانع وعمليات تصنيع النفط الخام.
ويمكن أن ينبعث ثاني أكسيد الكبريت في الجو نتيجة للكوارث الطبيعية، ويشكل هذا 10% من مجموع هذا الغاز المنبعث من البراكين ورذاذ ماء البحر والعوالق (الكائنات الحية المعلقة في الماء) والنباتات المتعفنة. وعلى العموم فإن 69,4 في المائة من ثاني اكسيد الكبريت ينتج عن الاحتراق الصناعي. أما المواصلات فهي مسؤولة عن 3,7 في المائة من ثاني اكسيد الكبريت المنبعث.
ثاني أكسيد النيتروجين
أما المادة الكيماوية الأخرى المسؤولة بشكل رئيسي عن تكوين المطر الحمضي فهي أكسيد النيتروجين، وتستخدم هذه العبارة لوصف أي مركب من النيتروجين مع أية كمية من ذرات الأكسجين. ان أول اكسيد النيتروجين وثاني اكسيد النيتروجين هما الاثنان أكسيدا نيتروجين.
تطلق عبارة المطر الحامض على الأمطار التي يكون معدل الأس الهيدروجيني فيها أقل من 5,6 (<5,6) إذ يعتبر معدل PH=7 متعادلا.
ويدور حاليا جدل شديد بالنسبة إلى هذا النوع من تلوث الهواء بسبب الضرر الذي يلحقه بالبيئة والممتلكات في العالم. ففي السنوات العشر الماضية تسببت هذه الظاهرة في تدمير آلاف البحيرات والجداول المائية في الولايات المتحدة وكندا ومناطق أخرى في أوروبا.
ويعتبر غاز اكسيد النيتروجين خطيرا في حد ذاته إذ انه يهاجم أغشية أعضاء الجهاز التنفسي ويزيد من احتمال الإصابة بالأمراض التنفسية، كما يساهم في اتلاف طبقة الأوزون ويعمل على تكوين الضباب الدخاني. ويمكن أن ينتشر الاكسيد بعيدا عن المكان الذي تكون فيهِ بواسطة المطر الحامض. وتعمل التغييرات البيئية على تغيير الحياة البرية الموجودة في المناطق التي حدث فيها التغيير.
تكون الأمطار الحمضية
تتكون الأمطار الحمضية من تفاعل الغازات المحتوية على الكبريت. وأهمها ثاني أكسيد الكبريت مع الأكسجين بوجود الأشعة فوق البنفسجية الصادرة عن الشمس، وينتج ثالث اكسيد الكبريت الذي يتحد بعد ذلك مع بخار الماء الموجود في الجو، ليعطي حمض الكبريت.
الذي يبقى معلقا في الهواء على هيئة رذاذ دقيق تنقله الرياح من مكان لآخر، وقد يتحد مع بعض الغازات في الهواء مثل النشادر، وينتج في هذه الحالة مركب جديد هو كبريتات النشادر، أما عندما يكون الجو جافا، ولا تتوفر فرصة لسقوط الأمطار، فان رذاذ حمض الكبريت، ودقائق كبريتات النشادر تبقى معلقة في الهواء الساكن، وتظهر على هيئة ضباب خفيف، لاسيما عندما تصبح الظروف مناسبة لسقوط الأمطار فإنهما يذوبان في ماء المطر، ويسقطان على سطح الأرض على هيئة مطر حمضي، وتشترك اكاسيد النيتروجين مع اكاسيد الكبريت في تكوين الأمطار الحمضية حيث تتحول أكاسيد النيتروجين بوجود الأكسجين والأشعة فوق البنفسجية إلى حمض النيتروجين.
ولابد من إبداء الملاحظتين الآتيتين في هذا المجال:
- الملاحظة الأولى: ان الغازات الملوثة تنتقل بواسطة التيارات الهوائية تؤكد الدراسات في إسكندنافيا ان كمية غازات الكبريت أعلى (2.0) مرة مما تطلقه مصانعها، وفي الوقت نفسه، لا تزيد كمية غازات الكبريت في اجواء بعض اقطار أوروبا الغربية، وخاصة المملكة المتحدد عن 10- 20%. وهذا يعني ان هذه الغازات الملوثة، تنتقل بواسطة التيارات الهوائية من أوروبا الغربية إلى إسكندنافيا وإنكلترا.
- الملاحظة الثانية: الأمطار تزداد مع الزمن، كما جاء في كتاب "التلوث مشكلة العصر" حيث تشير الدراسات إلى ان حموضة الأمطار التي سقطت فوق السويد عام 1982 كانت أعلى بعشر مرات من حموضة الأمطار التي سقطت عام 1969، حيث لاحظ الخبراء أن نسبة حموضة مياه الأمطار زادت بشكل منذر بالخطر، أما درجة حموضة الأمطار في بريطانيا فقد وصلت إلى 4.5 في عام 1979، ووصلت في نفس العام في كندا إلى 3.8 وفي فرجينيا إلى 1.5، حيث كانت درجة حموضة أمطار فرجينيا تقارب درجة حموضة حمض الكبريت (حامض البطارية) وفي اسكتلندا، وصلت إلى 2.7 عام 1977، ووصلت في لوس أنجلس إلى 3 عام 1980. اي أكثر حموضة من الخل وعصير الليمون.
ولا يقتصر التوزع الجغرافي للأمطار على البلاد الصناعية، إذ يمكن ان تنتقل الغيوم لمسافات بعيدة عن مصادر التلوث الصناعي، فتهطل أمطارا حمضية على مناطق لا علاقة لها بمصدر التلوث. ولابد من الإشارة إلى ان درجة حموضة ماء المطر النقي هي بين 5.5 - 6 اي تميل إلى الحموضة قليلا، ولم يسجل أي تأثير سلبي لهذه النسبة حصل خلال ملايين السنين، ويمكن اعتبار ماء المطر نقيا في حدود هذه الدرجة وغير ضار بالبيئة حسب المعلومات المتوفرة.
العمليات الكيميائية
ينتج عن احتراق الوقود ثاني أكسيد الكبريت وأكاسيد النيتريك. يتم تحويلها إلى حامض الكبريتيك وحمض النيتريك.
كيمياء المرحلة الغازية
يتأكسد ثاني أكسيد الكبريت في الطور الغازي بالتفاعل مع شق الهيدروكسيل عبر تفاعل بين الجزيئات.
SO2 + OH· → HOSO2·
يليه:
HOSO2· + O2 → HO2· + SO3
في وجود الماء ، يتحول ثالث أكسيد الكبريت (SO3) بسرعة إلى حمض الكبريتيك:
(SO3 (g) + H2O (l) → H2SO4 (aq
يتفاعل ثاني أكسيد النيتروجين مع OH لتكوين حمض النيتريك:
NO2 + OH· → HNO3
أثار المطر الحمضي
إن خفض PH من 7 إلى 4 يعتبر تغييرا مهما في البيئة كما يظهر ذلك من التغييرات في الحياة الفطرية.
وهناك تأثيرات مباشرة وغير مباشرة للمطر الحامض. إن الحامض يتدخل بشكل مباشر في قدرة الأسماك على امتصاص الأكسجين والأملاح والمواد المغذية اللازمة للحياة. ويعمل الحامض الموجود في الماء على تكوين المخاط في خياشيم الأسماك ويمنعها من امتصاص الأكسجين من المياه المجاورة. ومع بعض الاستثناءات القليلة فإن الأسماك الكبيرة لا تستطيع العيش في مياه يكون فيها معدل PH أقل من 4,8. وعلى أية حال فإن بيض الأسماك والأسماك الصغيرة لا تستطيع العيش عندما يكون مستوى PH أقل من 5,5.
وإذا كان التكاثر غير ممكن فإن المجموعة المفترضة من الأسماك ستنفق في النهاية حتى لو كان معدل PH ليس منخفضا بشكل كاف لقتل الأسماك الكبيرة. إن الشيء الأكثر أهمية هو أن المطر الحامض يمكن أن يلحق بنا الضرر من خلال الغلاف الجوي أو التربة التي نحصل منها على غذائنا. ويعمل المطر الحامض على انفصال المعادن السامة عن مركباتها الكيماوية الطبيعية مما يجعل هذه المعادن غير الضارة في السابق معادن خطيرة. وتطلق هذه المعادن التي أصبحت خطرة مواد سامة يمكن أن تمتصها مياه الشرب والمحاصيل والحيوانات التي يأكلها الإنسان. إن مثل هذه الأطعمة التي يتناولها الإنسان قد تسبب تلفا عصبيا عند الأطفال أو تلفا دماغيا شديدا. وهناك شك في وجود علاقة بين الألمنيوم ومرض الزهايمر.
ومن أحد ابرز المضاعفات الجانبية الخطيرة للمطر الحامض على البشر تلك المشكلات المتعلقة بالجهاز التنفسي. ان انبعاث غاز ثاني اكسيد الكبريت واكسيد النيتروجين يزيد من مخاطر المشكلات التنفسية مثل السعال الجاف والربو والصداع وأمراض العين والأنف وحساسية البلعوم.
السلبيات
وتؤدي ظاهرة المطر الحامض كذلك إلى تدهور البنايات والتماثيل إذ يتفاعل هذا المطر مع المواد المعدنية المختلفة، ويتكون المطر الحامض عندما يتحد مع أكسيد النيتروجين والكبريتيد مع الرطوبة في الغلاف الجوي ليكون أحماض الكبريتيك والنيتريك. ويمكن أن تنقل هذه الأحماض إلى مسافات بعيدة عن مكانها الأصلي.
على البيئة البحرية
إن زيادة حموضة الماء تعود إلى انتقال حمض الكبريت وحمض الأزوت (النيتروجين) إليها مع مياه السيول والأنهار بعد هطول الأمطار الحمضية. إضافة إلى ذلك فان الأمطار الحمضية تجرف معها عناصر معدنية مختلفة بعضها بشكل مركبات من الزئبق والرصاص والنحاس والالمنيوم، فتقتل الأحياء في البحيرات، ومن الجدير ذكره ان درجة حموضة ماء البحيرة الطبيعي تكون بين 5-6 فاذا قلت عن الرقم 5 ظهرت المشاكل البيئية، وكما أن ماء البحيرات يذيب بعض المركبات القاعدية القلوية الموجودة في صخور القاع أو تنتقل إليها مع مياه الأنهار والسيول، فتنطلق شوارد البيكربونات وشوارد أخرى تعدل حموضة الماء، وتحول دون انخفاض الرقم الهيدروجيني، ويعبر عن محتوى الماء من شوارد التعديل ب "سعة تعديل الحمض"، فاذا تدل الإحصائيات على ان عدد البحيرات التي كانت حموضتها أقل من 5 درجات في أميركا في النصف الأول من هذا القرن كان 8 بحيرات فقط، وأصبح الآن 109 بحيرات، كما أحصي في منطقة أونتاريو في كندا، أكثر من الفي بحيرة حموضة مياهها اقل من 5 درجات، وفي السويد أكثر من 20% من البحيرات تعاني من ارتفاع الحموضة، وبالتالي الخلل البيئي واضطراب الحياة فيها.
على الغابات والنباتات

إن تدمير الغابات له تأثير في النظام البيئي، فمن الملاحظ أن إنتاج الغابات يشكل نحو 15% في الإنتاج الكلي للمادة العضوية على سطح الأرض، ويكفي ان نتذكر ان كمية الاخشاب التي يستعملها الإنسان في العالم تزيد عن 2.4 مليار طن في السنة، كما أن غابات الحور المزروعة في واحد كم2 تطلق 1300 طن من الأكسجين، وتمتص نحو 1640 طنا من ثاني أكسيد الكربون خلال فصل النمو الواحد. كذلك تؤثر الأمطار الحمضية في النباتات الاقتصادية ذات المحاصيل الموسمية وفي الغابات الصنوبرية، فهي تجرد الأشجار من اوراقها، وتحدث خللا في التوازن الشاردي في التربة، وبالتالي تجعل الامتصاص يضطرب في الجذور، والنتيجة تؤدي لحدوث خسارة كبيرة في المحاصيل وعلى سبيل المثال: فقد بلغت نسبة الاضرار في الاوراق بصورة ملحوظة في احراجها 34% سحابة من الغيوم تنذر بوقوع الكارثة في ألمانيا في السبعينات وازدادت إلى 50% عام 1985.
وفي السويد وصلت الأضرار إلى 30% في احراجها، وتشير التقارير إلى ان 14% من جميع اراضي الاحراج الأوروبية قد اصابها الضرر نتيجة الأمطار الحمضية. إضافة إلى ان معظم الغابات في شرقي الولايات المتحدة الاميركية، تتأثر بالأمطار الحمضية، لدرجة ان اطلق عـلى هذه الحالة اسم فالدشترين وتعني موت الغابة، علما بان أكثر الأشجار تأثرا بالأمطار الحمضية هي الصنوبريات في المرتفعات الشاهقة.. نظرا لسقوط اوراقها قبل اوانها مما يفقد الاخشاب جودتها، وبذلك تؤدي إلى خسارة اقتصادية في تدمير الغابات وتدهورها. وتبدو الأمطار الحمضية كملوث خطير، له تأثيرات سلبية على العديد من مكونات النظام البيئي البري، فهي تؤثر أولاً على الغطاء النباتي، فتقضي عليه، إما بتفاعل المطر الحمضي مع أوراق النبات حيث يعمل على تآكلها وتلفها وسقوطها، وإما عن طريق تحميض التربة ومهاجمة جذور النبات، والقضاء على الكائنات الحية الدقيقة والإخلال بنسب غذاء النبات، فيتعثر نمو النبات ويجف في النهاية.[1]
على التربة
تبين التقارير ان التربة في مناطق أوروبا، اخذت تتأثر بالحموضة، مما يؤدي إلى اضرار بالغة من انخفاض نشاط البكتيريا المثبتة للنيتروجين مثلا. وانخفاض معدل تفكك الاداة العضوية، مما أدى إلى سماكة طبقة البقايا النباتية إلى الحد الذي أصبحت فيه تعوق نفاذ الماء إلى داخل التربة وإلى عدم تمكن البذور من الإنبات، وقد ادت هذه التأثيرات إلى انخفاض إنتاجية الغابات. وتؤثر أيضاً على التربة، حيث يوجد العديد من المعادن السامة فيها، وإضافة إلى المواد الحمضية التي تحتويها، ويعمل الحمض على تلف الكائنات الدقيقة التي تعيش في التربة واللازمة لتحلل الأجسام العضوية إلى مواد غذائية صالحة للنبات.
على الحيوانات
تتوقف سلامة كل مكون من مكونات النظام البيئي على سلامة المكونات الأخرى، دخان المصانع السبب الرئيسي فمثلا تأثر النباتات بالأمطار الحمضية يحرم القوارض من المادة الغذائية والمأوى، ويؤدي إلى موتها أو هجرتها، كما تموت الحيوانات اللاحمة التي تتغذى على القوارض أو تهاجر أيضا وهكذا.. وقد يلاحظ التأثير المباشر للأمطار الحمضية في الحيوانات. كما لوحظ موت القشريات والأسماك الصغيرة في البحيرات المتحمضة، نظرا لتشكل مركبات سامة بتأثير الحموض (الأمطار الحمضية)، تدخل في نسيج النباتات والبلانكتون- العوالق النباتية- (نباتات وحيدة الخلية عائمة).. وعندما تتناولها القشريات والأسماك الصغيرة، تتركز المركبات السامة في انسجتها بنسبة أكبر. وهكذا تتركز المواد السامة في المستهلكات الثانوية والثالثية حتى تصبح قاتلة في السلسلة الغذائية.. ولابد من الإشارة إلى ان النظام البيئي لا يستقيم إذ ا حدث خلل في عناصره المنتجة أو المستهلكة أو المفككة وبالنتيجة يؤدي موت الغابات إلى موت الكثير من الحيوانات الصغيرة، وهجرة الكبيرة منها، فهي أيضاً تضر بالطيور، حيث تساعد على نقص تمثيل الكالسيوم لديها، مما يؤثر على عظامها ومتانة بيضها، كما تضطرها إلى مغادرة المناطق الملوثة، كما تقتل العديد من الحيوانات التي تتغذى على الأوراق والنباتات التي تعالج بها.
على الإنسان
يتشكل الضباب الدخاني في المدن الكبيرة، وهو يحتوي على حموض، حيث يبقى معلقا في الجو عدة أيام، وذلك عندما تتعرض الملوثات الناتجة عن وسائل النقل بصورة فادحة إلى الأشعة فوق البنفسجية الآتية من الشمس، فيحدث بين مكوناتها تفاعلات كيميائية، تؤدي إلى تكوين الضباب الدخاني الذي يخيم على المدن وخاصة في ساعات الصباح الأولى، والأخطر في ذلك، هو غازي ثاني أكسيد النيتروجين، لأنه يشكل المفتاح الذي يدخل في سلسلة التفاعلات الكيميائية الضوئية التي ينتج عنها الضباب الدخاني وبالتالي نكون أمام مركبات عديدة لها تأثيرات ضارة على الإنسان إذ تسبب احتقان الأغشية المخاطية وتهيجها والسعال والاختناق وتلف الأنسجة وانخفاض معدل التمثيل الضوئي في النبات الأخضر. وكل هذا ينتج عن حدوث ظاهرة الانقلاب الحراري، كما حدث في مدينة لندن عام 1952 عندما خيم الضباب الدخاني لمدة ثلاثة أيام، مات بسببه 4000 شخص، وكذلك ما حدث في أنقرة وأثينا.

هذا فضلاً عن التأثيرات الخطيرة للأمطار الحمضية على الصحة الإنسانية حينما يتناول الإنسان الخضراوات والأسماك التي تركزت واختزنت فيها المركبات الحمضية. كما لا يخفى أثر الأمطار الحمضية على الأحياء البحرية في البحيرات والأنهار، فقد أدت إلى فناء الأسماك، والبكتريا المحللة، وعملت على تزايد نمو الطحالب والفطريات وبعض النباتات المقاومة للحموضة، مما يجعل البحيرة تنطمر وتتحول إلى موات، نشير هنا إلى أن أكثر الدول معاناة من ظاهرة الأمطار الحمضية، هي الدول الإسكندنافية، حيث تأتيها الرياح من جنوب أوروبا، وكذلك كندا، وتأتيها الرياح من شمال الولايات المتحدة وشرقها، محملة بالملوثات المنبعثة من المصانع ومحطات توليد الطاقة والسيارات، والتي يتكون منها المطر الحامضي.[2]
أضرار الدخان
ويشكل الضباب والمطر (الدخان) ضررا للاشخاص الذين يعانون من مشكلات مثل الربو، كما أن المطر الحامض قد يعمل على تفاقم مشكلة التنفس عند المرضى ما قد يؤدي إلى الوفاة. إن عملية ترميم المباني والنصب التذكارية بسبب التآكل الناجم عن المطر الحامض قد يكون مكلفا بشكل كبير. ففي وستمنسر بإنجلترا تم تخصيص ما يصل إلى عشرة ملايين جنيه لأعمال الترميم للمباني المتضررة من المطر الحامض. أما الولايات المتحدة فقد انفقت 35 مليار دولار على التلف الذي أصاب الأصباغ بسبب هذا المطر. ووصلت كلف ترميم كاتدرائية كولونيا في ألمانيا إلى حوالي 20 مليون دولار، أما كلف ترميم النصب التذكارية الرومانية فقد كلفت الإيطاليين حوالي 200 مليون دولار.
طرق الوقاية
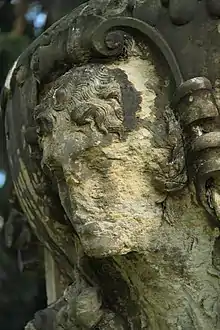
الحلول التقنية
تستخدم العديد من محطات توليد الطاقة التي تعمل بالفحم إزالة الكبريت من غاز المداخن (FGD) لإزالة الغازات المحتوية على الكبريت من غازات المداخن. بالنسبة لمحطة الطاقة النموذجية التي تعمل بالفحم ، فإن جهاز إزالة الكبريت من غاز المداخن سيزيل 95٪ أو أكثر من ثاني أكسيد الكبريت في غازات المداخن. ومن الأمثلة على إزالة الكبريت من غاز المداخن جهاز التنظيف الرطب الشائع الاستخدام. جهاز التنظيف الرطب هو في الأساس برج تفاعل مزود بمروحة تقوم باستخراج غازات مكدس الدخان الساخن من محطة توليد الكهرباء إلى البرج. يتم أيضًا حقن الجير أو الحجر الجيري في شكل ملاط في البرج ليختلط مع غازات المداخن ويتحد مع ثاني أكسيد الكبريت الموجود. تنتج كربونات الكالسيوم في الحجر الجيري كبريتات الكالسيوم متعادلة الأس الهيدروجيني والتي تتم إزالتها فعليًا من جهاز التنظيف. أي أن جهاز التنظيف يحول تلوث الكبريت إلى كبريتات صناعية.
في بعض المناطق ، تُباع الكبريتات لشركات الكيماويات كجبس عندما يكون نقاوة كبريتات الكالسيوم عالية. في حالات أخرى ، يتم وضعهم في مكب النفايات. يمكن أن تستمر آثار المطر الحمضي لأجيال ، حيث يمكن أن تحفز تأثيرات تغير مستوى الأس الهيدروجيني على الترشيح المستمر للمواد الكيميائية غير المرغوب فيها إلى مصادر المياه النقية ، مما يؤدي إلى القضاء على أنواع الحشرات والأسماك المعرضة للخطر وعرقلة الجهود المبذولة لاستعادة الحياة الأصلية.
يقلل الاحتراق بالطبقة المميعة أيضًا من كمية الكبريت المنبعثة من إنتاج الطاقة.
يقلل التحكم في انبعاثات المركبات من انبعاثات أكاسيد النيتروجين من السيارات.
الجهد الدولي
وفي العام 1991 وقعت الولايات المتحدة وكندا اتفاقا بخصوص نوعية الهواء. وقد اتفقت الدولتان منذ ذلك الحين على اتخاذ اجراءات لتقليل انبعاث ثاني اكسيد الكبريت، وبموجب الاتفاق وافقت الولايات المتحدة على تقليل انبعاث ثاني اكسيد الكبريت بحوالي عشرة ملايين طن سنويا بحلول العام 2000.
وقبل عام من الاتفاق حاول اتفاق الهواء النقي المعدل تقليل انبعاث اكسيد النيتروجين بمقدار 2 مليون طن، وقد ركز هذا البرنامج على المصدر الذي ينبعث منه اكسيد النيتروجين مثل السيارات ومراجل توليد الطاقة.
تقليل الانبعاثات
إن ما يمكن أن يعمله الإنسان لتقليل انبعاث ثاني اكسيد الكبريت واكسيد النيتروجين هو التقليل من استهلاك الوقود الاحفوري، كما أن الاستخدام الجماعي للسيارات ووسائل النقل العام والمشي يمكن أن يقلل بشكل كبير من انبعاث هذه الغازات، ويعتبر التقليل من استهلاك الطاقة مفيدا للبيئة لأن الطاقة المستهلكة تأتي من الوقود الاحفوري الذي يؤدي إلى تكوين المطر الحامض.
فعلى سبيل المثال يمكننا اطفاء الأنوار التي لا نحتاج إليها والتقليل من استخدام أجهزة التكييف والتدفئة. كما أن استبدال الأجهزة القديمة بأجهزة جديدة لا تستهلك الكثير من الطاقة فكرة ممتازة. كما يمكن التقليل من غاز ثاني اكسيد الكربون المنبعث في الهواء باستخدام أجهزة غسل الغاز في المصانع.
مصادر الطاقة الآمنة
ويمكن كذلك استخدام مصدر طاقة بديلا في محطات إنتاج الطاقة للتقليل من الغازات المنبعثة. وتشمل هذه البدائل: الطاقة الحرارية الأرضية، الطاقة الشمسية، الطاقة التي يمكن توليدها عن طريق الريح والماء.
آثار أخرى
الأمطار الحمضية يمكن أيضا أن تحدث أضرار ببعض أنواع المباني والآثار التاريخية والتماثيل. هذا يحدث عندما يتفاعل حمض الكبريتيك في تلك الأمطار مع مركبات الكالسيوم في الحجارة (كالأحجار الجيرية أو الرخام أو الغرانيت) لتكوين الجص الذي يتشقق ويسقط. المعادلة الكيميائية للتفاعل:
يمكن أيضا أن يتفاعل حمض الأزوت (النيتروجين) الموجود في الأمطار الحمضية مع كثير من المعادن في المنشآت الصناعية ويتسبب في تخريبها.
المراجع
- أحمد عبد الكريم سلامة. قانون حماية البيئة. ص342.
- لطف الله قاري. الأمطار الحامضية. مطابع جامعة الملك سعود. الرياض. ص152.
اقرأ أيضاً
مراجع
وصلات خارجية
- National Acid Precipitation Assessment Program Report - a 98-page report to Congress
- Acid rain for schools
- Acid rain for schools - Hubbard Brook
- U.S. Environmental Protection Agency - New England Acid Rain Program (superficial)
- Acid Rain (more depth than ref. above)
- U.S. Geological Survey - What is acid rain?
- Acid rain analysis - freeware for simulation and evaluation of titration curves and pH calculations
- CBC Digital Archives – Acid Rain: Pollution and Politics
- Larssen, Thorjørn et al. “Acid Rain in China”. Environmental Science and Technology, 40:2, 2006, pp 418-425.
- Acid Rain: A Continuing National Tragedy - a report from The Adirondack Council on acid rain in the Adirondack region
- Assortment of Summaries on Acid Rain
- Acid rain linked to decline of the wood thrush, a songbird of the Eastern Forest
- Trouble in the Forest, a 1988 documentary hosted by David Suzuki
- بوابة الفضاء
- بوابة الكيمياء
- بوابة طبيعة
- بوابة علم البيئة
