كبريتيد الهيدروجين
كبريتيد الهيدروجين (أو سلفيد الهيدروجين) هو مركب كيميائي يحمل الصيغة H2S وهو غاز عديم اللون قابل للاشتعال وهو كريه الرائحة تشبه رائحته عفن البيض. وهو غاز أثقل من الهواء ولذلك تجده في الأماكن العميقة في حالة تسربه. يستخرج من الغاز المصاحب للبترول ويتم فصله بالحرارة وتتم معالجته وتكثيفه لتسهيل عملية نقله حيث يتم تصديره إلى الخارج. يدخل في صناعة بعض الأدوية، ويُستخدم على نطاق واسع في التحاليل الكيميائية.
| كبريتيد الهيدروجين | |
|---|---|
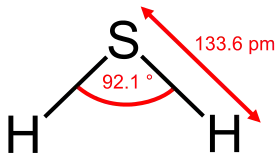 كبريتيد الهيدروجين | |
 كبريتيد الهيدروجين | |
| الاسم النظامي (IUPAC) | |
كبريتيد هيدروجين | |
| المعرفات | |
| رقم CAS | 7783-06-4 |
| بوب كيم | 402 |
مواصفات الإدخال النصي المبسط للجزيئات
| |
| الخواص | |
| الصيغة الجزيئية | H2S |
| الكتلة المولية | 34.082 غ/مول |
| المظهر | غاز عديم اللون |
| الكثافة | 1.363 غ/ل غاز |
| نقطة الانصهار | -82.30 °س |
| نقطة الغليان | -60.28 °س |
| الذوبانية في الماء | 0.25 غ/100 مل ماء عند 40 °س |
| حموضة (pKa) | 7.04 [3] |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
كبريتيد الهيدروجين ذو رائحة نفاذة كريهة، نعرفه من رائحة البيض الفاسد. قليل الذوبان في الماء ويذوب في الإيثانول . يعتبر H2S من حمض ضعيف ، ويكون أملاحا من السلفيد (الكبريتيد) .
مصادره
يوجد كبريتيد الهيدروجين طبيعيا بنسب مختلفة، من آثار إلى نحو 80% حجما في الغاز الطبيعي وفي النفط ، كما يخرج من البراكين مع غازات اخرى وفي بعض آبار المياه. كما ينتج من تحلل الكتلة الحيوية بسبب تخمرها وفسادها، كذلك هو من نواتج عمليات تحلل الجثث وكذلك تحلل القمامة.
وهو من مسببات الرائحة الكريهة لفم من لا يعتنون بتنظيف أسنانهم.[4]
تحضيره
يمكن إنتاج كبريتيد الهيدروجين في المختبر عن طريق تفاعل حمض الهيدروكلوريك مع كبريتيد الحديد ، حيث يسكب قطرات الحمض على سلفيد الحديد، فيتم التفاعل:
- من سلفيد الحديد (كبريتيد الحديد) وحمض الهيدروكلوريد ينتج كلوريد الحديد وكبريتيد الهيدروجين.
مثل هذا الناتج يكون به شوائب غازات أخرى مثل الهيدروجين وثنائي أكسيد الكربون و النتروجين. وعند استخدام كبريتيد الحديد الطبيعي مثل "البيرهوتين" Pyrrhotin فمن الممكن أن تنشأ غازات أخرى مثل هيدرات الزرنيخ ومونوفوسفان، وهيدرات السيلين.
يمكن تحضبر كبريتيد الهيدروجين النقي عن طريق تسخين محلول مركز من هيدروسلفيد المنغنيز، أو من العناصر النقية أو من كبريتيد الصوديوم وحمض الفسفوريك.[5]
كذلك يمكن تحضير كبريتيد الهيدروجين من كبريتيد الألمونيوم والماء:[6]
- 6 H2O + Al2S3 → 3 H2S + 2 Al(OH)3
يعتبر تحضير كبريتيد الهيدروجين مرتفع التكلفة بسبب الخطورة المصاحبة لإنتاجه.
الأمن
كبريتيد الهيدروجين عالي السمية و قابل للاشتعال (مدى إشتعاله يقع مابين 4.3 و 46%). و هو غاز ثقيل مما يؤدي إلى بقاءة قريبا من سطح الارض ولا يتطاير إلى الطبقات العليا كما يبقى محصورا ضمن المناطق قليلة التهوية. و رغم أن رائحته نفاذة، إلا أنه سرعان ما يخدر حواس الشم، ولهذا يعتقد الذين يستنشقونه أنهم أصبحوا في مأمن لانعدام قدرتهم على شمه.
السمية
يعتبر كبريتيد الهيدروجين سم ذو مدى واسع؛ فهو قادر على تسميم أجهزة مختلفة ضمن جسم الإنسان، ويبقى الجهاز العصبي هو الأكثر تضررا. يمكن موازاة سمية كبريتيد الهيدروجين بسمية أول أكسيد الكربون و حمض الهيدروسيانيك.[7] و هو يشكل مركب معقد مع الحديد الموجود في الإنزيمات ضمن الميتوكندريون (مركز "توليد الطاقة" للخلية، وبدونها لن تستطيع الخلية إنتاج الطاقة اللازمة لها للحفاظ على الحياة) و عليه تتوقف آلية التنفس الخلوي وتموت الخلية.
و بسبب إنتاج الجسم البشري لكبريتيد الهيدروجين بصورة طبيعية يمكن له تحمل نسبة بسيطة من كبريتيد الهيدروجين وذلك لوجود إنزيمات في الجسم للتخلص من سميته، حيث يتم أكسدة الغاز لينتج عنصر الكبريت الغير ضار.[8] و لكن عند عبور حاجز الخطر (300 إلى 350 جزء بالمليون)) لا يمكن للإنزيمات المؤكسدة أن تحدِّد الكمية الموجودة وبالسرعة المناسبة. معظم أجهزة الإنذارالمتوفرة لدى معظم الشركات والجهات المختلفة تطلق تنبيها عند وصول تركيزه إلى مدى بين 5 إلى 10 جزء بالمليون، وتطلق إنذارًا أقصى بالخطر عند وصول التركيز إلى 15 جزء بالمليون.
فوهة مائية حرارية
 مقالة مفصلة: فوهة مائية حرارية
مقالة مفصلة: فوهة مائية حرارية
تعيش بعض البكتيريا التي توجد في اعماق البحار على كبريتيد الهيدروجين وتحوله مع مواد أخرى إلى مواد عضوية. توجد تلك الأنواع من البكتيريا بالقرب من فوهات مائية حرارية تخرج منها غازات وأملاح معدنية ومن ضمنها غاز كبريتيد الهيدروجين، وقد تكون ساخنة إلى درجات حرارة قد تصل إلى 400 درجة مئوية. ترسب تلك البكتيريا المواد المعدنية في هيئة قمعية في قاع البحار والمحيطات، وقد يصل ارتفاعها إلى نحو 20 متر.
طالع أيضاً
المراجع
- معرف بوب كيم: https://pubchem.ncbi.nlm.nih.gov/compound/402 — تاريخ الاطلاع: 18 نوفمبر 2016 — العنوان : hydrogen sulfide — الرخصة: محتوى حر
- معرف بوب كيم: https://pubchem.ncbi.nlm.nih.gov/compound/402
- المؤلف: Robert C. Weast — المحرر: Robert C. Weast — الاصدار الأول — الناشر: CRC Press — ISBN 978-0-8493-0740-9
- Wolfgang Legrum: Riechstoffe, zwischen Gestank und Duft, Vieweg + Teubner Verlag (2011) S. 61–62, ISBN 978-3-8348-1245-2.
- Georg Brauer (Hrsg.): Handbook of Preparative Inorganic Chemistry. Band 1. 2. Auflage. Academic Press, New York 1963, S. 344–346.
- McPherson, William (1913). Laboratory manual. Boston: Ginn and Company. صفحة 445. مؤرشف من الأصل في 15 مارس 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Lindenmann J, Matzi V, Neuboeck N, Ratzenhofer-Komenda B, Maier A, Smolle-Juettner FM (December 2010). "Severe hydrogen sulphide poisoning treated with 4-dimethylaminophenol and hyperbaric oxygen". Diving and Hyperbaric Medicine : the Journal of the South Pacific Underwater Medicine Society. 40 (4): 213–7. PMID 23111938. مؤرشف من الأصل في 13 ديسمبر 2019. اطلع عليه بتاريخ 07 يونيو 2013. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - S. Ramasamy, S. Singh, P. Taniere, M. J. S. Langman, M. C. Eggo (2006). "Sulfide-detoxifying enzymes in the human colon are decreased in cancer and upregulated in differentiation". Am. J. Physiol. Gastrointest. Liver Physiol. 291 (2): G288–G296. doi:10.1152/ajpgi.00324.2005. PMID 16500920. مؤرشف من الأصل في 22 أغسطس 2010. اطلع عليه بتاريخ 20 أكتوبر 2007. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link)
- بوابة الكيمياء
- بوابة علم الفلك
