حمض الهيدروكلوريك
حمض الهيدروكلوريك أو الكلوريدريك ويعرّب حمض كلور الماء؛ وسماه جابر بن حيان روح الملح[ع 1] ، هو حمض معدني قوي، وهو عبارة عن محلول مائي لغاز كلوريد الهيدروجين HCl؛ يعدّ حمض الهيدروكلوريك المكوّن الرئيس للعصارة الهضمية، والتي تساعد على استفادة الجسم من الغذاء.
| حمض الهيدروكلوريك | |
|---|---|
 نموذج ثلاثي الأبعاد لجزيء الماء |
 نموذج ثلاثي الأبعاد لجزيء كلوريد الهيدروجين |
 نموذج ثلاثي الأبعاد لكاتيون الهيدرونيوم |
 نموذج ثلاثي الأبعاد لأنيون الكلوريد |
 حمض الهيدروكلوريك | |
| الاسم النظامي (IUPAC) | |
حمض الهيدروكلوريك | |
| المعرفات | |
| رقم CAS | 7647-01-0 |
| بوب كيم (PubChem) | 313 |
| الخواص | |
| الصيغة الجزيئية | HCl |
| الكتلة المولية | 36.46 غ/مول |
| المظهر | سائل شفاف عديم اللون إلى أصفر |
| الكثافة | 1.19 غ/سم3 (محلول 37%) |
| نقطة الانصهار | - 30 °س (محلول 37%) |
| نقطة الغليان | 48 درجة حرارة مئوية |
| الذوبانية في الماء | يمتزج مع الماء |
| حموضة (pKa) | - 6.3[1] |
| اللزوجة | ميغا باسكال.ثانية عند 25 °س، 31.5% محلول |
| المخاطر | |
| ترميز المخاطر |  C C |
| توصيف المخاطر | |
| تحذيرات وقائية | |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
تاريخياً يوجد لهذا الحمض عدّة أسماء، فكان يدعى ملح الحمض، وحمض المورياتيك، وروح الملح، لأنه كان ينتج من ملح الصخور والزاج الأخضر، وحضّره العالم جابر بن حيان أوّلاً، ووصفت طرق تحضيره في مدوّنات بازيليوس فالانتينوس في أوروبا في القرن الخامس عشر؛ كما وصفه أندرياس ليبافيوس أيضاً في القرن السادس عشر، واستخدمه عدد من الكيميائيين في أبحاثهم مثل جوزيف بريستلي وهمفري ديفي ويوهان رودولف غلاوبر؛ ثم ليقوم الأخير بإنتاجه من الملح الشائع وحمض الكبريت في القرن السابع عشر.
بدأ الإنتاج الرئيسي على نطاق واسع في الثورة الصناعية، حيث يستخدم حمض الهيدروكلوريك في الصناعة الكيميائية كمتفاعل كيميائي (مادة متفاعلة) على نطاق واسع في إنتاج المونوميرات المستخدمة لصناعة بلاستيك مثل الكلوريد متعدد الفاينيل (PVC) ومتعدد اليوريثان. كما أنّ له تطبيقات كثيرة على نطاق أصغر تشمل مواد التنظيف المنزلي وفي إنتاج الجيلاتين وفي إضافات الطعام وفي إزالة الترسّبات في الأنابيب المعدنية وفي معالجة الجلود.
يجب أن يتمّ التعامل مع حمض الهيدروكلوريك بحرص شديد مع اتخاذ احتياطات الأمان الملائمة حيث أنه سائل أكّال، ويطلق على أملاحه اسم الكلوريدات، وعندما يكون التفاعل مع قاعدة عضوية يشكل أملاح الهيدروكلوريدات.
التاريخ وأصل التسمية
عُرف حمض الهيدروكلوريك للخيميائيين (الكيميائيين قديماً) الأوروبيين كروح الملح أو acidum salis (حمض الملح). كلا الاسمين لا يزالا مستخدَمين، مثل الألمانية: Salzsäure، والهولندية: Zoutzuur، والسويدية: Saltsyra، والتركية: Tuz Ruhu، والبولندية: kwas solny. من التسميات الأخرى أيضاً حمض المورياتيك، وذلك يعود لنفس المصدر (مورياتيك تعني "ما يخص مياه البحر المالحة أو الملح" من هنا موريتات تعني هيدروكلوريد)؛ وهذا الاسم لا زال يستخدم أحياناً.[2][3] أمّا اسم حمض الهيدروكلوريك فصاغه الكيميائي الفرنسي لوي جوزيف غي لوساك في عام 1814.[4]
اكتشف الحمض جابر بن حيان في حوالي عام 800م؛ واستخدمه لتحضير الماء الملكي، وذلك بحلّ ملح النشادر في حمض النتريك (روح النتر)،[ع 2][ع 3] ثم استخدم في العصور الوسطى حيث كان السعي الدؤوب لإيجاد حجر الفيلسوف. انتقلت معرفته بعد ذلك إلى القارة الأوروبية، حيث ورد في مدوّنات جابر الزائف المترجمة في القرن الثالث عشر.[5][6][7][8][9] وصف أندرياس ليبافيوس في القرن السادس عشر طريقة تحضير حمض الهيدروكلوريك الحرّ من تسخين الملح في بواتق فخّارية.[10] في حين أنّ آراء أخرى تقول أنّ بازيليوس فالانتينوس كان أوّل من وصف تحضير حمض الهيدروكلوريك الحرّ في القرن الخامس عشر،[11] وذلك من تسخين ملح الطعام مع الزاج الأخضر.[12]
لاحقاً استخدمه العلماء الأوروبيين في العديد من العمليات الصناعية، فقام غلاوبر في القرن السابع عشر بتسخين كلوريد الصوديوم مع حمض الكبريتيك وذلك لتحضير كبريتات الصوديوم في عملية مانهايم، حيث يتحرّر غاز كلوريد الهيدروجين؛ كما حضّره العالمان جوزيف بريستلي عام 1772،[13] ثمّ همفري ديفي في عام 1808، والذي أثبت أنّه يتركّب من الهيدروجين والكلور.[14] خلال الثورة الصناعية في أوروبا زاد الطلب على القلويات؛ ممّا أدّى إلى تطوير عملية صناعية جديدة عبر نيكولا لوبلان، الذي تمكّن من إنتاج كمّيات كبيرة من كربونات الصوديوم (رماد الصودا) بثمن رخيص. في هذه العملية (عملية لوبلان) تمّ تحويل الملح الشائع إلى رماد الصودا باستخدام حمض الكبريتيك وحجر الكلس (الحجر الجيري) والفحم، حيث يتحرّر كلوريد الهيدروجين كناتج ثانوي. كلّ غاز كلوريد الهيدروجين الناتج عن العملية كان يصرّف بالهواء، إلى أن ظهرت تشريعات بيئية أجبِرت منتجي رماد الصودا على امتصاص النواتج الغازية بالماء، ممّا أدّى إلى إنتاج حمض الهيدروكلوريك بكمّيات صناعية.[7][15] في القرن العشرين تمّ استبدال عملية لوبلان بشكل مؤثّر بعملية سولفاي بدون تكوين الناتج الثانوي لحمض الهيدروكلوريك؛ إلّا أنّ مبدأ امتصاص غاز كلوريد الهيدروجين لا يزال مستخدماً، ولكن من غاز كلوريد الهيدروجين الناتج ثانوياً من تحضير المركّبات العضوية الصناعية.[7][15][16][ع 2]
الإنتاج
يحضّر حمض الهيدروكلويك من حلّ غاز كلوريد الهيدروجين في الماء، وبما أنّه يوجد عدّة طرق لتحضير ذلك الغاز، فإنّه توجد بالتالي طرق مختلفة متعدّدة لتحضير حمض الهيدروكلوريك. وينتج حالياً في الصناعات الكيميائية كناتج ثانوي خلال تحضير الكيمياويات الأخرى.
التحضير المباشر
يتمّ تحليل الملح كهربياً وينتج الكلور الحر و هيدروكسيد الصوديوم والهيدروجين؛ ثمّ تجرى إعادة اتحاد الكلور النقي مع الهيدروجين ويتمّ تكوين غاز كلوريد الهيدروجين النقي. وذلك التفاعل تفاعل طارد للحرارة.
غاز كلوريد الهيدروجين الناتج يتمّ إذابته في ماء منزوع الأيونات حيث ينتج حمض الهيدروكلوريك النقي.[17][18]
أمّا مخبرياً فيمكن تحضير غاز كلوريد الهيدروجين من تفاعل حمض الكبريتيك مع كلوريد الصوديوم:
ثم يركّز الغاز الناتج ويمرّر في الماء لتحضير الحمض.
التحضير العضوي
يتكامل أكبر إنتاج لحمض الهيدروكلوريك مع صناعة المركّبات العضوية المكلورة والمفلورة.
وعادة في حالات الإنتاج مثل هذه فإنّه يتمّ استهلاك الحمض فور تحضيره في نفس مكان اصطناعه.
السوق الصناعية
يقدّر حجم السوق العالمي المفتوح بـ 5 طنّ مكعّب سنوياً.[7] يمكن أن يتمّ إنتاج حمض الهيدروكلوريك بمحلول يصل تركيزه إلى 38% (محلول مركّز). تعدّ التراكيز الأعلى التي تصل تقريباً حوالي 40% ممكنة كيميائياً، إلّا أنّ ضغط البخار سيكون بالتالي مرتفعاً، ممّا يصعّب من عملية تخزينه، وسيحتاج التعامل به احتراساً وحذراً أكبر. عملياً يتمّ الإنتاج بالكمّيات الصناعية بتراكيز تتراوح بين 30% - 35%، وذلك بشكل يحقّق التوازن بين كفاءة النقل وبين الحفاظ على المنتج من التبخّر. يباع حمض الهيدروكلوريك في الولايات المتحدة والمملكة المتحدة لأغراض الاستخدمات المنزلية (غالباً لأغراض التنظيف) بتراكيز بين 10% إلى 12%.[7]
الخواص الكيميائية
حمض الهيدروكلوريك حمض أحادي البروتون والذي يعني أنّه يتأيّن ويعطي أيون هيدروجين واحد (بروتون واحد) +H، والذي عادة ما يمثَّل كيميائياً على شكل أيون هيدرونيوم +H3O عندما يتّحد أيون الهيدروجين مع جزيء ماء؛ أمّا الأيون الآخر الذي يتكوّن عند تفكّك هذا الحمض فهو أيون الكلوريد.[17][18]
يعدّ حمض الهيدروكلوريك من الأحماض المعدنية القوية، أي أنّه يتأيّن (يتفكّك) بشكل كامل بالماء.[17][18] للحمض القوي مثل الهيدروكلوريك ثابت تفكّك كبير القيمة. جرت محاولات نظرية لتعيين قيمة ثابت تفكّك حمض الهيدروكلوريك.[19] عند إضافة أملاح الكلوريد مثل كلوريد الصوديوم لمحلول مائي من الحمض فلا يكون لها عملياً أيّ تأثير على درجة الحموضة (باهاء الوسط (pH))، ممّا يشير إلى أنّ أيون الكلوريد هو قاعدة مرافقة ضعيفة جدّاً، وبالتالي فإنّ حمض الهيدروكلوريك يتفكّك كلّياً في المحلول المائي. بالنسبة للمحاليل المركّزة أو متوسّطة التركيز من حمض الهيدروكلوريك تكون فرضية أنّ التركيز المولي لأيون الهيدروجين تساوي التركيز المولي لحمض الهيدروكلوريك ممتازة، وتتوافق لأربع منازل عشرية معنوية.[17][18]
يتميّز حمض الهيدروكلوريك من بين الأحماض المعدنية الأخرى أنّه الحمض أحادي البروتون الأقل قابلية لتفاعل الأكسدة والاختزال، كما أنّه بالرغم من قوّته، إلّا أنّه الأقلّ خطورة، لأنّه يحتوي على أيون الكلوريد غير السامّ. ومحلول حمض الهيدروكلوريك المتوسّط القوّة ثابت في حالة التخزين، ويحتفظ بتركيزه لفترات طويلة. كما أنّه الحمض المفضّل في المعايرة بالتحليل الكيميائي لتحديد تراكيز القواعد، وذلك لوضوح النقطة النهائية للمعايرة.
يعدّ حمض الهيدروكلوريك (بتركيز تقريباً 20.2%) ثابتاً ضد الغليان (أزيوتروبي)، ويمكن استخدامه كمعيار أولي في التحليل الكمّي، بالرغم من أنّ تركيزه الدقيق يعتمد على الضغط الجوّي عند تحضيره.[20] كما يستخدم بكثرة في التحليل الكيميائي لتحضير (هضم) العينات لتحليلها، والمحاليل المركّزة منه تذيب (تحلّ) العديد من الفلزّات والمعادن، ويكوّن الكلوريدات المُوافقة وغاز الهيدروجين:
كما يتفاعل أيضاً مع المركّبات القاعدية مثل كربونات الكالسيوم أو أكسيد النحاس مكوَناً الكلوريدات المنحلّة التي يمكن أن يتمّ تحليلها.[17][18]
يطلق على مزيج حمض الكلوريك مع حمض النتريك اسم الماء الملكي، وسمّي كذلك لأنه قادر على إذابة الذهب، وتنشأ تلك الظاهرة بسبب تشكّل كلوريد النتروزيل NOCl المؤكسد، بالإضافة إلى أثر التقليل من تركيز أيونات الذهب بتفاعل تشكّل معقّد تناسقي:
كلّ هذه الصفات بالإضافة إلى حقيقة كونه متوافراً ككاشف نقي تجعل من حمض الهيدروكلوريك كاشفاً حمضياً ممتازاً.
الخواص الفيزيائية
حمض الهيدروكلوريك سائل عديم اللون وذو رائحة لاذعة كريهة. (عندما يكون الحمض ذو لون أصفر فهذا يعني أنّه يحتوي على شوائب من معادن مذابة فيه). حمض الهيدروكلوريك ذو توصيل رديء للتيّار الكهربائي.
| التركيز | الكثافة | المولارية | أس هيدروجيني | اللزوجة | السعة الحرارية | ضغط البخار | نقطة الغليان | نقطة الانصهار | ||
|---|---|---|---|---|---|---|---|---|---|---|
| كغ HCl/كغ | كغ HCl/م3 | بوميه | كغ/ل | مول/ل | ميلي باسكال.ثانية | كيلوجول/(كغ·كلفن) | كيلوباسكال | °س | °س | |
| 10% | 104.80 | 6.6 | 1.048 | 2.87 | −0.5 | 1.16 | 3.47 | 1.95 | 103 | −18 |
| 20% | 219.60 | 13 | 1.098 | 6.02 | −0.8 | 1.37 | 2.99 | 1.40 | 108 | −59 |
| 30% | 344.70 | 19 | 1.149 | 9.45 | −1.0 | 1.70 | 2.60 | 2.13 | 90 | −52 |
| 32% | 370.88 | 20 | 1.159 | 10.17 | −1.0 | 1.80 | 2.55 | 3.73 | 84 | −43 |
| 34% | 397.46 | 21 | 1.169 | 10.90 | −1.0 | 1.90 | 2.50 | 7.24 | 71 | −36 |
| 36% | 424.44 | 22 | 1.179 | 11.64 | −1.1 | 1.99 | 2.46 | 14.5 | 61 | −30 |
| 38% | 451.82 | 23 | 1.189 | 12.39 | −1.1 | 2.10 | 2.43 | 28.3 | 48 | −26 |
| قيم درجة الحرارة والضغط في الجدول أعلاه هي عند 20 °س و 1 جو (101.325 كيلو باسكال) أما قيم ضغط البخار فهي مأخوذة من الجداول العالمية الحدّية وتشير إلى ضغط البخار الكلي للمحلول. | ||||||||||
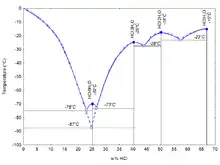
إنّ الخواص الفيزيائية لحمض الهيدروكلوريك مثل درجات الغليان والانصهار والكثافة ودرجة الحموضة وغيرها تعتمد على التركيز (أو المولارية) في المحلول المائي. يمكن أن تمتدّ قيم التركيز انطلاقاً من الماء الحاوي على تراكيز قليلة جداً تقترب قيمتها إلى صفر% من حمض الهيدروكلوريك، وصولاً إلى قيم تراكيز مرتفعة من حمض الهيدروكلوريك المدخِّن تقريباً تركيز 40% من الحمض.[17][18][23]
حمض الهيدروكلوريك هو مزيج ثنائي التركيب (يحتوي 2 من المكونات) من كلوريد الهيدروجين والماء، ويمتلك خاصية الثبات ضد الغليان على تركيز 20.2% هيدروكلوريد و 108.6 °س. كما أنّ له أربع نقاط أصهرية بلورية ثابتة تتراوح بين الشكل البلّوري (HCl·H2O (68% HCl و (HCl·2H2O (51% HCl و (HCl·3H2O (41% HCl و (HCl·6H2O (25% HCl و الجليد (0% HCl). كما توجد أيضاً نقطة شبه أصهرية تقع بين تركيز 24.8% و التبلور عند HCl·3H2O.[23]
الدور الحيوي
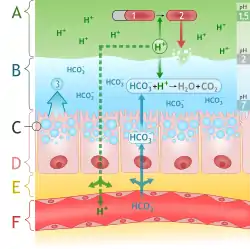
تعدّ حموض المعدة من الإفرازات الرئيسية للمعدة. تتكوّن بشكل رئيسي من حمض الهيدروكلوريك الذي يعمل على زيادة حموضة محتوى المعدة إلى درجة حموضة (pH) تتراوح بين 1 إلى 2.[24][25]
يتمّ فرز أيونات الهيدروجين والكلوريد بشكل منفصل في منطقة رأس المعدة عبر خلايا الجدار من بطانة المعدة لتكوّن شبكة إفرازية تسمّى قنيوات قبل دخولها إلى تجويف المعدة الأنبوبي.[26] يعمل حمض المعدة كمطهر فاتل للكائنات الحية الدقيقة (ميكروبات) لمنع حدوث عدوى ويساعد أيضاً على تفتيت وهضم الطعام. تقوم درجة الحموضة المنخفضة له على انشقاق البروتينات بالتالي تصغيرها عبر الإنزيمات الهاضمة مثل البيبسين. تنشّط كذلك درجة الحموضة المنخفضة النواة المكوّنة للإنزيم (المكوّن الرئيسي له) بيبسينوجين، ليتكوّن الإنزيم الفعّال (النشط) البيبسين عن طريق حدوث انقسام ذاتي. بعد مغادرة المعدة يتعادل كيموس الحمض بمنطقة الاثناعشر من خلال بيكربونات الصوديوم التي تفرزها بعض خلايا المعدة أيضا.[24]
يتمّ حماية المعدة نفسها من إفرازاتها الحمضية القوية عبر إفرازها طبقة سميكة من المخاط وعبر إفراز السيكريتين الذي يعمل على درء بيكربونات الصوديوم. وعندما تفشل هذه الآليات تحدث الحرقة وقرحة المعدة. تعمل أدوية مضادات الهيستامين ومثبّطات مضخّة البروتون على تثبيط إنتاج حمض المعدة، كما تستخدم أدوية مضادات الحموضة على معادلة حموض المعدة الموجودة، أي التي تمّ إفرازها.[24][27]
التطبيقات
حمض الهيدروكلوريك حمض لاعضوي قوي ويستخدم في عمليات صناعية عدّة منها صقل المعادن وتنقيتها. وعادة ما يكون التطبيق هو المحدّد لجودة المنتج المطلوب.[7]
تنظيف سطح الفولاذ
من أهمّ التطبيقات التي يستخدم فيها حمض الهيدروكلوريك في الصناعة هي عملية الصقل الحمضي للفولاذ (التخليل) لإزالة الصدأ أو قشرة أكاسيد الحديد من على السطح قبل القيام بعمليات لاحقة، مثل البثق أو الدرفلة أو الغلفنة أو أيّ معالجات صناعية أخرى.[7][16] عادةً ما تستخدم محاليل من حمض الهيدروكلوريك بتركيز 18% وبجودة تقنية كافية لأغراض صقل الفولاذ الكربوني بدرجاته.
يمكن نظرياً إعادة تدوير حمض الهيدروكلوريك من محلول كلوريد الحديد الثنائي، إّلا أنّ النسبة المرتفعة من الفلزّات الثقيلة في المحاليل المستخدمة في الصقل قلّلت من هذه الممارسة. يمكن أن تتمّ عملية إعادة التدوير من حيث المبدأ بأسلوب التحلّل المائي (الحلمهة) بأسلوب حراري بوجود أكسجين الهواء وفق المعادلة:[7]
وبذلك يتمّ الاسترداد وفق دائرة مغلقة للحمض.[16] أمّا الناتج الثانوي من أكسيد الحديد الثلاثي من عملية إعادة التدوير فهو هام وذو قيمة، بحيث يستخدم في صناعات ثانوية متنوّعة.[7]
إعادة تنشيط المبادلات الأيونية
من تطبيقات حمض الهيدروكلوريك عالي الجودة هو إعادة تنشيط راتنجات المبادلات الأيونية. تعدّ المبادلات الكاتيونية واسعة الاستخدام لإزالة الأيونات مثل أيونات الصوديوم +Na والكالسيوم 2+Ca لإنتاج مياه خالية من المعادن؛ ويستخدم الحمض لإزالة الكاتيونات من على الراتنج (الريزين)،[7] فتحلّ أيونات الهيدروجين محلّ الصوديوم أو الكالسيوم وفق النسب الكيميائية.
تستخدم كلّ من المبادلات الأيونية والمياه غير المعدنية في الكثير من الصناعات الكيميائية والغذائية وفي إنتاج مياه الشرب.[7]
إنتاج المركّبات العضوية
من بين التطبيقات الرئيسية الأخرى لحمض الهيدروكلوريك استخدامه في إنتاج المركّبات العضوية، مثل كلوريد الفاينيل وثنائي كلورو الإيثان من أجل تحضير بولي فاينيل كلوريد PVC. يعدّ هذا غالباً لسدّ حاجات المنتجين بحيث يستهلك حمض الهيدروكلوريك المنتَج محلّياً الذي لا يصل فعلياً للسوق المفتوح. من المركّبات العضوية الأخرى المنتَجة باستخدام حمض الهيدروكلوريك كلّ من: ثنائي الفينول أ لتحضير متعدد الكربونات، والكربون المنشَّط وحمض الأسكوربيك، كذلك في تحضير مجموعة كبيرة من المنتجات الصيدلانية.[16]
يستخدم حمض الهيدروكلوريك في الصناعات الدوائية عادةَ من أجل تحضير أملاح الهيدروكلوريد للمكوّنات الفعالة القاعدية ضعيفة الانحلال في الماء، مثل سيبروفلوكساسين وسيتالوبرام وكلينبوتيرول وكليندامايسين؛ مما يسهّل من تعاطي العقار.[28]
إنتاج المركّبات غير العضوية
يمكن إنتاج العديد من المركّبات انطلاقاً من حمض الهيدروكلوريك عبر تفاعل حمض-قاعدة نمطي، ينتج منه مركّبات غير عضوية من الكلوريدات، وهذا يشمل كيميائيات معالجة الماء مثل كلوريد الحديد الثلاثي وكلوروهيدرات الألومنيوم.
يستخدم كلّ من المركبين المذكورين كعوامل تندّف وتخثير في معالجة مياه الصرف الصحي وإنتاج المياه الصالحة للشرب وصناعة الورق.
من المركّبات غير العضوية الأخرى المنتَجة باستخدام حمض الهيدروكلوريك كلّ من ملح كلوريد الكالسيوم المستخدم في رش الطرقات لإذابة الجليد، وكلوريد النيكل الثنائي للتلبيس الكهربائي (الطلي)، وكلوريد الزنك للجلفنة ولصناعة البطاريات.[16]
ضبط pH الوسط
يستخدم حمض الهيدروكلوريك لضبط حموضة الوسط (pH) في المحاليل.
يستخدم حمض الهيدروكلوريك ذو الجودة العالية في الصناعات التي تتطلّب نقاوة (مثل الصناعات الغذائية والصيدلانية وفي صتاعة مياه الشرب) للتحكّم بدرجة الحموضة لمجاري مياه العملية. أمّا في الصناعات الأقلّ تطلّباً فيستخدم حمض الهيدروكلوريك ذو الجودة التقنية، إذ يفي بالغرض لمعادلة مجاري الفضلات والتحكّم بدرجة حموضة برك السباحة.[16]
أخرى
يستخدم حمض الهيدروكلوريك لعدد واسع من التطبيقات الصغيرة مثل معالجة الجلود، وتنقية الملح، ومستحضرات التنظيف المنزلية،[29] والصناعات الإنشائية.[16] كذلك يستخدم في استخراج النفط حيث يحقن حمض الهيدروكلوريك من أجل إذابة جزء من الصخر والحصول على البنية المسامية؛ وهذه العملية من تحميض الآبار الصخرية شائعة في استخراج نفط بحر الشمال.[7]
يستخدم حمض الهيدروكلوريك لإذابة كربونات الكالسيوم، مثلاَ في إزالة الترسبات في المراجل والغلّايات. كما يستخدم أيضاَ في التطبيقات الإنشائية لإزالة الملاط من بناء الآجر. عند استخدامه على بناء الآجر يحدث التفاعل التالي:
هناك عدّة تفاعلات كيميائية تتضمّن حمض الهيدروكلوريك، ويتم تطبيقها في الصناعات الغذائية مثل تحضير المضافات الغذائية. تشمل المنتجات النموذجية في هذا السياق: الأسبارتام والفركتوز وحمض الليمون (حمض الستريك) واللايسين وفي إنتاج الجيلاتين. يمكن إضافة حمض الهيدروكلوريك ذي النقاوة الكبيرة في الصناعات الغذائية عند الحاجة للمنتج النهائي.[7][16] ولذلك الغرض فللحمض رمز (رقم إي) خاص به وهو E 507.
احتياطات الأمان

| التركيز وزناً |
التصنيف[30] | عبارات التحذير |
|---|---|---|
| 10–25% | مهيّج (Xi) | R36/37/38 |
| > 25% | أكّال (C) | R34 R37 |
يمكن لحمض الهيدروكلوريك عالي التركيز أن يشكّل ضباباً (يوصف حينئذ بحمض الهيدروكلوريك المدخَّن). لكلّ من المحلول والضباب تأثير أكّال على أنسجة الإنسان، حيث يمكن أن يؤذي أعضاء التنفّس والعين والجلد والأمعاء بشكل مستديم وبأثر غير عكسي. في حال انسكاب الحمض على الجلد يتسبّب بحروق جلدية تتراوح درجتها حسب تركيزه.
عند خلط حمض الهيدروكلوريك مع مواد كيميائية مؤكسدة شائعة مثل هيبوكلوريت الصوديوم (المبيّض) أو بيرمنغنات البوتاسيوم ينتج غاز الكلور السام:
تختلف الاحتياطات المتّبعة أثناء التعامل مع المادة باختلاف الكمّية والظروف المحيطة. فعند التعامل بحمض الهيدروكلوريك يجب أخذ الحيطة والحذر، واستعمال واقيات الأعين والقفّازات بالإضافة إلى اللباس الواقي والساحبات الهوائية. عند تعرّض الملابس لامتصاص الحمض يجب أن يمدّد بكمّيات وافرة من الماء ومن ثم الإسراع بطرحها. وعند تعرّض الجلد أو العيون لرذاذ الحمض يتمّ معالجتها مباشرة بالغسل بكمّيات وافرة من الماء و بشكل مطوّل مع استمرار المراقبة الطبية. صنّفت وكالة حماية البيئة الأمريكية حمض الهيدروكلوريك كمادّة سامّة.[31]
المراجع
باللغة العربية
- المرجع في تاريخ العلوم عند العرب نسخة محفوظة 16 ديسمبر 2019 على موقع واي باك مشين.
- KSAG. "بوابة التقدم العلمي - حِمْضُ الهَيْدروكلوريك". مؤرشف من الأصل في 12 أغسطس 2017. اطلع عليه بتاريخ 12 أغسطس 2017. الوسيط
|CitationClass=تم تجاهله (مساعدة) - خالد حربي. "جابر بن حيان". بوابة حراء. مؤرشف من الأصل في 14 أغسطس 2017. اطلع عليه بتاريخ 13 أغسطس 2017. الوسيط
|CitationClass=تم تجاهله (مساعدة)
بلغات أجنبية
- William L. Jolly "Modern Inorganic Chemistry" (McGraw-Hill, 1984), p.177
- "Hydrochloric Acid". مؤرشف من الأصل في 15 أكتوبر 2010. اطلع عليه بتاريخ 16 سبتمبر 2010. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Muriatic Acid" (PDF). PPG Industries. 2005. مؤرشف من الأصل (pdf) في 2 يوليو 2015. اطلع عليه بتاريخ 10 سبتمبر 2010. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Gay-Lussac (1814) "Mémoire sur l'iode" (Memoir on iodine), Annales de Chemie, 91 : 5–160. From page 9: " … mais pour les distinguer, je propose d'ajouter au mot spécifique de l'acide que l'on considère, le mot générique de hydro ; de sorte que le combinaisons acide de hydrogène avec le chlore, l'iode, et le soufre porteraient le nom d'acide hydrochlorique, d'acide hydroiodique, et d'acide hydrosulfurique ; … " ( … but in order to distinguish them, I propose to add to the specific suffix of the acid being considered, the general prefix hydro, so that the acidic combinations of hydrogen with chlorine, iodine, and sulfur will bear the name hydrochloric acid, hydroiodic acid, and hydrosulfuric acid ; … ) نسخة محفوظة 20 مارس 2015 على موقع واي باك مشين.
- Bauer, Hugo (2009). A history of chemistry. BiblioBazaar, LLC. صفحة 31. ISBN 978-1-103-35786-4. مؤرشف من الأصل في 6 أبريل 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Karpenko, V.; Norris, J.A. (2001). "Vitriol in the history of chemistry" (PDF). Chem. Listy. 96: 997. مؤرشف من الأصل (PDF) في 14 فبراير 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Hydrochloric Acid". Chemicals Economics Handbook. معهد ستانفورد للأبحاث. 2001. صفحات 733.4000A–733.3003F. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Norton, S. (2008). "A Brief History of Potable Gold". Molecular Interventions. 8 (3): 120–3. doi:10.1124/mi.8.3.1. PMID 18693188. مؤرشف من الأصل في 6 أبريل 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Thompson, C. J. S. (2002). "Alchemy and Alchemists" (الطبعة Reprint of the edition published by George G. Harrap and Co., London, 1932). Dover Publications, Inc., Mineola, NY: 61, 18. الوسيط
|CitationClass=تم تجاهله (مساعدة); Cite journal requires|journal=(مساعدة) - Leicester, Henry Marshall (1971). The historical background of chemistry. Courier Dover Publications. صفحة 99. ISBN 978-0-486-61053-5. مؤرشف من الأصل في 6 أبريل 2020. اطلع عليه بتاريخ 19 أغسطس 2010. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Waite, A. E. (1992). Secret Tradition in Alchemy (الطبعة public document). Kessinger Publishing. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Von Meyer, Ernst Sigismund (1891). A History of Chemistry from Earliest Times to the Present Day. صفحة 51. مؤرشف من الأصل في 16 ديسمبر 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Priestley, Joseph (1772). "Observations on different kinds of air [i.e., gases]". Philosophical Transactions of the Royal Society of London. 62: 147–264 (234–244). doi:10.1098/rstl.1772.0021. مؤرشف من الأصل في 16 ديسمبر 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Davy, Humphry (1808). "Electro-chemical researches, on the decomposition of the earths; with observations on the metals obtained from the alkaline earths, and on the amalgam procured from ammonia". Philosophical Transactions of the Royal Society of London'. 98: 333–370. doi:10.1098/rstl.1808.0023. مؤرشف من الأصل في 21 سبتمبر 2014.
p. 343: When potassium was heated in muriatic acid gas [i.e., gaseous hydrogen chloride], as dry as it could be obtained by common chemical means, there was a violent chemical action with ignition; and when the potassium was in sufficient quantity, the muriatic acid gas wholly disappeared, and from one-third to one-fourth of its volume of hydrogene was evolved, and muriate of potash [i.e., potassium chloride] was formed. (The reaction was: 2HCl + 2K → 2KCl + H2)
الوسيط|CitationClass=تم تجاهله (مساعدة) - Aftalion, Fred (1991). A History of the International Chemical Industry. Philadelphia: University of Pennsylvania Press. ISBN 0-8122-1297-5. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (الطبعة الثانية). Butterworth-Heinemann. صفحات 946–48. ISBN 0-08-037941-9. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Lide, David (2000). CRC Handbook of Chemistry and Physics (الطبعة 81st). CRC Press. ISBN 0-8493-0481-4. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Perry, R.; Green D.; Maloney J. (1984). Perry's Chemical Engineers' Handbook (الطبعة 6th). McGraw-Hill Book Company. ISBN 0-07-049479-7. مؤرشف من الأصل في 16 ديسمبر 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Dissociation constants pKa and pKb". ChemBuddy.com. مؤرشف من الأصل في 9 أكتوبر 2018. اطلع عليه بتاريخ 06 سبتمبر 2008. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Mendham, J.; Denney, R. C.; Barnes, J. D.; Thomas, M.J.K.; Denney, R. C.; Thomas, M. J. K. (2000). Vogel's Quantitative Chemical Analysis (الطبعة 6th). New York: Prentice Hall. ISBN 0-582-22628-7. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Systemnummer 6 Chlor". Gmelins Handbuch der Anorganischen Chemie. Chemie Berlin. 1927. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Systemnummer 6 Chlor, Ergänzungsband Teil B – Lieferung 1". Gmelins Handbuch der Anorganischen Chemie. Chemie Weinheim. 1968. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Aspen Properties. (الطبعة calculations by Akzo Nobel Engineering). Aspen Technology. 2002–2003. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Maton, Anthea; Jean Hopkins; Charles William McLaughlin; Susan Johnson; Maryanna Quon Warner; David LaHart; Jill D. Wright (1993). Human Biology and Health. Englewood Cliffs, New Jersey, USA: Prentice Hall. ISBN 0-13-981176-1. مؤرشف من الأصل في 15 ديسمبر 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Haas, Elson. "Digestive Aids:Hydrochloric acid". healthy.net. مؤرشف من الأصل في 7 فبراير 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Arthur, C.; Guyton, M. D.; Hall, John E. (2000). Textbook of Medical Physiology (الطبعة 10th). W.B. Saunders Company. ISBN 0-7216-8677-X. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Bowen, R. (18 March 2003). "Control and Physiologic Effects of Secretin". Colorado State University. مؤرشف من الأصل في 16 أغسطس 2018. اطلع عليه بتاريخ 16 مارس 2009. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Axel Kleemann, Jürgen Engel, Bernd Kutscher und Dietmar Reichert: Pharmaceutical Substances, 4. Auflage (2000), 2 Bände erschienen im Thieme-Verlag Stuttgart, ISBN 978-1-58890-031-9; seit 2003 online mit halbjährlichen Ergänzungen und Aktualisierungen.
- Simhon, Rachel (13 September 2003). "Household plc: really filthy bathroom". ديلي تلغراف. London. مؤرشف من الأصل في 11 نوفمبر 2012. اطلع عليه بتاريخ 31 مارس 2010. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Council Directive 67/548/EEC of 27 June 1967 on the approximation of laws, regulations and administrative provisions relating to the classification, packaging and labelling of dangerous substances". EUR-lex. مؤرشف من الأصل في 26 أغسطس 2017. اطلع عليه بتاريخ 02 سبتمبر 2008. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "HCl score card". وكالة حماية البيئة الأمريكية. مؤرشف من الأصل في 1 سبتمبر 2009. اطلع عليه بتاريخ 12 سبتمبر 2007. الوسيط
|CitationClass=تم تجاهله (مساعدة)