كلوريد الزنك
كلوريد الزنك مركب كيميائي له الصيغة ZnCl2، ويكون على شكل بلورات بيضاء.
| كلوريد الزنك | |
|---|---|
 كلوريد الزنك | |
 كلوريد الزنك | |
| الاسم النظامي (IUPAC) | |
كلوريد الزنك | |
| المعرفات | |
| رقم CAS | 7646-85-7 |
| بوب كيم (PubChem) | 3007855 |
مواصفات الإدخال النصي المبسط للجزيئات
| |
| الخواص | |
| الصيغة الجزيئية | ZnCl2 |
| الكتلة المولية | 136.29 غ/مول |
| المظهر | بلورات بيضاء |
| الكثافة | 2.91 غ/سم3 |
| نقطة الانصهار | 283 °س |
| نقطة الغليان | 732 °س |
| الذوبانية في الماء | 432 غ/100 مل ماء |
| الذوبانية | الإيثانول والغليسيرين والأسيتون |
| المخاطر | |
| ترميز المخاطر |  C C
 N N |
| توصيف المخاطر | |
| تحذيرات وقائية | |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
الخواص والبنية
- ينحل كلوريد الزنك بشكل جيد جداً في الماء، حوالي 4.3 كغ لكل 1 ليتر من الماء، كما ينحل بشكل جيد في الإيثانول.
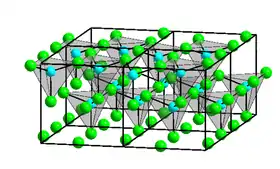
- توجد أربعة أشكال بلورية من كلوريد الزنك، وفي كل منها تكون لأيونات الزنك 2+Zn بنية مثلثية مستوية متساندة إلى أربع أيونات كلوريد.[4] أما في الطور الغازي فتكون لجزيئات كلوريد الزنك بنية خطية وتكون طول الرابطة 205 بيكومتر.[5] يعطي التبريد السريع لمصهور كلوريد الزنك بنية زجاجية لا بلورية صلبة.[6]
- إن الرابطة الكيميائية في كلوريد الزنك هي رابطة تساهمية، وذلك بسبب انخفاض درجة انصهار المركب نسبياً (275°س).[7] ومما يعزز من هذا الرأي هو الانحلالية العالية (الذوبانية) في المحلات اللاقطبية مثل الإيثر، حيث يشكل نواتج إضافة لها الصيغة العامة ZnCl2L2، حيث تمثل L ربيطة مثل ثنائي إيثيل الإيثر.
- يكون لمصهور كلوريد الزنك لزوجة عالية عند نقطة انصهاره، كما يكون له ناقلية كهربائية ضئيلة نسبياً والتي تزداد بشكل ملحوظ مع ارتفاع درجة الحرارة. .[5][8] تظهر أطياف رامان للمصهور وجود بنية بوليميرية.[9] أما دراسة تبعثر النيوترونات فتشير إلى وجود معقدات رباعية الوجوه من {ZnCl4} في بنية المصهور.[10]
- توجد خمسة أشكال مائية (هيدرات) من كلوريد الزنك ZnCl2(H2O)n حيث n = 1, 1.5, 2.5, 3, 4، وعند بَلـْوَرة كلوريد الزنك من محاليله المائية يتشكل ZnCl2(H2O)4 رباعي الهيدرات.[11]
التحضير
يحضر كلوريد الزنك اللامائي من تفاعل الزنك مع كلوريد الهيدروجين حسب المعادلة:
- Zn + 2 HCl → ZnCl2 + H2
أما الأشكال المائية فيحصل عليها من تفاعل الزنك مع حمض الهيدروكلوريك، كما يمكن أن تحضر من تفاعل أكسيد الزنك أو كبريتيد الزنك مع HCl:
ZnS + 2 HCl → ZnCl2 + H2S
الاستخدامات
- يستخدم كلوريد الزنك في الصناعات المعدنية كمادة تساهم في التخلص من الأكاسيد على السطوح المعدنية) flux.
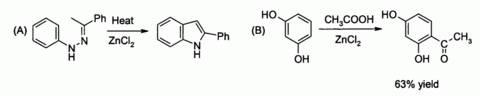
- يستخدم كحفاز في الاصطناع العضوي وذلك بسبب كونه من أحماض لويس. فهو يحفز مثلا A: اصطناع فيشر للإندول[12] و B: تفاعل فريدل-كرافتس المتضمن لحلقة عطرية منشّطة.[13][14]
المراجع
- معرف بوب كيم: https://pubchem.ncbi.nlm.nih.gov/compound/5727 — تاريخ الاطلاع: 19 نوفمبر 2016 — العنوان : Zinc dichloride — الرخصة: محتوى حر
- معرف بوب كيم: https://pubchem.ncbi.nlm.nih.gov/compound/5727
- صفحة البيانات الكيميائية من Alfa [وصلة مكسورة] نسخة محفوظة 9 مارس 2020 على موقع واي باك مشين.
- A.F. Wells (1984). Structural Inorganic Chemistry. Oxford: Clarendon Press. ISBN 0198553706. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Reg. H. Prince (1994). R. Bruce King (المحرر). Encyclopedia of Inorganic Chemistry. John Wiley & Sons. ISBN 0471936200. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Mackenzie, J. D.; Murphy, W. K. (1960). "Structure of Glass-Forming Halides. II. Liquid Zinc Chloride". The Journal of Chemical Physics. 33: 366. doi:10.1063/1.1731151. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Greenwood, Norman N.; Earnshaw, A. (1997), Chemistry of the Elements (2nd ed.), Oxford: Butterworth-Heinemann, ISBN 0-08-037941-9
- H. S. Ray (2006). Introduction to Melts: Molten Salts, Slags and Glasses. Allied Publishers. ISBN 8177648756. الوسيط
|CitationClass=تم تجاهله (مساعدة) - V. Danek (2006). Physico-Chemical Analysis of Molten Electrolytes. Elsevier. ISBN 044452116X. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Price, D L; Saboungi, M -L; Susman, S; Volin, K J; Wright, A C (1991). Journal of Physics Condensed Matter. 3: 9835. doi:10.1088/0953-8984/3/49/001. الوسيط
|CitationClass=تم تجاهله (مساعدة); مفقود أو فارغ|title=(مساعدة) - A. F. Holleman, E. Wiberg (2001). Inorganic Chemistry. Academic Press: San Diego. ISBN 012352651 تأكد من صحة
|isbn=القيمة: length (مساعدة). الوسيط|CitationClass=تم تجاهله (مساعدة) - R. L. Shriner, W. C. Ashley, E. Welch (1955). Organic Syntheses Collective Volume 3. Wiley, New York. صفحة 725. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - S. R. Cooper (1955). Organic Syntheses Collective. 3. Wiley, New York. صفحة 761. الوسيط
|CitationClass=تم تجاهله (مساعدة) - S. Y. Dike, J. R. Merchant, N. Y. Sapre (1991). "A new and efficient general method for the synthesis of 2-spirobenzopyrans: First synthesis of cyclic analogues of precocene I and related compounds". Tetrahedron. 47: 4775. doi:10.1016/S0040-4020(01)86481-4. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link)
- بوابة الكيمياء
- بوابة صيدلة
في كومنز صور وملفات عن: كلوريد الزنك
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.
