أكسيد المغنيسيوم
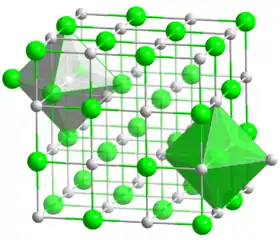
أُكسيد المغنيسيوم (MgO) يمكن الحصول عليه من الدولوميت، سليكات المغنيسيوم المميأة (Talc)، وكربونات المغنيسيوم. تبلغ درجة إنصهار أُوكسيد المغنيسيوم (2800 °C) لذلك يستخدم في المواد الحرارية والعوازل كذلك يمتاز بتمدده المنخفض ومقاومته للتشقق. ويمتلك أُوكسيد المغنيسيوم تركيب بلوري مكعب.
| أكسيد المغنيسيوم | |
|---|---|
 أكسيد المغنيسيوم | |
 أكسيد المغنيسيوم | |
| الاسم النظامي (IUPAC) | |
Magnesium oxide | |
| المعرفات | |
| رقم CAS | 1309-48-4 |
| بوب كيم (PubChem) | 14792 |
مواصفات الإدخال النصي المبسط للجزيئات
| |
| الخواص | |
| الصيغة الجزيئية | MgO |
| الكتلة المولية | 40.3044 g/mol |
| المظهر | White powder |
| الرائحة | Odorless |
| الكثافة | 3.58 g/cm³ |
| نقطة الانصهار | 2852 °س، 3125 °ك، 5166 °ف |
| نقطة الغليان | 3600 °س، 3873 °ك، 6512 °ف |
| الذوبانية في الماء | 0.0086 g/100 mL (30 °C) |
| الذوبانية | Soluble in حمض, أمونياك insoluble in كحول |
| حموضة (pKa) | 10.3 |
| فجوة النطاق | 7.8 eV[2] |
| الناقلية الحرارية | 45–60 W·m−1·K−1[3] |
| معامل الانكسار (nD) | 1.736 |
| البنية | |
| البنية البلورية | هاليت (cubic), رمز بيرسون |
| زمرة فراغية | Fm3m, No. 225 |
| التنسيق الهندسي [الإنجليزية] | Octahedral (Mg2+); octahedral (O2–) |
| كيمياء حرارية | |
| الحرارة القياسية للتكوين ΔfH |
−602 kJ·mol−1[4] |
| إنتروبيا مولية قياسية S |
27 J·mol−1·K−1[4] |
| المخاطر | |
| صحيفة بيانات سلامة المادة | ICSC 0504 |
| فهرس المفوضية الأوروبية | Not listed |
| توصيف المخاطر | |
| مخاطر | حمى أدخنة المعادن, Irritant |
| NFPA 704 |
0
1
0
|
| نقطة الوميض | Non-flammable |
| مركبات متعلقة | |
| أنيونات أخرى | كبريتيد المغنيسيوم |
| كتيونات أخرى | أكسيد البيريليوم أكسيد الكالسيوم أكسيد السترونشيوم أكسيد الباريوم |
| مركبات ذات علاقة | هيدروكسيد المغنيسيوم نتريد المغنيسيوم |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
وقد استخدم أكسيد المغنيسيوم كممدد قلوي في الأشكال الصلبة ويُستخدم كغذاء إضافي وكمُضاد حموضة إما وحده أو بالمشاركة مع هيدروكسيد الألومنيوم. إضافة لذلك فيمكن اعتباره مليناً تناضحياً.
إنتاج
ويتم إنتاج أكسيد المغنيسيوم عن طريق معالجة تكليس من كربونات المغنيسيوم أو هيدروكسيد المغنيسيوم أو عن طريق معالجة كلوريد المغنيسيوم مع الجير تليها الحرارة.
التطبيقات
الطب
يُستخدم كغذاء إضافي وكمُضاد حموضة إما وحده أو بالمشاركة مع هيدروكسيد الألومنيوم . إضافة لذلك فيمكن اعتباره مليناً تناضحياً.
الزمرة الدوائية
ملح من أملاح المغنزيوم مضاد حموضة، وملين.
الاستطباب
- علاج الإمساك العابر القصير الأمد.
- علاج فرط الحموضة المعدية الأعراضي.
آلية التأثير
- يحث على عملية إفراغ الأمعاء باحتباسه للسوائل ضمنها بآلية تناضحية الأمر الذي يؤدي لتمدد الكولون وبالتالي زيادة فعاليته التمعجية.
- يتفاعل مع حمض كلور الماء المعدي ليشكل كلوريد المغنزيوم.
مضادات الاستطباب
- فرط الحساسية للمركب أو لأحد مكوناته.
- التهاب الزائدة، رفو اللفائفي، رفو القولون، التهاب القولون التقرحي، التهاب الرتوج، حصار القلب، أذية العضلة القلبية، اضطراب الوظيفة الكلوية الشديد، التهاب الكبد، داء أديسون.
التأثير على صحة الجسم
إن استخدام أكسيد المغنيسيوم هو استخدام واسع في المجالات الصيدلانية والعلاجية ففي إطار العلاج يُعطى 250-500 ملغ فموياً منه كمُضاد حموضة و 2-5 غ كمُليّن تناضحي .و قد تم تصنيفه في فئة المواد غير السامة إذا أعطي بمقادير مسموحة له ، عند استخدامه كسواغ بالرغم من أن آثاره الجانبية الناشئة عن تأثيره المليّن لا تظهر إلا في الجرعات العالية جداً.
الآثار الجانبية
تحدث بنسبة 1% إلى 10%:
- هضمية: إسهال عند تناوله بجرعة مفرطة.
تحدث بنسبة تقل عن 1%:
- قلبية وعائية: هبوط التوتر الشرياني.
- غدية واستقلابية: فرط مغنزيوم الدم.
- هضمية: مغص بطني.
- عصبية عضلية: ضعف عضلي.
- تنفسية: تثبيط تنفسي.
الجرعة
- البالغين (فموياً):
• إعاضة عوز المغنزيوم: 27-45 مك (1-2 قرص) 2-3 مرات/يوم. • علاج فرط الحموضة المعدية: 0.5-3 أقراص مع الماء أو الحليب 4 مرات/يوم (بعد الوجبات وعند النوم). • علاج الإمساك: 2-4 غرام عند النوم مع كأس كاملة من الماء.
- يجب مراقبة تركيز مغنزيوم المصل عند إعطاء هذا المحضر لمريض تقل تصفية الكرياتينين لديه عن 25 مل/د، ويجب عدم إعطائه للمريض المصاب بالقصور الكلوي الشديد.
الحرائك الدوائية
- يبدأ تأثيره الملين خلال 4-8 ساعات من تناوله.
- الإطراح: تُطرح أيونات المغنزيوم الممتصة (30%) مع البول، وتُطرح غير الممتصة مع البراز.
فرط الجرعة/الانسمام
- قد يحدث اضطراب توازن شاردي خطير ومهدد للحياة عند استخدامه لفترة طويلة أو بجرعة مفرطة بسبب الإسهال المرافق.
- يتظاهر فرط الجرعة بارتفاع تركيز مغنزيوم المصل والتخليط والتثبيط العصبي المركزي وانخفاض التوتر الشرياني والضعف العضلي وحصار النقل العصبي العضلي المحيطي.
- عندما يزيد تركيز مغنزيوم المصل عن 4 مك/ليتر قد نلاحظ ضعف المنعكسات الوترية، وعندما يبلغ 10 مك/ليتر أو أكثر قد نلاحظ غيابها وتطور شلل تنفسي وحصار قلبي.
- يعاطس الكالسيوم الوريدي (5-10 مك) الشلل التنفسي وحصار القلب الناجمين عن الانسمام بالمغنزيوم، وفي حالات نادرة قد يستطب اللجوء للديلزة الدموية والبريتوانية.
- قد يموت المريض في حال زاد تركيز مغنزيوم المصل عن 12 مك/ليتر.
التداخلات الدوائية
- ينقص معدل امتصاص التتراسيكلينات والديجوكسين وأملاح الحديد والإندوميتاسين عند إشراك أحد هذه المحضرات معه.
- إن أوكسيد المغنيسيوم هو أكسيد أساسي و يستطيع أن يتفاعل مع المركبات الحامضية في حالتها الصلبة لإعطاء الأملاح مثل Mg(ibuprophen)2 أو يفسد عقاقير Labile القلويـة.
- يمكن لأوكسيد المغنيسيوم أن يشكل معقدات مع البوليميرات مثال على ذلك إيدرجيت SR يثبط تحرر العقاقير .
التداخلات المخبرية
يسبب تناوله ارتفاع تركيز مغنزيوم المصل وانخفاض تركيز البروتين والكالسيوم والبوتاسيوم.
سلامة الاستعمال
تختلف الاحتياطات المتبعة أثناء التعامل مع أكسيد المغنيسيوم وفقاً للظروف و الكميات المستعملة حيث أنه قد يؤدي إلى أذيات فيما إذا استنشق أو أخذ بجرعات عالية نسبياً و يُعتبر مخرشاً للأعين و الجهاز التنفسي حيث يُنصح باستعمال القفازات و القناع الأنفي أو استخدام جهاز التنفس الاصطناعي ، كما يُنصح بحماية الأعين .
التعليمات الخاصة بالمريض
- أقرط وامضغ الأقراص قبل ابتلاعها، وتناولها مع كأس كاملة من الماء.
- راجع الطبيب في حال عدم تحسن الألم البطني أو في حال ظهور إحدى علامات النزف الهضمي.
تحذيرات
- استخدمه بحذر عند المريض المسن أو الذي يُعالج بالليثيوم.
- قد يسبب تناوله إسهالاً شديداً يترافق مع اضطراب التوازن المائي والشاردي.
- اسستخدمه بحذر عند المريض المصاب باضطراب الوظيفة الكلوية ولا سيما إن كانت تصفية الكرياتينين تقل عن 30 مل/د حيث قد يتراكم في الجسم مسبباً الانسمام بالمغنزيوم.
- استخدمه بحذر عند المريض الذي يتناول أحد محضرات الديجيتال لأنه قد يسبب الحصار.
- استخدمه بحذر عند المريض الذي يتناول أحد الليثيوم أو المرخيات العضلية أو مثبطات الجملة العصبية المركزية.
معلومات إضافية
يحوي هذا المحضر المغنيسيوم العنصري بنسبة 60% (49.6 مك مغنزيوم/غ)
المستحضرات الصيدلانية
- كبسول: 140 ملغ.
- أقراص: 400 ملغ، 425 ملغ.
المصادر
- كتاب الشامل في الأدوية السريرية، د.محمد عبد الرحمن العينية - د.محمود موسى طلوزي، منشورات دار القدس للعلوم.
- معرف بوب كيم: https://pubchem.ncbi.nlm.nih.gov/compound/14792 — تاريخ الاطلاع: 4 أكتوبر 2016 — العنوان : MAGNESIUM OXIDE — الرخصة: محتوى حر
- Taurian, O.E.; Springborg, M.; Christensen, N.E. (1985). "Self-consistent electronic structures of MgO and SrO" (PDF). Solid State Communications. 55 (4): 351–5. Bibcode:1985SSCom..55..351T. doi:10.1016/0038-1098(85)90622-2. مؤرشف من الأصل (PDF) في 3 مارس 2016. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Application of magnesium compounds to insulating heat-conductive fillers. konoshima.co.jp [وصلة مكسورة] نسخة محفوظة 30 ديسمبر 2013 على موقع واي باك مشين.
- Zumdahl, Steven S. (2009). Chemical Principles (الطبعة 6th). Houghton Mifflin Company. صفحة A22. ISBN 0-618-94690-X. الوسيط
|CitationClass=تم تجاهله (مساعدة)
- بوابة الكيمياء
- بوابة صيدلة
- بوابة طب
- بوابة علم المواد

