أكسيد البيريليوم
أكسيد البيريليوم مركب كيميائي له الصيغة BeO، ويكون على شكل بلورات بيضاء.
| أكسيد البيريليوم[1] | |
|---|---|
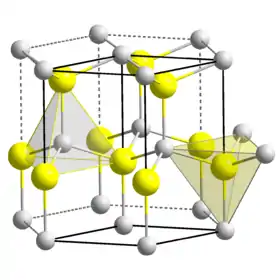 أكسيد البيريليوم | |
| الاسم النظامي (IUPAC) | |
Beryllium oxide | |
| المعرفات | |
| رقم CAS | 1304-56-9 |
| بوب كيم (PubChem) | 14775 |
مواصفات الإدخال النصي المبسط للجزيئات
| |
| الخواص | |
| الصيغة الجزيئية | BeO |
| الكتلة المولية | 25.01 غ/مول |
| المظهر | بلورات بيضاء |
| الكثافة | 3.01 غ/سم3 |
| نقطة الانصهار | 2575 °س |
| نقطة الغليان | ~ 3900 °س |
| الذوبانية في الماء | غير منحل في الماء |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
التحضير
يوجد أكسيد البيريليوم طبيعياً في معدن بروميليت Bromellite، والذي عثر عليه لأول مرة في منجم في السويد.[4]
يحضّر أكسيد البيريليوم مخبرياً من إجراء عملية تكليس لمركب كربونات البيريليوم:
أو من إجراء عملية نزع ماء من هيدروكسيد البيريليوم:
أو من الأكسدة المباشرة للفلز، والتي غالباً ما تحدث تلقائياً نتيجة النشاط الكيميائي الكبير لفلز البيريليوم.
مع ضرورة الإشارة إلى أن إشعال الفلز بأكسجين الهواء يعطي مزيجاً من أكسيد البيريليوم ونتريد البيريليوم Be3N2.[5]
الخواص
على العكس من أكاسيد بقية عناصر الفلزات القلوية الترابية، والتي تكون ذات صفة قاعدية، فإن أكسيد البيريليوم له صفة مذبذبة.
يتحمّل أكسيد البيريليوم درجات الحرارة العالية، ويبدي مقاومة للمحاليل الحمضية والقلوية الممددة. ينحل أكسيد البيريليوم في محلول بيفلوريد الأمونيوم (NH4HF2) كما في محلول كبريتات الأمونيوم NH4)2SO4) المائي الساخن، وكذلك في حمض الكبريتيك المركز الساخن.
على العكس من أكاسيد المجموعة الثانية في الجدول الدوري، مجموعة الفلزات القلوية الترابية، والتي تتبلور أكاسيدها (MgO و CaO و SrO وBaO) وفق النظام البلوري المكعب، فإن لأكسيد البيريليوم بنية بلورية تتبع النظام البلّوري السداسي وفق بنية الفورتزيت،[5] مع وجود مراكز رباعية من 2+Be و 2-O، كما في لونسداليت ونتريد البورون BN، المتساويان إلكترونياً مع BeO. عند درجات حرارة مرتفعة يحدث هناك تحوّل في بنية أكسيد البيريليوم وتصبح وفق النظام البلوري الرباعي.[6]
الاستخدامات
إن أكسيد البيريليوم الملبّد له استخدامات في مجال صناعة الخزف.[7]
نتيجة لخصائصه الحرارية والكهربائية المميزة، يستخدم أكسيد البيريليوم في صناعة أشباه الموصلات وفي الصمّامات المفرغة وفي الصمّامات المغناطيسية الإلكترونية وفي الأجزاء المكوّنة في ليزر الغاز.
احتياطات الأمان
إن البيريليوم ومركباته عبارة عن مواد سامة ومسرطنة، والتي يمكن ان تسبب مرض البيريليوم المزمن. لذا يجب أخذ الحيطة والحذر عند التعامل مع هذه المادة.
المراجع
- صفحة بيانات المادة من شركة Alfa [وصلة مكسورة] نسخة محفوظة 26 يناير 2020 على موقع واي باك مشين.
- معرف بوب كيم: https://pubchem.ncbi.nlm.nih.gov/compound/14775 — تاريخ الاطلاع: 7 أكتوبر 2016 — العنوان : BERYLLIUM OXIDE — الرخصة: محتوى حر
- معرف بوب كيم: https://pubchem.ncbi.nlm.nih.gov/compound/14775
- Gmelins Handbuch der Anorganischen Chemie, BERYLLIUM, System Nummer 26, Achte Auflage, Verlag Chemie GmbH Berlin 1930.
- Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 0080379419.
- A.F. Wells (1984). Structural Inorganic Chemistry (الطبعة 5). Oxford Science Publications. ISBN 0-19-855370-6. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Günter Petzow, Fritz Aldinger, Sigurd Jönsson, Peter Welge, Vera van Kampen, Thomas Mensing, Thomas Brüning"Beryllium and Beryllium Compounds" in Ullmann's Encyclopedia of Industrial Chemistry 2005, Wiley-VCH, Weinheim. doi:10.1002/14356007.a04_011.pub2
- بوابة الكيمياء