نصف القطر الأيوني
نصف القطر الأيوني هو نصف قطر أيون لذرة ما. على الرغم من صعوبة تحديد شكل نهائي للذرات أو للأيونات، إلا أنه يمكن اعتبارها على شكل كرات ذات أنصاف أقطار، بحيث أنه في مركب أيوني يكون مجموع نصفي قطر الكاتيون (الحامل للشحنة الموجية) والأنيون (الحامل للشحنة السالبة) يعطي في النهاية المسافة بين الأيونات في الشبكة البلورية.
تقاس أنصاف الأقطار الأيونية بوحدات من أبعاد البيكومتر (pm) أو الأنغستروم (Å). عادةً ما تتراوح أنصاف الأقطار الأيونية بين 30 إلى 200 بيكومتر (0.3 إلى 2 أنغستروم).
صفات عامة
| X− | NaX | AgX |
|---|---|---|
| F | 464 | 492 |
| Cl | 564 | 555 |
| Br | 598 | 577 |
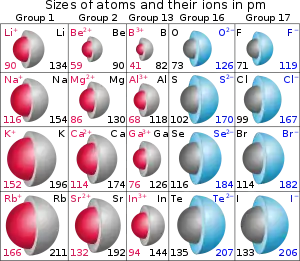
يمكن أن تكون الأيونات أكبر أو أصغر من الذرات المعتدلة، وذلك حسب شحنة الأيون. عندما تفقد الذرة إلكترون ما من مدارها الخارجي لتشكّل كاتيون، فإن الإلكترون المفقود لم يعد يساهم في وقاية الإلكترونات الأخرى من تأثير شحنة النواة، وبالتالي، فإن الإلكترونات الأخرى تنجذب بقوة أكبر إلى النواة، مما يجعل نصف قطر النواة أصغر. بالمقابل، فإنه عند إضافة إلكترون إلى النواة وتشكيل أنيون فإن الإلكترون المضاف يقلل من تأثير الحجب المذكور، مما يؤدي إلى زيادة نصف قطر النواة.
إن نصف القطر الأيوني عبارة عن خاضيّة متغيّرة وليست ثابتة، أي أنها تتغيّر بتغيّر العدد التساندي وحالة اللف المغزلي بالنسبة للإلكترونات d، بالإضافة إلى عوامل أخرى. ولكن على الرغم من ذلك، فإن قيم نصف القطر الأيوني تحدد غالباً بالمقارنة بين المركبات المختلفة لإظهار التفاوت.
تحديد نصف القطر الأيوني
تحدد المسافة بين أيونين في الشبكة البلورية باستخدام علم دراسة البلورات بالأشعة السينية، والذي يعطي أبعاد وحدة الخلية في البلورة. على سبيل المثال، فإن أبعاد وحدة الخلية في بلورة كلوريد الصوديوم يبلغ 564.02 بيكومتر. إن كل طرف من وحدة الخلية يمكن اعتباره حسب الترتيب Na+∙∙∙Cl−∙∙∙Na+، أي أن البعد هو ضعف المسافة بين Na-Cl، أي 282.01 بيكومتر.
خلال سنوات عدة كانت هناك تقديرات وحسابات مختلفة لأنصاف الأقطار الأيونية. قام ألفرد لانده Alfred Landé بإجراء تقديرات لأنصاف الأقطار الأيونية وذلك للمركبات الأيونية التي فيها تفاوت كبير في الحجم مثل يوديد الليثيوم LiI.[1] إن أيونات الليثيوم صغيرة مقارنة مع أيونات اليود، بحيث أن الليثيوم يسع في الثقوب ضمن الشيكة البلورية التي تشكلها أيونات اليود، مما يسمح نظرياً بتماس أيونات اليود مع بعضها، وبالتالي، فإن المسافة بين أيوني يود متجاورين هو قطر أيون اليود، أي أن نصف المسافة هو نصف القطر. على هذا الأساس ثبت لانده نصف قطر اليود على أساس 214 بيكومتر، وأصبح بالإمكان معرفة نصف قطر الكاتيونات الأخرى في مركبات اليوديد.
قام العالم واساستجيرنا Wasastjerna بتقدير أنصاف القطر الأيونية عن طريق الحجم النسبي للأيونات المستحصل عن طريق الاستقطاب الكهربائي، والذي يحدد عن طريق قرينة الانكسار للبلورات.[2] هذه النتائج جرى توسيعها من قبل فكتور غولدشميت Victor Goldschmidt والذي أعطى أنيون الأكسيد 2−O قيمة نصف قطر مقدارها 132 بيكومتر..[3]
استخدم باولنغ قيم الشحنة النووية الفعالة لوضع تناسب بين مسافات الأيونات وذلك إلى أنصاف قطر أنيونية وكاتيونية.[4] وأعطت بياناته قيمة مقدارها 140 بيكومتر كنص قطر لأيون 2−O.
جرت هناك عملية مراجعة لقيم أنصاف الأقطار الأيونية من قبل شانون Shannon، والذي أعطى قيم لأنصاف الأقطار حسب العدد التساندي.[5]
| العدد الذري | الاسم | الرمز | 3– | 2– | 1– | 1+ | 2+ | 3+ | 4+ | 5+ | 6+ | 7+ | 8+ |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 3 | ليثيوم | Li | 90 | ||||||||||
| 4 | بيريليوم | Be | 59 | ||||||||||
| 5 | بورون | B | 41 | ||||||||||
| 6 | كربون | C | 30 | ||||||||||
| 7 | نيتروجين | N | 132 (4) | 30 | 27 | ||||||||
| 8 | أكسجين | O | 126 | ||||||||||
| 9 | فلور | F | 119 | 22 | |||||||||
| 11 | صوديوم | Na | 116 | ||||||||||
| 12 | مغنسيوم | Mg | 86 | ||||||||||
| 13 | ألومنيوم | Al | 67.5 | ||||||||||
| 14 | سيليكون | Si | 54 | ||||||||||
| 15 | فوسفور | P | 58 | 52 | |||||||||
| 16 | كبريت | S | 170 | 51 | 43 | ||||||||
| 17 | كلور | Cl | 167 | 26 (3py) | 41 | ||||||||
| 19 | بوتاسيوم | K | 152 | ||||||||||
| 20 | كالسيوم | Ca | 114 | ||||||||||
| 21 | سكانديوم | Sc | 88.5 | ||||||||||
| 22 | تيتانيوم | Ti | 100 | 81 | 74.5 | ||||||||
| 23 | فاناديوم | V | 93 | 78 | 72 | 68 | |||||||
| 24 | كروم لف مغزلي منخفض | Cr | 87 | 75.5 | 69 | 63 | 58 | ||||||
| 24 | كروم لف مغزلي مرتفع | Cr | 94 | ||||||||||
| 25 | منغنيز لف مغزلي منخفض | Mn | 81 | 72 | 67 | 47 (4) | 39.5 (4) | 60 | |||||
| 25 | منغنيز لف مغزلي مرتفع | Mn | 97 | 78.5 | |||||||||
| 26 | حديد لف مغزلي منخفض | Fe | 75 | 69 | 72.5 | 39 (4) | |||||||
| 26 | حديد لف مغزلي مرتفع | Fe | 92 | 78.5 | |||||||||
| 27 | كوبالت لف مغزلي منخفض | Co | 79 | 68.5 | |||||||||
| 27 | كوبالت لف مغزلي مرتفع | Co | 88.5 | 75 | 67 | ||||||||
| 28 | نيكل لف مغزلي منخفض | Ni | 83 | 70 | 62 ls | ||||||||
| 28 | نيكل لف مغزلي مرتفع | Ni | 74 | ||||||||||
| 29 | نحاس | Cu | 91 | 87 | 68 ls | ||||||||
| 30 | زنك | Zn | 88 | ||||||||||
| 31 | غاليوم | Ga | 76 | ||||||||||
| 32 | جرمانيوم | Ge | 87 | 67 | |||||||||
| 33 | زرنيخ | As | 72 | 60 | |||||||||
| 34 | سيلينيوم | Se | 184 | 64 | 56 | ||||||||
| 35 | بروم | Br | 182 | 73 (4sq) | 45 (3py) | 53 | |||||||
| 37 | روبيديوم | Rb | 166 | ||||||||||
| 38 | سترونشيوم | Sr | 132 | ||||||||||
| 39 | إتريوم | Y | 104 | ||||||||||
| 40 | زركونيوم | Zr | 86 | ||||||||||
| 41 | نيوبيوم | Nb | 86 | 82 | 78 | ||||||||
| 42 | موليبدنوم | Mo | 83 | 79 | 75 | 73 | |||||||
| 43 | تكنيشيوم | Tc | 78.5 | 74 | 70 | ||||||||
| 44 | روثينيوم | Ru | 82 | 76 | 70.5 | 52 (4) | 50 (4) | ||||||
| 45 | روديوم | Rh | 80.5 | 74 | 69 | ||||||||
| 46 | بالاديوم | Pd | 73 (2) | 100 | 90 | 75.5 | |||||||
| 47 | فضة | Ag | 129 | 108 | 89 | ||||||||
| 48 | كادميوم | Cd | 109 | ||||||||||
| 49 | إنديوم | In | 94 | ||||||||||
| 50 | قصدير | Sn | 83 | ||||||||||
| 51 | أنتيموان | Sb | 90 | 74 | |||||||||
| 52 | تيلوريوم | Te | 207 | 111 | 70 | ||||||||
| 53 | يود | I | 206 | 109 | 67 | ||||||||
| 54 | زينون | Xe | 62 | ||||||||||
| 55 | سيزيوم | Cs | 181 | ||||||||||
| 56 | باريوم | Ba | 149 | ||||||||||
| 57 | لانثانوم | La | 117.2 | ||||||||||
| 58 | سيريوم | Ce | 115 | 101 | |||||||||
| 59 | براسيوديميوم | Pr | 113 | 99 | |||||||||
| 60 | نيوديميوم | Nd | 143 (8) | 112.3 | |||||||||
| 61 | بروميثيوم | Pm | 111 | ||||||||||
| 62 | ساماريوم | Sm | 136 (7) | 109.8 | |||||||||
| 63 | يوروبيوم | Eu | 131 | 108.7 | |||||||||
| 64 | غادولينيوم | Gd | 107.8 | ||||||||||
| 65 | تيربيوم | Tb | 106.3 | 90 | |||||||||
| 66 | ديسبروسيوم | Dy | 121 | 105.2 | |||||||||
| 67 | هولميوم | Ho | 104.1 | ||||||||||
| 68 | إربيوم | Er | 103 | ||||||||||
| 69 | ثوليوم | Tm | 117 | 102 | |||||||||
| 70 | إتربيوم | Yb | 116 | 100.8 | |||||||||
| 71 | لوتيشيوم | Lu | 100.1 | ||||||||||
| 72 | هافنيوم | Hf | 85 | ||||||||||
| 73 | تانتالوم | Ta | 86 | 82 | 78 | ||||||||
| 74 | تنغستن | W | 80 | 76 | 74 | ||||||||
| 75 | رينيوم | Re | 77 | 72 | 69 | 67 | |||||||
| 76 | أوزميوم | Os | 77 | 71.5 | 68.5 | 66.5 | 53 (4) | ||||||
| 77 | إريديوم | Ir | 82 | 76.5 | 71 | ||||||||
| 78 | بلاتين | Pt | 94 | 76.5 | 71 | ||||||||
| 79 | ذهب | Au | 151 | 99 | 71 | ||||||||
| 80 | زئبق | Hg | 133 | 116 | |||||||||
| 81 | ثاليوم | Tl | 164 | 102.5 | |||||||||
| 82 | رصاص | Pb | 133 | 91.5 | |||||||||
| 83 | بزموت | Bi | 117 | 90 | |||||||||
| 84 | بولونيوم | Po | 108 | 81 | |||||||||
| 85 | أستاتين | At | 76 | ||||||||||
| 87 | فرانسيوم | Fr | 194 | ||||||||||
| 88 | راديوم | Ra | 162 (8) | ||||||||||
| 89 | أكتينيوم | Ac | 126 | ||||||||||
| 90 | ثوريوم | Th | 108 | ||||||||||
| 91 | بروتكتينيوم | Pa | 116 | 104 | 92 | ||||||||
| 92 | يورانيوم | U | 116.5 | 103 | 90 | 87 | |||||||
| 93 | نبتونيوم | Np | 124 | 115 | 101 | 89 | 86 | 85 | |||||
| 94 | بلوتونيوم | Pu | 114 | 100 | 88 | 85 | |||||||
| 95 | أمريسيوم | Am | 140 (8) | 111.5 | 99 | ||||||||
| 96 | كوريوم | Cm | 111 | 99 | |||||||||
| 97 | بيركليوم | Bk | 110 | 97 | |||||||||
| 98 | كاليفورنيوم | Cf | 109 | 96.1 | |||||||||
| 99 | أينشتاينيوم | Es | 92.8[6] |
طالع أيضاً
المراجع
- Landé, A. (1920). "Über die Größe der Atome". Zeitschrift für Physik. 1 (3): 191–197. Bibcode:1920ZPhy....1..191L. doi:10.1007/BF01329165. مؤرشف من الأصل في 27 يناير 2020. اطلع عليه بتاريخ 01 يونيو 2011. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Wasastjerna, J. A. (1923). "On the radii of ions". Comm. Phys.-Math., Soc. Sci. Fenn. 1 (38): 1–25. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Goldschmidt, V. M. (1926). Geochemische Verteilungsgesetze der Elemente. Skrifter Norske Videnskaps—Akad. Oslo, (I) Mat. Natur. الوسيط
|CitationClass=تم تجاهله (مساعدة) This is an 8 volume set of books by Goldschmidt. - لينوس باولنغ (1960). The Nature of the Chemical Bond (3rd Edn.). Ithaca, NY: Cornell University Press.
- R. D. Shannon (1976). "Revised effective ionic radii and systematic studies of interatomic distances in halides and chalcogenides". Acta Cryst. A32: 751–767. Bibcode:1976AcCrA..32..751S. doi:10.1107/S0567739476001551. الوسيط
|CitationClass=تم تجاهله (مساعدة) - R. G. Haire, R. D. Baybarz: "Identification and Analysis of Einsteinium Sesquioxide by Electron Diffraction", in: Journal of Inorganic and Nuclear Chemistry, 1973, 35 (2), S. 489–496; doi:10.1016/0022-1902(73)80561-5.
- بوابة الكيمياء
- بوابة علم الأحجار الكريمة والمجوهرات
- بوابة علم المواد
- بوابة علم طبقات الأرض