إلكترون تكافؤ
في الكيمياء إلكترونات التكافؤ هي الإلكترونات الموجودة في أغلفة التكافؤ (آخر مستويات الإلكترونية) للذرة، والتي تميل لأن تشارك في التفاعلات الكيميائية عن طريق الترابط مع الذرات أو الجزيئات أو الأيونات الأخرى.[1]
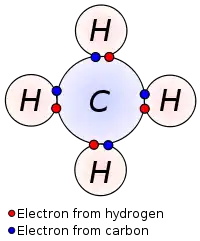
4 روابط تساهمية لذرة الكربون التي تملك 4 إلكترونات تكافؤ مع كل ذرة هيدروجين والتي تملك إلكترون تكافؤ واحد بكل ذرة.
عدد إلكترونات التكافؤ في الذرة تحدد الخواص الكيميائية للعنصر، ولهذا فإن العناصر التي لها نفس عدد الإلكترونات في الغلاف الخارجي يكون لها خصائص كيميائية متشابهة. والروابط هي وسيلة توصيل الذرات ببعضها لتكوين المركبات، ومن أنواع هذه الروابط الروابط التساهمية والتي هي الأساس في المركبات العضوية.
ومن أنواع الروابط الكيميائية الروابط الأيونية، والتي تقوم بتوصيل كل من الأيونات الموجبة (الكاتيونات) بالايونات السالبة (الأنيونات)، وينتج من ذلك مركب أيوني. وتصبح الذرة كاتيون بفقد إلكترون أو أكثر، وعند اكتسابها لإلكترون أو أكثر تصبح أنيون.
انظر أيضاً
مراجع
- THE ORDER OF FILLING 3d AND 4s ORBITALS. chemguide.co.uk نسخة محفوظة 31 ديسمبر 2017 على موقع واي باك مشين.
في كومنز صور وملفات عن: إلكترون تكافؤ
- بوابة كيمياء فيزيائية
- بوابة علوم
- بوابة الفيزياء
- بوابة الكيمياء
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.
