هيدريد ألومنيوم الليثيوم
هيدريد ألومنيوم الليثيوم مركب كيميائي له الصيغة LiAlH4، ويرمز له اختصارًا بـ LAH، ويكون على شكل بلورات بيضاء، إلا أن العينات التجارية منه قد تبدو ذات لون رمادي بسبب الإشابة،[4] وهو عامل مختزل مهم في الاصطناع العضوي.
| هيدريد ألومنيوم الليثيوم | |
|---|---|
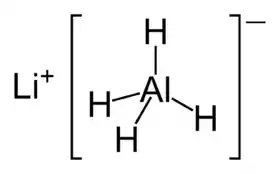 هيدريد ألومنيوم الليثيوم | |
| الاسم النظامي (IUPAC) | |
هيدريد ألومنيوم الليثيوم | |
| المعرفات | |
| رقم CAS | 16853-85-3 |
| بوب كيم (PubChem) | 28112 |
مواصفات الإدخال النصي المبسط للجزيئات
| |
| الخواص | |
| الصيغة الجزيئية | LiAlH4 |
| الكتلة المولية | 37.95 غ/مول |
| المظهر | بلورات بيضاء |
| الكثافة | 0.92 غ/سم3 |
| نقطة الانصهار | 125 °س يتفكك |
| الذوبانية في الماء | يتفاعل |
| المخاطر | |
| ترميز المخاطر |  F F |
| توصيف المخاطر | |
| تحذيرات وقائية | |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
التحضير

حضر هيدريد ألومنيوم الليثيوم لأول مرة من قبل فينهولت (Finholt) وبوند (Bond) وشليسنغر (Schlesinger) عام 1947.[5]
يحضر مركب هيدريد ليثيوم ألومنيوم من تشكيل مستعلق من هيدريد الليثيوم وكلوريد الألومنيوم في وسط من ثنائي إيثيل الإيثر.[6] يزال كلوريد الليثيوم كناتج ثانوي بإجراء عملية تصفية، ثم بإزالة الإيثر بالتبخير فنحصل على الناتج المطلوب:
أما صناعيًا، فإن طريقة التحضير تتضمن تحضير لمركب هيدريد ألومنيوم الصوديوم، وذلك من العناصر المكونة له عند ضغوط ودرجات حرارة مرتفعة,[7] حسب المعادلة:
بإضافة كلوريد الليثيوم، يحدث تفاعل تبادل ونحصل على الناتج المطلوب.
هذه الطريقة ذات مردود عال، ويحوي الناتج على نسبة 1% وزنًا w/w من كلوريد الليثيوم.[7]
الخواص
تحترق البلورات الدقيقة والنقية من هيدريد ألومنيوم الليثيوم عند تعرضها لأكسجين الهواء الجوي، في حين أن البلورات الكبيرة لا تظهر هذه الخاصية.[8] تحوي بعض العينات التجارية من هيدريد ألومنيوم الليثيوم على زيت معدني لمنع التفاعل مع الرطوبة الجوية، لكن الشائع هو تغليف العبوات بأكياس بلاستيكية حاجبة للرطوبة.[9]
البنية
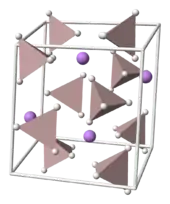
يتبلور هيدريد ألومنيوم الليثيوم حسب النظام البلوري أحادي الميل وله المجموعة الفراغية P21c، وتعرف وحدة الخلية كالتالي: a = 4.82 و b = 7.81 و و c = 7.92 Å و α = γ = 90° وβ = 112°. تتألف البنية من مراكز أيونات الليثيوم الموجبة +Li، والتي يحاط كل منها بخمس رباعيات سطوح من -AlH4. ترتبط مراكز أيونات الليثيوم بذرة هيدروجين من كل رباعي سطوح بحيث نحصل بالنهاية على شكل هرمي مضاعف bipyramid. أما عند تعريض المركب لضغوط مرتفعة (>2.2 GPa) فنحصل على النمط بيتا β-LAH من المركب.[10]
الانحلالية
يتفاعل هيدريد ألومنيوم الليثيوم بعنف مع الماء في تفاعل حلمهة [4] وذلك حسب التفاعل:
يمثل هذا التفاعل وسيلة لتحضير غاز الهيدروجين مخبريًا. يمكن الكشف عن العبوات المتقادمة من هيدريد ألومنيوم الليثيوم، بوجود مزيج أبيض من هيدروكسيد الليثيوم وهيدروكسيد الألومنيوم.[11]
ينحل هيدريد ألومنيوم الليثيوم في العديد من المركبات الإيثرية، لكنه يمكن أن يتفكك فيها عند وجود شوائب تحفز تفاعل التفكك. في المقابل، وجد أن المركب ثابت في وسط من رباعي هيدرو الفوران على الرغم أنه أقل انحلالية فيه من ثنائي إيثيل الإيثر على سبيل المثال.[12]
| درجة الحرارة (°س) | |||||
| المحل | 0 | 25 | 50 | 75 | 100 |
| ثنائي إيثيل الإيثر | – | 5.92 | – | – | – |
| رباعي هيدرو الفوران | – | 2.96 | – | – | – |
| ثنائي ميثوكسي الإيثان | 1.29 | 1.80 | 2.57 | 3.09 | 3.34 |
| مضاعف ثنائي ميثوكسي إيثيل الإيثر | 0.26 | 1.29 | 1.54 | 2.06 | 2.06 |
| ثلاثي ثنائي ميثوكسي إيثيل الإيثر | 0.56 | 0.77 | 1.29 | 1.80 | 2.06 |
| رباعي ثنائي ميثوكسي إيثيل الإيثر | 0.77 | 1.54 | 2.06 | 2.06 | 1.54 |
| ديوكسان | – | 0.03 | – | – | – |
| ثنائي بوتيل الإيثر | – | 0.56 | – | – | – |
التفكك الحراري
مركب هيدريد ألومنيوم الليثيوم شبه مستقر عند درجة حرارة الغرفة، حيث يتفكك المركب عند تخزين العينات لفترات طويلة إلى Li3AlH6 وهيدريد الليثيوم.[13] ويمكن لهذا التفكك أن يحفز بوجود آثار من فلزات الحديد أو التيتانيوم أو الفاناديوم.
عند تسخين هيدريد ألومنيوم الليثيوم، فإن المركب يتفكك حراريًا وفق آلية تتكون من ثلاث مراحل: [13][14][15]
يبدأ التفاعل R1 عند انصهار LAH عند درجات حرارة تتراوح بين 150–170 °س,[16][17][18] يلي ذلك مباشرة التفكك إلى الشكل الصلب من Li3AlH6، على الرغم من أن التفاعل R1 يمكن أن يحدث عند درجات حرارة أقل من ذلك.[19] عند حوالي 200°س يتفكك Li3AlH6 إلى هيدريد الليثيوم [13][15][18] حسب R2، وإلى الألومنيوم الذي يتحول حسب R3 إلى LiAl فوق الدرجة 400°س.[15] التفاعل R1 غير عكوس، أما R3 فهو عكوس ويكون الضغط عند التوازن 0.25 بار عند 500 °س. يمكن للتفاعلين R1 و R2، أن يحدثا عند درجة حرارة الغرفة، وذلك باستعمال حفازات ملائمة.[20]
البيانات الترموديناميكية
يتضمن الجدول أدناه البيانات الديناميكية الحرارية لمركب هيدريد ألومنيوم الليثيوم ولبعض تفاعلاته.[21][22] وكذلك قيم تغيرات المحتوى الحراري (الإنثالبية) والإنتروبية وطاقة جيبس الحرة.
| التفاعل | ΔH° (كيلوجول/مول) | ΔS° (جول/(مول·كلفن)) | ΔG° (كيلوجول/مول) | تعليق |
|---|---|---|---|---|
| (Li (s) + Al (s) + 2 H2(g) → LiAlH4 (s | −116.3 | −240.1 | −44.7 | تفاعل التشكيل من العناصر. |
| (LiH (s) + Al (s) + 3/2 H2 (g) → LiAlH4 (s | −25.6 | −170.2 | 23.6 | باستعمال ΔH°f(LiH) = −90.5 و ΔS°f(LiH) = −69.9 و ΔG°f(LiH) = −68.3. |
| (LiAlH4 (s) → LiAlH4 (l | 22 | – | – | حرارة الانصهار. القيمة مشكوك بها. |
| (LiAlH4 (l) → ⅓ Li3AlH6 (s) + ⅔ Al (s) + H2 (g | 3.46 | 104.5 | −27.68 | ΔS° جرى حسابها من قيم ΔH° و ΔG°. |
الاستخدامات
في الكيمياء العضوية
يستخدم هيدريد ألومنيوم الليثيوم بشكل واسع في الكيمياء العضوية كمختزل (عامل اختزال)،[4] وهو أكثر قوة من كاشف بورهيدريد الصوديوم، وذلك بسبب ضعف الرابطة بين الألومنيوم والهيدروجين Al-H مقارنة مع رابطة B-H بين البورون والهيدروجين.[23] يستخدم أيضًا من أجل اختزال الاسترات والأحماض الكربوكسيلية والألدهيدات والكيتونات إلى الكحولات الموافقة. بشكل مشابه، فإنه يحول الأميدات ومركبات النترو والإيمينات والأكسيمات والأزيدات إلى الأمينات الموافقة. يستعمل هيدريد ألومنيوم الليثيوم عادة على النطاق المخبري، وقلما يستعمل على نطاق صناعي، بسبب صعوبة التعامل مع المادة لتفاعليتها الكيميائية المرتفعة، ويفضل عليها استخدام مركب هيدريد مضاعف (2-ميثوكسي إيثوكسي) ألومنيوم الصوديوم المعروف بالاختصار Red-Al والمستخدم بشكل أوسع.[24]
يستعمل هيدريد ألومنيوم الليثيوم بشكل شائع في اختزال الاسترات،[25][26] والأحماض الكربوكسيلية[27] إلى الكحولات الأولية الموافقة. وكانت هذه العملية قبل اكتشاف هيدريد ألومنيوم الليثيوم صعبة نسبيًا، حيث كان الأمر يتطلب استخدام فلز الصوديوم في الإيثانول المغلي، وذلك حسب تفاعل بوفو-بلانك. بالإمكان أيضًا اختزال الألدهيدات والكيتونات باستعمال هيدريد ألومنيوم الليثيوم،[28] إلا أن هذا التفاعل غالبًا ما يجرى باستعمال كواشف ألطف مثل بورهيدريد الصوديوم. وكمثال على اختزال الكيتونات باستعمال LAH، فإن الكيتونات α,β غير المشبعة تختزل إلى الكحولات الأليلية.[29] أما عند اختزال الإيبوكسيدات باستعمال المركب، فإن الكاشف يهاجم الطرف الأقل إعاقة فراغية من الإيبوكسيد مشكلاً كحول ثانوي أو ثالثي. فعلى سبيل المثال تختزل مركبات إيبوكسي حلقي الهكسان بواسطة LAH، لتعطي الكحولات المحورية بشكل مفضل.[30]
Error: imagemap_invalid_image
يمكن الحصول على الأمينات باستخدام هيدريد ألومنيوم الليثيوم في اختزال الأميدات،[31][32] أو الأكسيمات[33] أو النتريلات أو مركبات النترو والأزيدات الموافقة.
يمكن استخدام هيدريد ألومنيوم الليثيوم في اختزال هاليدات الألكيل إلى الألكانات، إلا أن هذا التفاعل لا يطبق إلا نادرًا،[34][35] ووجد أن يوديدات الألكيل هي الأسرع في التفاعل، يليها البروميدات ثم الكلوريدات. أما بالنسبة لتفرع السلسلة الكربونية، فإن الهاليدات الأولية هي الأكثر نشاطًا كيمائيًا، ثم الهاليدات الثانوية. أما الهاليدات الثالثية، فتتفاعل عند شروط معينة.[36] بالمقابل فإن هيدريد ألومنيوم الليثيوم لا يقوم باختزال الألكينات البسيطة، والأرينات، أما الألكاينات فتختزل فقط عند وجود مجموعة كحول قريبة.[37]
في الكيمياء اللاعضوية

يستخدم هيدريد ألومنيوم الليثيوم في الكيمياء اللاعضوية في تحضير هيدريدات الفلزات المختلفة من التفاعل مع الهاليدات. فعلى سبيل المثال يحضر هيدريد الصوديوم من تفاعل LAH مع كلوريد الصوديوم،[21] حسب المعادلة:
كما يقوم هيدريد ألومنيوم الليثيوم بالتفاعل مع العديد من الربيطات اللاعضوية، ليشكل معقدات تساندية للألومنيوم، والتي تساهم أيونات الليثيوم فيها:[21]
تخزين الهيدروجين
يحوي هيدريد ألومنيوم الليثيوم على 10.6% من وزنه هيدروجين، مما يجعل من LAH وسطًا ملائمًا لتخزين الهيدروجين من أجل الاستخدام في خلايا الوقود، إلا أن تفاعل تحرير الهيدروجين يتطلب درجات حرارة مرتفعة نسبيًا (فوق 400 °م)، وهو ما يُشكل عائقًا للاستخدام في خلايا الوقود المستعملة في وسائط النقل. بالإضافة إلى ذلك، فإن هناك مشكلة في إعادة تدوير LiAlH4، والذي يتطلب ضغطًا مرتفعًا جدًا من الهيدروجين بحوالي 10,000 بار،[38] إلا أن الأبحاث لا زالت مستمرة حول هذا الموضوع.
مركبات مشابهة
هنالك العديد من الأملاح المشابهة في تركيبها لهيدريد ألومنيوم الليثيوم، فللحصول على هيدريد ألومنيوم الصوديوم فإن LAH يتفاعل مع هيدريد الصوديوم بتفاعل استبدال في وسط من رباعي هيدرو الفوران:
أما هيدريد ألومنيوم البوتاسيوم، فيحضر بشكل مشابه في وسط من مضاعف (2-ميثوكسي إيثيل) الإيثر المستخدم كمحل[39]
تجدر الإشارة إلى أنه يمكن الحصول على LAH من هيدريد ألومنيوم الصوديوم أو البوتاسيوم، بالتفاعل مع كلوريد أو هيدريد الليثيوم في وسط من ثنائي إيثيل الإيثر أو رباعي هيدرو الفوران.[39]
أما هيدريد ألومنيوم المغنسيوم (ألانات المغنسيوم)، فتحضر من تفاعل LAH مع بروميد المغنسيوم،[40] حسب المعادلة:
المراجع
- معرف بوب كيم: https://pubchem.ncbi.nlm.nih.gov/compound/28112 — تاريخ الاطلاع: 18 نوفمبر 2016 — العنوان : Lithium tetrahydridoaluminate — الرخصة: محتوى حر
- معرف بوب كيم: https://pubchem.ncbi.nlm.nih.gov/compound/28112
- "البيانات الكيميائية من Sigma-Aldrich". مؤرشف من الأصل في 26 مارس 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Gerrans, G.C. and Hartmann-Petersen, P. (2007). Sasol Encyclopaedia of Science and Technology. New Africa Books. صفحة 143. ISBN 1869283848. مؤرشف من الأصل في 21 ديسمبر 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Finholt, A. E.; Bond, A. C.; Schlesinger, H. I. (1947). Journal of the American Chemical Society. 69: 1199. doi:10.1021/ja01197a061. الوسيط
|CitationClass=تم تجاهله (مساعدة); مفقود أو فارغ|title=(مساعدة) - A. E. Finholt, A. C. Bond, H. I. Schlesinger: Lithium Aluminum Hydride, Aluminum Hydride and Lithium Gallium Hydride, and Some of their Applications in Organic and Inorganic Chemistry, in: J. Am. Chem. Soc. 1947, 69, 1199–1203.
- Holleman, A. F., Wiberg, E., Wiberg, N. (2007). Lehrbuch der Anorganischen Chemie, 102nd ed. de Gruyter. ISBN 978-3-11-017770-1. مؤرشف من الأصل في 17 يناير 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Keese, Reinhart; Brändle, Martin and Toube, Trevor Philip (2006). Practical organic synthesis: a student's guide. John Wiley and Sons. صفحة 134. ISBN 0470029668. مؤرشف من الأصل في 20 يوليو 2017. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Andreasen, A.; Vegge, T.; Pedersen, A.S. (2005). "Dehydrogenation kinetics of as-received and ball-milled LiAlH4" (PDF). Journal of Solid State Chemistry. 178: 3672. doi:10.1016/j.jssc.2005.09.027. مؤرشف من الأصل (PDF) في 3 مارس 2016. اطلع عليه بتاريخ أغسطس 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ الوصول=(مساعدة) - Løvvik, O.M.; Opalka, S.M.; Brinks, H.W.; Hauback, B.C. (2004). "Crystal structure and thermodynamic stability of the lithium alanates LiAlH4 and Li3AlH6". Physical Review B. 69: 134117. doi:10.1103/PhysRevB.69.134117. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Pohanish, Richard P. (2008). Sittig's Handbook of Toxic and Hazardous Chemicals and Carcinogens (الطبعة 5th). William Andrew Publishing. صفحة 1540. ISBN 978-0-8155-1553-1. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Mikheeva, V. I.; Troyanovskaya, E. A. (1971). "Solubility of lithium aluminum hydride and lithium borohydride in diethyl ether". Bulletin of the Academy of Sciences of the USSR Division of Chemical Science. 20: 2497. doi:10.1007/BF00853610. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Dymova T. N.; Aleksandrov, D. P.; Konoplev, V. N.; Silina,T. A.; Sizareva; A. S. (1994). Russ. J. Coord. Chem. 20: 279. الوسيط
|CitationClass=تم تجاهله (مساعدة); مفقود أو فارغ|title=(مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Dilts, J. A.; Ashby, E. C. (1972). "Thermal decomposition of complex metal hydrides". Inorganic Chemistry. 11: 1230. doi:10.1021/ic50112a015. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Blanchard, D; Brinks, H; Hauback, B; Norby, P (2004). "Desorption of LiAlH4 with Ti- and V-based additives". Materials Science and Engineering B. 108: 54. doi:10.1016/j.mseb.2003.10.114. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Chen, Jun; Kuriyama, Nobuhiro; Xu, Qiang; Takeshita, Hiroyuki T.; Sakai, Tetsuo (2001). "Reversible Hydrogen Storage via Titanium-Catalyzed LiAlH4and Li3AlH6". The Journal of Physical Chemistry B. 105: 11214. doi:10.1021/jp012127w. الوسيط
|CitationClass=تم تجاهله (مساعدة). - Balema, V (2000). "Solid state phase transformations in LiAlH4 during high-energy ball-milling". Journal of Alloys and Compounds. 313: 69. doi:10.1016/S0925-8388(00)01201-9. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Andreasen, A (2006). "Effect of Ti-doping on the dehydrogenation kinetic parameters of lithium aluminum hydride". Journal of Alloys and Compounds. 419: 40. doi:10.1016/j.jallcom.2005.09.067. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Andreasen, A; Pedersen, A S; Vegge, T (2005). "Dehydrogenation kinetics of as-received and ball-milled LiAlH4". Journal of Solid State Chemistry. 178: 3672. doi:10.1016/j.jssc.2005.09.027. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Balema, V; Wiench, J. W.; Dennis, K. W.; Pruski, M.; Pecharsky, V. K. (2001). "Titanium catalyzed solid-state transformations in LiAlH4 during high-energy ball-milling". Journal of Alloys and Compounds. 329: 108. doi:10.1016/S0925-8388(01)01570-5. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Patnaik, Pradyot (2003). Handbook of Inorganic Chemicals. McGraw-Hill. صفحة 492. ISBN 978-0-07-049439-8. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Smith, Martin B.; Bass, George E. (1963). "Heats and Free Energies of Formation of the Alkali Aluminum Hydrides and of Cesium Hydride". Journal of Chemical & Engineering Data. 8: 342. doi:10.1021/je60018a020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Brown, H. C. (1951). Org. React. 6: 469. الوسيط
|CitationClass=تم تجاهله (مساعدة); مفقود أو فارغ|title=(مساعدة) - "Red-Al, Sodium bis(2-methoxyethoxy)aluminumhydride". مؤرشف من الأصل في 5 يونيو 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Reetz, M. T.; Drewes, M. W.; Schwickardi, R. Organic Syntheses, Coll. Vol. 10, p.256 (2004); Vol. 76, p.110 (1999). (Article) نسخة محفوظة 05 أكتوبر 2012 على موقع واي باك مشين. [وصلة مكسورة]
- Oi, R.; K. Barry Sharpless|Sharpless, K. B. Organic Syntheses, Coll. Vol. 9, p.251 (1998); Vol. 73, p.1 (1996). (Article) نسخة محفوظة 17 فبراير 2012 على موقع واي باك مشين. [وصلة مكسورة]
- Koppenhoefer, B.; Schurig, V. Organic Syntheses, Coll. Vol. 8, p.434 (1993); Vol. 66, p.160 (1988). (Article) نسخة محفوظة 05 أكتوبر 2012 على موقع واي باك مشين. [وصلة مكسورة]
- Barnier, J. P.; Champion, J.; Conia, J. M. Organic Syntheses, Coll. Vol. 7, p.129 (1990); Vol. 60, p.25 (1981). (Article) نسخة محفوظة 05 أكتوبر 2012 على موقع واي باك مشين. [وصلة مكسورة]
- Elphimoff-Felkin, I.; Sarda, P. Organic Syntheses, Coll. Vol. 6, p.769 (1988); Vol. 56, p.101 (1977). (Article) نسخة محفوظة 06 أكتوبر 2012 على موقع واي باك مشين. [وصلة مكسورة]
- Rickborn, Bruce; Quartucci, Joe (1964). "Stereochemistry and Mechanism of Lithium Aluminum Hydride and Mixed Hydride Reduction of 4-t-Butylcyclohexene Oxide". The Journal of Organic Chemistry. 29: 3185. doi:10.1021/jo01034a015. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Seebach, D.; Kalinowski, H.-O.; Langer, W.; Crass, G.; Wilka, E.-M. Organic Syntheses, Coll. Vol. 7, p.41 (1990). (Article) نسخة محفوظة 06 أكتوبر 2012 على موقع واي باك مشين. [وصلة مكسورة]
- Park, C. H.; Simmons, H. E. Organic Syntheses, Coll. Vol. 6, p.382 (1988); Vol. 54, p.88 (1974). (Article) نسخة محفوظة 06 أكتوبر 2012 على موقع واي باك مشين. [وصلة مكسورة]
- Chen, Y. K.; Jeon, S.-J.; Walsh, P. J.; Nugent, W. A. Organic Syntheses, Vol. 82, p.87 (2005). (Article) نسخة محفوظة 06 أكتوبر 2012 على موقع واي باك مشين. [وصلة مكسورة]
- Johnson, J. Enoch; Blizzard, Ronald H.; Carhart, Homer W. (1948). "Hydrogenolysis of alkyl halides by lithium aluminum hydride". Journal of the American Chemical Society. 70 (11): 3664. doi:10.1021/ja01191a035. PMID 18121883. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Krishnamurthy, S.; Brown, Herbert C. (1982). "Selective reductions. 28. The fast reaction of lithium aluminum hydride with alkyl halides in THF. A reappraisal of the scope of the reaction". The Journal of Organic Chemistry. 47: 276. doi:10.1021/jo00341a018. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Carruthers, W. (2004). Some modern methods of organic synthesis. Cambridge University Press. صفحة 470. ISBN 0521311179. مؤرشف من الأصل في 20 مارس 2017. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Wender, P. A.; Holt, D. A.; Sieburth, S. Mc N. Organic Syntheses, Coll. Vol. 7, p.456 (1990); Vol. 64, p.10 (1986). (Article) نسخة محفوظة 06 أكتوبر 2012 على موقع واي باك مشين. [وصلة مكسورة]
- Varin, R A; Czujko, T; Wronski, Z S (2009). Nanomaterials for Solid State Hydrogen Storage (الطبعة 5th). Springer. صفحات 338. ISBN 978-0-387-77711-5. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Santhanam, Ranganathan; Sean Mcgrady, G. (2008). "Synthesis of alkali metal hexahydroaluminate complexes using dimethyl ether as a reaction medium". Inorganica Chimica Acta. 361: 473. doi:10.1016/j.ica.2007.04.044. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Wiberg, Egon; Wiberg, Nils and Holleman, Arnold Frederick (2001). Inorganic chemistry. Academic Press. صفحة 1056. ISBN 0123526515. مؤرشف من الأصل في 26 مارس 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link)
- بوابة الكيمياء