إستر
الاسترات هي صنف من المركبات الكيميائية العضوية لأنها تحتوي على الكربون العضوي، والصيغة العامة لها كالتالي ´R-COO-R تتشكل الاسترات بتفاعل حمض أكسيدي (يحتوي على زمرة الأوكسو X=O) مع مركب هيدروكسيل مثل الكحول أو الفينول.[1] تتشكل الاسترات عادة من الحموض اللاعضوية أو الحموض العضوية حيث يستبدل زمرة -O-ألكيل (ألكوكسي) التي تأتي عادة من الحموض الكربوكسيلية أو الكحولات بزمرة الهيدروكسيل -OH.
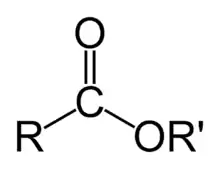
الاسترات واسعة الأنتشار؛ فمعظم الدسم والزيوت الطبيعية هي استرات للغليسرول (أنظر الحموض الدسمة). تستخدم الاسترات ذات الوزن الجزيئي المنخفض عموماً كأرائج (ج: أريج)، فهي توجد في الزيوت العطرية والفيرومونات. وتشكل استرات الفوسفات السلسلة الأساسية في جزيئات DNA. أما استرات النترات، مثل نيتروغليسرين، فهي معروفة بخواصها الانفجارية. ويعد البولي إستر من أهم المواد البلاستيكية.
CH3 COOCH3 يسمى هذا المركب ميثيل ميثيل الإستر أو ثنائي ميثيل الإستر أو الإستر الميثيلي. تتميز الاسترات برائحة مميزة غالباً
CH3-COOC3H7 يسمى هذا المركب بروبيل ميثيل الإستر تنتج الاسترات من تفاعل الإسترة وهو تفاعل الكحول مع حمض بوجود حمض كوسيط.

البنية والترابط
الاسترات تحتوي على الكربونيل في المركز التي تعطي 120 °C-C-O وO-C-O زواية تتكون جزيئاتها من عناصر الكربون والهيدروجين والأكسجين تكون الجزيئات قطبية لاحتوائها على ثلاث روابط قطبية O - C , C - O , C = O - لا تحتوي على هيدروجين حمضي . فهي تميل إلى أن تكون أقل صلابة (انخفاض درجة انصهارها) وأكثر تطايرا (نقطة الغليان أقل) من الأميدات المقابلة [2]
من ضمن الاسترات نجد فوسفات ثنائي هيدروكسي الأسيتون ، الذي له دور كبير في عمليات الأيض في الإنسان والحيوان. وصيغة هذا الإستر:
- HOCH2C(O)CH2OPO32-.
الخواص الفيزيائية للإسترات
1 ـ درجة غليان الإستر أقل من درجة غليان الحمض والكحول المكونين له. وذلك عائد إلى عدم قدرة الاسترات على تكوين الروابط الهيدروجينية بين جزيئاتها.
2 ـ تذوب الاسترات الصغرى في الماء لبروز الصفة القطبية فيها ولتكون روابط هيدروجينية بينها وبين الماء إلا إن هذه الذائبية تقل بازدياد الكتلة الجزيئية. وتُعتبر الإسترات مذيبات مناسبة لبعض المركبات العضوية مثل ميثنوات الإيثيل التي تستخدم لإذابة النيتروسليلوز الذي يدخل في صناعة المفرقعات.
3 ـ توجد الإسترات ذات الكتل الجزيئية المنخفضة على الحالة السائلة، كما أن لمعظمها روائح الأزهار والثمار والزيوت العطرية. لذا تستخدم الإسترات مُكسبات للطعام وفي صناعة العطور. وتقل رائحة الإسترات تدريجياً بارتفاع الكتلة الجزيئية للأحماض والكحولات الداخلة في تكوينها .[2]
مراجع
- الاتحاد الدولي للكيمياء البحتة والتطبيقية. "esters". Compendium of Chemical Terminology Internet edition.
- March, J. “Advanced Organic Chemistry” 4th Ed. J. Wiley and Sons, 1992: New York. ISBN 0-471-60180-2.
وصلات خارجية
- بوابة الكيمياء
