ألكان
الألكان في الكيمياء العضوية، هو هيدروكربون مشبع مؤلف من سلسلة مفتوحة غير حلقية والتي فيها يكون الجزيء به الحد الأقصى من ذرات الهيدروجين وبالتالي تكون روابطها أحادية.
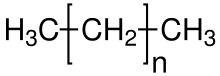
الألكانات تعرف أيضاً باسم برافينات، أو إجمالا "سلسلة البرافينات" وهذه المصطلحات يمكن أن تستخدم أيضا للألكينات والتي تكون ذرات الكربون بها سلسلة أحادية، غير متفرعة، وعند وجود تفرعات في سلسلة الألكانات تسمي "أيزوبرافينات" وتنتمى الألكانات للمركبات الأليفاتية.
المعادلة العامة لتركيب الألكانات وأبسط ألكان على هذا يكون الميثان, CH4، ويليه الإيثان، C2H6، وهكذا. وكل ذرة كربون في الألكانات لها تهجين sp3.
التصاوغ
 مقالة مفصلة: تصاوغ
مقالة مفصلة: تصاوغ
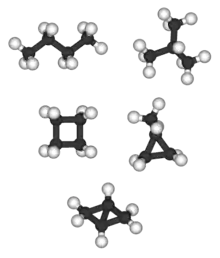
بايسيكلو[1.1.0] بوتان هو المركب الوحيد C4H6 وليس له متماكب، تيتراهيدران (ليس بالرسم) هو المركب الوحيد C4H4 وليس له متماكب.
يمكن للجزيئات التي تحتوي على أكثر من 3 ذرات كربون أن تترتب بعدة طرق، مكونة متماكبات عديدة. الألكانات "العادية" لها تركيب خطي، غير متفرع. ويزيد عدد المتماكبات بشدة بزيادة عدد ذرات الكربون، فعدد الأيزومرات للألكانات التي لها من 1 إلى 12 ذرة كربون تكون كالتالي: 1, 1. 1, 2, 3, 5, 9, 18, 35, 75, 159, 355 بالترتيب.[1]
تسمية الألكانات
تسمية الاتحاد الدولي
ينتهى اسم الألكان باللاحقة "ان". الحلقات المستقيمة للألكانات والتي بها 8 أو أقل من ذرات الكربون يتم تسميتها طبقا للجدول التالي، والذي يحتوى أيضا على اسم الألكيل المتكون بنزع ذرة الهيدروجين الطرفية.
| اسم الألكان | صيغة الألكان | الجذر الألكيلي | صيغة الجذر الألكيلي |
| ميثان | CH4 | ميثيل | CH3 |
| ايثان | C2H6 | إيثيل | C2H5 |
| بروبان | C3H8 | بروبيل | C3H7 |
| بيوتان | C4H10 | بيوتيل | C4H9 |
| بنتان | C5H12 | بنتيل | C5H11 |
| هكسان | C6H14 | هكسيل | C6H13 |
| هبتان | C7H16 | هبتيل | C7H15 |
| أوكتان | C8H18 | اوكتيل | C8H17 |
| نونان | C9H20 | نونيل | C9H19 |
| ديكان | C10H22 | ديكيل | C10H21 |
تسمية الألكانات: تسمى المركبات العضوية حسب نظامين، التسمية الشائعة والتي قد تختلف من مكان إلى آخر، وتسمية دولية محددة تبعاً لنظام الإيوباك والتي تعتمد على اسم الألكان. والألكانات قد تكون غير متفرعة أو متفرعة أي تحتوي على مجموعات جانبية
يتم تسميتها طبقا للآتي:
- تحديد أطول سلسلة متصلة لذرات الكربون.
- ترقيم الذرات بداية من أحد الأطراف حتى الطرف الآخر، على أن يكون طرف البداية هو الأقرب لمجموعات التفرع في حالة وجودها.
- تحديد المجموعات المتصلة بالسلسلة بالترتيب وبداية كتابة اسم الألكان كالتالي:
- رقم ذرة الكربون المتصلة بمجموعات فرعية، وفي حالة وجود أكثر من تفرع يتم كتابة أرقام التفرع بترتيب الترقيم في السلسلة الرئيسية (3,2- وليس 2,3-. 4,1- وليس 1,4-. وهكذا)
- في حالة وجود اتصال لنفس المجموعة أكثر من مرة بسلسلة الألكان، نستخدم البادئات التالية طبقا لعدد مرات التكرار: "ثنائي"، "ثلاثي"، "رباعي"، وهكذا.
- اسم المجموعة أو المجموعات المتصلة بالسلسلة، بنفس ترتيبها طبق لترقيم السلسلة.
- ينتهى الاسم بكتابة اسم أطول سلسلة مستقيمة.
ولتنفيذ هذه الخطوات، يجب أن نعرف اسم المجموعات المتصلة بالسلسلة. وهذا يتم بنفس الطريقة السابقة فيما عدا انه يتم ترقيم المجموعة بداية من أول ذرة كربون متصلة بسلسلة الألكان، وفي اتجاه أطول سلسلة بداية من هذه النقطة، وليس طبقا لأطول سلسلة موجودة في المجموعة.
فمثلا المركب (1) في الشكل القادم هو الاحتمال الوحيد لوجود تفرع في البيوتان. واسمه الرسمي 2-ميثيل بروبان، بينما البنتان يمكن أن يكون له 2 متزامر (isomer)، بالإضافة إلى شكل سلسلته المستقيمة. الشكل (2) 2,2- ثنائي ميثيل بروبان، الشكل (3) 2-ميثيل بيوتان.
لمزيد من التفاصيل شاهد تسمية IUPAC
تسمية الألكانات ذات السلسلة المتفرعة أي تحتوي على مجموعات جانبية كما في الصيغتين التاليتين: قواعد تسمية الألكانات ذات السلسلة المتفرعة حسب الأيوباك 1 ـ نحدد أطول سلسلة متصلة من ذرات الكربون. 2 ـ نرقم ذرات الكربون في هذه السلسلة من أحد طرفيها إلى الطرف الآخر بحيث تأخذ ذرة الكربون المتصلة بالمجموعة الجانبية أصغر رقم. 3 ـ نحدد المجموعة أو المجموعات من حيث موقع اتصالها بالسلسلة. 4 ـ نكتب الرقم الدال على موقع اتصال المجموعة الجانبية بالسلسلة ثم اسم المجموعة، ويتم الفصل بين الرقم والاسم بخط قصير. 5 ـ في حالة وجود أكثر من مجموعة جانبية مثل ميثيل (- CH3) وإيثيل (- C2H5) فإن أولوية كتابة المجموعة برقمها تتم طبقاً للترتيب الأبجدي أي إيثيل قبل ميثيل. 6 ـ عند اتصال مجموعتين متماثلتين مثل مجموعتي ميثيل (- CH3) بنفس ذرة الكربون في السلسلة، فنستخدم كلمة ثنائي ونضع قبلها نفس رقم ذرة الكربون مرتين.
أسماء شائعة
عديد من الأسماء التي لا تتبع قواعد IUPAC تستخدم مثل:
| المركب | اسم IUPAC | الاسم الشائع |
| C4H10 | بيوتان | "ن"-بيوتان |
| C5H12 | بينتان | "ن"-بينتان |
| C6H14 | هيكسان | "ن"-هيكسان |
| (وهكذا) | ||
| C4H10 | 2-ميثيل بروبان | أيزوبيوتان i-butane |
| C5H12 | 2-ميثيل بيوتان | أيزو بينتان |
| C6H14 | 2-ميثيل بينتان | أيزو هيكسان |
| (وهكذا) | ||
| C5H12 | 2,2-ثنائي ميثيل بروبان | نيو بينتان |
الخواص
الخواص الفيزيائية
- الألكانات لا تذوب في الماء.
- كثافة الألكانات أقل من الماء.
- تزيد نقطة الانصهار والغليان للألكانات بصفة عامة بزيادة الوزن الجزيئي وأيضا بزيادة طول سلسلة الكربون الرئيسية.
- في الظروف القياسية فإن الألكانات من CH4 إلى C4H10 تكون في الحالة الغازية، ومن C5H12 إلى C17H36 تكون في الحالة السائلة، وبعد C18H38 تكون في الحالة الصلبة.
الخواص الكيميائية
- الألكانات نشاطيتها منخفضة لأن الروابط الاحادية بين C-C، و C-H ومن نوع سيجما التي تكون ثابتة نسبيا، وصعبة التكسير وغير قطبية. ولا تتفاعل الألكانات مع الأحماض، الألكيلات، الفلزات، العوامل المؤكسدة. ومن العجيب أن النفط (أوكتان) لا يتفاعل مع حمض الكبريتيك المركز، فلز الصوديوم، منجنيز البوتاسيوم. وهذا الخمول هو أصل كلمة "برافينات" (الأصل اللاتيني "بارا"+"أفين"، يعني هنا لا يوجد انجذاب).
الخواص الكيميائية
1) تفاعل الاحتراق:
تتفاعل الالكانات مع كمية وافرة من الأكسجين حيث تنكسر روابط(c-h) وروابط(c-c) ويتحول الكربون إلى ثاني أكسيد الكربون ويتحول الهيدروجين إلى ماء، وتنطلق كمية كبيرة من الطاقة الحرارية التي يستفاد منها في احتراق أنواع الوقود المختلفة إما للتدفئة أو لتحريك الآلات أو توليد الكهرباء أو تشغيل السيارات والقطارات والمصانع المختلفة ويمكن تمثيل التفاعل احتراق الالكانات بالمعادلة التالية: CH4+2O2→CO2+2H2O+Energy في وجود لهب.
2) تفاعل الهلجنة:
تتفاعل الالكانات مع البروم والكلور في وجود الضوء أو الحرارة كمصدر للطاقة لينتج بروميد أو كلوريد الالكيل على التوالي، ويمكن توضيح ذلك من خلال المثال التالي: C2H6+Cl2→C2H5Cl+2H2O+HCl في وجود الضوء والحرارة
نلاحظ أنه خلال التفاعل كسرت الرابطة بين الكربون والهيدروجين في الايثان ورابطة بين الكلور في جزيء غاز الكلور بفعل الطاقة الضوئية (ضوء الشمس) أو الحرارة. وتكونت رابطة بين الكربون والكلور ورابطة أخرى بين الكلور والهيدروجين. أي حدث تفاعل استبدال بين ذرة هيدروجين في الالكان وذرة كلور في جزيء الكلور ويمكن أن يستمر هذا التفاعل حتى تستبدل جميع ذرات الهيدروجين وتتكون العديد من النواتج ذات الاستعمالات المتعددة كما نرى ذلك عند دراسة تفاعلات الميثان.[2]
التفاعلات
التفكك
التفكك أو التكسير هو تكسر الجزيئات الكبيرة إلى جزيئات أصغر. ويمكن أن يتم هذا إما بالحرارة أو باستخدام محفز. يتبع عملية التفكك الحراري آلية تماثل، أي انه، تتكسر الروابط بتماثل وتنتج أزواج من الجذور الحرة (Free Radiacl). ويتضمن التكسير الحفزي تواجد حمض حفاز (غالبا ما يكون حمض صلب مثل سيليكا-ألومينا وزيولايت) وهذا يؤدي لتكسير غير متماثل للروابط مما ينتج أزواج من الأيونات بشحنات متضادة، غالبا كاتيون كربوني أو شرجبة كربونية، وأنيون الهيدريد (شرسبة الهيدريد الغير ثابت. الشق الحر لذرات الكربون المتمركزة والكاتيونات ثابتهم ضعيف للغاية، وبالتالي يحدث إعادة ترتيب للسلسلة، يحدث انقسام C-C في الموضع بيتا (تكسر) وينتقل الهيدروجين داخل الجزيئات، وبين الجزيئات أو انتقال هيدريد. وفي كل من العمليتين، فإن المتفاعلات الوسيطة (شق، أيونات) تتجدد باستمرار، أي أنه يكون لها نظام تجدد ذاتي. وتنتهى سلسلة التفاعل في آخر الأمر بإتحاد شق أو أيون.
مثال للتكسير في البيوتان CH3-CH2-CH2-CH3
- الاحتمال الأول (48 %) أن يحدث التكسر عند CH3-CH2 bond.
CH3* / *CH2-CH2-CH3
وبعد عدد معين من الخطوات، سيتم الحصول على ألكان وألكين.
CH4 + CH2=CH-CH3
- الاحتمال الثاني (38 %) أن يحدث التكسير عند CH2-CH2 bond.
CH3-CH2* / *CH2-CH3
وبعد عدد معين من الخطوات، سيتم الحصول على ألكان وألكين من عدة أنواع : CH3-CH3 + CH2=CH2
- الاحتمال الثالث (14 %) تكسر الرابطة C-H
وبعد عدد معين من الخطوات، سيتم الحصول على ألكين وغاز هيدروكربوني: CH2=CH-CH2-CH3 + H2
تفاعلات الهلجنة
R + X2 → RX + HX
الخطوات الآتية تمثل عملية كلورة الميثان. وهو تفاعل تفاعل طارد للحرارة بشدة، وقد يؤدي إلى انفجار.
1. خطوة البداية: فصل جزيء الكلور لتكوين ذرتين كلور. وكل ذرة كلور لديها 2 إلكترون حر تتصرف كشق حر.
Cl2 → Cl* / *Cl
يتك إمداد التفاعل بالطاقة عن طريق UV
2. الانتشار (خطوتين): تسحب ذرة هيدروجين من الميثان ثم يقوم الميثيل بسحب ذرة كلور من Cl2.
CH4 + Cl* → CH3* + HCl
CH3* + Cl2 → CH3Cl + Cl*
وهذا ينتج المركب المطلوب بالإضافة إلى جذر كلور آخر. ويقوم هذا الجذر بخطة انتشار أخرى ويسبب استمرار تسلسل التفاعل. وفي حالة وجود زيادة في الكلور، فإنه من الممكن تكون نواتج أخرى مثل CH2Cl2.
3. خطوة الانتهاء: إعادة اتحاد جذرين حرين من الكلور.
- Cl* + Cl* → Cl2، أو
- CH3* + Cl* → CH3Cl، أو
- CH3* + CH3* → C2H6.
الاحتمال الأخير لخطوة الانتهاء يؤدي إلى عدم نقاء الخليط الناتج، ومن الواضح في هذا التفاعل أنه نتج لها سلسلة كربونية أكبر من المتفاعلات.
الاحتراق
R + O2 → CO2 + H2O + H2
الاحتراق تفاعل طارد للحرارة بشدة. وفي حالة عدم كفاية الأكسجين O2، فسيؤدي هذا لتكون غاز أول أكسيد كربون (CO) السام. المثال الآتي للميثان:
CH4 + 2 O2 → CO2 + 2 H2O
عند عدم توفر الأكسجين O2:
2CH4 + 3 O2 → 2 CO + 4 H2O
وفى حالة أن الأكسجين O2 أقل:
CH4 + O2 → C + 2 H2O
مصادر
- فيديو تعليمي عن الألكانات على يوتيوب
- (المصدر من كتاب كيمياء3 التعليم الثانوي (نظام المقررات)مسار العلوم الطبيعة إنتاج سنه 2009-2008)وزاره التربية والتعليم المملكة العربية السعودية)
 صور وملفات صوتية من كومنز
صور وملفات صوتية من كومنز
- بوابة الكيمياء
