بوتان (كيمياء)
البيوتان[5] أو البوتان[6] هو ألكان غير متفرع ويتكون من أربعة ذرات كربون CH3CH2CH2CH3.
| بوتان (كيمياء) | |
|---|---|
 Skeletal formula of butane with all carbon and hydrogen atoms shown |
Skeletal formula of butane |
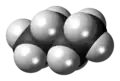 Space-filling model of the butane molecule |
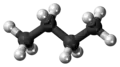 Ball-and-stick model of the butane molecule |
| الاسم النظامي (IUPAC) | |
بيوتان[1] | |
| المعرفات | |
| رقم CAS | 106-97-8 |
| بوب كيم (PubChem) | 7843 |
مواصفات الإدخال النصي المبسط للجزيئات
| |
| |
| الخواص | |
| صيغة كيميائية | C4H10 |
| كتلة مولية | 58.12 غ.مول−1 |
| المظهر | غاز عديم اللون |
| الرائحة | شبيهة بوقود السيارات أو الغاز الطبيعي[2] |
| الكثافة | 2.48 كغم/م3 (15 °م (59 °ف)) |
| نقطة الانصهار | -140--134 °س، 133-139 °ك، -220--209 °ف |
| نقطة الغليان | -1-1 °س، 272-274 °ك، 30-34 °ف |
| الذوبانية في الماء | 61 مغ·ل−1 (20 °م (68 °ف)) |
| log P | 2.745 |
| ضغط البخار | ~170 كيلوباسكال (283 ك) [3] |
| قه | 11 نانومول·باسكال−1·كغم−1 |
| كيمياء حرارية | |
| الحرارة القياسية للتكوين ΔfH |
(−126.3)-(−124.9) كيلوجول·مول−1 |
| تغير الإنتالبي القياسي للاحتراق ΔcH |
(−2.8781)-(−2.8769) ميغاجول·مول−1 |
| إنتروبيا مولية قياسية S |
310.2 جول لكل مول كلفن [4] |
| الحرارة النوعية، C | 98.49 جول·ك−1·مول−1 |
| المخاطر | |
| رمز الخطر وفق GHS |  |
| وصف الخطر وفق GHS | DANGER |
| بيانات الخطر وفق GHS | H220 |
| بيانات وقائية وفق GHS | P210 |
| ترميز المخاطر |  F+ F+ |
| توصيف المخاطر | |
| تحذيرات وقائية | |
| NFPA 704 |
4
1
0
|
| حدود الاشتعال | 1.8–8.4% |
| حد التعرض المسموح به U.S | غير ممكن[2] |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
البوتان كاختصار لمصطلح ن-بيوتان (نظامي البوتان)، وذلك للتفريق بينه وبين المصاوغ الوحيد له آيزو-بيوتان (2-ميثيل البروبان) CH3CH(CH3)2.
البيوتان غاز من غير رائحة أو لون وهو سريع الاشتعال ومن الغازات سهلة الإسالة.
التركيب الكيميائي
| الاسم الشائع | نظامي البوتان بوتان غير متفرع ن-البوتان |
إيزو البوتان إ-بوتان |
| تسمية نظامية | بوتان | ميثيل البروبان |
| بنية جزيئية |
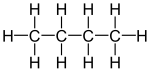 |
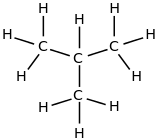 |
| بنية خطية |
التفاعلات والاستخدامات
في وفرة من الهواء, يشتعل البيوتان ليكون ثاني أكسيد الكربون, وبخار الماء:
بيوتان + أكسجين ----> ثاني أكسيد الكربون + بخار الماء.
وفى حالة قلة وفرة الهواء يتكون سخام الكربون أو أول أكسيد الكربون.
يباع غاز البيوتان في إسطوانات كمصدر للوقود لاستخدامه في الطبيخ, والتخييم, وفي هذه الحالة يطلق عليه الاسم التجاري غاز البترول المسال, ويطلق عليه في المملكة المتحدة "غاز التسخين". كما يستخدم كمكون في صناعات البترول لإنتاج البتروكيماويات السفلى في التكسير البخاري, كما يستخدم في مليء ولاعات السجائر, وأيضا كمادة لدفع الرذاذ في المنتجات التي تعتمدعلى الرش ابطريقة الرذاذ.
وأدت الاهتمامات الحديثة بالمخاطر التي تتعرض لها طبقة الأوزون من غاز الفريون, إلى تزايد استخدام غاز البيوتان في أنظمة التبريد, وخاصة الثلاجات والمجمدات التي تستخدم في المنازل. وفي حالة استخدامه كمبرد يطلق على الأيزوبيوتان إيزوبوتان.
الاستخدام الصيدلاني
باعث أو دافع للرذاذات Aerosol propellant . يستخدم البوتان كباعث للرذاذات بالمشاركة مع باعثات الرذاذات الأخرى ( غازات الرذاذات ) الهيدروكربونية منها و مركبات كلوروفلوروكربون ، خصوصاً في الرذاذات الموضعية التطبيق . و بحسب التطبيق يتراوح تركيز باعث الرذاذات الهيدروكربوني ما بين 5 - 95% وزن/وزن . و المركبات الهيدروكربونية النقية بشكل عالي هي وحدها المستخدمة في الأشكال الصيدلانية حيث أنه من الممكن أن تحتوي على آثار من المركبات غير المشبعة التي تؤثر بتشكيل رائحة و لو كانت ضعيفة ، بالإضافة إلى أنها قد تتفاعل مع عناصر أخرى . كما و يستخدم البوتان في المنتجات الغذائية و يستخدم كوقود .[7]
سلامة الاستعمال
يُعتبر البوتان و باعثات الرذاذ الهيدروكربونية غازات مُميَّعة ( مُسالة )و تماسها المباشر مع الجلد محفوف بالمخاطر حيث أنه قد يؤدي إلى حروق باردة خطيرة ، ويُنصح بارتداء الملابس الواقية ، و القفازات المطاطية و حماية العين و يجب التعامل مع هذه الغازات في بيئة جيدة التهوية . يُعتبر بخار البوتان وسطاً غير ملائم للحياة و لهذا السبب يجب أخذ الاحتياطات الكافية عند تنظيف الخزانات و ذلك بإمداد العامل الذي يقوم بالتنظيف بالأكسجين . يُعد البوتان غازاً قابلاً للاشتعال و قابلاً للانفجار و يجب التعامل معه في غرف محمية من الانفجار التي تكون مجهزة بأجهزة إنذار ملائمة . و يتم إخماد الحرائق الناتجة عن الغاز باستخدام المسحوق الجاف المخمد للنار Dry Powder Extinguishers بتطبيقه على النقطة الملتهبة .
اقرأ أيضاً
المراجع
- بوبكيم 7843
- "NIOSH Pocket Guide to Chemical Hazards #0068". المعهد الوطني للسلامة والصحة المهنية (NIOSH). الوسيط
|CitationClass=تم تجاهله (مساعدة) - W. B. Kay. "Pressure-Volume-Temperature Relations for n-Butane". Standard Oil Company. مؤرشف من الأصل في 14 ديسمبر 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة) - https://chem.libretexts.org/Bookshelves/General_Chemistry/Book%3A_ChemPRIME_(Moore_et_al.)/16%3A_Entropy_and_Spontaneous_Reactions/16.06%3A_Standard_Molar_Entropies — تاريخ الاطلاع: 25 يناير 2019
- قاموس المورد، البعلبكي، بيروت، لبنان.
- المعجم الطبي الموحد.
- Handbook of Pharmaceutical Excipients SIXTH EDITION Edited by Raymond C Rowe BPharm, PhD, DSC, FRPharmS, FRSC, CPhys, MInstP Chief Scientist Intelligensys Ltd, Stokesley, North Yorkshire, UK Paul J Sheskey BSc, RPh Application Development Leader The Dow Chemical Company, Midland, MI, USA Marian E Quinn BSc, MSc Development Editor Royal Pharmaceutical Society of Great Britain, London, UK
