كثافة إلكترونية
كثافة الإلكترونات هو مقياس احتمال وجود الإلكترون في مكان معين.
في الجزيئات, مناطق كثافة الإلكترونات توجد عادة حول الذرة ، سنداتها. في الأنظمة المبدلة أو المترافقة ، مثل الفينول, والبنزين والمركبات مثل الهيموجلوبين و الكلوروفيل ، كثافة الإلكترونات تغطي منطقة كاملة، أي في البنزين نوجد الالكترونات فوق وتحت الخاتم الحلقي. هذا يتم التعبير عنه في بعض الأحيان بسلسلة من الروابط الأحادية والمزدوجة بالتناوب. في حالة الفينول والبنزين، تُظهر دائرة داخل شكل سداسي طبيعة المركب بكونه مبدل. هذا مبين أدناه:
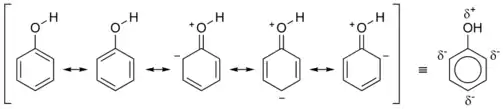
في المركبات عديدة النظم الحلقية المترابطة لم يعد هذا دقيقا ولذلك يتم استخدام روابط أحادية ومزدوجة بالتناوب. في المركبات مثل الكلوروفيل والفينول تظهر بعض الرسوم البيانية خط متقطع أو منقط لتمثيل تبديل المناطق التي تكون فيها كثافة الإلكترونات أعلى بجانب الروابط الأحادية.[1] النظم المترافقة تمثل في بعض الأحيان المناطق التي يتم فيها امتصاص الإشعاع الكهرومغناطيسي في أطوال موجية مختلفة مما يؤدي إلى المركبات التي تظهر ملونة. في البوليمرات تعرف هذه المناطق باسم حاملات.
في حسابات الكم الكيميائية ، كثافة الإلكترونات هي وظيفة الإحداثيات r حيث يتم تعريفها بوصفها عدد الالكترونات في حجم صغير dr. في جزيء ذي أغلفة مغلقة فإن كثافة الالكترونات يمكن أن يتم التعبير عنها بـ:
حيث P هي مصفوفة الكثافة. كثافة الإلكترون غالبا ما يتم تقديمها في شروط التشابه السطحي مع حجم وشكل سطح تحددها قيمة الكثافة المختارة، أو كنسبة مئوية من مجموع الإلكترونات المغلقة.
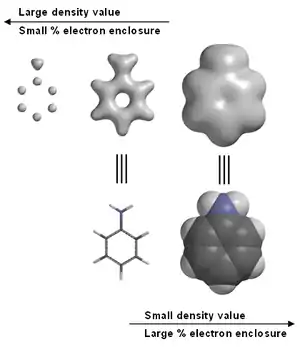
توفر التقنية الجويئية المعدلة في كثير من الأحيان صورا رسومية لكثافة الإلكترونات. على سبيل المثال، في الأنيلين (انظر الصورة على اليمين). النماذج الرسومية، بما في ذلك كثافة الإلكترونات هي أداة تستخدم كثيرا في تعليم الكيمياء.[2] نلاحظ في أقصى اليسار صورة الأنيلين، كثافة الكترونات عالية بخصوص الكربون و النيتروجين ، ولكن ذرات الهيدروجين غير مرئية مع وجود بروتون واحد في النواة. هذا هو السبب في أن حيود الأشعة السينية يواجه بعض الصعوبات في تحديد مكان ذرة الهيدروجين.
معظم حزم برامج النمذجة الالكترونية تسمح للمستخدم باختيار قيمة كثافة الإلكترونات حيث تسمى في كثير من الأحيان IsoValue. بعض البرامج[3] بعض البرامج تسمح أيضا بتحديد كثافة الإلكترونات من حيث النسبة المئوية من مجموع الإلكترونات المغلقة. اعتمادا على IsoValue (الوحدات النموذجية هي الإلكترونات في كل مكعب بور) ، أو النسبة المئوية من مجموع الإلكترونات المغلقة، كثافة الإلكترونات السطحية يمكن استخدامها لتحديد موقع الذرات، والتأكيد على كثافة الإلكترون المرتبط الروابط الكيميائية ، أو تشير عموما إلى الحجم الجزيئي والشكل.[4]
تحليل موليكين السكاني يعتمد على كثافة الإلكترون في الجزيئات وهي طريقة لتقسيم الكثافة بين الذرات لإعطاء قمية تقديرية للشحنات الذرية .
كثافة الدوران
كثافة الدوران هو كثافة الإلكترونات التي يتم تطبيقها على الجذور الحرة. ويعرف بأنه مجموع كثافة الإلكترونات ذات اللفة الواحدة ناقص كثافة الإلكترونات من الإلكترونات التي تدور في الاتجاه الآخر. واحدة من الطرق لقياس ذلك تجريبيا هو الرنين المغناطيسي الإلكتروني,[5] حيود النيوترونات يسمح رسم الخرائط مباشرة في فضاء ثلاثي الأبعاد.
انظر أيضا
المراجع
- e.g., the white line in the diagram on Chlorophylls and Carotenoids نسخة محفوظة 09 أغسطس 2017 على موقع واي باك مشين. [وصلة مكسورة]
- Alan J. Shusterman and Gwendolyn P. Shusterman. The Journal of Chemical Education. Bibcode:1997JChEd..74..771S. الوسيط
|CitationClass=تم تجاهله (مساعدة); مفقود أو فارغ|title=(مساعدة) - or example, the Spartan program from Wavefunction, Inc. نسخة محفوظة 21 سبتمبر 2017 على موقع واي باك مشين.
- Warren J. Hehre, Alan J. Shusterman, Janet E. Nelson. الوسيط
|CitationClass=تم تجاهله (مساعدة); مفقود أو فارغ|title=(مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - IUPAC Gold Book Link [وصلة مكسورة] نسخة محفوظة 16 ديسمبر 2019 على موقع واي باك مشين.
- بوابة كيمياء فيزيائية
- بوابة ميكانيكا الكم
- بوابة الكيمياء
- بوابة الفيزياء