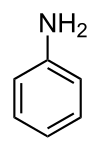
أنيلين
وهو من أبسط وأهم الأمينات العطرية، ويستخدم كمركب أولي للمواد الكيميائية الأكثر تعقيدًا. ويستخدم بشكل أساسي في تصنيع عديد إيثان اليوريا.وكما هو الحال في معظم الأمينات الطيارة، فإن الأنيلين يمتلك نوعا ما رائحة غير سارة تشبه رائحة السمك الفاسد وطعم عطري محروق، وهو سم لاذع بشكل كبير. وهو يشتعل بسهولة، ويحترق بلهب ذي دخان.
| أنيلين | |
|---|---|
 F |
 F |
| معلومات عامة | |
| الاسم النظامي | أمينو بنزين |
| أسماء أخرى | فينيل أمين أمينو بنزن بنزن أمين |
| الصيغة الجزيئية | C6H7N |
| SMILES | NC1=CC=CC=C1 |
| رقم CAS | [62-53-3] |
| سجل التأثيرات السامة للمواد الكيميائية | ؟ |
| الخواص | |
| الكتلة المولية | 93.13 غ/مول |
| المظهر | سائل عديم اللون |
| الكثافة | 1.0217 غ/سم3 سائل |
| درجة الانصهار | -6.3 °م |
| درجة الغليان | 184.13 °م |
| انحلالية في الماء | 3.6 غ/100 مل (20°م) |
| Acidity (pKa) | 9.4202 |
| Acidity (pKb) | 27 |
| اللزوجة | 3.71 بواز (25°م) |
| معامل الانعكاس | ؟ (؟ °م) |
| ثابت العزل الكهربائي | ؟ (؟ °م) |
| عزم ثنائي القطب | 1.53 ديباي (؟ °م) |
| مخاطر | |
| توصيف المخاطر | R23/24/25، R40، R41، R43 R48/23/24/25، R68، R50 |
| تحذيرات وقائية | S1/2، S26، S27، S36/37/39 S45، S46، S61، S63 |
| الجرعة المميتة للنصف LD50 | -- ملغ/كغ |
| نقطة الوميض | ؟ °م |
| مركبات قريبة | |
| 1-Naphthylamine 2-Naphthylamine |
Phenylhydrazine Nitrosobenzene نتروبنزين |
| في حال عدم ذكر الشروط فإن
البيانات الواردة أعلاه مقاسة في الشروط النظامية ومدونة حسب النظام الدولي للوحدات | |
البنية
تأخذ جزيئة الأنيلين شكلًا مقاربًا للشكل الهرمي قليلًا، وتهجين ذرة النيتروجين يقع بين sp3 و sp2، ونتيجة لذلك يمتلك النيتروجين مزدوجًا إلكترونيًا في الأوربيتال المهجن spx تغلب عليه صفات الأوربيتال p. تكون مجموعة الأمين في الأنيلين أكثر تسطحًا من نظيرتها في الأمينات الأليفاتية، ويعود ذلك إلى التعاقب الحاصل بين المزدوج الإلكتروني في وإلكترونات مجموعة الأريل.
يعكس الشكل الهندسي لهذه الجزيئة توازنًا بين عاملين هما: 1) استقرار المزدوج الإلكتروني الموجود على ذرة النيتروجين في أوربيتال تغلب عليه صفات الأوربيتال s يوجّه الجزيئة نحو الشكل الهرمي (تكون طاقة الأوربيتالات التي تغلب عليها صفات الأوربيتال s منخفضة) 2) لا موقعية المزدوج الإلكتروني على ذرة النتيروجين يوجّه الجزيئة نحو الشكل المسطح (وجود المزدوج الإلكتروني في أوربيتال p خالص يمنح أفضل ازدواج بين الأوربيتالات من نوع π في حلقة البنزين).[1]
طريقة الاصطناع
يُنتج الأنيلين صناعيًا بخطوتين بدءًا من البنزين:
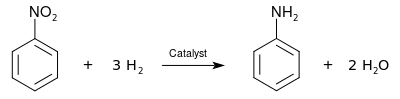
- أولا، تجرى عملية نترتة البنزين باستخدام مزيج مركز من حمض النتريك وحمض الكبريتيك عند درجة حرارة من 50° إلى 60°م، وينتج عن هذه العملية النيتروبنزين.
- في الخطوة الثانية، يتم هدرجة النتروبنزين، عند درجة حرارة (200-300 °م) بوجود فلزكمحفز ليعطي الأنيلين.
أول من اختزل النيتروبنزين إلى الأنيلين كان نيكولاي زينين سنة 1842 باستخدام سلفيد غير عضوي كعامل مختزل (تفاعل زينين). وقد أجريت عملية اختزال النيتروبنزين إلى الأنيلي كجزء من تفاعلات اختزال أجراها أنطوان بيشامب سنة 1854 باستخدام الحديد كعامل مختزل (اختزال بيشامب).
وكطريقة بديلة، يمكن تحضير الأنيلين من الفينول والأمونيا، حيث يشتق الفينول من الكومين(Cumene).[2]
التفاعلات
تمتاز تفاعلات الأنيلين بالتنوع والكثرة ويعود ذلك إلى توفّر هذا المركب بأثمان زهيدة ومنذ فترة طويلة.
الأكسدة
لقد أجريت دراسات مكثفة على تفاعلات أكسدة الأنيلين، وغالبًا ما تُجرى هذه التفاعلات على ذرة النيتروجين وتؤدي غالبًا إلى تكوين روابط C-N جديدة. في المحاليل القلوية، ينتج الآزوبنزين، ويُنتج تفاعل حمض الزرنيخيك مع الأنيلين إلى إنتاج الصبغة البنفسجية فيولأنيلين violaniline. يحوّل حمض الكروميك الأنيلين إلى الكوينون، وتتفاعل الكلورات مع الأنيلين بوجود بعض الأملاح الفلزية (وعلى وجه الخصوص الفاناديوم) لتكوّن أسود الأنيلين. يتفاعل حمض الهيدروكلوريك وكلورات البوتاسيوم مع الأنيلين لتكوين الكلورانيل. ويؤكسد بيرمنغنات البوتاسيوم الأنيلين في المحاليل المتعادلة لتكوين النيتروبنزين، وفي المحاليل القلوية لتكوين الآزوبنزين والأمونيا وحمض الأوكساليك، وفي المحاليل الحامضية لتكوين أسود الأنيلين. يتفاعل حمض الهيبوكلوروز مع الأنيلين لتكوين 4-أمينوفينول وبارا-أمينو ثنائي فنيل أمين[3]. وينتج عن تفاعل البيرسلفات مع الأنيلين أنواع مختلفة من الأنيلينات المتعددة، وتمتلك هذه البوليمرات خصائص تأكسدية وحامضية-قاعدية متنوعة.
القاعدية
يعدّ الأنيلين قاعدة ضعيفة، وتكون الأمينات الأروماتية مثل الأنيلين، قواعد أضعف بكثير من نظائرها الأليفاتية. يتفاعل الأنيلين مع القواعد القوية لتكوين أيون الأنيلينيوم (C6H5-NH3+) أو ما يعرف بأيون الفنيل أمونيوم.[4]
تعزى قاعدية الأنيلين إلى تعاضد التأثير الحثي الناتج من ذرات الكربون ذات التهجين sp2 والتي تمتلك سالبية كهربائية أعلى وتأثير الرنين الذي ينتج من لا موقعية المزدوج الإلكتروني في نظام باي في حلقة البنزين (انظر الصورة في أدناه):
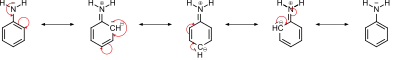
الأسيلة
يتفاعل الأنيلين مع كلوريدات الأسيل مثل كلوريد الأسيتيل لتكوين الأميدات.
الاستخدامات
جاءت القيمة التجارية الكبيرة لاكتشاف الأنيلين بسبب جاهزية الحقل الذي سيستخدم فيه، وهو صناعة الأصبغة. اكتشاف صباغ الموف (اللون البنفسجي الزاهي) في 1856 من قبل ويليام هنري بيركن، وهو الأول من سلسلة من الأصبغة الصنعية التي أصبحت يقدر عددها الآن بالمئات. ويمكن قراءة مقالات الصباغة، وصباغ الفوكسين، وصباغ الصفرنين، وصباغ الإندولين، لمزيد من التفاصيل عن هذا الموضوع. وبالإضافة إلى استخدامه كمركب أولي للأصبغة، فهو مركب أولي لتصنيع العديد من الأدوية، مثل الباراسيتامول (تايلينول) والفيكودين.
اقرأ أيضاً
المراجع
- Alabugin, Igor V. (Professor) (2016). Stereoelectronic effects : a bridge between structure and reactivity. Chichester, UK. ISBN 978-1-118-90637-8. OCLC 957525299. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Thomas Kahl, Kai-Wilfrid Schröder, "Aniline" in Ullmann's Encyclopedia of Industrial Chemistry 2007; John Wiley & Sons: New York.
- Chisholm 1911، صفحة 48.
- قالب:McMurry3rd
- بوابة الكيمياء
 صور وملفات صوتية من كومنز
صور وملفات صوتية من كومنز
