كلورات
أيون الكلورات هو أيون سالب له الصيغة −ClO3.[1][2][3] تسمى المركبات الكيميائية التي تحوي هذا الأيون أيضاً بالكلورات، وهي مشتقة من حمض الكلوريك.
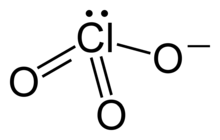
البنية والارتباط في أيون الكلورات
من الأمثلة على أملاح الكلورات مركب كلورات البوتاسيوم KClO3 وكلورات الصوديوم NaClO3.
التحضير
تحضر أملاح الكلورات القلوية من تمرير غاز الكلور في المحلول القلوي الموافق، كما هو الحال مع كلورات البوتاسيوم:
أما أملاح الكلورات الأخرى مثل كلورات الفضة فتستحصل من نظيراتها القلوية.
الخواص
يكون عدد أكسدة الكلور في هذه الأملاح +5، بالتالي فهي تتمتع بخواص مؤكسدة جيدة.
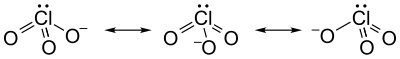
توجد هناك صيغ رنينية مختلفة لهذا الأيون:
الاستخدامات
نظراً لخطورتها فإن مركبات الكلورات عموماً ذات تطبيقات عملية قليلة.
مراجع
- Rao, B.; Hatzinger, P. B.; Böhlke, J. K.; Sturchio, N. C.; Andraski, B. J.; Eckardt, F. D.; Jackson, W. (2010). "Natural Chlorate in the Environment: Application of a New IC-ESI/MS/MS Method with a Cl18O3− Internal Standard". Environ. Sci. Technol. 44: 8429–8434. Bibcode:2010EnST...44.8429R. doi:10.1021/es1024228. PMID 20968289. الوسيط
|CitationClass=تم تجاهله (مساعدة) - J. Danielsen; A. Hazell; F. K. Larsen (1981). "The structure of potassium chlorate at 77 and 298 K". Acta Crystallogr. B. 37: 913–915. doi:10.1107/S0567740881004573. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Coates, J. D.; Achenbach, L. A. (2004). "Microbial perchlorate reduction: rocket-fuelled metabolism". Nature Reviews Microbiology. 2 (July): 569–580. doi:10.1038/nrmicro926. PMID 15197392. الوسيط
|CitationClass=تم تجاهله (مساعدة)
- بوابة الكيمياء
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.
