حمض الأكساليك
| حمض الاوكساليك | |
|---|---|
 حمض الأكساليك | |
 حمض الأكساليك |
 حمض الأكساليك |
| الاسم النظامي (IUPAC) | |
ethanedioic acid | |
| المعرفات | |
| رقم CAS | 144-62-7? |
| بوب كيم | 971 |
مواصفات الإدخال النصي المبسط للجزيئات
| |
| الخواص | |
| الصيغة الجزيئية | C2H2O4 (anhydrous) C2H2O4·2H2O (dihydrate) |
| الكتلة المولية | 90.03 g/mol (anhydrous) 126.07 g/mol (dihydrate) |
| المظهر | بلورات بيضاء |
| الكثافة | 1.90 g/cm³ (anhydrous) 1.653 g/cm³ (dihydrate) |
| نقطة الانصهار | 101-102 °C (dihydrate) |
| نقطة الغليان | 100.7 درجة حرارة مئوية |
| الذوبانية في الماء | 9.5 g/100 mL (15 °C) 14.3 g /100 mL (25 °C?) 120 g/100 mL (100 °C) |
| حموضة (pKa) | pKa1=1.27 pKa2=4.28 |
| المخاطر | |
| صحيفة بيانات سلامة المادة | External MSDS |
| NFPA 704 |
1
3
|
| نقطة الوميض | 166 °C |
| مركبات متعلقة | |
| مركبات ذات علاقة | كلوريد الاوكساليل أكسالات الصوديوم اوكسالات الكالسيوم اوكسالات الفنيل ester |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
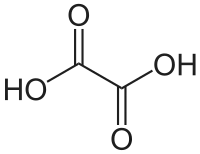
- حمض الاكساليك (حمْضْ أوكساليك) oxalic acid هو مركب عضوي
- الصيغة الكيميائية له H2C2O4.
- حمض عضوي قوي وهو بلورات صلبة عديمة اللون يذوب في الماء لاعطاء محلول عديم اللون. يصنف على أنه حمض ثنائي الكربوكسيل.
- من حيث القوة فهو حامض حوالي 3000 مرة أقوى من حمض الخليك. يوجد بكميات لا تضر في نباتات عديدة على صورة حمض .
- وهو عامل مختزل ملحه القاعدي يعرف بالاوكسلات:
(C2O42−).
- يوجد في صورة ماء تبلور بالصيغة:
H2C2O4•2H2O.
تحضيره
- يتم تصنيع حمض الأكساليك أساسا عن طريق أكسدة الكربوهيدرات أو الجلوكوز باستخدام حمض النيتريك أو الهواء في وجود خامس أكسيد الفاناديوم.
- يمكن استخدام مجموعة متنوعة من السلائف بما في ذلك حمض الجليكوليك والاثيلين جلايكول.[3]
- وهناك طريقة أحدث تتبع الكربنلةالتأكسدية للكحولات لإعطاء استرات ثنائية لحمض الأكساليك من:
- 4 ROH + 4 CO + O2 → 2 (CO2R)2 + 2 H2O
وتتحلل هذه الاسترات الثنائية بعد ذلك إلى حامض الأكساليك. ويتم إنتاج حوالي 120،000 طن متري سنويا[4] تم الحصول تاريخيا وحصريا على حمض الأكساليك باستخدام المواد الكاوية، مثل الصوديوم أو هيدروكسيد البوتاسيوم، على نشارة الخشب.[5]
البنية
يوجد حمض الأكساليك اللامائي في صورتين : في واحدة منهم الرابطة الهيدروجينية تنتج بنية تشبه السلسلة.اما في الاخرى الرابطة الهايدروجينية في شكل آخر يشبه الصفحة .[6] لأن المادة اللامائية على حد سواء والحمضية المحبة للماء (شغوفة للماء)، يتم استخدامها في الاسترة
التفاعلات
- :C2O4H2 → C2O4H− + H+; pKa = 1.27
- :C2O4H− → C2O42− + H+; pKa = 4.27
استخداماته
الإستخدامات الرئيسية تشمل:
- التنظيف أو التبييض ، وخصوصا لإزالة الصدأ.
- حمض الأكساليك هو أيضا مهم في الكيمياء كاشف اللانثينيدات.
- يستخدم حمض الأكساليك في ترميم الخشب القديم.
- يفرك حمض الأكساليك على التماثيل الرخامية لزيادة اللمعان .
- يستخدم حامض الاكساليك في الخطوات الاولى من مراحل عملية [[الانهاء السطحي عالي الجودة]] .
المحتوى في المواد الغذائية
وقد نشر هذا الجدول في الأصل في كتاب : (Agriculture Handbook No. 8-11, Vegetables and Vegetable Products, 1984.) :
| الخضار | حمض الاوكسليك(g/100 g) |
|---|---|
| القطيفة | 1.09 |
| الهليون | 0.13 |
| الفول | 0.36 |
| اوراق البنجر | 0.61 |
| البروكلى | 0.19 |
| ملفوف بروكسل | 0.36 |
| الكرنب | 0.10 |
| الجزر | 0.50 |
| الكسافا | 1.26 |
| القرنبيط | 0.15 |
| الكرفس | 0.19 |
| الهندباء | 0.21 |
| الثوم المعمر | 1.48 |
| الملفوف | 0.45 |
| الكزبرة | 0.01 |
| الذرة الحلوة | 0.01 |
| الخيار | 0.02 |
| الباذنجان | 0.19 |
| الهندباء | 0.11 |
| ثوم | 0.36 |
| كرنب | 0.02 |
| خس | 0.33 |
| بامية | 0.05 |
| بصل | 0.05 |
| بقدونس | 1.70 |
| جزر أبيض | 0.04 |
| البازلاء | 0.05 |
| جرس الفلفل | 0.04 |
| بطاطس | 0.05 |
| نبات الرجلة | 1.31 |
| فجل | 0.48 |
| لفت أصفر | 0.03 |
| السبانخ | 0.97 |
| الاسكواش | 0.02 |
| البطاطا الحلوة | 0.24 |
| الطماطم | 0.05 |
| اللفت | 0.21 |
| اللفت الأخضر | 0.05 |
| الجرجير | 0.31 |
السلامة
- حمض الاوكساليك سام للبشر، حيث أن الجرعة المميتة الوسطية قدرها 71 mg/kg. وله مذاق شديد المضايقة.
- 2 جرام قادرة قتل الشخص حيث تحدث دوخة وطرش وغثيان واسهال وتوسع حدقة العين والاكتئاب حتى طلوع الروح.
- واي كمية اقل من ربع جرام تعتبر كمية كافية على اتلاف الكلية وترسيب الحصوات واحداث اضطرابات في الجهاز البولي.
- واي كمية بسيطة بالملجم يتم اكلها او استنشاقها عن طريق الخطاء فأن اضعاف الكمية تترسب على شكل حصوات في الكلية .
- إن اغلب الأعشاب السمية القاتلة بعد فحصها وجدت في عصارتها املاح حمض الاوكساليك وكذالك وجدت حمض الاوكساليك نفسه بنسب كبيرة جدا لذالك تقتل الحيوانات خاصة الأبقار في حال أكلها مع البرسيم أو الأعشاب الأخرى .
- واحيانا تجد الأعشاب السمية التي تحتوي على حمض الأوكساليك مخضرة لونها شاحب باهت أصفر واحيانا تموت نتيجة تركيز حمض الاوكساليك فيها وحين تموت النبته ينتشر السم في التربة مما يؤدي إلى قتل العشب الحي المجاور لها لذلك في الغابات والطبيعة حينما تجد اعشاب سمية تجد بعضها خضراء جدا وتنظر إلى أحد الأطراف تكون لونها صفراء مع انها من نفس النبتة، ولا تجد الحشرات تأكل من اوراقها وثماراها لذلك حين زراعة النباتات السمية يجب ان يقطع الساق الأصفر اولا باول ويرمى خارج المزرعة وكذالك يجب وضع السماد القاعدي من ملح سترات الصوديوم وتنظف المزرعة اولا باول من النباتات والأعشاب الميتة .
المراجع
- معرف بوب كيم: https://pubchem.ncbi.nlm.nih.gov/compound/971 — تاريخ الاطلاع: 20 نوفمبر 2016 — العنوان : oxalic acid — الرخصة: محتوى حر
- معرف بوب كيم: https://pubchem.ncbi.nlm.nih.gov/compound/971
- Yonemitsu Eiichi, Isshiki Tomiya, Suzuki Tsuyoshi, Yashima Yukio, Process for the production of oxalic acid, US 3678107
- Wilhelm Riemenschneider, Minoru Tanifuji "Oxalic acid" in Ullmann's Encyclopedia of Industrial Chemistry, 2002, Wiley-VCH, Weinheim. doi: 10.1002/14356007.a18_247.
- Von Wagner, Rudolf (1897). Manual of chemical technology. New York: D. Appleton & Co. صفحة 499. مؤرشف من الأصل في 19 أكتوبر 2015. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Wells, A.F. (1984) Structural Inorganic Chemistry, Oxford: Clarendon Press. ISBN 0-19-855370-6.
- "Oxalic Acid Content of Selected Vegetables". مؤرشف من الأصل في 29 يناير 2013. الوسيط
|CitationClass=تم تجاهله (مساعدة)
وصلات خارجية
- "Oxalic acid". ChemicalLand21.com. مؤرشف من الأصل في 27 مارس 2013. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Table: Oxalic acid content of selected vegetables (USDA)
- Alternative link: Table: Oxalic Acid Content of Selected Vegetables (USDA)
- About rhubarb poisoning (The Rhubarb Compendium)
- Oxalosis & Hyperoxaluria Foundation (OHF) The Oxalate Content of Food 2008 (PDF)
- Oxalosis & Hyperoxaluria Foundation (OHF) Diet Information
- Calculator: Water and solute activities in aqueous oxalic acid
- بوابة الكيمياء
- بوابة حشرات
- بوابة كيمياء عضوية
حمض الأكساليك في المشاريع الشقيقة
 صور وملفات صوتية من كومنز
صور وملفات صوتية من كومنز
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.

