أيون متعدد الذرات
إن أيون متعدد الذرات، يعرف أيضا باسم أيون جزيئي، هو نوع كيميائي مشحون (أيون) يتكون من ذرات أو أكثر من الذرات التساهمية أو مجمع المعادن الذي يمكن اعتباره بمثابة وحدة واحدة.[1][2][3] البادئة بولي- يعني "العديد"، في اليونانية، ولكن حتى أيونات ذرات اثنين ويشار عادة باسم متعدد الذرات. في الأدب القديم، ويشار أيضا أيونات متعدد الذرات كما الراديكالية، وأقل شيوعا، كمجموعة الراديكالية. في الاستخدام المعاصر، المصطلح الراديكالي يشير إلى الجذور الحرة التي هي (ليست بالضرورة مشحونة) الأنواع مع الإلكترون غير الممزوج.
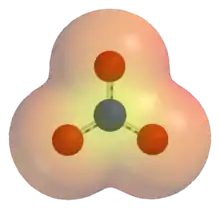
مثال على أيونات متعدد الذرات هو أيون هيدروكسيد. تتكون من ذرة أكسجين واحد ذرة هيدروجين واحدة، هيدروكسيد له تهمة -1. الصيغة الكيميائية لها هي OH-. يتكون أيون الأمونيوم من ذرة واحدة من النيتروجين وأربع ذرات هيدروجين: شحنته +1، وصيغته الكيميائية هي NH4+
وغالبا ما تكون الأيونات متعددة الذرات مفيدة في سياق الكيمياء الحمضية القاعدية أو في تكوين الأملاح. ويمكن اعتبار أيون متعدد الذرات في كثير من الأحيان بمثابة حمض / قاعدة متقارن لجزيء محايد. على سبيل المثال، قاعدة مترافقة من حامض الكبريتيك (H2SO4) هو أنيونات كبريتات الهيدروجين متعدد الذرات (هسو-4). إزالة أيون الهيدروجين آخر ينتج أنيون الكبريتات (SO2-4).
تسميات الأنيونات متعددة الذرات
هناك نوعان من "القواعد" التي يمكن استخدامها لتعلم تسميات الأنيونات متعددة الذرات. أولا، عندما يتم إضافة البادئة ثنائية إلى اسم، يتم إضافة الهيدروجين إلى صيغة أيون ويتم زيادة تهمة لها بنسبة 1، وهذا الأخير هو نتيجة تهمة أيون الهيدروجين +1. بديل عن البادئة هو استخدام كلمة الهيدروجين في مكانها: أنيون مشتق من H + + CO2 3، HCO- 3، يمكن أن يسمى إما بيكربونات أو كربونات الهيدروجين.
لاحظ أن العديد من الأنيونات متعددة الذرات المشتركة هي قواعد مترافقة من الأحماض المستمدة من أكاسيد العناصر غير المعدنية. على سبيل المثال، أنيون سلفات، SO42-، مشتق من H 2SO4، والتي يمكن اعتبارها SO3 + H2O
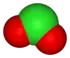
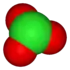
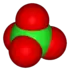
القاعدة الثانية تنظر في عدد من الأكسجين في أيون. النظر في عائلة أوكسوانيون الكلور:
| oxidation state | −1 | +1 | +3 | +5 | +7 |
|---|---|---|---|---|---|
| anion name | chloride | hypochlorite | chlorite | chlorate | perchlorate |
| formula | Cl- | ClO- | ClO2- | ClO3- | ClO4- |
| structure |  |
 |
 |
 |
 |
أولا، فكر في (ate-)الأيونات على أنها اسم "القاعدة"، وفي هذه الحالة يضيف إضافة البادئة الأوكسجين. تغيير اللاحقة (ate-) إلى (ite-) تقليل الأكسجين من قبل واحد، والحفاظ على لاحقة -إضافة وإضافة بادئة يقلل من عدد الأكسجين من قبل واحد آخر. في جميع الحالات، لا يتأثر التهمة. نمط التسمية يتبع في العديد من سلسلة أوكسيانيون مختلفة على أساس الجذر القياسية لتلك السلسلة معينة. و -لديها أقل من الأوكسجين أقل من-أ، ولكن أنيونات مختلفة قد يكون لها أعداد مختلفة من ذرات الأكسجين.
هذه القواعد لن تعمل مع جميع الأنيونات متعددة الذرات، لكنها تعمل مع الأكثر شيوعا (كبريتات، فوسفات، نترات، كلورات).
أمثلة على الأيونات متعددة الذرات المشتركة
الجداول التالية تعطي أمثلة للأيونات متعددة الذرات التي تواجه عادة. يتم إعطاء عدد قليل من الممثلين فقط، حيث أن عدد الأيونات متعددة الذرات التي واجهتها في الممارسة كبيرة جدا.
| Anions | |
|---|---|
| Acetate (ethanoate) | CH3COO- or C2H3O2- |
| Acetylide | C22- |
| Benzoate | C6H5COO- or C7H5O2- |
| Carbonate | CO32- |
| Chromate | CrO42- |
| Citrate | C6H5O73- |
| Cyanide | CN- |
| Hypochlorite | ClO- |
| Chlorite | ClO2- |
| Chlorate | ClO3- |
| Perchlorate | ClO4- |
| Dichromate | Cr2O72- |
| Dihydrogen phosphate | H2PO4- |
| Hydrogen carbonate (bicarbonate) | HCO3- |
| Hydrogen sulfate (bisulfate) | HSO4- |
| Hydrogen phosphate | HPO42- |
| Hydroxide | OH- |
| Nitrite | NO2- |
| Nitrate | NO3- |
| Peroxide | O22- |
| Permanganate | MnO4- |
| Phosphate | PO43- |
| Sulfite | SO32- |
| Sulfate | SO42- |
| Cations | |
|---|---|
| Ammonium | NH4+ |
| Phosphonium | PH4+ |
| Hydronium | H3O+ |
| Fluoronium | H2F+ |
| Mercury(I) | Hg22+ |
| Tropylium | C7H7+ |
| Guanidinium | C(NH2)3+ |
مراجع
- "معلومات عن أيون متعدد الذرات على موقع dx.doi.org". dx.doi.org. مؤرشف من الأصل في 1 يونيو 2018. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "معلومات عن أيون متعدد الذرات على موقع britannica.com". britannica.com. مؤرشف من الأصل في 6 مارس 2016. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "معلومات عن أيون متعدد الذرات على موقع academic.microsoft.com". academic.microsoft.com. مؤرشف من الأصل في 25 أكتوبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة)
- بوابة كيمياء فيزيائية
- بوابة الفيزياء
- بوابة الكيمياء