بيركلورات الليثيوم
بيركلورات الليثيوم هو مركب كيميائي له الصيغة LiClO4، ويكون على شكل ملح بلّوري أبيض اللون. يوجد بيركلورات الليثيوم على شكل لامائي أو على شكل ثلاثي هيدرات، وهو من المؤكسدات القويّة.
| بيركلورات الليثيوم | |
|---|---|
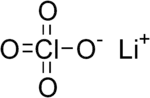 بيركلورات الليثيوم | |
| الاسم النظامي (IUPAC) | |
Lithium perchlorate | |
| المعرفات | |
| رقم CAS | 7791-03-9 |
| بوب كيم (PubChem) | 23665649 |
مواصفات الإدخال النصي المبسط للجزيئات
| |
| الخواص | |
| الصيغة الجزيئية | LiClO4 |
| الكتلة المولية | 106,39 غ/مول |
| المظهر | صلب أبيض اللون |
| الكثافة | 2.43 غ/سم3 [2] |
| نقطة الانصهار | 236 °س [2] |
| نقطة الغليان | 400 °س (يتفكك) [2] |
| الذوبانية في الماء | 59.8 غ/100 مل ماء عند 25 °س |
| الذوبانية | ينحل في الإيثانول.[3] |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
التحضير
يحضّر مركّب بيركلورات الليثيوم من تفاعل حمض فوق الكلوريك مع كربونات الليثيوم،[4] وذلك حسب التفاعل:
كما يمكن أن بحضّر من تفاعل بيركلورات الصوديوم مع كلوريد الليثيوم.
بطريقة أخرى، يحضّر بيركلورات الليثيوم من التحليل الكهربائي لكلورات الليثيوم عند 200 ميلي أمبير/سم2 وذلك عند درجات حرارة تتجاوز 20 °س.[5]
الخواص
يتبلور بيركلورات الليثيوم عندما يكون بشكل ثلاثي الهيدرات LiClO4 · 3 H2O حسب النظام البلّوري السداسي وذلك في الزمرة الفراغية P63mc. تكون أبعاد الشبكة البلورية كالتالي: a = 7.719 Å و c = 5.455 Å.[6]
عند تسخين الشكل ثلاثي الهيدرات من بيركلورات الليثيوم إلى درجات حرارة بين 98 - 100 °س فإنّه يفقد جزيئتي ماء ويتحوّل إلى الشكل أحادي الهيدرات، في حين أنّ الشكل اللامائي يتشكّل بالتسخين إلى درجات حرارة بين 130 - 150 °س.[4]
يكون للشكل اللامائي بنية بلّورية مختلفة عن الشكل المائي ثلاثي الهيدرات، حيث يتبلور حسب النظام البلوري المعيني القائم في الزمرة الفراغية Pnma بأبعاد الشبكة البلورية كالتالي: a = 8.657 Å و b = 6,912 Å و c = 4.832 Å. يمكن أن توجد أربع صيغ في وحدة الخلية.[7]
يتفكّك بيركلورات الليثيوم عند 380 °س إلى كلورات الليثيوم، وكلوريد الليثيوم والأكسجين.[4] كما يتفكك كلورات الليثيوم في هذه العملية أيضاً.
ويكون التفاعل الكلّي:
في حال وجود شوائب في المركب، تحدث عملية التفكك عند درجات حرارة أقل من 300 °س.
الاستخدامات
مصدر للأكسجين
تشكّل نسبة الأكسجين في المركّب حوالي 60% من كتلته، لذلك يستخدم بيركلورات الليثيوم كمصدر للأكسجين في بعض مولّدات الأكسجين الكيميائية.
التحفيز
إنّ انحلالية بيركلورات الليثيوم في المذيبات العضوية كبيرة جداً، مثل إيثانول وأسيتات الإيثيل وثنائي إيثيل الإيثر. تستعمل محاليل بيركلورات الليثيوم في المذيبات العضوية في تفاعل ديلز-ألدر حيث أن Li+ يكون على حمض لويس ويرتبط إلى مواقع لويس القاعدية على الكاشف المحب للديين dienophile، ممّا يسرّع من التفاعل.[8]
البطاريات
يستخدم بيركلورات الليثيوم ككهرل في بطارية ليثيوم-أيون. يفضّل هذا المركب عن غيره من مركّبات الليثيوم مثل سداسي فلوروفوسفات الليثيوم أو رباعي فلوروبورات الليثيوم وذلك لخصائصه المميّزة من حيث المعاوقة والناقلية الكهربائية والاسترطاب والثباتية المصعدية.[9]
احتياطات الأمان
إنّ مركّبات فوق الكلورات عادة ما تشكّل مزائج انفجارية مع المركّبات العضوية.[5]
المراجع
- معرف بوب كيم: https://pubchem.ncbi.nlm.nih.gov/compound/23665649 — تاريخ الاطلاع: 14 أكتوبر 2016 — العنوان : 7791-03-9 — الرخصة: محتوى حر
- صفحة بيانات المادة من شركة alfa نسخة محفوظة 20 أغسطس 2014 على موقع واي باك مشين.
- صفحة المادة في موقع Römpp Online نسخة محفوظة 29 يوليو 2016 على موقع واي باك مشين.
- R. Abegg, F. Auerbach, I. Koppel: Handbuch der anorganischen Chemie. Verlag S. Hirzel, 1908, 2. Band, 1. Teil, S. 137. النص (بالألمانية) نسخة محفوظة 13 يناير 2017 على موقع واي باك مشين.
- Helmut Vogt, Jan Balej, John E. Bennett, Peter Wintzer, Saeed Akbar Sheikh, Patrizio Gallone "Chlorine Oxides and Chlorine Oxygen Acids" in Ullmann's Encyclopedia of Industrial Chemistry 2002, Wiley-VCH. doi:10.1002/14356007.a06_483
- A. Sequeira, I. Bernal, I.D. Brown, R. Faggiani: "The Structure of Lithium Perhclorate Trihydrate Li(H2O)3ClO4 - an X-ray and Neutron Diffraction Study" in Acta Cryst. 1975, B31, S. 1735. Abstract نسخة محفوظة 02 يونيو 2018 على موقع واي باك مشين.
- M. S. Wickleder: "Crystal Structure of LiCl04" in Zeitschrift für anorganische und allgemeine Chemie, 2003, 629(9), S. 1466-1468. doi:10.1002/zaac.200300114 (بالألمانية)
- Charette, A. B. "Lithium Perchlorate" in Encyclopedia of Reagents for Organic Synthesis (Ed: L. Paquette) 2004, J. Wiley & Sons, New York. doi:10.1002/047084289.
- Xu, Kang (2004). "Nonaqueous liquid electrolytes for lithium-based rechargeable batteries" (PDF). Chemical Reviews. 104 (10): 4303–4417. doi:10.1002/chin.200450271. PMID 15669157. مؤرشف من الأصل (PDF) في 3 مارس 2016. اطلع عليه بتاريخ 24 فبراير 2014. الوسيط
|CitationClass=تم تجاهله (مساعدة)
- بوابة الكيمياء