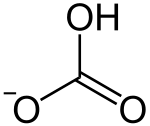
بيكربونات
بيكربونات أو هيدروجين كربونات (كربونات هيدروجينية)) هي أملاح حمض الكربونيك، ونحصل عليها عن طريق معادلة
| بيكربونات | |
|---|---|
 بيكربونات | |
 بيكربونات | |
| تسمية الاتحاد الدولي للكيمياء | |
Hydroxidodioxidocarbonate(1−)[1] | |
| أسماء أخرى | |
Hydrogencarbonate[1] | |
| المعرفات | |
| رقم CAS | 71-52-3 |
| بوب كيم (PubChem) | 769 |
مواصفات الإدخال النصي المبسط للجزيئات
| |
| |
| الخواص | |
| الصيغة الجزيئية | HCO3- |
| الكتلة المولية | 61.0168 g mol−1 |
| log P | −0.82 |
| حموضة (pKa) | 10.3 |
| القاعدية (pKb) | 7.7 |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
هذا الحمض بأحد القواعد. كما يسمى أحيانا أيون تلك الأملاح "أيون هيدروجين الكربونات " (HCO3−). مع إضافة القاعدة تستبدل أولا أحد رابطتي الهيدروجين في حمض الكربونيك بذرة من الفلز فينتج "بيكربونات الفلز"، ومع استمرار إضافة محلول الفلز (قاعدي) إلى محلول البيكربونات تستبدل الرابطة الهيدروجينية الثانية في البيكربونات بالفلز وينتج كربونات. من الأملاح المتداولة "بيكربونات الصودا " التي تستخدم كثيرا في صناعة الخبز والمعجنات لتعوض عن الخميرة أو لزيادة مفعول الخميرة.
بسبب شحنتي أيون البيكربونات فهو يستطيع أن يعطي بروتونا، ولذلك فهو يعتبر واحد من المواد مانحة البروتون، كما في استطاعته أكتساب برتونا ثانيا ويسمى آخذ بروتون وهو يلعب دورا مهما في الفيزيولوجيا كأحد مكونات أنظمة " حمض الكربونيك-بيكربونات "، ويستخدم كمحلول منظم وفي محاليل الدم، وتنظيم محتوي حمض-قلوي في الكائنات الحية والثدييات .
من أهم هيدروجين الكربونات بيكربونات الصوديوم (NaHCO3), وبيكربونات الأمونيوم NH4HCO3) وهيدروكربونات الكالسيوم. تتسبب كثرة الكربونات في الماء فيما يسمى عسر الماء وهو لا يساعد على نشأة رغوة الصابون.
في الكيمياء غير العضوية، تعتبر البيكربونات (أو التسمية الموصى بها من قبل IUPAC: "كربونات الهيدروجين")[2] شكلًا وسيطًا في نزع بروتونات حمض الكربونيك. وهو أنيون متعدد الذرات صيغته الكيميائية HCO3.
البيكربونات في البيئة
توجد بيكربونات الصوديوم طبيعيا في معدن "ناهكوليت " في الولايات المتحدة الأمريكية. تعد البيكربونات الشكل السائد للكربون غير العضوي المذاب في مياه البحر[3]، ومعظم المياه العذبة.
وعلى هذا النحو تعتبر البيكربونات خزان مهم في دورة الكربون. وفي علم بيئة المياه العذبة، يؤدي نشاط عملية التمثيل الضوئي القوي الذي تقوم به نباتات المياه العذبة في ضوء النهار إلى إطلاق غاز الأكسجين في الماء وفي نفس الوقت ينتج أيونات البيكربونات. يؤدي هذا إلى ارتفاع قيمة الأس الهيدروجيني حتى تصبح درجة القلوية في ظروف معينة سامة لبعض الكائنات الحية أو يمكن أن تجعل مكونات كيميائية أخرى مثل الأمونيا سامة. وعند غياب عملية التمثيل الضوئي (في الظلام)، تطلق عمليات التنفس ثاني أكسيد الكربون، ولا يتم إنتاج أيونات بيكربونات جديدة، مما يؤدي إلى سرعة انخفاض درجة الحموضة.
توجد بيكربونات الصوديوم طبيعيا في معدن "ناهكوليت " في الولايات المتحدة الأمريكية.
خواص البيكربونات
البيكربونات هي أملاح حيث ينشأ بين أيونات الهيدروكربونات والكاتيونات رابطة أيونية التي تميل إلى تنظيم هيكل بلوري. والبيكربونات ليس لها رائحة ولا لون إلا في حالة أتيان الكاتيون بلون خاص به وتكون فيهيئة مسحوق. وتكون معظم البيكربونات التي تذوب في الماء كهارل موصلة للتيار الكهربائي حيث أن الكاتيوناون حرية الحركة وكذلك أنيونات الهيدروجين كربونات.
التحلل:
تتحلل البيكربونات فوق درجة حرارة أعلى من 50 درجة مئوية وينتج منها ماء وثاني أكسيد الكربون.
تعتبر بيكربونات الفلزات القلوية الترابية: الكالسيوم والمغنسيوم والباريوم والسترونتيوم جيدة الذوبان في الماء، في حين أن كربونات تلك الفلزات ضعيفة الذوبان في الماء.
تفاعلات البيكربونات
تتفاعل بيكربونات الصوديوم مع الكالسيوم وينتج من التفاعل كربونات الصوديوم وكربونات الكالسيوم والهيدروجين.
تستخدم كربونات الصوديوم الهيدروجينية NaHCO3 (مسحوق الخبيز) في صناعة الخبز والمعجنات والكيك حيث ينحل بالحرارة ليعطي غاز ثاني أكسيد الكربون الذي يعمل على انتفاخ العجين واعطائه القوام الاسفنجي، عندما لا تكون الخبيرة مستحسنة الطعم أو لاختصار وقت فعل الخميرة. يَنتج ثاني أكسيد الكربون من مسحوق الخبيز بعد اتّحاده مع الهيدروجين بفعل الحرارة حسب المعادلة التّالية:
NaHCO3 + H+ → Na+ + CO2 + H2O
استخدامات
يعتبر أشهر أنواع أملاح البيكربونات شهرة هو بيكربونات الصوديوم NaHCO3، والمعروفة باسم صودا الخبز. وعند تسخينها أو تعريضها لحمض مثل حمض الخليك (الخل)، فإن بيكربونات الصوديوم تطلق ثاني أكسيد الكربون. يستخدم هذا كعامل تخمير في الخبز.
يعد تدفق أيونات البيكربونات من الصخور التي تم تجويتها بواسطة حمض الكربونيك في مياه الأمطار (الأمطار الحمضية) جزءًا هامًا من دورة الكربون.
كما يتم استخدام بيكربونات الأمونيوم في صناعة بسكويت الهضم. ويستخدم كثيرا في الصناعات الغذائية مثل الحبوب الفوارة. كما يستخدم في الأغراض الطبية لمقاومة حموضة المعدة. ويستخدم أيضا كأحد مركبات أنابيب إطفاء الحريق.
علم التشخيص
يعتبر مقدار (قيمة) البيكربونات في الدم أحد المؤشرات العديدة المتسخدمة في الطب التشخيصي لمعرفة حالة التوازن الحمضي_القلوي الفيزيزلوجي في الجسم . تركيز البيكربونات القياسي (standard bicarbonate concentration) (SBCe) هو مُتَثابِتَة (باراميتر) تقيس تركيز البيكربونات في الدم عند الضغط الشرياني لثاني أكسيد الكربون الجزئي (PaCO2) يساوي 40 ملم زئبق (mmHg) و 5.33 بالكيلوباسكال (kPa)، عند درجة حرارة 36 °C وإشباع كامل للأكسجين .[4]
الدور الكيميائي الحيوي
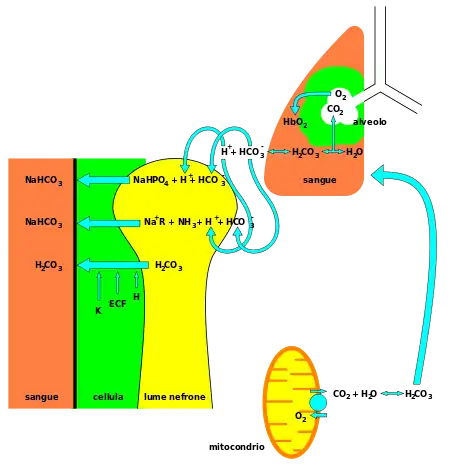
البيكربونات (HCO3) تفاعلها قلوي (Alkaline)، وهو من المكونات الأساسية لنظام تخزين الحمض المؤقت في الجسم، (يؤمن التوازن الحمضي القلوي في الجسم) .
70-75% من ثاني أكسيد الكربون يتم تحويله إلى حمض الكربونيك (H2Co3) , والتي سيصبح من السهولة قلبها إلى بيكربونات.[5] بالإضافة إلى حمض الكربونيك كوسيط نوعي، فإن البيكربونات المنحلة بالماء، وشوارد الهيدروجين، وثاني أكسيد الكربون، تشكل كلها جهاز التخزين المؤقت المحتفظ به بتوازن متقلب، المطلوب منه تأمين مقاومة حثيثة لأي تبدل جذري في PH الدم، في الاتجاهين الحمضي أو القلوي . وهذا هام جداً لحماية خلايا الجهاز العصبي المركزي، حيث يكون ال PH بعيد عن القيم الطبيعية في أي اتجاه، ممكن ان تؤدي لنتائج كارثية. إن البيكربونات تقوم بدور منظم للباهاء 《PH》 في المعي الدقيق أيضاً، حيث أنها تتحرر من البنكرياس تحت تحفيز هرمون السيكريتين لتعدل حموضة الكيموس الداخل للعفج آتياً من المعدة.[6]
محلول منظم بيكربونات
هو محلول منظم الدم ، يعمل على تنظيم قيمة الأس الهيدروجيني (البي إتش) PH value في الدورة الدموية. [7]وهو يتكون من حمض الكربونيك (H2CO3) و بيكربونات والتي لها مفعول قاعدة. فإذا كانت حموضية الدم غير كافية يذوب أيون هيدروجين (H+) من حمض الكربونيك مكونة البيكربونات. وإذا كان الدم ذو حمضية عالية (بمعنى فيه عدد زائد من أيونات الهيدروجين) فتربط بعض جزيئات البيكربونات أيونات الهيدروجين (الزائدة) وتتحول إلى جزيئات حمض الكربونيك. ويتفكك حمض الكربونيك مكونا ماء (H2O) و ثاني أكسيد الكربون (CO2). وعن طريق التنفس يخرج ثاني أكسيد الكربون مع الزفير .
مركبات البيكربونات
- بيكربونات الصوديوم (IUPAC: كربونات هيدروجين الصوديوم)، والمعروف باسم صودا الخبز أو بيكربونات الصودا، هو مركب كيميائي صيغته NaHCO3.
- بيكربونات البوتاسيوم (المعروف أيضًا باسم كربونات هيدروجين البوتاسيوم أو كربونات حمض البوتاسيوم)، هو مركب غير عضوي له الصيغة الكيميائية KHCO3.
- بيكربونات السيزيوم، مركب كيميائي له الصيغة الكيميائية CsHCO3.
- بيكربونات المغنيسيوم أو كربونات هيدروجين المغنيسيوم، مركب كيميائي صيغته Mg (HCO3) 2.
- بيكربونات الكالسيوم أو كربونات هيدروجين الكالسيوم، مركب له الصيغة الكيميائية Ca (HCO3) 2.
- بيكربونات الأمونيوم، هو مركب غير عضوي له الصيغة (NH4) HCO3، ويمكن تبسيطها إلى NH5CO3.
- حمض الكربونيك، هو حمض ثنائي القاعدة له الصيغة الكيميائية H2CO3.
المصادر
- "hydrogencarbonate (CHEBI:17544)". Chemical Entities of Biological Interest (ChEBI). UK: European Institute of Bioinformatics. IUPAC Names. مؤرشف من الأصل في 07 يونيو 2015. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Nomenclature of Inorganic Chemistry IUPAC Recommendations 2005 (PDF), IUPAC, صفحة 137, مؤرشف (PDF) من الأصل في 18 مايو 2017 الوسيط
|CitationClass=تم تجاهله (مساعدة); الوسيط|separator=تم تجاهله (مساعدة)CS1 maint: ref=harv (link) - "The chemistry of ocean acidification : OCB-OA". www.whoi.edu (باللغة الإنجليزية). Woods Hole Oceanographic Institution. 24 September 2012. مؤرشف من الأصل في 19 مايو 2017. اطلع عليه بتاريخ 17 مايو 2017. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Acid Base Balance (page 3) [وصلة مكسورة] نسخة محفوظة 28 يناير 2013 على موقع واي باك مشين.
- "Clinical correlates of pH levels: bicarbonate as a buffer". Biology.arizona.edu. October 2006. مؤرشف من الأصل في 18 ديسمبر 2017. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Berne & Levy, Principles of Physiology
- "معلومات عن محلول منظم بيكربونات على موقع academic.microsoft.com". academic.microsoft.com. مؤرشف من الأصل في 7 أبريل 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة)
- بوابة كيمياء فيزيائية
- بوابة الفيزياء
- بوابة الكيمياء
- بوابة طب