كربونات
الكربونات في الكيمياء هو ملح حمض الكربونيك وله الصيغة 2−CO3، وله شحنة كهربائية مقدارها -2.
| كربونات | |
|---|---|
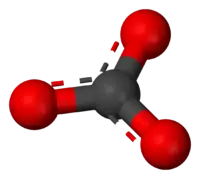 Ball-and-stick model of the carbonate anion | |
| الاسم النظامي (IUPAC) | |
Carbonate | |
| تسمية الاتحاد الدولي للكيمياء | |
Trioxidocarbonate[1]:127 | |
| المعرفات | |
| رقم CAS | 3812-32-6 |
| بوب كيم (PubChem) | 19660 |
مواصفات الإدخال النصي المبسط للجزيئات
| |
| |
| الخواص | |
| صيغة كيميائية | CO3 |
| كتلة مولية | 60.01 غ.مول−1 |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |

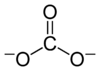
وقد تعني التسمية استر لحامض الكربونيك، وهو مركب عضوي يحتوي على مجموعة كربونات C(
=O)(O–)2.
من الأملاح المشهورة أيضا البيكربونات bicarbonate وكلاهما ينتج من ثاني أكسيد الكربون.
تنتج أملاح لكربونات من حمض الكربونيك (H2CO3). يحتوي جزيء هذا الحمض على ذرتين من الهيدروجين وتنشأ منها الهيدروكربونات ورمزها الكيمايئي MIHCO3 والكربونات وصيغتها الكيميائية MI2CO3 وتنشأ الكربونات من أيون الكربونات الذي له شحنتين سالبتين: CO32−.
وصيغة استر حمض الكربونات هي R1−O−C(=O)−O−R2 حيث R1 und R2 مجموعة ألكيل أو مجموعة أريل تحتويان على الكربون. بولي كربونات وصيغتها العامة: (O−R−O−C(=O)−)n.
كما يستخدم مصطلح (carbonate) "بالإنجليزية" أيضا كفعل ، لوصف عملية الكربنة: وهي عملية رفع تركيز أيونات الكربونات والبيكربونات في الماء لإنتاج المياه الغازية وغيرها من المشروبات الغازية - إما عن طريق إضافة غاز ثاني أكسيد الكربون تحت الضغط ، أو عن طريق إذابة الكربونات أو أملاح البيكربونات في الماء.
كما يمكن أن يشير مصطلح "كربونات" في علم الجيولوجيا وعلم المعادن، إلي الصخور والمعادن الكربونية (والتي تتكون في الأساس من معادن الكربونات)، وكلا من المعادن والصخور يهيمن عليهم أيون الكربونات CO2−3.
تنتشر وتتنوع معادن الكربونات بشكل واسع في القشرة الأرضية وتتواجد في كل مكان وبشكل كبير في الصخور الرسوبية المترسبة كيميائيًا. ومن أكثر أنواع الكربونات شيوعًا كربونات الكالسيوم، CaCO3 ، المكون الرئيسي للحجر الجيري (بالإضافة إلى المكون الرئيسي لأصداف الرخويات والهياكل المرجانية) ؛ الدولوميت، وهو كربونات الكالسيوم والمغنيسيوم CaMg (CO3) 2 ؛ والسيدريت ، أو كربونات الحديد-اثنين ، (FeCO3 ، أحد الأنواع الهامة لخام الحديد. كما يتم استخدام كربونات الصوديوم ("الصودا" أو "النطرون") وكربونات البوتاسيوم ("البوتاس") منذ العصور القديمة للتنظيف والحفظ ، وأيضاً لتصنيع الزجاج. تستخدم الكربونات على نطاق واسع في الصناعة، مثل صهر الحديد، كمادة خام لتصنيع الأسمنت البورتلاندي والجير، في عملية تزجيج الخزف، وأكثر من ذلك.
الهيكل والروابط
يعتبر أيون الكربونات أبسط أنيون أوكسوكربوني. حيث يتكون من ذرة كربون واحدة محاطة بثلاث ذرات أكسجين، في ترتيب مستوى ثلاثي الزوايا، في التناظر الجزيئي D3h.كتلته الجزيئية 60.01 جم / مول ويحمل أيون الكربونات شحنة إجمالية قدرها -2. أيون الكربونات هو القاعدة المرافقة لأيون كربونات الهيدروجين (بيكربونات)، HCO3 ، وأيضا القاعدة المرافقة لـ H2CO3، (حمض الكربونيك).
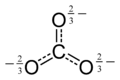
يحتوي هيكل لويس لأيون الكربونات على رابطين منفردتين (الرابطتين الطويلتين) مرتبطين مع ذرات الأكسجين السالبة، ورابطة واحدة مزدوجة قصيرة مرتبطة مع ذرة أكسجين متعادل.
هذا الهيكل غير متوافق مع التناظر الملحوظ للأيون، والذي يدل علي أن الروابط الثلاثة متساوية الطول وأن ذرات الأكسجين الثلاث متكافئة. كما في حالة أيون النترات متساوي الإلكترون، يمكن تحقيق التناظر عن طريق الرنين بين ثلاثة هياكل:

ويمكن تلخيص هذا الرنين من خلال نموذج مع روابط كسرية ورسوم غير محددة:

خصائص كيميائية
شكل أنيون الكربونات مسطحا وتفصل بين ذرات الأكسجين فيه زوايا قدرها 120° متمركزة على ذرة الكربون، ويبلغ الرابطة بين الأكسجين وذرة الكربون نحو 130 بيكومتر وهي مسافة تقارن بمسافة الرابطة الأحادية C-O- التي تبلغ 143 بيكومتر والرابطة الثنائية C=O-التي تبلغ طولها 123 بيكومتر.[2]
تنتمي الكربونات إلى الأملاح الأيونية وهل لذلك تكون متبلورة في درجة حرارة الغرفة. ولا يبدي لأنيون الكربونات لونا، وعندما يكون ملح الكربونات ملونا فيأتي لونه من الكاتيون المرتبط بأنيون الكربونات. وليس للكربونات رائحة.
تتحلل جميع أملاح أو معادن الكربونات بشكل عام بالتسخين، ويتحرر ثاني أكسيد الكربون من دورة الكربون طويلة المدى إلى دورة الكربون قصيرة المدى ويترك وراءه أكسيد المعدن[3]. وتسمى هذه العملية "التكليس"،بعد الاسم السابق "الكالكس"، وهو الاسم اللاتيني للجير الحي أو أكسيد الكالسيوم، CaO، والذي يتم الحصول عليه عن طريق تحميص الحجر الجيري في فرن الجير. تتكون أملاح الكربونات عندما يرتبط أيون موجب الشحنة (+,+2 ،أو +3) بذرات الأكسجين سالبة الشحنة للأيون عن طريق تكوين عوامل جذب كهروستاتيكية معها، مكونًا مركبًا أيونيًا:
2 M+ + CO32- → M2CO3
M2+ + CO32− → MCO3
2 M3+ + 3 CO32- → M2(CO3)3
كما أن معظم أملاح الكربونات غير قابلة للذوبان في الماء (عند درجة حرارة وضغط قياسيين)، مع ثبوت توازن الانحلالية عند أقل من 1 × 10−8 ، وهذا يجعل تفاعلات الفلزات تترسب عند تفاعلها مع كربونات القلويات. وتشمل الاستثناءات كربونات الليثيوم والصوديوم والبوتاسيوم والأمونيوم، بالإضافة إلى العديد من كربونات اليورانيوم.
تتواجد كربونات وبيكربونات وثاني أكسيد الكربون وحمض الكربونيك معًا في توازن ديناميكي في المحاليل المائية. يسود (ينتشر بشكل أكبر في التفاعل) أيون الكربونات، في التفاعلات المشتقة من القواعد القوية، بينما في تفاعلات الأملاح المشتقة من قاعدة ضعيفة، يكون أيون البيكربونات هو السائد. وعندما تكون الأملاح الحمضية أقوي، يتكون ثاني أكسيد الكربون المائي ، والذي يكون في حالة اتزان مع حمض الكربونيك، بحيث يكون التوازن بشكل أكبر تجاه ثاني أكسيد الكربون.فإن كربونات الصوديوم قاعدة قوية، وبيكربونات الصوديوم قاعدية ضعيفة ، بينما ثاني أكسيد الكربون نفسه حمض ضعيف.
تتكون المياه الغازية عن طريق إذابة ثاني أكسيد الكربون في الماء تحت الضغط. عندما ينخفض الضغط الجزئي لثاني أكسيد الكربون، فعلى سبيل المثال عند فتح علبة صودا، تتغير حالة توازن كل أنواع الكربونات في العلبة (كربونات، بيكربونات، ثاني أكسيد الكربون، وحمض الكربونيك) حتى يصبح تركيز ثاني أكسيد الكربون في المحلول يساوي ذوبانية ثاني أكسيد الكربون عند درجة حرارة وضغط الجو. يعمل إنزيم أنهيدراز الكربونيك (كربوأنهيدراز) في الكائنات الحية، على تسريع التحول البيني لثاني أكسيد الكربون وحمض الكربونيك.
وعلى الرغم من أن معظم أملاح الكربونات غير قابلة للذوبان في الماء ، فإن الأمر نفسه لا ينطبق على أملاح البيكربونات. ففي المحاليل المائية، يتغير التوازن بين الكربونات والبيكربونات وثاني أكسيد الكربون وحمض الكربونيك باستمرار، وذلك تبعاً للتغيرات في درجة الحرارة وظروف الضغط. ففي حالة وجود أيونات بعض المعادن التي تحتوي على كربونات غير قابلة للذوبان (مثل كربونات الكالسيوم CaCO3)، ينتج عنها تكوين مركبات غير قابلة للذوبان نتيجة لهذه الأيونات.
تفاعلات الكربونات
- تفاعل حمض الكربونيك مع الكربونات:
يتفاعل كربونات الكالسيوم مع الماء وثاني أكسيد الكربون ويتحول إلى هيدروكربونات الكالسيوم. وينشأ هذا التفاعل عند ذوبان الحجر الجيري في المياه الأرضية المحتوية على حمض الكربونيك. وينشأ عن ذلك الماء العسر.
- تتفكك كربونات المغنسيوم وينتج عنها أيون مغنسيوم وأيون كربونات.
- تحلل الكربونات بالحرارة:
تتحلل كربونات الكالسيوم إلى أكسيد الكالسيوم وثاني أكسيد الكربون، وبهذا التفاعل ننتج الجير الحي أو الكلس الحي.
تفاعلات قلوية
تتفاعل أيونات الكربونات مع الماء وأيونات الهيدروكربونات ومع أيونات الهيدروكسيد. وهي تفاعلات حمض-قلوي.
يتميز هذا التفاعل بتوازن كيميائي. وبسبب وجود أيون الهيدروكسيد مركزة في المحلول فتتفاعل الكربونات في المحاليل تفاعلا قلويا.
اثبات وجود الكربونات
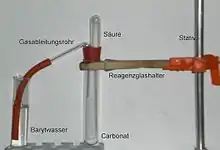
يمكن اثبات وجود أيونات الكربونات (CO32−) عن طريق إضافة حمض الهيدروكلوريك فينتصاعد ثاني أكسيد الكربون:
ويمرر ثاني أكسيد الكربون الناشيء في ماء الجير أو ماء الباريت حيث يحدث تعكيرا أبيض اللون للماء من كربونات الكالسيوم كاربونات أو كربونات الباريوم.
يتفاعل هيدروكسيد الباريوم مع ثاني اكسيد الكربون وينتج كربونات الباريوم وماء.
ويعين الكربونات بدقة في محاليل مخففة منها مع تعيين الكربونات الهيدروجينية عن طريق الترسيب بإضافة حمض الهيدروكلوريك: يظهر المحلول أولا pH-value أعلى من 8,3 ومع أضافة المزيد من حمض الهيدروكلوريك تصل القيمة إلى pH 8,3 والتي تعادل تركيز الكربونات. ومع استهلاك الحمض حتى الوصول إلى قيمة pH 4,3 فيصبح مقدار الحمض المستهلك يساوى مجموع كل من الكربونات والهيدروكربونات. وعندما يكون محلول الكربونات الأصلي تحت pH 8,3، يتم الإكتفاء بوضع مقدار 3 أو 4 عند المعايرة (فيتبقى هيدروكربونات فقط) ومن ثم يحتسب مقدار الحمض المستهلك.
وجودها وأهم أملاحها
توجد الكربونات كثيرا في الطبيعة في صورة معادن مختلفة. وطبقا لتصنيف شترونز للمعادن فهي تكون مع النترات صنفا معدنيا واحدا. كما يضم تصنيف دانا إليهما البورات.
ومن الأملاح الهامة نجد كربونات الباريوم (وثيريت وكربونات الكالسيوم (أراجونيت) والكالسيت، كذلك نجد كربونات الحديد سيديريت وكربونات النحاس القاعدية أزوريت ومالاخيت، وكربونات المغنسيوم مغنيسيت، وكربونات المنجنيز.
وكربونات الصوديوم (جايلوسيت) والنتريت والصودا وكربونات الزنك (سميثونيت).[4] وبعض عائلة الكربونات نجدها في الدولوميت مثل كربونات الكالسيوم والمغنسيوم التي تتواجد دائما في الطبيعة كمخلوط مع البوتاس كربونات الكالسيوم. وتحتوي صخور القشرة الأرضية على كمية من الكربونات تقدر بنحو 2,9·1016 طن.[2]
اقرأ أيضًا
المصادر
- International Union of Pure and Applied Chemistry (2005). Nomenclature of Inorganic Chemistry (IUPAC Recommendations 2005). Cambridge (UK): Royal Society of Chemistry–International Union of Pure and Applied Chemistry (IUPAC). (ردمك 0-85404-438-8). نسخة إلكترونية باللغة الإنجليزية.
- A.F. Holleman, E. Wiberg, N. Wiberg : Lehrbuch der anorganischen Chemie, 1995, Walter de Gruyter, ISBN 3-11-012641-9.
-
 هيو تشيشولم, المحرر (1911). . موسوعة بريتانيكا (الطبعة الحادية عشر). مطبعة جامعة كامبريدج. الوسيط
هيو تشيشولم, المحرر (1911). . موسوعة بريتانيكا (الطبعة الحادية عشر). مطبعة جامعة كامبريدج. الوسيط |CitationClass=تم تجاهله (مساعدة) - Wissenschaft-Online-Lexika: Eintrag zu Carbonate im Lexikon der Geographie.
- بوابة علم طبقات الأرض
- بوابة الكيمياء
- بوابة علم الأحجار الكريمة والمجوهرات
