حمض الكربونيك
حمض الكربونيك هو الحمض يوجد في المحاليل الناتجة عن حل غاز ثنائي أكسيد الكربون في الماء، وله الصيغة الكيميائية H2CO3.[4][5][6] أملاح حمض الكربونيك هي البيكربونات -HCO3 والكربونات CO32− ، وهو من الأحماض الضعيفة. يلعب حمض الكربونيك دوراً أساسياً في ضبط pH الوسط بالنسبة للماء والدم في الجسم.
| حمض الكربونيك | |
|---|---|
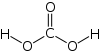 حمض الكربونيك |
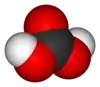 حمض الكربونيك |
| الاسم النظامي (IUPAC) | |
حمض الكربونيك | |
| المعرفات | |
| رقم CAS | 463-79-6 |
| بوب كيم (PubChem) | 747 |
مواصفات الإدخال النصي المبسط للجزيئات
| |
| الخواص | |
| الصيغة الجزيئية | H2CO3 |
| الكتلة المولية | 62.03 غ/مول |
| المظهر | يوجد فقط على شكل محلول |
| حموضة (pKa) | 6.37 [3] |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
التحضير
إن انحلالية غازز ثنائي أكسيد الكربون في الماء جيدة بالمقارنة بغاز مثل الأكسجين أو النيتروجين. ويتفاعل ثاني أكسيد الكربون مع الماء تفاعلا قليلا (فقط حوالي 0.2% وذلك حسب درجة الحرارة) ويكون في حالة توازن كيميائي معه حسب المعادلة:
- CO2 + H2O ⇌ H2CO3
يكون ثابت توازن تفاعل الإماهة عند الدرجة 25°س Kh= 1.70×10−3، مما يدل على أن قسماً ضئيلا فقط من غاز ثنائي أكسيد الكربون يتحول إلى حمض الكربونيك، في حين أن الباقي يبقى على[7] شكل جزيئات في الماء.
كما يمكن تحضيره من تفاعل كربونات الكالسيوم مع حمض الكبريتيك لإنتاجج كبريتات الكالسيوم و حمض الكربونيك
(CaCO3 + H2SO4 = Ca(SO4) + H2(CO3
تفاعلات التوازن
كما ذكر أعلاه فإن غاز ثنائي أكسيد الكربون المنحل في الماء يكون على توازن مع حمض الكربونيك:
- CO2 + H2O ⇌ H2CO3 (1)
بما أن حمض الكربونيك حمض ثنائي الوظيفة الحمضية (يملك بروتونين) فإنه تجري له عملية انحلال (تأين أو تشرد) على مرحلتين، في الأولى يتخلى عن واحد من بروتوناته:
H2CO3 + H2O ⇌ HCO3- + H3O + (2)
تكون قيمة ثابت انحلال الحمض pKa في التفاعل أعلاه 3.88، وهي قيمة تقارن مع تلك لحمض الخليك، إلا أنه نتيجة لصعوبة تحديد تركيز حمض الكربونيك الناتج من المعادلة (1)، فإنه يجري جمع كل من المعادلتين (1) و(2) لتعطي المعادلة التالية:
CO2 + 2H2O ⇌ H3O + + HCO3 - (3)
والتي تكون قيمة ثابت انحلال الحمض فيها 6.55، وهي القيمة المقاسة.
في خطوة الانحلال الثانية لحمض الكربونيك تتشكل أملاح الكربونات حسب المعادلة:
HCO3 - + H2O ⇌ CO3 2- + H3O + (4)
يكون لثابت انحلال الحمض في الخطوة الثانية قيمة تبلغ 10.5.
تأثير قيمة الأس الهيدروجيني على تركيب محاليل حمض الكربونيك
عند درجة حرارة معينة فإن تركيب محاليل حمض الكربونيك يتعلق بشكل رئيسي بالضغط الجزئي لغاز ثنائي أكسيد الكربون فوق المحلول. لمعرفة النسب المكونة لحمض الكربونيك حسابياً، يجب الأخذ بعين الاعتبار لكل من ثوابت التوازن بين الأنواع المختلفة الموجودة ضمن المحلول وهي (H2CO3 و HCO3− و CO32−)، بالإضافة إلى ثوابت توازن تفاعل الإماهة بين CO2 المنحل وH2CO3 مع اعتبار وجود نسبة ثابتة من ، وباعتماد العلاقة التالية بين غاز CO2 المنحل و CO2 الغازي الموجود فوق المحلول:
- CO2(غاز) ↔ CO2(محلول) حيث حيث kH=29.76 atm/(mol/L) عند 25 °C (ثابت هنري🗯🗯)
إن معادلات التوازن بالإضافة إلى العلاقة وعلاقة الاعتدال لحمض الكربونيك تعطي بالنهاية ست معادلات حاوية على ست مجاهيل وهي كل من تركيز [CO2] و [H2CO3] و [+H] و [−OH] و [HCO3−] و [CO32−]، وتظهر أن تركيب المحلول يعتمد بالإطلاق على .
تكون المعادلة التي تعطي تركيز الهيدرونيوم [+H] معادلة من الدرجة الثالثة (مكعبة)، ويعطي حلها قيمة الأس الهيدروجيني للوسط، وبالتالي يمكن حساب تراكيز المكونات الأخرى كما في الجدول التالي:
| (atm) | pH | [CO2] (mol/L) | [H2CO3] (mol/L) | [HCO3−] (mol/L) | [CO32−] (mol/L) |
| 10−8 | 7.00 | 3.36 × 10−10 | 5.71 × 10−13 | 1.42 × 10−9 | 7.90 × 10−13 |
| 10−6 | 6.81 | 3.36 × 10−8 | 5.71 × 10−11 | 9.16 × 10−8 | 3.30 × 10−11 |
| 10−4 | 5.92 | 3.36 × 10−6 | 5.71 × 10−9 | 1.19 × 10−6 | 5.57 × 10−11 |
| 3.5 × 10−4 | 5.65 | 1.18 × 10−5 | 2.00 × 10−8 | 2.23 × 10−6 | 5.60 × 10−11 |
| 10−3 | 5.42 | 3.36 × 10−5 | 5.71 × 10−8 | 3.78 × 10−6 | 5.61 × 10−11 |
| 10−2 | 4.92 | 3.36 × 10−4 | 5.71 × 10−7 | 1.19 × 10−5 | 5.61 × 10−11 |
| 10−1 | 4.42 | 3.36 × 10−3 | 5.71 × 10−6 | 3.78 × 10−5 | 5.61 × 10−11 |
| 1 | 3.92 | 3.36 × 10−2 | 5.71 × 10−5 | 1.20 × 10−4 | 5.61 × 10−11 |
| 2.5 | 3.72 | 8.40 × 10−2 | 1.43 × 10−4 | 1.89 × 10−4 | 5.61 × 10−11 |
| 10 | 3.42 | 0.336 | 5.71 × 10−4 | 3.78 × 10−4 | 5.61 × 10−11 |
- خلاصة
- يظهر أنه ومن خلال مجال واسع من الضغط فإن قيمة الـ pH هي أقل بكثير من قيمة pKa2، أي أن تركيز CO32− دوما أقل من تركيز -HCO3 .
- عند تناقص قيمة (ضغوط منخفضة) فإن pH الوسط يصبح قريباً من تلك للماء (pH = 7)، ويكون الشكل السائد هو-HCO3.
- عند الضغط الجوي النظامي ( atm)، نحصل على محلول حمضي خفيف (pH = 5.7)، ويكون الكربون المنحل على شكل CO2. وبارتفاع قيمة الضغط من هذه النقطة فإن تركيز [−OH] يصبح أيضاً مهملا بحيث أن القسم المتأين من المحلول عبارة عن محلول بنسبة متساوية من H+ و HCO3−.
- بالنسبة إلى ضغط غاز ثنائي أكسيد الكربون المطبق عادة في علب الكولا ( ~ 2.5 atm)، يكون للأس الهيدروجيني pH قيمة منخفضة نسبياً (وسط حمضي) وبوجود تركيز عال من CO2. لذلك فإن للمشروبات الغازية طعم حامض ولذلك تكون فوارة.
- عند ضغوط تتراوح بين 2.5 و 10 atm فإن قيمة ال pH تتجاوز قيمة pKa1 ويكون التركيز السائد هو تركيز H2CO3.
- بإهمال قيمة [CO32−] (حسب ما ورد أعلاه) فإنه من الممكن اشتقاق علاقة تحليلية تعطي تركيز [+H] بالنسبة لمحاليل حمض الكربونيك، وبالتالي تعطي علاقة لتحديد قيمة pH الوسط
اقرأ أيضا
مراجع
- معرف بوب كيم: https://pubchem.ncbi.nlm.nih.gov/compound/767 — تاريخ الاطلاع: 5 أكتوبر 2016 — العنوان : carbonic acid — الرخصة: محتوى حر
- معرف بوب كيم: https://pubchem.ncbi.nlm.nih.gov/compound/767
- المؤلف: Robert C. Weast — المحرر: Robert C. Weast — الاصدار الأول — الناشر: CRC Press — ISBN 978-0-8493-0740-9
- M. H. Moore; R. K. Khanna (1990). "Infrared and mass spectral studies of proton irradiated H2O + CO2 ice: Evidence for carbonic acid". Spectrochimica Acta Part A. doi:10.1016/0584-8539(91)80097-3. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Acid-Base Physiology 2.1 – Acid-Base Balanceby Kerry Brandis. نسخة محفوظة 31 ديسمبر 2017 على موقع واي باك مشين.
- Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: الجمعية الملكية للكيمياء. 2014. صفحات 414, 781. doi:10.1039/9781849733069-FP001. ISBN 978-0-85404-182-4. الوسيط
|CitationClass=تم تجاهله (مساعدة) - {{ # * ''''''''''}}
- بوابة الكيمياء
 صور وملفات صوتية من كومنز
صور وملفات صوتية من كومنز
