تريتيوم
التريتيوم هو نظير للهيدروجين ويحتوي على بروتون واثنين من النيوترونات ، ويستخدم في استخراج الطاقة النووية بواسطة الاندماج النووي، كما يحدث في القنبلة الهيدروجينية. ويبلغ وزنه ثلاثة أضعاف وزن الهيدروجين العادي. يرجع أصل الاسم تريتيوم إلى الكلمة اللاتينية Triومعناها ثلاثة. ويتحلل التريتيوم عن طريق إصدار أشعة بيتا ويتحول إلى الهيليوم-1 ، ويتحول نصف التريتيوم إلى هيليوم في حوالي 12 عامًا، ولهذا يقال في الفيزياء أن عمر النصف للتريتيوم 12 سنة.
| تريتيوم | |
|---|---|
 تريتيوم | |
| معلومات عامة | |
| الاسم، الرمز | tritium,3H |
| النيوترونات | 2 |
| البروتونات | 1 |
| بيانات النويدة | |
| الوفرة الطبيعية | نادر |
| عمر النصف | 12.32 سنة |
| نواتج الاضمحلال | 3He |
| الكتلة الذرية للنظير | 3.0160492 دالتون |
| الغزل | 1⁄2 |
| فائض الطاقة | 14,949.794± 0.001 keV |
| طاقة الترابط | 8,481.821± 0.004 keV |
| نمودج الاضمحلال | طاقة الاضمحلال |
| اضمحلال بيتا | 0.018590 إلكترون فولت |
خواصه
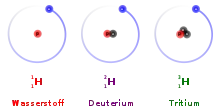
والرمز الكيميائي للتريتيوم 3H كما تختصره الاصطلاحات الأجنبية بحرف T.
وبعكس الديوتيريوم أو الهيدروجين الثقيل على 1 بروتون و1 نيوترون ، يحتوي التريتيوم على 1 بروتون و2 نيوترون في النواة ولهذا فتبلغ كتلته الذرية 3.
ولكن تلك النواة غير مستقرة وتتحول خلال عمر النصف قدره 12.32 سنة عن طريق إصدار إلكترون ونقيض نيوترينو إلى الهيليوم-3 3He ، أي عن طريق تحلل بيتا:
ويصاحب هذا التحلل إصدار طاقة تبلغ 18.6 كيلو إلكترون فولت (1000 إلكترون فولت). ويكون نصيب الإلكترون الصادر منها في المتوسط 5.7 كيلوإلكترون فولت تظهر في شكل طاقة حركته.[1]
وبالمقارنة بالطاقة الصادرة لتحلل بيتا للعناصر الأخرى فالطاقة الصادرة عن تحلل التريتيوم تعتبر طاقة ضعيفة. وهي تمتص في الماء خلال عدة ميكرومترات من مسارها، وهي لذلك لا تستطيع النفاذ في جسم الإنسان. ولكن خطورة غاز التريتيوم تكمن في استنشاقه، ولا يصح اشتنشاقه. ولذلك يتخد العاملين في مجال الفيزياء احتياطهم من عدم السماح للتريتيوم بالتسرب وكذلك عدم استنشاقه.
المراجع
- Table of Nuclides beim Korea Atomic Energy Research Institute نسخة محفوظة 04 مارس 2016 على موقع واي باك مشين.
اقرأ أيضا
- بوابة كيمياء فيزيائية
- بوابة طاقة نووية
- بوابة الكيمياء
- بوابة علوم
- بوابة الفيزياء
