نقل عصبي
النقل العصبي هو عملية تُطلق فيها النهاية المحورية للعصبونات السابقة للمشبك موادا كيميائية تُعرف بالناقلات العصبية، والتي ترتبط بالمستقبلات الموجودة على الزوائد الشجرية للعصبونات التالية للمشبك (انظر الرسم). وقد يحدث نقل عصبي متراجع (في الاتجاه المعاكس)، حيث تُطلق الزوائد الشجرية للعصبونات التالية للمشبك الناقلات العصبية (مثل الكانابينويد) نحو المستقبلات التي تقع على النهاية المحورية للعصبونات السابقة للمشبك، ويحدث النقل العصبي المتراجع بصورة أساسية في المشابك العصبية التي تسخدم حمض الجوتاميك وحمض الغاما-أمينوبيوتيريك كناقلات عصبية. [1] [2] [3]
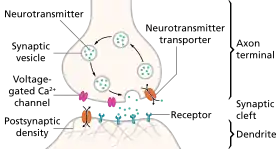
يعتمد النقل العصبي على توفر وإطلاق مادة الناقل العصبي، والعلاقة بينها وبين المستقبلات التالية للمشبك، ونشاط العصبونات التالية للمشبك؛ والإزالة أو التعطيل اللاحق للناقل العصبي.
تُطلق الناقلات العصبية من النهايات المحورية السابقة للمشبك العصبي كاستجابةً لجهد الفعل أو الوصول لعتبة تنشيط الجهد الغشائي، وتتحرك الناقلات العصبية المُتحررة عبر المشبك العصبي، فتميزها المستقبلات الموجودة على العصبونات التالية للمشبك وترتبط بها، ويؤثر هذا الارتباط على العصبونات التالية للمشبك إما بطريقة محفزة أو مثبطة، كما يمكن أن يؤدي هذا الارتباط إلى تغييرات قصيرة الأجل، مثل تغييرات في جهد الغشاء تُسمى الجهد التالي للمشبك، أو تغييرات طويلة الأجل عن طريق تنشيط تتابع الإشارات.
تشكل العصبونات شبكات عصبونية حيوية معقدة تُنقل خلالها الإشارات العصبية (جهد الفعل)، حيث لا تتلامس العصبونات فيما بينها (باستثناء المشبك الكهربائي)؛ وبدلاً من ذلك فإنها تتفاعل عند نقاط اتصال وثيقة تسمى نقاط الاشتباك العصبي، يَنقل عبره العصبون معلوماته العصبية مستخدما جهد الفعل، وعندما تصل المعلومات (الإشارات) العصبية إلى المشبك تتسبب في إطلاق ناقلات عصبية تؤثر على مستقبلات العصبون التالي للمشبك، وقد تتلقى العصبونات التالية للمشبك إشارات من عصبونات متعددة، سواء كانت إشارات محفزة أو مثبطة، حيث يجتمع تأثير كل منهما، وإذا كان الناتج في صالح الإشارة المثبطة فإن العصبونات تقل قابليتها على إرسال إشارات عصبية (أي توليد جهد الفعل)، ويحدث العكس إذا كان الناتج في صالح الإشارة المحفزة.
تعتمد قابلية استثارة العصبون على مقدار الفرق بين الجهد الغشائي وجهد البداية، وهو الجهد الذي يتولد عنده جهد الفعل نتيجة التنشيط الكافي لقنوات الصوديوم بحيث يتجاوز تيار الصوديوم الداخل جميع التيارات الخارجية.[4] ومن هنا فإن الإشارات المحفزة تقرب العصبون من جهد البداية، فيما تقوم الإشارات المثبطة بالعكس.
مراحل النقل العصبي عبر المشبك
- تخليق الناقلات العصبية، والذي يمكن أن يحدث في جسم العصبون أو في محوره أو في نهاياته المحورية.
- تخزين الناقلات العصبية في حبيبات أو حويصلات التخزين في النهايات المحورية.
- دخول الكالسيوم إلى النهايات المحورية أثناء جهد الفعل، مما يتسبب في إطلاق الناقلات العصبية إلى المشبك العصبي.
- ترتبط الناقلات العصبية بعد إطلاقها بالمستقبلات التالية للمشبك، وتقوم بتنشيطها.
- إبطال مفعول الناقلات العصبية، حيث يتم إيقاف نشاط الناقلات العصبية إما بالإنزيمات أو بإعادة امتصاصها مرة أخرى إلى المكان الذي جائت منه، حيث يمكن إعادة استخدامها أو تحللها وإزالتها. [5]
الوصف العام
تُخزن الناقلات العصبية بشكل تلقائي في حويصلات، ويتم إطلاقها بكميات متناهية الصغر بشكل مستقل بغض النظر عن جهد الفعل السابق للمشبك، وهذا الإطلاق يمكن اكتشافه حيث أنه ينتج عنه آثار في الصغر مثبطة أو محفزة للعصبون التالي للمشبك. ويُضخم جهد الفعل من هذه العملية لفترة وجيزة. ويمكن إعادة تدوير (استخدام) الناقلات العصبية بعد إطلاقها بإحدى الآليات الثلاثة المقترحة.
الآلية الأولى تتضمن فتح جزئي للحويصلة ثم إعادة إغلاقها. الآلية الثانية تنطوي على الاندماج الكامل للحويصلة مع الغشاء، يتبعه إعادة التدوير. ويكون الدافع وراء الاندماج الحويصلي إلى حد كبير هو تركيز الكالسيوم في المواقع القريبة من قنوات الكالسيوم، مما يسمح بإطلاق الناقلات العصبية لجزء من الثانية فقط، خلال الفترة المُستغرقة لعودة تركيز الكالسيوم لمستوياته الطبيعية. يُعتقد أن إطلاق الحويصلة للناقلات العصبية يكون مدفوعًا بمركب بروتيني يسمى SNARE، وهو موضع تأثر سم البوتوكس. وبمجرد إطلاق الناقلات العصبية فإنها تدخل المشبك وتقابل المستقبلات، التي يمكن أن تكون مستقبلات بروتينية أو أيونية.
انظر أيضا
- فيزيولوجيا كهربائية
- مستقبلات مقترنة بالبروتين ج
- علم عقاقير الأعصاب
- موصل عصبي عضلي
مراجع
- "Endocannabinoid signaling in midbrain dopamine neurons: more than physiology?". Current Neuropharmacology. 5 (4): 268–77. December 2007. doi:10.2174/157015907782793612. PMID 19305743.
Thus, it is conceivable that low levels of CB1 receptors are located on glutamatergic and GABAergic terminals impinging on DA neurons [127, 214], where they can fine-tune the release of inhibitory and excitatory neurotransmitter and regulate DA neuron firing.
الوسيط
Consistently, in vitro electrophysiological experiments from independent laboratories have provided evidence of CB1 receptor localization on glutamatergic and GABAergic axon terminals in the VTA and SNc.|CitationClass=تم تجاهله (مساعدة) - "Cannabinoid-hypocretin cross-talk in the central nervous system: what we know so far". Frontiers in Neuroscience. 7: 256. December 2013. doi:10.3389/fnins.2013.00256. PMID 24391536.
Direct CB1-HcrtR1 interaction was first proposed in 2003 (Hilairet et al., 2003). Indeed, a 100-fold increase in the potency of hypocretin-1 to activate the ERK signaling was observed when CB1 and HcrtR1 were co-expressed ... In this study, a higher potency of hypocretin-1 to regulate CB1-HcrtR1 heteromer compared with the HcrtR1-HcrtR1 homomer was reported (Ward et al., 2011b). These data provide unambiguous identification of CB1-HcrtR1 heteromerization, which has a substantial functional impact. ... The existence of a cross-talk between the hypocretinergic and endocannabinoid systems is strongly supported by their partially overlapping anatomical distribution and common role in several physiological and pathological processes. However, little is known about the mechanisms underlying this interaction. ... Acting as a retrograde messenger, endocannabinoids modulate the glutamatergic excitatory and GABAergic inhibitory synaptic inputs into the dopaminergic neurons of the VTA and the glutamate transmission in the NAc. Thus, the activation of CB1 receptors present on axon terminals of GABAergic neurons in the VTA inhibits GABA transmission, removing this inhibitory input on dopaminergic neurons (Riegel and Lupica, 2004). Glutamate synaptic transmission in the VTA and NAc, mainly from neurons of the PFC, is similarly modulated by the activation of CB1 receptors (Melis et al., 2004).
الوسيط|CitationClass=تم تجاهله (مساعدة)
· Figure 1: Schematic of brain CB1 expression and orexinergic neurons expressing OX1 (HcrtR1) or OX2 (HcrtR2)
· Figure 2: Synaptic signaling mechanisms in cannabinoid and orexin systems
· Figure 3: Schematic of brain pathways involved in food intake - "Role of endogenous cannabinoids in synaptic signaling". Physiological Reviews. 83 (3): 1017–66. July 2003. doi:10.1152/physrev.00004.2003. PMID 12843414. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Holden A, Winlow W (1984). The Neurobiology of Pain: Symposium of the Northern Neurobiology Group Held at Leeds on 18 April 1983 (الطبعة 1st). Manchester Univ Pr. صفحة 111. ISBN 978-0719010613. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Kolb B, Whishaw IQ (2003). Fundamentals of Human Neuropsychology (الطبعة 5th). Worth. صفحات 102–104. ISBN 978-0-7167-5300-1. الوسيط
|CitationClass=تم تجاهله (مساعدة) (reference for all five stages)
- بوابة علم الأحياء
- بوابة علوم عصبية
