خلية دم حمراء
كريات الدم الحمراء أو خلايا الدم الحمراء (بالإنجليزية: Red blood cell اختصاراً RBCs) نوع من أنواع خلايا الدم، وهي الأكثر تعداداً فيه. تشكل هذه الخلايا الوسيلة الرئيسية للفقاريات لتوصيل الأكسجين (O2) إلى أنسجة الجسم بواسطة الجريان الدموي في الدوران الجهازي.[1] تأخذ كريات الدم الحمراء الأكسجين في الرئتين، أو خياشيم الأسماك، وتحرره في الأنسجة أثناء مرورها في الشعيرات الدموية.[2]
| كرية دم حمراء | |
|---|---|
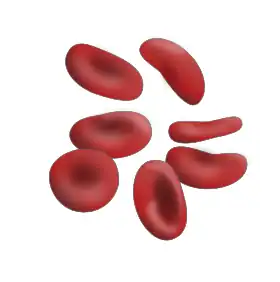 كريات الدم الحمراء (مقعرة الوجهين) | |
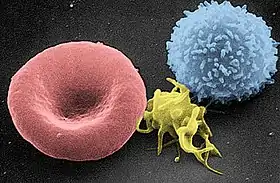 صورة بالمجهر الإلكتروني تظهر كرية دم حمراء (في اليسار)، صفيحة دموية (في الوسط)، كرية دم بيضاء (في اليمين). صورة بالمجهر الإلكتروني تظهر كرية دم حمراء (في اليسار)، صفيحة دموية (في الوسط)، كرية دم بيضاء (في اليمين). | |
| تفاصيل | |
| وظيفة | نقل الأوكسجين |
| اختصار | RBC |
| نظام أحيائي | الجهاز الدموي الوعائي |
| المكتشف | يان زفامردام |
| نوع من | خلية دم |
| جزء من | دم |
| معرفات | |
| ترمينولوجيا هستولوجيكا | H2.00.04.1.01001 |
| FMA | 62845 |
| ن.ف.م.ط. | A11.118.290، وA11.443.240، وA15.145.229.334 |
| ن.ف.م.ط. | D004912 |
يكون سيتوبلازم الكريات الحمراء غنيًا بالهيموغلوبين، وهو جزيء حيوي يحتوي على الحديد الذي يربط الأكسجين وهو المسؤول عن اللون الأحمر للخلايا والدم.[3] يتكون غشاء الخلية من بروتينات وليبيدات، ويوفر هذا الهيكل خصائص أساسية لوظيفة الخلية الفيزيولوجية مثل قابلية تغيير الشكل والهشاشة [الإنجليزية] أثناء عبور الجهاز الدوراني وخاصة شبكة الشعيرات الدموية.[4]
تكون خلايا الدم الحمراء الناضجة في البشر أقراصًا إهليلجية مقعرة الوجهين ومرنة.[2] تفتقر الكريات الحمر لنواة الخلية ومعظم العضيات، لكي تترك أقصى مساحة للهيموغلوبين "الخضاب"، إذ يمكن اعتبارها محافظ من الغشاء البلازمي بداخلها الهيموغلوبين.[2] يتم إنتاج ما يقرب من 2.4 مليون كريات دموية جديدة في الثانية في البشر البالغين.[5] تتطور الخلايا في نخاع العظم وتدور لمدة حوالي 100-120 يوم في الجسم قبل أن يتم إعادة تدوير مكوناتها عن طريق الخلايا البلعمية الكبيرة.[3] تستغرق كل دورة في جسم الإنسان حوالي 60 ثانية (دقيقة واحدة).[6] تشكل كريات الدم الحمراء حوالي 84% من الخلايا الموجودة في جسم الإنسان وعددها بين 20 إلى 30 تريليون خلية دم حمراء.[7][8][9] كما تشكل الكريات الحمر ما يقرب نصف حجم الدم، إذ يقدر الهيماتوكريت عند الرجل البالغ (38-46%) والأنثى البالغة (35-44%).[10]
التسمية
يطلق على كرية الدم الحمراء (بالإنجليزية: Erythrocyte) (بالإنجليزية: Red blood corpuscle) مسمياتٍ عديدة، منها خلية دم حمراء أو خلية حمراء (بالإنجليزية: Red Blood Cell)،[11] وتُعرف اختصارًا RBC. كما تُسمى أيضًا الهيماتيد (بالإنجليزية: Haematids) أو الخلية الحمراوية (بالإنجليزية: Erythroid cell). كلمة (Erythrocyte) مشتقةٌ من اليونانية (erythros تعني "حمراء" و kytos تعني "وعاء مجوف"، مع اللاحقة cyte- التي تعني "خلية").[3]
البنية
الفقاريات

تقريباً جميع الفقاريات، بما في ذلك جميع الثدييات والبشر، تملك كريات دم حمراء. الفقاريات الوحيدة المعروفة بفقدانها لكريات الدم الحمراء هي أسماك التمساح الثلجية (الاسم العلمي: Channichthyidae)، وهي تعيش في ماء بارد غني بالأكسجين حيث ينتقل الأكسجين المنحل بحرية في دمائها.[12] على الرغم من أنها لا تستخدم الهيموغلوبين، إلا أنه يمكن العثور على بقايا مورثات الهيموغلوبين في جينومها (مادتها الوراثية، وهي مجموع المورثات الموجودة في الكائن الحي).[13]
_(20670817635)-ar.jpg.webp)
تتكون كريات الدم الحمراء عند الفقاريات بشكل رئيسي من الهيموغلوبين، وهو بروتين فلزي يحتوي على مجموعات الهيم التي ترتبط ذراتها الحديدية مؤقتاً بجزيئات الأكسجين (O2) في الرئتين أو الخياشيم وتطلقها في جميع أنحاء الجسم، إذ يمكن للأكسجين أن ينتشر بسهولة من خلال غشاء كريات الدم الحمراء.[15] يحمل الهيموغلوبين الموجود في كريات الدم الحمراء أيضاً بعضاً من ثاني أكسيد الكربون الناتج عن نواتج أيض الأنسجة، ومع ذلك، يتم نقل معظم ثاني أكسيد الكربون إلى الشعيرات الدموية الرئوية على شكل بيكربونات (-HCO3) ذوابة في بلازما الدم. يعمل الميوغلوبين، وهو مركب مرتبط بالهيموغلوبين، على تخزين الأكسجين في الخلايا العضلية.[16] يعود لون كريات الدم الحمراء إلى مجموعة الهيم الموجودة في الهيموغلوبين.[3] أما بلازما الدم فتكون ذات لون شبيه بالقش،[17][18] ولكن تغير كريات الدم الحمراء لونها تبعاً لحالة الهيموغلوبين: عند ارتباطها بالأكسجين فإن أوكسي هيموغلوبين الناتج يكون قرمزي اللون، أما عندما يتم إطلاق الأكسجين يكون لون ديوكسي هيموغلوبين الناتج بلون أحمر داكن (خمري).[15][18] ومع ذلك، يمكن أن يبدو الدم مزرقاً عند رؤيته من خلال جدار الوعاء والجلد.[19] يستفيد مقياس الأكسجة والنبض من تغيير لون الهيموغلوبين لقياس إشباع الأكسجين في الدم الشرياني مباشرة باستخدام تقنيات القياس اللوني.[15] يملك الهيموغلوبين ألفة عالية جداً لأول أكسيد الكربون، مُشكلاً كربوكسي هيموغلوبين ذو لون أحمر قاني جداً.[20] في بعض الأحيان، يُقرأ إشباع الأكسجين 100% خطأً على مقياس الأكسجة والنبض عند المتسممين بأول أكسيد الكربون.
وجود البروتينات الحاملة للأكسجين داخل الخلايا المتخصصة (الكريات الحمراء) خطوة مهمة في تطور الفقاريات لأنها تجعل الدم أقل لزوجة، وتوفر تراكيز أعلى من الأكسجين، وانتشار أفضل للأكسجين من الدم إلى الأنسجة. يختلف حجم خلايا الدم الحمراء على نطاق واسع بين أنواع الفقاريات، يكون عَرض كريات الدم الحمراء أكبر من قطر الشعيرات الدموية بحوالي 25٪، وقد تم افتراض أن هذا يحسن نقل الأكسجين من كريات الدم الحمراء إلى الأنسجة.[21]
الثدييات
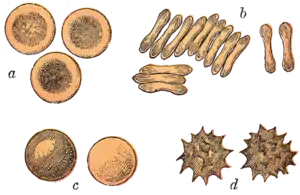
تأخذ كريات الدم الحمراء للثدييات شكل أقراص مقعرة الوجهين: مسطحة ومقعرة في المركز، مع مقطع عرضي يشبه الطارة، وحافة مستديرة للقرص. يسمح هذا الشكل بزيادة نسبة مساحة السطح إلى الحجم (SA/V) مما يسهل انتشار الغازات.[22] ومع ذلك، يوجد بعض الاستثناءات المتعلقة بالشكل في رتبة مزدوجات الأصابع (ذوات الحوافر بما في ذلك الماشية والغزلان)، والتي تملك مجموعة واسعة من أشكال كريات الدم الحمراء: الخلايا الصغيرة والبيضاوية للغاية في اللاما والإبل (عائلة جمليات)، خلايا كروية صغيرة في غزلان الفأر (عائلة طرغولية)، وخلايا ذات أشكال مغزلية، سِنانية الشكل، هلالية، ومتعددة الأضلاع بشكل غير منتظم وغيرها من الأشكال الزاويّة في الغزلان الحمراء والوَبِّيت (عائلة الأيل). من الواضح أن أعضاء من هذه الرتبة قد طوروا نمطاً شكلياً مختلفاً عن الثدييات.[14][23]
بشكل عام، تتميز كريات الدم الحمراء للثدييات بالمرونة وتغيير الشكل بشكل ملحوظ بسبب الضغط المطبق عليها أثناء مرورها في الشعيرات الدموية الصغيرة، وكذلك لزيادة سطحها من خلال افتراض شكل سيجارة، حيث تطلق حمولة الأوكسجين بكفاءة.[24]
إن كريات الدم الحمراء في الثدييات فريدة من نوعها بين الفقاريات لأنها لا تحتوي على نوى عندما تنضج.[15] تملك الكريات الحمراء نوى خلال المراحل المبكرة من تَكَوُّن الكريات الحمر، لكنها تتخلص منها أثناء تطورها عند الوصول إلى مرحلة النضج، مما يوفر مساحة أكبر للهيموغلوبين، تفقد كريات الدم الحمراء غير المنواة، والتي تدعى بالخلايا الشبكية، جميع العضيات الخلوية الأخرى مثل الميتوكندريا، جهاز كولجي، والشبكة الإندوبلازمية.[15]
يعمل الطحال كمخزن لكريات الدم الحمراء، ولكن هذا التأثير محدود نوعاً ما في البشر. في بعض الثدييات الأخرى، مثل الكلاب والخيول، يحتجز الطحال أعداداً كبيرة من كريات الدم الحمراء، التي يتم إلقاؤها في الدم عند الجهد، مما يزيد القدرة على نقل الأكسجين.[25]
الإنسان
يبلغ قطر كرية الدم الحمراء البشرية المعتاد حوالي 6.2-8.2 ميكرومتر،[26] ويبلغ سمكها في أثخن نقطة 2-2.5 ميكرون وسمكها في المركز 0.8-1 ميكرون، جاعلاً إياها أصغر بكثير من معظم الخلايا البشرية الأخرى. يبلغ متوسط حجم هذه الخلايا حوالي 90 فيمتوليتر[27] وتبلغ مساحتها حوالي 136 ميكرومتر مربع، ويمكن أن تتضخم إلى شكل كروي يحتوي على 150 فيمتوليتر، دون تَمَدُد الغشاء.[18]
يوجد لدى البشر البالغين في أي وقت من الأوقات ما يقرب من 20 إلى 30 تريليون كرية دم حمراء، وتشكل حوالي 70% من تعداد جميع خلايا الجسم.[28] تملك النساء حوالي 4-5 ملايين كرية دم حمراء لكل ميكروليتر (ملليمتر مكعب) من الدم أما الرجال حوالي 5-6 مليون كرية. يكون لدى الأشخاص القاطنين في المرتفعات -حيث يكون ضغط الأكسجين منخفض- تعداد كريات حمر أكبر. إن كريات الدم الحمراء أكثر تعداداً من خلايا الدم الأخرى: فهناك حوالي 4000-11000 خلية دم بيضاء وحوالي 150000-400000 صفيحة لكل ميكروليتر.[18]
تستغرق كريات الدم الحمراء البشرية في المتوسط 60 ثانية لإكمال دورة دموية واحدة.[6][9][29] يعود اللون الأحمر للدم إلى الخواص الطيفية لأيونات الحديد الهيمية في الهيموغلوبين. تحتوي كل كرية دم حمراء بشرية على حوالي 270 مليون[30] جزيئة هيموغلوبين. يحمل كل جزيء هيموغلوبين أربع مجموعات من الهيم، يشكل الهيموغلوبين حوالي ثلث إجمالي حجم الخلية. يعتبر الهيموغلوبين هو المسؤول عن نقل أكثر من 98% من الأكسجين في الجسم (يتم حمل الأكسجين المتبقي على شكل منحل في بلازما الدم). تخزن كريات الدم الحمراء عند ذكر بالغ حوالي 2.5 غرام من الحديد، وهو ما يمثل حوالي 65% من إجمالي الحديد الموجود في الجسم.[31][32]
النواة
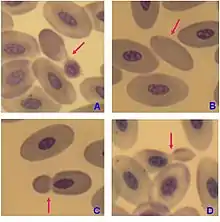
تكون كريات الدم الحمراء الناضجة غير منواة في الثدييات، وهذا يعني أنها تفتقر لنواة الخلية. بالمقابل، تحتوي كريات الدم الحمراء للفقاريات الأخرى على نوى، الاستثناءات الوحيدة المعروفة هي السمندرات من جنس بتراشيب وسمك من جنس موريولوس.[33][34]
تم تفسير ظاهرة غياب النواة في كريات الدم الحمراء عند الفقاريات بالتراكم المتتالي للحمض النووي DNA غير المرمز في الجينوم.[35] يدور الجدل على النحو التالي: يتطلب النقل الفعال للغاز عبور كريات الدم الحمراء عبر شعيرات دموية ضيقة للغاية، وهذا يقيد حجمها. تتواجد كريات الدم الحمراء المنواة في الثدييات في نوعين من الخلايا: الأرومات الطبيعية، وهي سلائف طبيعية منتجة للكريات الحمر الناضجة، والأرومات الضخمة، وهي سلائف غير طبيعية كبيرة تتشكل في فقر الدم الضخم الأرومات.
تكوين الغشاء
تكون كريات الدم الحمراء قادرة على تغيير شكلها، مرنة، قادرة على الالتصاق بخلايا أخرى، وتكون قادرة على التفاعل مع الخلايا المناعية. يلعب غشاء الكرية العديد من هذه الأدوار، إذ تعتمد هذه الوظائف بشكل كبير على تكوين الغشاء. يتكون غشاء كريات الدم الحمراء من ثلاث طبقات: كنان سكري موجود في الخارج، وهو غني بالسكريات، ليبيد ثنائي الطبقة يخترقه العديد من البروتينات عبر غشائية، إلى جانب مكوناتها الدهنية الرئيسية، وهيكل الغشاء، تتوضع شبكة هيكلية من البروتينات على السطح الداخلي لليبيدات ثنائية الطبقة. تشكل البروتينات حوالي 52% من كتلة الغشاء في كريات الدم الحمراء البشرية ومعظم الثدييات أما النصف الآخر دهون حوالي 40%، وهي فسفوليبيد وكوليسترول، أما السكريات تشكل حوالي 8%.[36][37][38]
ليبيدات الغشاء
يتكون غشاء كريات الدم الحمراء من ليبيد ثنائي الطبقة نموذجي، على غرار ما يمكن العثور عليه في جميع الخلايا البشرية تقريباً.[39] ببساطة، يتكون الليبيد ثنائي الطبقة من كوليسترول وفوسفوليبيد بنسب متساوية من حيث الوزن، كما أن تركيبة الليبيد مهمة لأنها تحدد العديد من الخصائص الفيزيائية مثل نفاذية الغشاء والسيولة.[39] بالإضافة إلى ذلك، يتم تنظيم نشاط العديد من بروتينات الغشاء من خلال التفاعلات مع الليبيدات في الطبقتين. على عكس الكوليسترول، الذي يتم توزيعه بالتساوي بين الطبقتين الداخلية والخارجية، تتوضع الأنواع الخمسة الرئيسية من الفوسفوليبيدات بشكل غير متماثل، كما هو موضح أدناه:
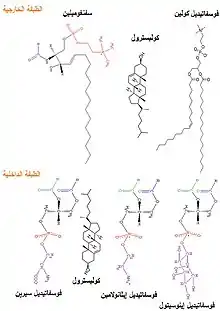
الطبقة الخارجية الأحادية
تتكون الطبقة الخارجية الأحادية من:[40]
- فسفاتيديل كولين (PC)
- سفنغوميلين (SM)
الطبقة الداخلية الأحادية
تتكون الطبقة الداخلية الأحادية من:[40]
- فسفاتيديل إيثانولامين [الإنجليزية] (PE)
- إينوزيتول فوسفات [الإنجليزية] (PI) (كميات صغيرة)
- فوسفاتيديل سيرين (PS)
توزيع الفوسفوليبيد غير المتماثل بين الطبقة الثنائية هو نتيجة وظيفة العديد من البروتينات الناقلة للفوسفوليبيد المعتمدة وغير المعتمدة على الطاقة.[41][42] تقوم البروتينات المسماة "فليباز" بنقل الفوسفوليبيد من الطبقة الخارجية إلى الطبقة الداخلية، بينما تقوم البروتينات الأخرى المسماة "فلوباز" بإجراء العملية المعاكسة، عكس مدروج التركيز بطريقة تعتمد على الطاقة.[43] بالإضافة إلى ذلك، هناك أيضاً بروتينات "سكرامبلاز" التي تحرك الفوسفوليبيدات في كلا الاتجاهين في نفس الوقت، حسب المدروج الأخفض بطريقة غير معتمدة على الطاقة. لا يزال هناك جدل كبير مستمر حول هوية بروتينات صيانة الغشاء في الكرية الحمراء.
يعد الحفاظ على توزيع الفوسفوليبيدات غير المتماثل في الطبقة الثنائية (مثل التوضع الحصري للفوسفاتيديل سيرين PS والفوسفوإينوسيتول PIs في الطبقة الداخلية) أمراً مهماً لسلامة الخلية ووظيفتها لعدة أسباب:
- تتعرف الخلايا البلعمية الكبيرة وتبلعم الكريات الحمراء التي تحوي PS على سطحها الخارجي. وبالتالي فإن توضع PS في الطبقة الأحادية الداخلية ضروري لنجاة الخلية من بالعات الجهاز الشبكي البطاني، خاصة في الطحال.
- تم ربط تدمير كريات الدم الحمراء الباكر في التلاسيميا وفقر الدم المنجلي باضطرابات عدم تناسق الليبيدات مما يؤدي إلى توضع PS في الطبقة الأحادية الخارجية.[44]
- يمكن أن يؤدي التعرض للـ PS إلى تحفيز التصاق كريات الدم الحمراء بالخلايا البطانية الوعائية، ويمنع بشكل فعال المرور الطبيعي خلال الأوعية الدموية الدقيقة. وبالتالي من المهم الحفاظ على PS فقط في الطبقة الداخلية لضمان التدفق الطبيعي للدم في الشعيرات الدموية الدقيقة.[45]
- يمكن لكل من PS و فوسفاتيديل لينوسيتول 4,5 ثنائي الفوسفات (PIP2) تنظيم الوظيفة الميكانيكية للغشاء، بسبب تفاعلهما مع بروتينات هيكلية مثل سبيكترين [الإنجليزية] والبروتين 4.1R.[46] أظهرت الدراسات الحديثة أن ربط السبيكترين مع PS يعزز الاستقرار الميكانيكي للغشاء.[46] يعزز PIP2 ارتباط البروتين 4.1R بالغليكوفرين C [الإنجليزية] ولكنه يقلل تفاعله مع البروتين 3، وبالتالي قد يعدل ارتباط الطبقة الثنائية بهيكل الغشاء.
وقد وصفت الدراسات الحديثة وجود هياكل متخصصة تسمى "الطوافات الليبيدية" في غشاء كريات الدم الحمراء. هذه الهياكل غنية بالكوليسترول والسفينغوليبيد المرتبطة ببروتينات غشاء محددة، وهي FLOT1، ستوماتين [الإنجليزية] (المجموعة 7)، بروتين G، مستقبلات بيتا الأدرينالية.[47][48]
تقوم الطوافات الليبيدية (التي تشارك في إحداث إشارات خلوية في خلايا غير الكريات الحمراء) في الكريات الحمر بالتوسط في إشارات مستقبلات بيتا 2 الأدرينالينية وزيادة مستويات أحادي فوسفات الأدينوسين الحلقي، وبالتالي تنظيم دخول طفيليات الملاريا إلى كريات حمراء طبيعية.[49][50]
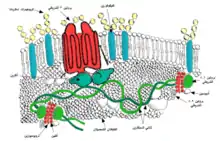
بروتينات الغشاء
تكون بروتينات الغشاء مسؤولة عن تغير شكل كريات الدم الحمراء ومرونتها، مما يمكّنها من الانضغاط أثناء عبورها الشعيرات الدموية[51] التي يقل قطرها عن نصف قطر كرية الدم الحمراء (7–8 ميكرون) واستعادة الشكل القرصي في أقرب وقت عندما تزول قوى الضغط المطبقة عليها، بطريقة مشابهة لجسم مطاطي.
يوجد حالياً أكثر من 50 بروتين غشائي معروف، يتراوح عددها من بضع مئات إلى مليون نسخة في كل كرية دم حمراء.[51] ما يقرب 25 نوع بروتيني غشائي يحمل مستضدات زمر الدم المختلفة، مثل مستضدات A و B و Rh.[51] يمكن أن تؤدي بروتينات الغشاء مجموعة متنوعة من الوظائف، مثل نقل الأيونات والجزيئات عبر غشاء الكرية الحمراء، الالتصاق والتفاعل مع الخلايا الأخرى[39] مثل الخلايا البطانية، كمستقبلات إشارة، بالإضافة إلى وظائف أخرى غير معروفة حالياً. نشأت أنواع الدم عند البشر نتيجة الاختلاف في البروتينات السكرية للكريات الحمراء. ترتبط اضطرابات بروتينات الغشاء بالعديد من الأمراض، مثل كثرة الكريات الحمر الكروية الوراثية، وكثرة الكريات الإهليلجية الوراثية، وكثرة الكريات المفوهة الوراثية [الإنجليزية]، والبيلة الهيموغلوبينية الليلية الانتيابية.[36][49]
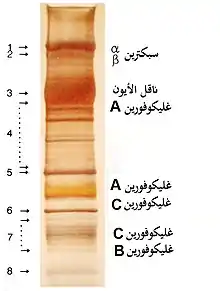
تصنف بروتينات الغشاء وفقاً لوظائفها:
النقل
- البروتين 3 الشريطي: ناقل الأيون، وهو أيضاً مُكوّن هيكلي مهم لغشاء كرية الدم الحمراء، ويُشكّل ما يقارب 25% من سطح غشاء الخلية، وتحتوي كل خلية حمراء على مليون نسخة تقريباً. يُعرِّف زمرة الدم دييغو.[51][53]
- أكوابورين 1: ناقل للماء، يُعرِّف زمرة الدم كولتون.[51]
- ناقل الجلوكوز 1: ناقل للجلوكوز وحمض ديهيدروسكوربيك.[51]
- بروتين مستضد Kidd: ناقل لليوريا.[51]
- البروتين السكري المرتبط بعامل ريزيوس: ناقل للغاز، وربما ثنائي أكسيد الكربون، يعرف زمرة دم ريزيوس وما يرتبط بها من النمط الظاهري لزمرة الدم رينول.[51]
- مضخة الصوديوم والبوتاسيوم.
- مضخة الكالسيوم.
- ناقل مشترك للصوديوم والبوتاسيوم والكلور.
- ناقل مشترك للصوديوم والكلور.
- مبادل عكسي بين البروتون والصوديوم.
- ناقل مشترك للبوتاسيوم والكلور.
- قناة غاردوس (هي قناة لنقل البوتاسيوم تُفعل بوجود الكالسيوم داخل الخلايا).
التصاق الخلية
- جزيء الالتصاق داخل الخلوي 4 ICAM-4: يتفاعل مع إنتغرين.
- جزيء التصاق الخلية القاعدية BCAM: بروتين سكري يعرف فصيلة الدم اللوثرية ويعرف أيضاً باسم بروتين Lu أو البروتين الرابط للامينين.
الدور الهيكلي
تقوم بروتينات الغشاء التالية بإنشاء روابط مع البروتينات الهيكلية وقد تلعب دوراً مهماًَ في تنظيم التماسك بين طبقة الشحوم الثنائية والهيكل الغشائي، مما يُمكِّن الكرية الحمراء من الحفاظ على مساحة مناسبة لسطح الغشاء عن طريق منع الغشاء من الانخماص.
- بروتينات المعقد كبيرة الجزيئات المعتمدة على الأنكرين: تربط طبقة الشحوم الثنائية بهيكل الغشاء من خلال تفاعل مجالات السيتوبلازم الخاصة بهم مع الأنكرين.
- البروتين 3 الشريطي: يجمع أيضاً العديد من الإنزيمات الحالة للغلوكوز، وناقل ثاني أكسيد الكربون المفترض، وكاربونيك أنهيدراز في مركب جزيئي كبير يسمى "metabolon"، والذي قد يلعب دوراً رئيسياً في تنظيم استقلاب الكريات الحمراء ووظيفة نقل الأيونات والغازات.[54]
- البروتين السكري المرتبط بالعامل ريزيوس: يشارك أيضاً في النقل، ويعرف النمط الظاهري النادر المرتبط بفصيلة الدم Rh mod.
- بروتينات المعقد كبيرة الجزيئات المعتمدة على البروتين 4.1R: بروتينات تتفاعل مع البروتين 4.1R.
- البروتين 4.1R: ضعيف التعبير عن مستضدات Gerbich.
- غليكوفورين C وغليكوبروتين D: يعرف زمرة الدم Gerbich.
- بروتين XK: يحدد زمرة الدم Kell والنمط الظاهري النادر Mcleod (نقص مستضد Kx والتعبير المنخفض لمستضدات Kell).
- نظام الزمرة الدموية الريسوسية RhD/RhCE: يُعرّف زمرة الدم الريزيوسية وما يرتبط بها من النمط الظاهري النادر لزمرة الدم Rh null.
- نظام مستضد دافي: تم اقتراحه ليرتبط مع كيموكين.[55]
- أديوسين: يتفاعل مع البروتين 3 الشريطي.
- ديماتين: يتفاعل مع ناقل الجلوكوز Glut1.[36][49]
الكمون الكهربائي السطحي
الكمون زيتا هي خاصية كهروكيميائية لأسطح الخلايا يتم تحديدها بواسطة الشحنة الكهربائية للجزيئات المكشوفة على سطح أغشية الخلية. كمون زيتا الطبيعي للكريات الحمراء هو 15.7 مللي فولت.[56] يبدو أن جزءً كبيراً من هذا الكمون قد ساهمت به بقايا حمض السياليك المتبقية في الغشاء إذ يؤدي إزالتها إلى كمون زيتا قدره −6.06 ميللي فولت.
دورة الحياة
التشكُّل
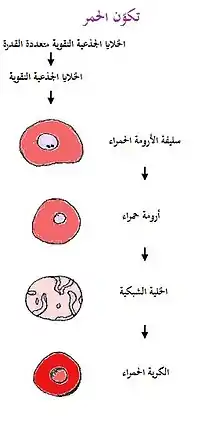
تُنتج خلايا الدم المحيطية من خلايا جذعية بعملية تدعى تكوّن الدم (بالإنجليزية: Hematopoiesis) حيث Hemo- بادئة تعني دم أو دموي أما poiesis- فهي لاحقة تعني تعني تكوّن،[10] والتي تستغرق حوالي 7 أيام.[57] تُنتج وتتحطم حوالي 200 مليار كرية دم حمراء في اليوم الواحد مما يسمح باستقرار عدد الكريات الحمراء.[58] جميع أنواع الخلايا الجذعية لها وظيفتان أساسيتان: التجدد الذاتي والتمايز. أثناء التطور، تُنتَج كريات الدم في مواقع مختلفة من الجسم. في البداية، يوفر كيس المح كريات دم حمراء حاملة للأكسجين، ثم تقوم عدة مواقع جنينية بإنتاج الخلايا الدموية. حيث تُنتج الكريات الحمر من قبل الكبد ثم في الثلث الثاني من الحمل تُنتج في نخاع العظام والطحال. مع تغير موقع الخلايا الجذعية، تتغير قدرة الخلايا الجذعية أيضاً بشكل تدريجي، إذ تزداد أنواع الخلايا المُنتَجة تعقيداً بالإضافة لتلك البسيطة الحاملة للأكسجين تُنتج الصفيحات الدموية والخلايا المناعية أخيراً.[10]
يولد نقي كل العظام كريات دم حمراء حتى عمر الخامسة ليصبح نخاع العظام بعد ذلك شحمياً، ما عدا الأقسام العلوية لعظمي العضد وقصبة الساق (الظنبوب)، ثم تتولد معظم خلايا الدم بعد سن العشرين من نقي العظام الغشائية كالفقرات، الأضلاع، القص والحرقفة.[2] ومع تقدم السن يقل إنتاج نقي العظم للخلايا الدموية.[2]
عند البالغين، الخلية الأولى التي يمكن تمييزها من سلسلة خلايا الدم الحمراء هي سليفة الأرومة الحمراء التي تتولد بأعداد كبيرة من الخلايا الجذعية، تنقسم سليفة الأرومات الحمر لتشكل الأرومات الحمر القاعدية -تتلون بالملونات القاعدية- التي تحوي كميات قليلة من الهيموغلوبين الذي تتمتلئ به في الأجيال اللاحقة كما تتكاثف النواة إلى حجم صغير وتطرح بقاياها الأخيرة إلى خارج الخلية، ويعاد في الوقت نفسه امتصاص الشبكة الإندوبلازمية لتسمى الخلية في هذه المرحلة بالخلية الشبكية لأنها مازالت تحوي كمية صغيرة من المادة القاعدية التي تتكون من بقايا جهاز غولجي والميتوكندريا والقليل من عضيات البلازما الأخرى، تصل الخلايا الشبكية إلى الشعيرات الدموية بعملية الانسلال (تشكل الخلايا الشبكية 1% من تركيز كريات الدم الحمراء)، حيث تختفي خلال يوم أو يومين بقية المواد القاعدية من الخلايا الشبكية لتتحول إلى كرية حمراء ناضجة.[2] تعيش كريات الدم الحمراء عند الفرد السليم في الدورة الدموية حوالي 100 إلى 120 يوماً[2][59] (و 80 إلى 90 يوماً في الرضيع).[60]
تؤثر عدة عوامل على إنتاج الكريات الحمراء منها أكسجة الأنسجة إذ يؤدي نقص الأكسجة إلى تحفيز تكوين الكريات الحمر، مُكوِنة الحمر "الإريثروبويتين" الذي تنتجه الكلى ويحفز تصنيع الكريات الحمراء، فيتامين B12 وفيتامين B9 إذ يؤدي عوزهما إلى فشل نضج السلسلة الحمراء.[2]
التحطُّم
مع تقدم عمر الكرية الحمراء، تصبح العمليات الاستقلابية (الأيضية) فيها أقل نشاطاً مما يجعل غشاء الكرية هشاً مؤدياً لتحطم الكرية أثناء مرورها في مناطق ضيقة في الدورة الدموية، إذ تتشظى العديد من الكريات الحمراء في لب الطحال حيث تكون سعة الأحياز بين الحويجزات حوالي 3 ميكرومتر فقط مقارنةً مع 8 ميكرومتر "قطر الكرية الحمراء السوية".[2][61][62] تسمى هذه العملية بالموت الخلوي المبرمج لكريات الدم الحمراء (بالإنجليزية: Eryptosis).[63] وعند استئصال الطحال تزداد الكريات الحمراء الشاذة والهرمة في الدورة الدموية.[2][64][65]
تبلعم البلاعم الهيموغلوبين مباشرة بعد تحريره من الكريات الحمر في عدة أقسام من الجسم، خاصة في الكبد (خلايا كوبفر) والطحال ونخاع العظم، ثم تحرر البلاعم الحديد إلى الدم ثانية لينقل بواسطة الترانسفيرين إلى نخاع العظم ليعاد استخدامه مجدداً لتصنيع كريات حمراء جديدة أو إلى الكبد والأنسجة الأخرى ليُخزَّن على شكل فيريتين، أما جزء البورفيرين تحوله البلاعم إلى بيليروبين يحرر في الدم ليطرح في الصفراء أخيراً.[2]
الوظيفة
الوظيفة الرئيسية
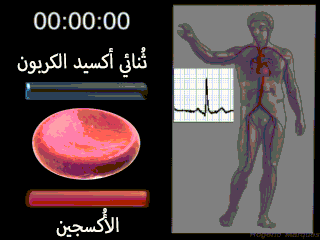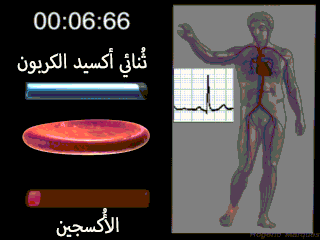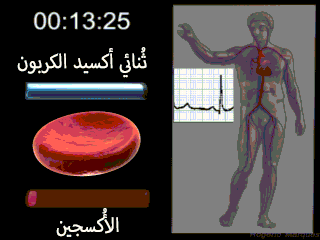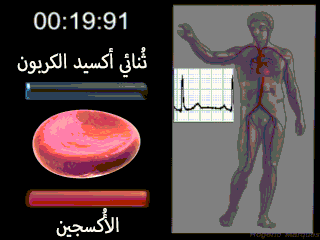
إن الوظيفة الرئيسية للكريات الحمراء هي نقل الهيموغلوبين الذي يقوم بدوره بحمل الأكسجين من الرئتين إلى الأنسجة. وفي بعض الحيوانات الدنيا يدور الهيموغلوبين كبروتين حر في البلازما وليس محصوراً في الكريات الحمر. ولكنه عندما يكون حراً في بلازما الإنسان يتسرب حوالي 3% منه خلال أغشية الأوعية الشعرية إلى أحياز الأنسجة أو خلال أغشية كبيبات الكلية إلى محفظة بومان كل مرة يمر فيها الدم خلال الشعيرات. ولذلك لكي يبقى الهيموغلوبين داخل مجرى الدم لا بد له من أن يبقى داخل كريات الدم الحمراء.[2]
وظائف ثانوية
- التوازن الحمضي القاعدي: تحوي الكريات الحمر كمية كبيرة من الأنهيدراز الكربونية التي تحفز التفاعل بين ثاني أكسيد الكربون والماء فتزيد بذلك من سرعة هذا التفاعل آلاف المرات. وتمكِّن سرعة هذا التفاعل العالية مصل الدم من أن يتفاعل مع كميات كبيرة من ثاني أكسيد الكربون فينقله بذلك من الأنسجة إلى الرئتين على شكل أيونات البيكربونات -HCO3 كما يكون الهيموغلوبين دارئاً (محلول منظم) حمضياً قاعدياً ممتازاً (كما هو الحال مع معظم البروتينات)، ولهذا فإن الكريات الحمر هي المسؤولة عن معظم قدرات الدم كله على الدرء.[2]
- التوترية الوعائية: عندما تتعرض كريات الدم الحمراء للضغط من قبل الأوعية المتقبضة، فإنها تطلق الأدينوسين ثلاثي الفوسفات (ATP)، مؤدياً إلى استرخاء وتمدد جدران الوعاء مما يعزز التدفق الطبيعي للدم.[66] وعندما يتم إزالة الأكسجين من جزيئات الهيموغلوبين، تفرز كريات الدم الحمراء مركبات S-نتروزو الثيولات، والتي تعمل أيضاً على تمدد الأوعية الدموية،[67] وبالتالي توجيه المزيد من الدم إلى مناطق الجسم ناقصة الأكسجة. كذلك يمكن لكريات الدم الحمراء تصنيع أكسيد النيتريك أنزيمياً، باستخدام L-أرجينين كركيزة، كما تفعل الخلايا البطانية.[68] إذ إن تعرض كريات الدم الحمراء لمستويات فيزيولوجية من قوى الضغط ينشط تركيب أكسيد النيتريك،[69] مما قد يسهم في تنظيم التوترية الوعائية.[15] ويمكن لكريات الدم الحمراء أيضاً إنتاج كبريتيد الهيدروجين، وهو غاز يؤدي إلى ارتخاء جدران الأوعية الدموية. حيث يُعتقد أن التأثيرات القلبية للثوم ترجع إلى قيام كريات الدم الحمراء بتحويل مركبات الكبريت إلى كبريتيد الهيدروجين.[70]
- الاستجابة المناعية: تلعب كريات الدم الحمراء أيضاً دوراً في الاستجابة المناعية للجسم، عندما يتم حلها بواسطة العوامل الممرضة مثل البكتيريا، مما يُطلق خضاب الكريات محرراً جذور حرة، تعمل على تحطيم جدار وغشاء الخلية الممرضة، مما يؤدي إلى قتلها.[71][72]
العمليات الخلوية
لا تستخدم الكريات الحمراء أياً من الأكسجين الذي تنقله نظراً لعدم احتوائها على متقدرات، بدلاً من ذلك، تنتج الأدينوسين ثلاثي الفوسفات عن طريق تحلل الجلوكوز وتخمير حمض اللبنيك منتجةً البيروفات.[15][73][74] علاوة على ذلك، يلعب مسار فوسفات البنتوز دوراً مهماً في الكريات الحمراء، انظر عوز نازعة هيدروجين غلوكوز -6- فوسفات لمزيد من المعلومات.
يفترض حالياً أن الاصطناع الحيوي للبروتين غائباً في الكريات الحمراء نتيجة غياب النواة. كما أن الكريات الحمر الناضجة لا تحتوي على الحمض النووي الريبوزي منقوص الأكسجين (DNA) ولا يمكنها تصنيع الحمض النووي الريبوزي (RNA) بسبب غياب النوية والعضيات الخلوية وبالتالي لا تملك القدرة على الانقسام وكذلك فإن إمكانية الإصلاح الخلوي محدودة.[75]
إن عدم القدرة على اصطناع البروتين يجعل الكريات الحمراء الخاصة بالثدييات غير مستهدفة من قبل أي فيروس.[76] ومع ذلك، يمكن أن تؤثر الإصابة بالفيروسة الصغيرة (Parvovirus) (مثل فيروس صغير ب 19) على سلائف الأرومة الحمراء، حيث لوحظ وجود سلائف أرومة حمراء عملاقة مع جزيئات فيروسية ومشتملات، وبالتالي تستنفذ بشكل مؤقت الشبكيات وتسبب فقر الدم.[77]
الأهمية السريرية
فئات الدم
 مقالة مفصلة: فئات الدم
مقالة مفصلة: فئات الدم
تصف زمرة الدم الواحدة مجموعة كاملة من 30 مادة على سطح كريات الدم الحمراء، وزمرة دم الفرد هي واحدة من العديد من التركيبات المحتملة لمستضدات زمر الدم.[78] في أنظمة زمر الدم الستة والثلاثين المختلفة، عُثر على 308 مستضد على سطح الكرية الحمراء.[79]
نظام ABO هو أهم نظام لزمر الدم عند نقل الدم بين البشر. عادة ما تكون الأجسام المضادة لـ A و B مرتبطة بالجلوبيولين المناعي IgM. تم الافتراض أن الأجسام المضادة IgM لنظام زمر الدم ABO تُنتج في السنوات الأولى من الحياة عن طريق التحسس للمواد البيئية مثل الطعام، البكتيريا، والفيروسات، على الرغم من تطبيق قواعد توافق فصيلة الدم على الأطفال حديثي الولادة والرضع على سبيل الممارسة.[80] المصطلح الأصلي الذي استخدمه كارل لاندشتاينر عام 1901 للتصنيف كان A/B/C، في المنشورات اللاحقة، حُولِت C إلى O.[81] يُطلق على النوع O غالباً 0 (zero, or null) في لغات أخرى.[81][82]
الأمراض
هناك أمراض كثيرة تصيب العناصر الدموية، من هذه الأمراض التي تصيب الكريات الحمراء:
- فقر الدم هو مجموعة أمراض تتميز بانخفاض القدرة على نقل الأكسجين في الدم، بسبب انخفاض عدد أو خلل في الكريات الحمراء أو الهيموغلوبين.[83] من أنواعه:
| نوع فقر الدم | الشرح |
|---|---|
| فقر الدم بعوز الحديد | هو فقر الدم الأكثر شيوعاً، يحدث عندما يكون المدخول الغذائي أو امتصاص الحديد غير كاف، وبالتالي لا يمكن تكوين الهيموغلوبين الحاوي على الحديد.[84] |
| فقر الدم الخبيث | هو مرض مناعي ذاتي حيث يفتقر الجسم العامل الداخلي، الضروري لامتصاص فيتامين ب 12 من الطعام (الهام لإنتاج الهيموغلوبين).[2] |
| فقر الدم الانحلالي | من أسبابه: مكتسب "مناعي، دوائي، إنتاني"، وراثي "فقر الدم المنجلي، تلاسيميا، كثرة الكريات الحمر الكروية الوراثي"
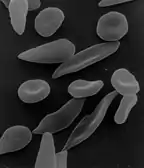 كريات دم حمراء منجلية الشكل عند مصاب بفقر الدم المنجلي
|
| فقر الدم اللاتنسجي | يحدث بسبب عدم قدرة نخاع العظام (النقي العظمي) على إنتاج خلايا الدم. يحدث عدم تنسج الكريات الحمراء النقي بسبب عدم قدرة النقي العظمي على إنتاج كريات الدم الحمراء فقط. |
- احمرار الدم هي زيادة نسبة الهيماتوكريت، قد يكون بسبب نقص تعداد الكريات الحمر[90] أو نقص في كمية البلازما.[91]
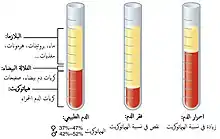
| أنواع احمرار الدم | الشرح |
|---|---|
| كثرة الحمر الحقيقة | يحدث نتيجة زيادة إنتاج نخاع العظم للكريات الحمراء وله نوعان:
|
| كثرة الحمر النسبية | فيه نجد ارتفاع نسبة الهيماتوكريت بشكل كاذب نتيجة لنقص حجم البلازما (تجفاف أو حروق أو..). |
- العديد من أمراض اعتلالات الأوعية الدقيقة [الإنجليزية]، بما في ذلك التخثر المنتشر داخل الأوعية واعتلال الأوعية الدقيقة الخثاري [الإنجليزية]، يُشاهد فيها شظايا كريات دم حمراء (مُشخِصَة) تسمى الكرية المنفلقة.[94] تولد هذه الأمراض خيوط من الفيبرين التي تمزق كريات الدم الحمراء أثناء محاولتها العبور عبر الخثرة.[95]
نقل الدم
 مقالة مفصلة: نقل الدم
مقالة مفصلة: نقل الدم
نقل الدم هي عملية يُنقل فيها كريات الدم الحمراء، إذ يمكن التبرع بالدم من شخص لآخر،[96] أو تخزينه من قبل المتلقي في وقت سابق. عادة ما يتطلب التبرع بالدم إجراء فحوصات للتأكد من خلو المتبرعين من الأمراض المنقولة بالدم.[97] يتم عادة جمع الدم وفحصه بحثاً عن الأمراض الشائعة أو الخطيرة المنقولة بالدم بما في ذلك فيروس التهاب الكبد B وفيروس التهاب الكبد C وفيروس نقص المناعة البشرية.[98] يتم تحديد زمرة الدم (A أو B أو AB أو O) ومصالبته مع دم المتلقي لتقليل احتمالية حدوث الانحلال الدموي الحاد المرتبط بنقل الدم [الإنجليزية]، وهو نوع من تفاعلات نقل الدم،[99] يتعلق هذا بوجود مستضدات على سطح الخلية. بعد هذه العملية، يتم تخزين الدم، وفي غضون فترة قصيرة يُنقل. يمكن إعطاء الدم كمنتج كامل أو فصل كريات الدم الحمراء كوحدة كريات الدم الحمراء المكدسة.[100] غالباً ما يتم نقل الدم عندما يكون هناك فقر دم معروف، أو نزف فعال عندما تكون نسبة فقد الدم حوالي 15-30% من حجم الدم الكلي في الجسم،[101] أو عند توقع فقد كمية دم هامة، مثل ما قبل التداخلات الجراحية. قبل نقل الدم، يتم أخذ عينة دم صغيرة من المتلقي وعينة من الدم المراد نقله وإجراء اختبار التوافق (التصالب الدموي).[102] في عام 2008، نجحت عملية إنتاج كريات دم حمراء من خلايا جذعية جنينية بشرية في المختبر. كانت الخطوة الصعبة هي حث الخلايا على التخلص من نواتها، وقد تحقق ذلك بتنمية الخلايا في خلايا سدوية في نخاع العظام. ويؤمل أن كريات الدم الحمراء الاصطناعية هذه يمكن استخدامها في نهاية المطاف في عمليات نقل الدم.[103]
الاختبارات الدموية
تشمل الاختبارات الدموية تعداد كريات الدم الحمراء، وحساب الهيماتوكريت (النسبة المئوية لحجم الدم الذي تشغله كريات الدم الحمراء)، سرعة ترسب الدم.[104] كما تُحدد فصيلة الدم للتحضير لنقل الدم أو زرع الأعضاء.[105]
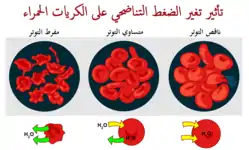
يتم تشخيص العديد من الأمراض الدموية باللطاخة الدموية (أو لطاخة الدم المحيطية)، حيث يتم مد طبقة رقيقة من الدم على شريحة مجهرية.[106] قد يكشف هذا عن تشوهات في شكل وهيئة كريات الدم الحمراء. عندما تتكدس كريات الدم الحمراء أحياناً ككومة، بحيث يكون الجانب المسطح للكرية بجانب الجانب المسطح للأخرى، يُعرف هذا بتكوين النضائد، ويحدث في كثير من الأحيان في حال كانت مستويات بعض بروتينات المصل مرتفعة، كما هو الحال أثناء الحوادث الالتهابية.[107]
من الاختبارات الأخرى، اختبار الهشاشة التناضحية (OFT) [الإنجليزية] الذي يستخدم لقياس مقاومة كريات الدم الحمراء للانحلال أثناء التعرض لمستويات مختلفة من التمديد بمحلول ملحي.[108]
تجزئة الدم والتنشيط بالدم
 مقالة مفصلة: تجزئة الدم
مقالة مفصلة: تجزئة الدم
يمكن الحصول على كريات الدم الحمراء من الدم الكامل عن طريق الطرد المركزي، الذي يفصل الكريات الحمر عن بلازما الدم في عملية تعرف باسم تجزئة الدم.[109] تستخدم كريات الدم الحمراء المكدسة، الناتجة عن فصل مكونات الدم الكامل، في نقل الدم.[110]
حاول بعض الرياضيين تحسين أدائهم عن طريق التنشيط بالدم: أولاً يُؤخذ حوالي لتر واحد من دمهم، حيث تُعزل كريات الدم الحمراء وتُجمد وتُخزن، ليتم حقنها قبل المنافسة بوقت قصير. (يمكن الحفاظ على كريات الدم الحمراء لمدة 5 أسابيع عند −79 درجة مئوية أو −110 درجة فهرنهايت، أو أكثر من 10 سنوات باستخدام واقيات التجمد [الإنجليزية][111]) من الصعب اكتشاف هذه الممارسة ولكنها قد تُعرض للخطر الجهاز القلبي الوعائي البشري غير المجهز للتعامل مع دم شديد اللزوجة. طريقة أخرى للتنشيط بالدم تتضمن حقن الإريثروبويتين من أجل تحفيز إنتاج كريات الدم الحمراء. كلتا الممارستين ممنوعتين من قبل الوكالة العالمية لمكافحة المنشطات.[112]
التاريخ
أول عالم وصف كريات الدم الحمراء هو عالم الأحياء الهولندي الشاب يان زفامردام، الذي استخدم مجهراً عام 1658 لدراسة دم ضفدع.[113] قدم أنطوني فان ليفينهوك وصفاً مجهرياً آخر في عام 1674، هذه المرة وصفاً أكثر دقة لكريات الدم الحمراء إذ قدر حجمها تقريباً "أصغر بـ 25000 مرة من حبة رمل دقيقة".[114]
في عام 1901، نشر كارل لاندشتاينر اكتشافه لثلاث زمر دم رئيسية هي A و B و C (والتي أعاد تسميتها لاحقاً إلى O).[115] وصف لاندشتاينر الأنماط التي حدثت فيها ردود الفعل عندما خُلط المصل مع كريات الدم الحمراء، وبالتالي تحديد المجموعات المتوافقة والمتضاربة بين زمر الدم هذه.[115] وبعد مرور عام، حدد ألفريد فون ديكاستيلو وأدريانو ستورلي، وهما زميلان لاندشتاينر، زمرة دم رابعة هي AB.[115]
في عام 1959، تمكن الدكتور ماكس بيروتس باستخدام دراسة البلورات بالأشعة السينية من الكشف عن بنية الهيموغلوبين، بروتين كريات الدم الحمراء الحامل للأكسجين.[116]
تم العثور على أقدم كريات دم حمراء سليمة في أوتزي، وهي مومياء لرجل توفي حوالي 3255 قبل الميلاد. تم اكتشاف هذه الخلايا في أيار 2012.[117]
انظر أيضًا
 صور وملفات صوتية من كومنز
صور وملفات صوتية من كومنز
المراجع
- "Blood Cells". مؤرشف من الأصل في 23 يوليو 2016. اطلع عليه بتاريخ أغسطس 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ الوصول=(مساعدة) - C. Guyton, M.D; John E. Hall, Ph.D (1996). "32". In translated to arabic by The world Health Organization (المحرر). Textbook of Medical physiology [المرجع في الفيزيولوجيا الطبية] (الطبعة التاسعة). الوسيط
|CitationClass=تم تجاهله (مساعدة) - F. C. Garg (2005). Experimental Microbiology (باللغة الإنجليزية) (الطبعة first edition). CBS Publishers & Distributors. صفحة 48. مؤرشف من الأصل في 11 أبريل 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: نص إضافي (link) - Li, He; Lykotrafitis, George (2014-08-05). "Erythrocyte Membrane Model with Explicit Description of the Lipid Bilayer and the Spectrin Network". Biophysical Journal. 107 (3): 642–653. doi:10.1016/j.bpj.2014.06.031. ISSN 0006-3495. PMID 25099803. مؤرشف من الأصل في 11 أبريل 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Erich Sackmann, Biological Membranes Architecture and Function., Handbook of Biological Physics, (ed. R.Lipowsky and E.Sackmann, vol.1, Elsevier, 1995
- J. A. Blom (15 December 2003). Monitoring of Respiration and Circulation. CRC Press. صفحة 27. ISBN 978-0-203-50328-7. مؤرشف من الأصل في 12 يناير 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Sender, Ron; Fuchs, Shai; Milo, Ron (19 August 2016). "Revised Estimates for the Number of Human and Bacteria Cells in the Body". PLoS Biology. doi:10.1371/journal.pbio.1002533. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Laura Dean. Blood Groups and Red Cell Antigens نسخة محفوظة 9 يونيو 2007 على موقع واي باك مشين.
- Pierigè F, Serafini S, Rossi L, Magnani M (January 2008). "Cell-based drug delivery". Advanced Drug Delivery Reviews. 60 (2): 286–95. doi:10.1016/j.addr.2007.08.029. PMID 17997501. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Dan L. (2016-09-22). Harrison's Hematology and Oncology, 3E (باللغة الإنجليزية). McGraw Hill Professional. ISBN 978-1-259-83582-7. مؤرشف من الأصل في 25 أبريل 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Vinay Kumar; Abul K. Abbas; Nelson Fausto; Richard N. Mitchell (2007). Robbins Basic Pathology (الطبعة 8th). Saunders. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Ruud JT (May 1954). "Vertebrates without erythrocytes and blood pigment". Nature. 173 (4410): 848–50. Bibcode:1954Natur.173..848R. doi:10.1038/173848a0. PMID 13165664. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Carroll, Sean (2006). The Making of the Fittest. W.W. Norton. ISBN 978-0-393-06163-5. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Gulliver, G. (1875). "On the size and shape of red corpuscles of the blood of vertebrates, with drawings of them to a uniform scale, and extended and revised tables of measurements". Proceedings of the Zoological Society of London. 1875: 474–495. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Alexander Fridman; Gary Friedman. Plasma Medicine. مؤرشف من الأصل في 11 أبريل 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Maton, Anthea; Jean Hopkins; Charles William McLaughlin; Susan Johnson; Maryanna Quon Warner; David LaHart; Jill D. Wright (1993). Human Biology and Health. Englewood Cliffs, New Jersey, USA: Prentice Hall. ISBN 978-0-13-981176-0. مؤرشف من الأصل في 15 ديسمبر 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Dentalman. United States. Bureau of Naval Personnel. 1969. صفحة 27. مؤرشف من الأصل في 11 أبريل 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Giuseppe Lippi; Gianfranco Cervellin; J. Favaloro, Emmanuel; Plebani, Mario (July 16, 2012). In Vitro and In Vivo Hemolysis: An Unresolved Dispute in Laboratory Medicine (باللغة الإنجليزية) (الطبعة 1 edition). De Gruyter. مؤرشف من الأصل في 11 أبريل 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: نص إضافي (link) - Anthis, Nick (April 17, 2008). "Why Are Veins Blue?". Scienceblogs. مؤرشف من الأصل في 2 نوفمبر 2018. اطلع عليه بتاريخ 23 أبريل 2015. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Robin R. Preston; Thad E. Wilson (2013). Physiology (باللغة الإنجليزية). صفحة 293. مؤرشف من الأصل في 11 أبريل 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Snyder, Gregory K.; Sheafor, Brandon A. (1999). "Red Blood Cells: Centerpiece in the Evolution of the Vertebrate Circulatory System". Integrative and Comparative Biology. 39 (2): 189. doi:10.1093/icb/39.2.189. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "BBC Bitesize – GCSE Biology – Blood – Revision 2". www.bbc.co.uk (باللغة الإنجليزية). مؤرشف من الأصل في 20 ديسمبر 2017. اطلع عليه بتاريخ 26 نوفمبر 2017. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Gregory TR (2001). "The bigger the C-value, the larger the cell: genome size and red blood cell size in vertebrates". Blood Cells, Molecules & Diseases. 27 (5): 830–43. CiteSeerX = 10.1.1.22.9555 10.1.1.22.9555. doi:10.1006/bcmd.2001.0457. PMID 11783946. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Goodman SR, Kurdia A, Ammann L, Kakhniashvili D, Daescu O (December 2007). "The human red blood cell proteome and interactome". Experimental Biology and Medicine. 232 (11): 1391–408. doi:10.3181/0706-MR-156. PMID 18040063. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Stewart, Ian B.; McKenzie, Don C. (2002). "The human spleen during physiological stress". Sports Medicine (Auckland, N.Z.). 32 (6): 361–369. doi:10.2165/00007256-200232060-00002. ISSN 0112-1642. PMID 11980500. مؤرشف من الأصل في 11 أبريل 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Mary Louise Turgeon (2004). Clinical Hematology: Theory and Procedures. Lippincott Williams & Wilkins. صفحة 100. ISBN 9780781750073. مؤرشف من الأصل في 02 مارس 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - McLaren CE, Brittenham GM, Hasselblad V (April 1987). "Statistical and graphical evaluation of erythrocyte volume distributions". Am. J. Physiol. 252 (4 Pt 2): H857–66. CiteSeerX = 10.1.1.1000.348 10.1.1.1000.348. doi:10.1152/ajpheart.1987.252.4.H857. PMID 3565597. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Bianconi, Eva; Piovesan, Allison; Facchin, Federica; Beraudi, Alina; Casadei, Raffaella; Frabetti, Flavia; Vitale, Lorenza; Pelleri, Maria Chiara; Tassani, Simone (2013-11-01). "An estimation of the number of cells in the human body". Annals of Human Biology. 40 (6): 463–471. doi:10.3109/03014460.2013.807878. ISSN 0301-4460. PMID 23829164. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Hillman, Robert S.; Ault, Kenneth A.; Rinder, Henry M. (2005). Hematology in Clinical Practice: A Guide to Diagnosis and Management (الطبعة 4). McGraw-Hill Professional. صفحة 1. ISBN 978-0-07-144035-6. الوسيط
|CitationClass=تم تجاهله (مساعدة) - D’Alessandro, Angelo (2017). "Red blood cell proteomics update: is there more to discover?". Blood Transfusion. 15 (2): 182–187. doi:10.2450/2017.0293-16. PMC 5336341. PMID 28263177. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Iron Metabolism, University of Virginia Pathology. Accessed 22 September 2007. نسخة محفوظة 4 مارس 2016 على موقع واي باك مشين.
- Iron Transport and Cellular Uptake by Kenneth R. Bridges, Information Center for Sickle Cell and Thalassemic Disorders. Accessed 22 September 2007. نسخة محفوظة 17 أغسطس 2019 على موقع واي باك مشين.
- Cohen, W. D. (1982). "The cytomorphic system of anucleate non-mammalian erythrocytes". Protoplasma. 113: 23–32. doi:10.1007/BF01283036. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Wingstrand KG (1956). "Non-nucleated erythrocytes in a teleostean fish Maurolicus mülleri (Gmelin)". Zeitschrift für Zellforschung und Mikroskopische Anatomie. 45 (2): 195–200. doi:10.1007/BF00338830 (غير نشط 2020-01-22). PMID 13402080. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Gregory, T. R. (2001). "The Bigger the C-Value, the Larger the Cell: Genome Size and Red Blood Cell Size in Vertebrates". Blood Cells, Molecules and Diseases. 27 (5): 830–843. CiteSeerX = 10.1.1.22.9555 10.1.1.22.9555. doi:10.1006/bcmd.2001.0457. PMID 11783946. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Yazdanbakhsh K, Lomas-Francis C, Reid ME (October 2000). "Blood groups and diseases associated with inherited abnormalities of the red blood cell membrane". Transfusion Medicine Reviews. 14 (4): 364–74. doi:10.1053/tmrv.2000.16232. PMID 11055079. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Ways, Peter; Reed, Claude F.; Hanahan, Donald J. (1963-08-01). "RED-CELL AND PLASMA LIPIDS IN ACANTHOCYTOSIS*". Journal of Clinical Investigation. 42 (8): 1248–1260. doi:10.1172/jci104810. ISSN 0021-9738. مؤرشف من الأصل في 22 أبريل 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Steck, Theodore L. (1974-07-01). "THE ORGANIZATION OF PROTEINS IN THE HUMAN RED BLOOD CELL MEMBRANE". The Journal of Cell Biology. 62 (1): 1–19. doi:10.1083/jcb.62.1.1. ISSN 1540-8140. مؤرشف من الأصل في 11 مايو 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Dr Erhabor; Dr Adias (2013). Essentials of Blood Transfusion Science (باللغة الإنجليزية). مؤرشف من الأصل في 22 أبريل 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - N.; Harris, J. Robin (2012-12-06). Endoplasmic Reticulum (باللغة الإنجليزية). Springer Science & Business Media. ISBN 978-1-4615-2912-5. مؤرشف من الأصل في 22 أبريل 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Daleke, David L (2008-05). "Regulation of phospholipid asymmetry in the erythrocyte membrane". Current Opinion in Hematology. 15 (3): 191–195. doi:10.1097/moh.0b013e3282f97af7. ISSN 1065-6251. مؤرشف من الأصل في 22 أبريل 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ=(مساعدة) - Wiedmer, Therese; Sims, Peter (2001). "Unraveling the Mysteries of Phospholipid Scrambling". Thrombosis and Haemostasis. 86 (07): 266–275. doi:10.1055/s-0037-1616224. ISSN 0340-6245. مؤرشف من الأصل في 22 أبريل 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Hankins, Hannah M.; Baldridge, Ryan D.; Xu, Peng; Graham, Todd R. (January 2015). "Role of Flippases, Scramblases and Transfer Proteins in Phosphatidylserine Subcellular Distribution". Traffic. 16 (1): 35–47. doi:10.1111/tra.12233. PMC 4275391. PMID 25284293. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Kuypers, Frans A.; Yuan, Jie; Lewis, Rachel A.; Snyder, L. Michael; Kiefer, Charles R.; Bunyaratvej, Ahnond; Fucharoen, Suthat; Ma, Lisa; Styles, Lori (1998-04-15). "Membrane Phospholipid Asymmetry in Human Thalassemia". Blood. 91 (8): 3044–3051. doi:10.1182/blood.v91.8.3044.3044_3044_3051. ISSN 1528-0020. مؤرشف من الأصل في 11 مايو 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Setty, B. N. Yamaja; Kulkarni, Surekha; Stuart, Marie J. (2002-03-01). "Role of erythrocyte phosphatidylserine in sickle red cell–endothelial adhesion". Blood. 99 (5): 1564–1571. doi:10.1182/blood.v99.5.1564. ISSN 1528-0020. مؤرشف من الأصل في 11 مايو 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Manno, S.; Takakuwa, Y.; Mohandas, N. (2002-02-05). "Identification of a functional role for lipid asymmetry in biological membranes: Phosphatidylserine-skeletal protein interactions modulate membrane stability". Proceedings of the National Academy of Sciences. 99 (4): 1943–1948. doi:10.1073/pnas.042688399. ISSN 0027-8424. مؤرشف من الأصل في 23 أبريل 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Salzer, Ulrich; Prohaska, Rainer (2001-02-15). "Stomatin, flotillin-1, and flotillin-2 are major integral proteins of erythrocyte lipid rafts". Blood. 97 (4): 1141–1143. doi:10.1182/blood.v97.4.1141. ISSN 1528-0020. مؤرشف من الأصل في 11 مايو 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Murphy, Sean C.; Samuel, Benjamin U.; Harrison, Travis; Speicher, Kaye D.; Speicher, David W.; Reid, Marion E.; Prohaska, Rainer; Low, Philip S.; Tanner, Michael J. (2004-03-01). "Erythrocyte detergent-resistant membrane proteins: their characterization and selective uptake during malarial infection". Blood. 103 (5): 1920–1928. doi:10.1182/blood-2003-09-3165. ISSN 0006-4971. مؤرشف من الأصل في 11 مايو 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Mohandas N, Gallagher PG (November 2008). "Red cell membrane: past, present, and future". Blood. 112 (10): 3939–48. doi:10.1182/blood-2008-07-161166. PMC 2582001. PMID 18988878. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Rodi PM, Trucco VM, Gennaro AM (June 2008). "Factors determining detergent resistance of erythrocyte membranes". Biophysical Chemistry. 135 (1–3): 14–8. doi:10.1016/j.bpc.2008.02.015. PMID 18394774. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Osaro; Adias, Teddy (2012-05-31). Transfusion Medicine Made Easy For Students of Biomedical Science, Allied Medical Sciences and Medicine (باللغة الإنجليزية). BoD – Books on Demand. ISBN 978-953-51-0523-7. مؤرشف من الأصل في 23 أبريل 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Characterization of membrane proteins by polychromatic silver staining". Hoppe-Seyler's Z Physiol Chem. 365: 241–242. 1984. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Iolascon A, Perrotta S, Stewart GW (March 2003). "Red blood cell membrane defects". Reviews in Clinical and Experimental Hematology. 7 (1): 22–56. PMID 14692233. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Bruce, L. J. (2003-01-16). "A band 3-based macrocomplex of integral and peripheral proteins in the RBC membrane". Blood. 101 (10): 4180–4188. doi:10.1182/blood-2002-09-2824. ISSN 0006-4971. مؤرشف من الأصل في 11 مايو 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Denomme GA (July 2004). "The structure and function of the molecules that carry human red blood cell and platelet antigens". Transfusion Medicine Reviews. 18 (3): 203–31. doi:10.1016/j.tmrv.2004.03.006. PMID 15248170. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Tokumasu F, Ostera GR, Amaratunga C, Fairhurst RM (2012) Modifications in erythrocyte membrane zeta potential by Plasmodium falciparum infection. Exp Parasitol
- Alexander; Friedman, Gary (2012-12-19). Plasma Medicine (باللغة الإنجليزية). John Wiley & Sons. ISBN 978-1-118-43765-0. مؤرشف من الأصل في 25 أبريل 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Kevin T. Patton; PhD, Gary A. Thibodeau; Msc, Andrew Hutton, BSC (2019-05-11). Anatomy and Physiology Adapted International Edition (باللغة الإنجليزية). Elsevier Health Sciences. ISBN 978-0-7020-7715-9. مؤرشف من الأصل في 4 يونيو 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Mollison, PL (1994-06). "The genetic basis of the Rh blood group system". Transfusion. 34 (6): 539–541. doi:10.1046/j.1537-2995.1994.34694295073.x. ISSN 0041-1132. مؤرشف من الأصل في 25 أبريل 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ=(مساعدة) - HARRISON, K. L. (1979-06). "Fetal Erythrocyte Lifespan". Journal of Paediatrics and Child Health. 15 (2): 96–97. doi:10.1111/j.1440-1754.1979.tb01197.x. ISSN 1034-4810. مؤرشف من الأصل في 25 أبريل 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ=(مساعدة) - Chen, Li-Tsun; Weiss, Leon (1973-04-01). "The Role of the Sinus Wall in the Passage of Erythrocytes Through the Spleen". Blood. 41 (4): 529–537. doi:10.1182/blood.v41.4.529.529. ISSN 0006-4971. مؤرشف من الأصل في 11 مايو 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Jung, F. (1958-01). "Das Schicksal toxisch veränderter roter Blutzellen in der Milz". Klinische Wochenschrift (2): 63–66. doi:10.1007/bf01486245. ISSN 0023-2173. مؤرشف من الأصل في 11 يونيو 2018. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ=(مساعدة) - Lang, Florian; Lang, Elisabeth; Föller, Michael (2012). "Physiology and Pathophysiology of Eryptosis". Transfusion Medicine and Hemotherapy. 39 (5): 308–314. doi:10.1159/000342534. ISSN 1660-3818. مؤرشف من الأصل في 09 مايو 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Drenckhahn, D. (1988). Platt, Dieter (المحرر). "Removal of Old and Abnormal Red Blood Cells from Circulation: Mechanical and Immunologic Mechanisms". Blood Cells, Rheology, and Aging (باللغة الإنجليزية). Berlin, Heidelberg: Springer: 62–72. doi:10.1007/978-3-642-71790-1_7. ISBN 978-3-642-71790-1. مؤرشف من الأصل في 03 يونيو 2018. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Biological sciences, Blood Cells [وصلة مكسورة] نسخة محفوظة 24 يوليو 2016 على موقع واي باك مشين.
- Wan J, Ristenpart WD, Stone HA (October 2008). "Dynamics of shear-induced ATP release from red blood cells". Proceedings of the National Academy of Sciences of the United States of America. 105 (43): 16432–7. Bibcode:2008PNAS..10516432W. doi:10.1073/pnas.0805779105. PMC 2575437. PMID 18922780. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Diesen DL, Hess DT, Stamler JS (August 2008). "Hypoxic vasodilation by red blood cells: evidence for an s-nitrosothiol-based signal". Circulation Research. 103 (5): 545–53. doi:10.1161/CIRCRESAHA.108.176867. PMC 2763414. PMID 18658051. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Kleinbongard P, Schutz R, Rassaf T, et al. (2006). "Red blood cells express a functional endothelial nitric oxide synthase". Blood. 107 (7): 2943–51. doi:10.1182/blood-2005-10-3992. PMID 16368881. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Ulker P, Sati L, Celik-Ozenci C, Meiselman HJ, Baskurt OK (2009). "Mechanical stimulation of nitric oxide synthesizing mechanisms in erythrocytes". Biorheology. 46 (2): 121–32. doi:10.3233/BIR-2009-0532. PMID 19458415. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Benavides, Gloria A; Victor M Darley-Usmar; Mills, R. W.; Patel, H. D.; Isbell, T. S.; Patel, R. P.; Darley-Usmar, V. M.; Doeller, J. E.; Kraus, D. W. (2007-11-13). "Hydrogen sulfide mediates the vasoactivity of garlic". Proceedings of the National Academy of Sciences of the United States of America. 104 (46): 17977–17982. Bibcode:2007PNAS..10417977B. doi:10.1073/pnas.0705710104. PMC 2084282. PMID 17951430. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Kesava, Shobana (2007-09-01). "Red blood cells do more than just carry oxygen; New findings by NUS team show they aggressively attack bacteria too" (PDF). The Straits Times. مؤرشف من الأصل (PDF) في 03 أبريل 2020. اطلع عليه بتاريخ 26 مارس 2013. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Jiang N, Tan NS, Ho B, Ding JL (October 2007). "Respiratory protein-generated reactive oxygen species as an antimicrobial strategy". Nature Immunology. 8 (10): 1114–22. doi:10.1038/ni1501. PMID 17721536. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Jr, Jeremy M. Berg, John L. Tymoczko, Lubert Stryer; with Gregory J. Gatto (2012). Biochemistry (الطبعة 7th). New York: W.H. Freeman. صفحات 455, 609. ISBN 9781429229364. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: التاريخ والسنة (link) - Tilton, WM; Seaman, C; Carriero, D; Piomelli, S (August 1991). "Regulation of glycolysis in the erythrocyte: role of the lactate/pyruvate and NAD/NADH ratios". The Journal of Laboratory and Clinical Medicine. 118 (2): 146–52. PMID 1856577. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Kabanova S, Kleinbongard P, Volkmer J, Andrée B, Kelm M, Jax TW (2009). "Gene expression analysis of human red blood cells". International Journal of Medical Sciences. 6 (4): 156–9. doi:10.7150/ijms.6.156. PMC 2677714. PMID 19421340. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Zimmer, Carl (2007-03-27). "Scientists Explore Ways to Lure Viruses to Their Death". The New York Times. مؤرشف من الأصل في 7 أبريل 2020. اطلع عليه بتاريخ 26 مارس 2013. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Erik D. Heegaard & Kevin E. Brown (July 2002). "Human parvovirus B19". Clin Microbiol Rev. 15 (3): 485–505. doi:10.1128/CMR.15.3.485-505.2002. PMC 118081. PMID 12097253. الوسيط
|CitationClass=تم تجاهله (مساعدة) - SEGHATCHIAN, M.J. (2008-06-28). "BRITISH BLOOD TRANSFUSION SOCIETY". Clinical & Laboratory Haematology. 16 (4): 379–380. doi:10.1111/j.1365-2257.1994.tb00439.x. ISSN 0141-9854. مؤرشف من الأصل في 04 يونيو 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Storry, J. R.; Castilho, L.; Chen, Q.; Daniels, G.; Denomme, G.; Flegel, W. A.; Gassner, C.; de Haas, M.; Hyland, C. (2016-06-27). "International society of blood transfusion working party on red cell immunogenetics and terminology: report of the Seoul and London meetings". ISBT Science Series. 11 (2): 118–122. doi:10.1111/voxs.12280. ISSN 1751-2816. مؤرشف من الأصل في 04 يونيو 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Banerjee, Jayanta; Aladangady, Narendra (2014-05-05). "Biomarkers to decide red blood cell transfusion in newborn infants". Transfusion. 54 (10): 2574–2582. doi:10.1111/trf.12670. ISSN 0041-1132. مؤرشف من الأصل في 04 يونيو 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Schmidt, P.; Okroi, M. (2001). "Also sprach Landsteiner – Blood Group 'O' or Blood Group 'NULL'". Transfusion Medicine and Hemotherapy. 28 (4): 206–208. doi:10.1159/000050239. ISSN 1660-3796. مؤرشف من الأصل في 04 يونيو 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Eder, Anne F. (2008-10-15). "Adverse Reactions to Blood Donation Among Adolescents—Reply". JAMA. 300 (15): 1759. doi:10.1001/jama.300.15.1760-b. ISSN 0098-7484. مؤرشف من الأصل في 5 يونيو 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Charlotte (2009-10-01). Porth Pathophysiology: Concepts of Altered Health States (باللغة الإنجليزية). Lippincott Williams & Wilkins. ISBN 978-1-60547-781-7. مؤرشف من الأصل في 29 أبريل 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "UpToDate". www.uptodate.com. مؤرشف من الأصل في 26 ديسمبر 2017. اطلع عليه بتاريخ 28 أبريل 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Zou, Li-hui; Chen, Jie; Zhang, Juan; Garcia, Narciso (2010-12). "Malaria Cell Counting Diagnosis within Large Field of View". 2010 International Conference on Digital Image Computing: Techniques and Applications. IEEE. doi:10.1109/dicta.2010.40. ISBN 978-1-4244-8816-2. مؤرشف من الأصل في 09 مايو 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ=(مساعدة) - James L. A. Webb (2014-03-31). The Long Struggle against Malaria in Tropical Africa (باللغة الإنجليزية). Cambridge University Press. ISBN 978-1-107-05257-4. مؤرشف من الأصل في 30 أبريل 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Kim, Youngchan; Kim, Kyoohyun; Park, YongKeun (2012-09-21). "Measurement Techniques for Red Blood Cell Deformability: Recent Advances". Blood Cell - An Overview of Studies in Hematology (باللغة الإنجليزية). doi:10.5772/50698. مؤرشف من الأصل في 2 يونيو 2018. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "What is Thalassemia? - Thalassemia.com". thalassemia.com. مؤرشف من الأصل في 13 مارس 2019. اطلع عليه بتاريخ 29 أبريل 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Paola; Mohandas, Narla (2015-11-06). Postgraduate Haematology. Oxford, UK: John Wiley & Sons, Ltd. صفحات 114–137. ISBN 978-1-118-85377-1. مؤرشف من الأصل في 09 مايو 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "absolute polycythemia" في معجم دورلاند الطبي
- "relative polycythemia" في معجم دورلاند الطبي
- مدلاين بلس Polycythemia vera
- Erhabor (2013-02-11). Haematology Made Easy (باللغة الإنجليزية). AuthorHouse. ISBN 978-1-4772-4651-1. مؤرشف من الأصل في 11 مايو 2016. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Burns, Edward R.; Lou, Yenmay; Pathak, Anjali (2004-01). "Morphologic diagnosis of thrombotic thrombocytopenic purpura". American Journal of Hematology. 75 (1): 18–21. doi:10.1002/ajh.10450. ISSN 0361-8609. PMID 14695628. مؤرشف من الأصل في 17 أبريل 2015. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ=(مساعدة) - Fotiadis Dimitrios; Antonios, Charalambopoulos; Demosthenes, Polyzos (2010-08-26). Advanced Topics In Scattering Theory And Biomedical Engineering - Proceedings Of The 9th International Workshop On Mathematical Methods In Scattering Theory And Biomedical Engineering (باللغة الإنجليزية). World Scientific. ISBN 978-981-4464-23-9. مؤرشف من الأصل في 6 مايو 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Office of Technology Assessment United; Assessment, United States Congress Office of Technology (2002-06). Ownership of Human Tissues and Cells: New Developments in Biotechnology (باللغة الإنجليزية). The Minerva Group, Inc. ISBN 978-0-89499-178-3. مؤرشف من الأصل في 5 مايو 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ=(مساعدة) - "Blood Safety Basics | CDC". www.cdc.gov (باللغة الإنجليزية). 2020-03-18. مؤرشف من الأصل في 28 أبريل 2020. اطلع عليه بتاريخ 05 مايو 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Weiss, Eric S.; Makary, Martin A.; Wang, Theresa; Syin, Dora; Pronovost, Peter J.; Chang, David; Cornwell, Edward E. (2005-5). "Prevalence of Blood-Borne Pathogens in an Urban, University-Based General Surgical Practice". Annals of Surgery. 241 (5): 803–809. doi:10.1097/01.sla.0000161174.71460.1f. ISSN 0003-4932. PMID 15849516. مؤرشف من الأصل في 5 مايو 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ=(مساعدة) - Laura (2005). Blood transfusions and the immune system (باللغة الإنجليزية). National Center for Biotechnology Information (US). مؤرشف من الأصل في 10 سبتمبر 2015. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Bone Marrow Cells—Advances in Research and Application: 2013 Edition (باللغة الإنجليزية). ScholarlyEditions. 2013-06-21. ISBN 978-1-4816-9804-7. مؤرشف من الأصل في 5 مايو 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Michael F.; Pamphilon, Derwood H. (2008-04-15). Practical Transfusion Medicine (باللغة الإنجليزية). John Wiley & Sons. ISBN 978-1-4051-4372-1. مؤرشف من الأصل في 6 مايو 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Laura (2005). Blood Groups and Red Cell Antigens (باللغة الإنجليزية). NCBI. مؤرشف من الأصل في 5 مايو 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Coghlan, Andy (2008-08). "First red blood grown in the lab". New Scientist. 199 (2670): 10. doi:10.1016/s0262-4079(08)62089-8. ISSN 0262-4079. مؤرشف من الأصل في 09 مايو 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ=(مساعدة) - Ann; Schroeder, Carol L. (2008-07-02). Medical Terminology for Health Professions (Book Only) (باللغة الإنجليزية). Cengage Learning. ISBN 978-1-111-80231-8. مؤرشف من الأصل في 09 مايو 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Sarkar, R.S.; Philip, J.; Yadav, Pramod (2013-4). "Transfusion medicine and solid organ transplant – Update and review of some current issues". Medical Journal, Armed Forces India. 69 (2): 162–167. doi:10.1016/j.mjafi.2012.11.012. ISSN 0377-1237. PMID 24600091. مؤرشف من الأصل في 09 مايو 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ=(مساعدة) - William K.; Nahirney, Patrick C. (2007-09-28). Netter's Essential Histology E-Book (باللغة الإنجليزية). Elsevier Health Sciences. ISBN 978-1-4377-0084-8. مؤرشف من الأصل في 09 مايو 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Rouleaux [Presence] in Blood by Light microscopy". LOINC (باللغة الإنجليزية). مؤرشف من الأصل في 09 مايو 2020. اطلع عليه بتاريخ 09 مايو 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Osmotic Fragility of Erythrocytes: Reference Range, Interpretation, Collection and Panels". 2020-03-04. مؤرشف من الأصل في 7 أكتوبر 2017. الوسيط
|CitationClass=تم تجاهله (مساعدة); Cite journal requires|journal=(مساعدة) - Denise M. (2018-11-30). Modern Blood Banking & Transfusion Practices (باللغة الإنجليزية). F.A. Davis. ISBN 978-0-8036-9462-0. مؤرشف من الأصل في 11 مايو 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Wilkinson, Gertrude T. (1965-02). "The Connecticut Red Cross Blood Program: The New Trend in Blood Programs". American Association of Industrial Nurses Journal. 13 (2): 7–11. doi:10.1177/216507996501300201. ISSN 0098-6097. مؤرشف من الأصل في 11 مايو 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ=(مساعدة) - "Depression Can Break Your Heart". PsycEXTRA Dataset. مؤرشف من الأصل في 11 مايو 2020. اطلع عليه بتاريخ 10 مايو 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Blood Doping". World Anti-Doping Agency (باللغة الإنجليزية). 2014-12-01. مؤرشف من الأصل في 8 أبريل 2020. اطلع عليه بتاريخ 10 مايو 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Cole, F. J. (1937-11). "The Birthplace of Jan Swammerdam 1637-1680". Isis. 27 (3): 452–452. doi:10.1086/347272. ISSN 0021-1753. مؤرشف من الأصل في 19 مايو 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ=(مساعدة) - Lesley; Backer, Jantien; Biemans, Claud; Doorn, Joop van; Krab, Klaas; Reijnders, Willem (2016-05-19). Antoni van Leeuwenhoek: Master of the Minuscule (باللغة الإنجليزية). BRILL. ISBN 978-90-04-30430-7. مؤرشف من الأصل في 19 مايو 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Stephen (2011-07-15). The Bleeding Disease: Hemophilia and the Unintended Consequences of Medical Progress (باللغة الإنجليزية). JHU Press. ISBN 978-1-4214-0442-4. مؤرشف من الأصل في 19 مايو 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Georgina (2011-07-14). In Defence of Learning. British Academy. ISBN 978-0-19-726481-2. مؤرشف من الأصل في 19 مايو 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Bower, Bruce (2001-04-28). "Peru Holds Oldest New World City". Science News. 159 (17): 260. doi:10.2307/3981489. ISSN 0036-8423. مؤرشف من الأصل في 19 مايو 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة)
وصلات خارجية
- قاعدة بيانات لأحجام كريات الدم الحمراء في الفقاريات.
- الذهب الأحمر، موقع بي بي إس يحتوي على حقائقٍ والتاريخ.
- فصائل الدم ومستضدات الخلية الحمراء بواسطة لورا دين. كتاب دراسي عبر الإنترنت يمكن البحث فيه وتحمليه ضمن النطاق العام.
- بوابة طب
- بوابة علم الأحياء الخلوي والجزيئي
- بوابة علم وظائف الأعضاء
