فقر الدم الخبيث
فقر الدم الخبيث هو عبارة عن نقص في خلايا الدم الحمراء بسبب نقص في فيتامين بي 12.[1]، ومن الأعراض الأكثر شيوعا للأنيميا هو الشعور بالتعب.[2] بالإضافة إلى أعراض أخرى مثل ضيق في التنفس، و شحوب البشرة، وألم في الصدر، وخُدر باليد والقدم، وخلل في التوازن، والإرتباك والاكتئاب، و ردود الفعل هذه ضعيفة.[2] أما إذا لم يتم معالجة هذه الأعراض فسوف تصبح دائمة .
| فقر الدم الخبيث | |
|---|---|
| معلومات عامة | |
| الاختصاص | علم الدم |
| من أنواع | فقر الدم الغذائي ، واضطراب سوء تغذية |
| الأسباب | |
| الأسباب | نقص فيتامين بي 12 |
| الإدارة | |
| أدوية | |
| التاريخ | |
| سُمي باسم | توماس أديسون |
أسباب مرض فقر الدم :
وقد يحدث فقر الدم الخبيث نتيجة لنقص العامل الداخلي الذي تنتجه الخلايا الجدارية بالمعدة والمسؤولة عن امتصاص فيتامين بي 12. وقد يكون سبب نقص العامل الداخلي هو مرض مناعي ذاتي يهاجم الخلايا الجدارية بالمعدة والمسؤولة عن إنتاجه.[3] أو قد يحدث نتيجة لخلل وراثي أو بعد عملية قص جزء من المعدة.[3] ومن الأسباب الأخرى التي تتسبب في نقص فيتامين بي 12 هو سوء التغذية كما هو الحال عند الأشخاص النباتيون.[3] وعندما يكون هناك شك بوجود هذا المرض يتم أخذ عينات من الدم وفي بعض الأحيان يتم أخذ عينة من نخاع العظمي.[4] وتبين فحوصات الدم أن هناك عدد قليل من خلايا الدم الحمراء، ولكن يكون حجم الخلايا كبير مع وجود عدد قليل من خلايا الدم الحمراء الجديدة، وكميات قليلة من فيتامين بي 12، ووجود أجسام مضادة للعامل الداخلي.[4]
علاج مرض فقر الدم :
فمرض فقر الدم الخبيث الناتج عن نقص العامل الداخلي لا يمكن منعه.[5] أما مرض الدم الخبيث الناتج عن عوامل أخرى فيمكن منعه عن طريق الغذاء المتوازن والمكملات الغذائية.[5] ويمكن علاجه بسهولة عن طريق الحقن والحبوب.[6] إذا كانت أعراض المرض حادة فيجب معالجته عن طريق الحقن في البداية.[6] كما يمكن استخدام رذاذ الأنف للذين يواجهون صعوبة في بلع الحبوب.[6] وقد تكون فترة العلاج مدى الحياة.[7]
أما مرض الدم الخبيث الناتج عن مشاكل وأمراض الجهاز المناعي الذاتي تصيب شخص من كل 1000 شخص.[8] وتكون أعمارهم فوق عمر الـ 60 . و 2% منهم يعانون من مرض فقر الدم الخبيث. ويعتبر شمال أوروبا من أكثر الأماكن التي يصاب شعبها بمرض الدم الخبيث.[9] ويصيب النساء أكثر من الرجال.[10] إذا تمت معالجته بطريقة جيدة سوف يعيش المصاب حياة عادية.[1] وبسبب احتمال الإصابة بسرطان المعدة يجب أن يتم الفحص بشكل منتظم.[7]
أول وصف واضح لهذا المرض كان عن طريق توماس أديسون عام 1849.[11][12] وكان هذا المرض مميتاً قبل اكتشاف الأدوية المناسبة حيث كان معنى مرض الدم الخبيث هو الموت.[1][13]
التاريخ
تم وصف الاعراض أولا عام 1822م عن طريق الدكتور جيمس كومبى في (معاملات الجمعية الطبية السريرية لإدنبرج), تحت عنوان التاريخ في قضايا الانيميا.[14]
ومع ذلك، لم يتم البحث في المرض بشكل معمق حتى عام 1849م, عن طريق البيريطاني الجراح توماس اديسون ومن ذلك اكتسبت الاسم اديسون انيميا. وفي عام 1871م, لاحظ الألماني الجراح ميخائيل انتون خصائص أو اعراض لانيميا في أحد مرضاه، ثم صاغ اسم مرض الدم الخبيث التقدمي.[15] ثم عام 1907م, قام ريتشاد كلارك باعداد تقرير لحوالي 1200 مصاب بمرض الدم الخبيث حيث كان معدل النجاة لهم من سنة إلى ثلاث سنين.
كان فقر الدم الخبيث مرضًا مميتًا قبل عام 1920 تقريبًا، عندما اقترح جورج ويبل الكبد النيء كعلاج. بدأ أول علاج عملي لفقر الدم الخبيث عندما بدأ ويبل أبحاثاً جعل فيها الكلاب تنزف إلى أن عانوا من فقر الدم، ثم قام بإعطائهم أطعمة مختلفة لمعرفة ما الطعام الذي سيساعد في علاجهم بسرعة أكبر (كان يبحث وقتها عن علاجات لفقر الدم من النزيف، وليس فقر الدم الخبيث). اكتشف ويبل حينها أن تناول كميات كبيرة من الكبد ساهم في علاج فقر الدم الناتج عن النزيف، وحاول استخدام الكبد كعلاج لفقر الدم الخبيث، مبلغاً عن حدوث تحسن هناك أيضًا في بحث نشر عام 1920. سعى جورج مينوت ووليم مورفي لاستخلاص الجزء من الكبد المسؤول عن معالجة فقر الدم. وأظهرت الدراسة في عام 1926 أن هذا الجزء المسؤول كان في عصارة الكبد النيء (في هذه العملية أيضا تبين أنه الحديد في أنسجة الكبد الذي لعب دوراً في العلاج، وليس العامل القابل للذوبان في عصارة الكبد، التي عالجت فقر الدم الناتج عن النزيف في الكلاب ). وهكذا، يعتبر اكتشاف الكبد كعلاج لفقر الدم الخبيث محض الصدفة. عملت فريدا روبشيت روبنز بشكل وثيق مع ويبل، وشاركت في تأليف 21 بحثًا من عام 1925 إلى 1930. و هكذا، تقاسم ويبل، مينوت ومورفي جائزة نوبل في الطب عام 1934 لاكتشافهم علاجاً لمرضٍ قاتل غير معروف السبب.[16]
بعد تحقيق مينتو ومورفي في نتائج بحث ويبل عام 1926 ، قام ضحايا فقر الدم المهلك باكل على الاقل نصف باوند من الكبد البارد أو شرب عصارة الكبد البارد كل يوم . [بحاجة لمصدر] استمر هذا لعدة سنوات إلى ان اصبحت كمية كبيرة من عصارة الكبد متاحة . عام 1928 , قام الكيميائي ادوين كوهن بتحضير خلاصة كبد أفضل ب 50 إلى 100 مرة من الطعام الطبيعي ( الكبد ) . [ بحاجة لمصدر ] كان يمكن حقن الخلاصة في العضلات، وهذا يعني ان المرضى ليسوا بحاجة بعد الان لاكل كمية كبيرة من الكبد أو العصارة . و هذا ايضا قلل من تكلفة العلاج كثيرا. [ بحاجة لمصدر ] المكونات الحيوية في الكبد بقيت غير معروفة حتى عام 1948 ، عندما كانت معزولة من قبل الكيميائيان كارل اوغست من الولايات المتحدة والكسندر رمزي . و تود من بريطانيا العظمى . [بحاجة لمصدر] المكونات كانت (كوبالمين) الذي سماه المستكشفين ب فيتامين B12 . الفيتامين الجديد من عصارة الكبد تم اخيرا تنقيته وتميزه بشكل كامل في الخمسينيات من القرن الماضي، وكانت النظريات حول انتاجه من البكتيريا تتطور . [باحجة لمصدر ] يمكن حقنه في العضلات مع اقل الم أو تهيج، الذي جعل امكانية علاج المرضى أكثر سهولة . [ بحاجة لمصدر ] تم اخيرا علاج فقر الدم الفتاك سواء عن طريق الحقن ام عن طريق جرعات B12 عن طريق الفم، وتكون من 1 إلى 4 ملغ يوميا . [بحاجة لمصدر ] اظهر أحد الكاتبين ان ماري تود لينكولن زوجة الرئيس الأمريكي ابراهام لينكولن قد عانت من فقر دم فتاك لعقود من الزمن مما ادى إلى موتها . [17]
أسباب الإصابة
يعتبر فيتامين ب 12 أحد الفيتامينات الضرورية لجسم الإنسان والتي لا يمكن تصنيعها وإنما الحصول عليها من النظام الغذائي، عند تناول الأطعمة المحتوية على ب 12، عادةً ما يرتبط الفيتامين ببروتين ثم يتم اطلاقه عن طريق البروتياز المنتج من البنكرياس والمفرز في الأمعاء الدقيقة. بعد اطلاقه، يتم امتصاص معظم فيتامين ب 12 في الأمعاء الدقيقة (المعي اللفائفي) و ذلك بعد ارتباطه بالبروتين المعروف بإسم العامل المعدي الداخلي. يتم انتاج هذا العامل الداخلي من قبل الخلايا الجدارية المتواجدة في الغشاء المخاطي للمعدة، ثم يتم امتصاص مركب (العامل المعدي الداخلي- فيتامين ب 12) من قبل مستقبلاته في الجدران الطلائية.[18][19] يتميز فقر الدم الخبيث بنقص ب 12 الناجم عن نقص في العامل المعدي الداخلي.[20]
يمكن اعتبار فقر الدم الخبيث مرحلة نهائية من التهاب المعدة ذو العلاقة باضطرابات المناعة الذاتية، وهو مرض يتميز بضمور المعدة ووجود أجسام مضادة للخلايا الجدارية وضد العامل المعدي الداخلي .[21] يرتبط نوع معين من التهاب المعدة المزمن بشكل كبير مع فقر الدم الخبيث وهو التهاب المعدة الضامر(النوع أ). يصيب اضطراب المناعة الذاتية هذا جسم المعدة حيث توجد الخلايا الجدارية.[20] تتسبب الأجسام المضادة للعامل الداخلي والخلايا الجدارية في تدمير الغشاء المعدي، الذي توجد فيه الخلايا الجدارية، مما يؤدي إلى فقدان القدرة على تصنيع العامل الداخلي. بدون العامل الداخلي، لا يمكن للفائفي امتصاص فيتامين ب 12 [22]
على الرغم من أن ارتباط جرثومة المعدة في فقر الدم الخبيث لا يزال موضع جدل، إلا أن الدلائل تشير إلى أن جرثومة المعدة لها دور في التسبب بالمرض. حيث قد تؤدي العدوى طويلة الأمد بجرثومة المعدة إلى تشكيل المناعة الذاتية في المعدة عن طريق آلية تعرف باسم التقليد الجزيئي.
يمكن للأجسام المضادة التي ينتجها الجهاز المناعي أن تكون متفاعلة مع بعضها البعض وقد ترتبط أيضاً بكل من مولدات الضد لجرثومة المعدة وتلك الموجودة في الغشاء المخاطي للمعدة. يتم إنتاج الأجسام المضادة من قبل الخلايا البائية النشطة التي تتعرف على كل من العامل الممرض والببتيدات المشتقة ذاتيًا. المركبات الذاتية التي يُعتقد أنها تسبب التفاعلات الذاتية هي وحدتي ألفا وبيتا في [22] [23] H+/K+-ATPase
أقل شيوعا، يمكن أن تسبب جرثومة المعدة و متلازمة زولينجر إيليسون أيضا شكلا من أشكال التهاب المعدة غير المرتبطة بالمناعة الذاتية والتي يمكن أن تؤدي إلى فقر الدم الخبيث.[24]
يمكن أيضا أن يحدث ضعف امتصاص فيتامين ب12 بعد إزالة المعدة (استئصال المعدة) أو جراحة لتغيير شرايين المعدة. في هذه العمليات الجراحية، تتم إزالة أجزاء المعدة التي تنتج إفرازات معوية أو يتم تجاوزها. وهذا يعني أن العامل المعدي الداخلي، وكذلك العوامل الأخرى اللازمة لامتصاص فيتامين ب12 ، غير متوفرة. ومع ذلك، فإن نقص فيتامين ب12 بعد جراحة المعدة لا يصبح عادة مسألة سريرية. ربما يرجع السبب في ذلك إلى أن الجسم يخزن لعديد من السنوات فيتامين ب12 في الكبد وأن من يستأصلون المعدة يأخذون مكملات ب12 بشكل كاف.[25][26]
على الرغم من عدم تحديد جينات القابلية للإصابة بمرض فقر الدم الخبيث، فمن المحتمل أن يكون للعامل الوراثي دورٌ في هذا المرض. غالباً ما يصاحب فقر الدم الخبيث اضطرابات المناعة الذاتية الأخرى، مما يوحي بأن جينات القابلية للإصابة باضطرابات المناعة الذاتية الشائعة قد تكون عاملًا مسببًا للمرض.[20] وعلى الرغم من ذلك، فقد أشارت دراسات وراثية سابقة إلى وجود ميل لوراثة مرض فقر الدم الخبيث على وجه الخصوص، ويبدو أن أقرباء مرضى فقر الدم الخبيث يشكلون جزء من الحالات المرضية المعروفة. وعلاوة على ذلك، فقد تم الإشارة إلى أن تكوين الأجسام المضادة لخلايا المعدة كان جينا سائدًا وراثيًا، وقد لا يكون وجود الأجسام المضادة لخلايا المعدة مرتبطًا بالضرورة بحدوث التهاب المعدة الضموري.[27][28]
الأعراض
تظهر أعراض فقر الدم الخبيث ببطء. غير المعالجة، يمكن أن يؤدي إلى مضاعفات عصبية، وفي الحالات الخطيرة، الموت. العديد من العلامات والأعراض ناجمة عن فقر الدم نفسه، عندما يكون فقر الدم موجودًا. قد تتكون الأعراض من ثالوث الوخز أو غيرها من الأحاسيس الجلدية (تنمل) ، وجع اللسان (التهاب اللسان) ، والتعب والضعف العام.[29][30] ويظهر مع عدد من الأعراض الشائعة الأخرى، [30] بما في ذلك مزاج الاكتئاب ، والحمى منخفضة الدرجة، والإسهال ، وعسر الهضم ، وفقدان الوزن، [30] آلام الأعصاب، واليرقان ، والتقرحات في زاوية الفم (التهاب الشفة الزاوي) ، وهي مظهر من الإرهاق مع شفتين شاحبة ومشوهة أو متشققة ودوائر مظلمة حول العينين، وكذلك أظافر هشة، [30] ورقيق وشعر مبكر من الشعر.[30] لأن فقر الدم الخبيث قد يؤثر على الجهاز العصبي، قد تشمل الأعراض أيضًا صعوبة في استقبال الحس العميق، [31] تغيرات الذاكرة، [صفحة مطلوبة] ضعف إدراكي معتدل (بما في ذلك صعوبة التركيز وردود بطيئة، يشار إليها بالعامية باسم الضباب الدماغي) ، وحتى الذهان ، ضعف التبول، [30] ضياع الإحساس في القدمين، المشي غير المستقر، صعوبة في المشي، [30]ضعف العضلات [30] والبراعة.[30] قد يؤدي فقر الدم أيضًا إلى تسرع القلب (سرعة ضربات القلب) ، [30] نفخة قلبية، شحوب صفراء صفراء، [30] تغير ضغط الدم (منخفض أو مرتفع) ، وضيق النفس (المعروف باسم "التنهدات").[30] [صفحة مطلوبة]قد يكون النقص موجودًا أيضًا مع اضطرابات الغدة الدرقية.[30] في الحالات الشديدة، قد يسبب فقر الدم دليلاً على قصور القلب الاحتقاني. من مضاعفات فقر الدم الخبيث المزمنة الوخيمة، انحلال النخاع الشوكي الحاد تحت الحاد، والذي يؤدي إلى فقدان الحواس البعيدة (العمود الخلفي) ، منعكس الكاحل الغائب، زيادة استجابة منعكس الركبة، واستجابة أخمصي الباسطة.[29] بخلاف فقر الدم، قد تشمل أعراض الدم قلة الكريات ، انحلال الدم داخل النقي، واعتلال الأوعية الدماغية التخثر الزائفة.[8] مكن أن يساهم فقر الدم الخبيث في تأخر النمو البدني عند الأطفال، وقد يكون أيضًا سببًا للتأخير في سن البلوغ للمراهقين.
طريقة حدوث المرض
على الرغم من أن الجسم السليم يخزن ما بين ثلاث إلى خمس سنوات من B12 في الكبد، فإن نشاط المناعة الذاتية غير المكتشف عادة في الأمعاء خلال فترة طويلة من الزمن يؤدي إلى استنفاد B12 وفقر الدم هو الناتج.مطلوب B12 بواسطة الانزيمات لاثنين من التفاعلات: تحويل CoA methylmalonyl إلى succinyl CoA ، وتحويل الهوموسيستين إلى ميثيونين.في التفاعل الأخير، يتم نقل مجموعة الميثيل من 5-methyltethydrofolate إلى الهموسيستين لإنتاج رباعي هيدروفولات والميثيونين.يتم تحفيز هذا التفاعل بواسطة إنزيم ميثيونين سينثيز مع B12 كعامل مساعد أساسي.خلال نقص B12 ، لا يمكن لهذا التفاعل أن يستمر، مما يؤدي إلى تراكم 5 methyltethydrofolate. يستنزف هذا التراكم أنواع أخرى من حمض الفوليك اللازمة لتخليق البيورين وتيرميديلات ، وهي مطلوبة لتوليف الحمض النووي.تثبيط تكرار الحمض النووي في خلايا الدم الحمراء يؤدي إلى تكوين كرات الدم الحمراء الضخمة الهشة.ويعتقد أن المظاهر العصبية للمرض تنشأ من تراكم ميثيل مالونيل CoA بسبب اشتراط B12 كعامل مساعد لعامل إنزيم metaylmalonyl CoA mutase.[32][33][34][35]
التشخيص
يكون هناك احتمال الإصابة بفقر الدم الخبيث إذا كان عينة الدم المريض تُظهر خلايما دم حمراء ضخمة وهشة و غير ناضجة تُسمى ميجلاوبلاستس. تشخيص فقر الدم الخبيث يتطلب عينة دم ووفحص تعداد الدم، وهذه الفحوصات تقيم معدل حجم الخلايا الحمراء وهيموجلوبين الكرية الوسطي. وتتاكد نتيجة الإصابة بمرض فقر الدم الخبيث إذا كان معدل حجم الخلايا الحمراء كبير وهميوجلوبين الكرية الوسطي طبيعي. وكما وتتواجد بعينة دم المصاب الكرية الاهليجية. ومن الاعراض المرضية لفقر الدم الخبيث ان تكون العدلات كثيرة التجزئة. وكما يستخدم مصل الدم لمعرفة مستوى كمية البي تويلف في الدم، ولكن هذا الفحص لا يفرق عن سبب الإصابة بمرض فقر الدم الخبيث. كمية البي تويلف قد تكون مرتفعة أو منخفضة بشكل خاطئ وتكون النتائج غير دقيقة. قد يكون مستوى البي تويلف في مصل الدم طبيعي في حالة عندما يكون الفقر والامراض مثل امراض الكبد أو اضطرابات التكاثر النقيي اونقص البروتين الحامل لبي تويلف ويدعى ترانزكوبلامين 2 أو عندما تكون بكتيريا الامعاء الدقيقة كثيرة متواجدان. وقد يكون سبب انخفاض البي تويلف في مصل الدم لاسباب اخرى غير نقص الفيتامين بي تويلف. مثل الحمل، موانع الحمل التي تؤخذ عن طريق الفم، أو نقص الهابتوكورن أو بسبب مرض النخاعي المتعدد.[36]
وجود الأجسام المضادة لخلايا المعدة الجدارية والعامل المعدي الداخلي أمر شائع في فقر الدم الخبيث. إلا أن هذه الأجسام المضادة متواجدة في اضطرابات ذاتية أخرى وأيضا في 10٪ من الأفراد الأصحاء، مما يجعل الاختبار غير محدد. ومع ذلك، حوالي 85 ٪ من مرضى فقر الدم الخبيث لديهم أجسام مضادة للخلايا الجدارية، مما يعني أنها دلالة دقيقة للمرض. تكون الأجسام المضادة للعامل المعدي الداخلي أقل حساسية بكثير من الأجسام المضادة للخلايا الجدارية، ولكنها أكثر تحديدًا. حيث أن نصف مرضى فقر الدم الخبيث يحملون الاجسام المضادة للعامل الداخلي وانها نادرا جدا ما توجد في اضطرابات أخرى. يمكن أن تميز اختبارات الأجسام المضادة هذه بين فقر الدم الخبيث وسوء امتصاص فيتامين ب12.[37]
قد يؤدي الجمع بين كلا الاختبارين للأجسام المضادة للعامل المعدي الداخلي والخلايا الجدارية للمعدة إلى تحسين النتائج التشخيصية العامة وجعلها أكثر دقة.[38]
يلعب فيتامين ب12 دوراً مهماً في عمليات الأيض والوظائف الخلوية. لذلك فإن نقصه يؤدي إلى تراكم بعض نواتج عمليات الايض. يعتبر حمض الميثيل مالونك والهموسيستين احدى نواتج عمليات الأيض والتي يمكن قياس نسبها في جسم الانسان. تقاس نسبة حمض الميثيل مالونك في الدم والبول، أما نسبة الهموسيستين فلا يتم قياسها إلا في الدم. إن الزيادة في نسب كلاهما يساعد في التفريق بين نقص فيتامين ب 12 و نقص حمض الفوليك، ذلك لأن زيادة نسبة الهموسيستين وحده دليل على نقص حمض الفوليك. [39] 80-90% من مرضى فقر الدم الخبيث يملكون نسب مرتفعة من الغاسترين، لكن هذه النسب المرتفعة موجودة أيضا في حالات التهابات المعدة. انخفاض مستويات البيبسينوجين الأول أو انخفاض نسبة البيبسينوجين 1 إلى نسبة البيبسين 2 قد تكون موجودة أيضًا، على الرغم من أن هذه النتائج أقل دقة بالنسبة إلى فقر الدم الخبيث ويمكن العثور عليها في سوء امتصاص فيتامين (ب 12) وأشكال أخرى من التهابات المعدة.
وينبغي تأكيد تشخيص التهاب المعدة الضامر من النوع A عن طريق تنظير المعدة والخزعة التدريجية. حوالي 90٪ من الأفراد الذين لديهم PA لديهم أجسام مضادة للخلايا الجدارية. ومع ذلك، فإن 50 ٪ فقط من جميع الأفراد في عموم السكان المصابين بهذه الأجسام المضادة يعانون من فقر الدم الخبيث.[40] يجب النظر في أشكال نقص فيتامين B12 غير PA في التشخيص التفريقي لفقر الدم ضخم الأرومات. على سبيل المثال، حالة نقص فيتامين ب12 التي تسبب فقر الدم الضخم الأرومات والتي يمكن أن تكون مخطئة بالنسبة PA التقليدية ناتجة عن الإصابة بدودة الدودة الشريطية Diphyllobothrium latum ، ربما بسبب منافسة الطفيلي مع مضيف فيتامين ب 12. لم يعد الاختبار الكلاسيكي لـ PA ، اختبار Schilling ، مستخدمًا على نطاق واسع، حيث تتوفر طرق أكثر كفاءة. تألف هذا الاختبار التاريخي، في خطوتها الأولى، من تناول جرعة فموية من فيتامين ب 12 المشع راديولول، متبوعًا بكمية الفيتامين في بول المريض على مدار 24 ساعة عبر قياس النشاط الإشعاعي. خطوة ثانية من الاختبار تكرر اسلوب واجراء الخطوة الأولى، مع إضافة عامل جوهري عن طريق الفم. يقدم المريض المصحوب بمرض PA كميات أقل من المعتاد من العوامل الداخلية ؛ وبالتالي، فإن إضافة عامل جوهري في الخطوة الثانية يؤدي إلى زيادة في امتصاص فيتامين ب 12 (على خط الأساس المحدد في الأول). أظهر اختبار Schilling المميز PA من أشكال أخرى من عوز B12 ، [] على وجه التحديد، من متلازمة Imerslund-Grasbeck (IGS) ، وهو عوز فيتامين B12 بسبب طفرات في مستقبلات الكوبالامين.[41]
التنبؤ بالمرض
يمكن للشخص المصاب بمرض فقر الدم الخبيث المسيطر عليه جيداً أن يعيش حياة صحية. بينما، قد يؤدي عدم التشخيص والعلاج في الوقت المناسب إلى حدوث ضرر دائم في الجهاز العصبي، الإرهاق المفرط، الاكتئاب، فقدان الذاكرة، ومضاعفات أخرى. في الحالات الشديدة، يمكن أن تؤدي المضاعفات العصبية الناتجة عن فقر الدم الخبيث إلى الموت - ومن هنا جاء الاسم، "الخبيث" ، الذي يعني المميت.
وقد لوحظ وجود ارتباط بين فقر الدم الخبيث وأنواع معينة من سرطان المعدة، إلا أن الصلة السببية غير مؤكدة.[22]
علم الأوبئة
و يقدر ان فقر الدم الخبيث يؤثر على 0.1 % من عامة الناس، و 1.9% من الذين تزيد أعمارهم عن 60 وهو ما يمثل 20-50% من نقص فيتامين ب12 لدى البالغين.[8] يظهر استعراض للأدبيات أن فقر الدم الخبيث ينتشر بكثرة في شمال أوروبا، الدول الاسكندنافية خاصة، وبين السكان المنحدرين من أصل أفريقي، وأن زيادة الوعي بالمرض وأدوات التشخيص الأفضل قد تلعب دوراً في ارتفاع معدلات الإصابة على ما يبدو.[42]
العلاج
يكون هناك احتمال الإصابة بفقر الدم الخبيث إذا كان عينة الدم المريض تُظهر خلايما دم حمراء ضخمة وهشة وغير ناضجة تُسمى ميجلاوبلاستس. تشخيص فقر الدم الخبيث يتطلب عينة دم ووفحص تعداد الدم، وهذه الفحوصات تقيم معدل حجم الخلايا الحمراء وهيموجلوبين الكرية الوسطي. وتتاكد نتيجة الإصابة بمرض فقر الدم الخبيث إذا كان معدل حجم الخلايا الحمراء كبير وهميوجلوبين الكرية الوسطي طبيعي. وكما وتتواجد بعينة دم المصاب الكرية الاهليجية. ومن الاعراض المرضية لفقر الدم الخبيث ان تكون العدلات كثيرة التجزئة.[43]
وكما يستخدم مصل الدم لمعرفة مستوى كمية البي تويلف في الدم، ولكن هذا الفحص لا يفرق عن سبب الإصابة بمرض فقر الدم الخبيث. كمية البي تويلف قد تكون مرتفعة أو منخفضة بشكل خاطئ وتكون النتائج غير دقيقة. قد يكون مستوى البي تويلف في مصل الدم طبيعي في حالة عندما يكون الفقر والامراض مثل امراض الكبد أو اضطرابات التكاثر النقيي اونقص البروتين الحامل لبي تويلف ويدعى ترانزكوبلامين 2 أو عندما تكون بكتيريا الامعاء الدقيقة كثيرة متواجدان. وقد يكون سبب انخفاض البي تويلف في مصل الدم لاسباب اخرى غير نقص الفيتامين بي تويلف. مثل الحمل، موانع الحمل التي تؤخذ عن طريق الفم، أو نقص الهابتوكورن أو بسبب مرض النخاعي المتعدد.[44]
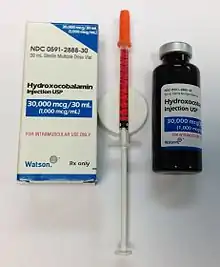
علاج فقر الدم الخبيث يختلف حسب الدولة والمنطقة. حيث يوجد اراء مختلفة حول فعالية طريقة اخذ العلاج اما عن طريق الحقن أو الحبوب، واراء مختلفة عن كمية واوقات اخذ العلاج، وهناك اشكال مختلفة لفيتامين بي تويلف (مثل...). ولا تزال هناك حاجة للدراسات أكثر للتحقق من طريقة علاجية معينة لمرض الدم الخبيث في التطبيق الاكلانيكي. لايوجد علاج دائم لمرض الدم الخبيث، ومع ذلك يجب ان نتوقع اشباع الجسم بالبي تويلف وذلك بسبب وقف الاعراض الناتجة عن مرض الدم الخبيث، ووقف التدهور العصبي، وايضاً في حالة لايوجد هناك تدهور عصبي، سوف يتم هناك شفاء دائم لجميع الاعراض، ما دام هناك اخذ لمكملات البي تويلف. حيث هناك عدة طرق لاشباع الجسم بالبي تويلف.
الحقت العضلي:
Cobalamin العلاجات القياسية والمعترف بها لفقر الدم الخبيث عن طريق الحقن العضلي ب
حيث يتوفر باشكال مختلفة مثل:
[45]سيانوكوبالامين (CN-Cbl), hydroxocobalamin (OH-Cbl) or methylcobalamin
الجرعات عن طريق الفم:
العلاج عن طريق جرعة كبيرة بالفيتامين بي تويلف سوف يكون فعال جداً.[45][46][47]
بحث
مركب “SNAC”
على الرغم من أن الجرعات الكبيرة الفموية والحقن العضلي هي أكثر طرق العلاج المتوفرة حاليًا، يتم اختبار العديد من الأساليب الجديدة، مع وعد كبير للدمج المستقبلي في أساليب المعالجة السائدة. بما أن الحقن هي مركبات غير مفضلة لإيصال الدواء ، فإن الأبحاث الحالية تتضمن تحسين الانتشار السلبي عبر الدقاق عن طريق الابتلاع بالفم لمشتقات الكوبالامين. استفاد الباحثون مؤخرًا من مركبN-[8-(2-hydroxybenzoyl) amino]caprylate (SNAC) ، والذي يعزز إلى حد كبير التوافر البيولوجي والاستقرار الأيضي
[48] مركبات " SNAC " لها القدرة على تشكيل مركبات تساهمية مع الكوبلامين مع الحفاظ على سلامتها الكيميائية. .]بحاجة لمصدر[هذا المركب أكثر حبا للدهون من فيتامين ب 12 القابل للذوبان في الماء ، لذا فهو قادر على المرور عبر الأغشية الخلوية بسهولة أكبر.
عامل داخلي مؤتلف
طريقة أخرى لزيادة الامتصاص من خلال الدقاق هو ابتكار معقد Cbl الذي يرتبط به العامل الجوهري بالفعل. يمكن استكمال النقص في العامل الجوهري الذي ينتجه جسم المريض باستخدام العامل الجوهري الإنساني الاصطناعي إذا تم إنتاجه من اتحادات نباتات البازلاء.[49] مع ذلك ، في الحالات التي تكون فيها الأجسام المضادة للعامل الجوهري هي سبب سوء الامتصاص عبر الدقاق ، يكون هذا العلاج غير فعال
توصيل تحت اللسان والانف
كما تم افتراض علاجات تحت اللسان لتكون أكثر فعالية من العلاجات الفموية وحدها. وجدت دراسة أجريت عام 2003 [50] في حين أن هذه الطريقة فعالة ، فإن جرعة مقدارها 500 ميكروغرام من السيانوكوبالامين تعطى إما عن طريق الفم أو تحت اللسان ، تكون فعالة بنفس القدر في استعادة التركيزات الفيزيولوجية الطبيعية للكوبالامين. وقد درست طرق الأنف أيضا كوسيلة لتوصيل كوبالامين. رصدت دراسة [51] أجريت عام1997 تركيز الكوبالمين في البلازما لستة مرضى بفقر الدم الخبيث خلال فترة 35 يومًا أثناء علاجهم بـ 1500 ميكروغرام من هيدروكسيوكوبالامين الأنفي. بعد ساعة واحدة من الإعطاء ، أظهر جميع المرضى في المتوسط زيادة فورية بثمانية أضعاف في تركيز الكوبالامين في البلازما وزيادة مرتين بعد 35يومًا مع ثلاث معالجات 1500 ميكروغرام. ومع ذلك ، هناك حاجة إلى مزيد من الدراسات للتحقيق في فعالية طريقة التوصيل هذه على المدى الطويل.
علاجات استكشافية
أحد الطرق الاستكشافية، والطريقة البديلة المحتملة لعلاج فقر الدم الخبيث هو استخدام البقع عبر الأدمة. في أحد هذه الأنظمة، تتكون البقع من سيانوكوبالامين، المثبتات ، محفزات اختراق البشرة.[52] المصدر الذي تم نشره ذاتيًا يسمح عبر الجلد لمشتق الكوبالمين بالانتشار السلبي من خلال الطبقة القرنية ، البشرة ، والأدمة ، وفي النهاية دخول مجرى الدم. وبالتالي ، يتجنب الكوبالامين تأثير الكبريت الأول ، وبالتالي يوفر إمكانية تحسين التوافر الحيوي وفعاليته. يؤدي الإطلاق البطيء إلى زيادة عمر نصف للكوبالامين ، مما يوفر إمكانية الانخفاض في الجرعة المطلوبة، المطلوبة بالنسبة لأساليب الولادة عن طريق الفم.في أحد هذه الأنظمة ، يمكن لألياف بوليكابرولاكتون المحشوة بالمخدرات والتي يتم تحضيرها ككربون نانوي دقيق electrospun أن تطلق المئات من ميكروغرام كوبلامين في اليوم الواحد.[53]
المراجع
- "Pernicious Anemia | National Heart, Lung, and Blood Institute (NHLBI)". www.nhlbi.nih.gov (باللغة الإنجليزية). مؤرشف من الأصل في 09 أبريل 2019. اطلع عليه بتاريخ 06 مايو 2018. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ أرشيف=(مساعدة) - "Pernicious Anemia | National Heart, Lung, and Blood Institute (NHLBI)". www.nhlbi.nih.gov (باللغة الإنجليزية). مؤرشف من الأصل في 09 أبريل 2019. اطلع عليه بتاريخ 06 مايو 2018. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ أرشيف=(مساعدة) - "Pernicious Anemia | National Heart, Lung, and Blood Institute (NHLBI)". www.nhlbi.nih.gov (باللغة الإنجليزية). مؤرشف من الأصل في 09 أبريل 2019. اطلع عليه بتاريخ 06 مايو 2018. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ أرشيف=(مساعدة) - "Pernicious Anemia | National Heart, Lung, and Blood Institute (NHLBI)". www.nhlbi.nih.gov (باللغة الإنجليزية). مؤرشف من الأصل في 09 أبريل 2019. اطلع عليه بتاريخ 06 مايو 2018. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ أرشيف=(مساعدة) - "Pernicious Anemia | National Heart, Lung, and Blood Institute (NHLBI)". www.nhlbi.nih.gov (باللغة الإنجليزية). مؤرشف من الأصل في 09 أبريل 2019. اطلع عليه بتاريخ 06 مايو 2018. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ أرشيف=(مساعدة) - "Pernicious Anemia | National Heart, Lung, and Blood Institute (NHLBI)". www.nhlbi.nih.gov (باللغة الإنجليزية). مؤرشف من الأصل في 09 أبريل 2019. اطلع عليه بتاريخ 06 مايو 2018. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ أرشيف=(مساعدة) - "Pernicious Anemia | National Heart, Lung, and Blood Institute (NHLBI)". www.nhlbi.nih.gov (باللغة الإنجليزية). مؤرشف من الأصل في 09 أبريل 2019. اطلع عليه بتاريخ 06 مايو 2018. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ أرشيف=(مساعدة) - Andres, Emmanuel; Serraj, Khalid (2012-09-10). "Optimal management of pernicious anemia". Journal of Blood Medicine. 3: 97–103. doi:10.2147/JBM.S25620. ISSN 1179-2736. PMID 23028239. مؤرشف من الأصل في 17 ديسمبر 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Wilkins, Lippincott Williams & (2009). Professional Guide to Diseases (باللغة الإنجليزية). Lippincott Williams & Wilkins. ISBN 9780781778992. مؤرشف من الأصل في 4 سبتمبر 2018. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Greer, John P. (2009). Wintrobe's Clinical Hematology (باللغة الإنجليزية). Lippincott Williams & Wilkins. ISBN 9780781765077. مؤرشف من الأصل في 22 يونيو 2018. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Wailoo, Keith (2002-11-04). Drawing Blood: Technology and Disease Identity in Twentieth-Century America (باللغة الإنجليزية). JHU Press. ISBN 9780801870293. مؤرشف من الأصل في 4 أبريل 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Collin, P. H. (2014-06-11). Dictionary of Medicine (باللغة الإنجليزية). Routledge. ISBN 9781135928414. مؤرشف من الأصل في 17 ديسمبر 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Tamparo, Carol D. (2016-02-03). Diseases of the Human Body (باللغة الإنجليزية). F.A. Davis. ISBN 9780803657915. مؤرشف من الأصل في 22 يونيو 2018. الوسيط
|CitationClass=تم تجاهله (مساعدة) - History, Leith. "History of Leith, Edinburgh » James Scarth Combe". www.leithhistory.co.uk. مؤرشف من الأصل في 20 يونيو 2018. اطلع عليه بتاريخ 06 مايو 2018. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Whonamedit - dictionary of medical eponyms". www.whonamedit.com (باللغة الإنجليزية). مؤرشف من الأصل في 15 ديسمبر 2018. اطلع عليه بتاريخ 06 مايو 2018. الوسيط
|CitationClass=تم تجاهله (مساعدة) - The Nobel Prize in Physiology or Medicine 1934 نسخة محفوظة 02 أكتوبر 2017 على موقع واي باك مشين.
- John G. Sotos, What an Afflication -- Mary Todd Lincoln's Fatal Pernicious Anemia. Perspectives in Biology and Medicine. 2015; 58: 419-443
- "Redirecting". linkinghub.elsevier.com. مؤرشف من الأصل في 29 ديسمبر 2018. اطلع عليه بتاريخ 06 مايو 2018. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Christensen, Erik Ilsø; Birn, Henrik (2002-04). "Megalin and cubilin: multifunctional endocytic receptors". Nature Reviews Molecular Cell Biology (باللغة الإنجليزية). 3 (4): 258–267. doi:10.1038/nrm778. ISSN 1471-0072. مؤرشف من الأصل في 17 ديسمبر 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ=(مساعدة) - "Pernicious anemia – Genetic insights". Autoimmunity Reviews (باللغة الإنجليزية). 10 (8): 455–459. 2011-06-01. doi:10.1016/j.autrev.2011.01.009. ISSN 1568-9972. مؤرشف من الأصل في 08 مارس 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - De Block, Christophe E. M.; De Leeuw, Ivo H.; Van Gaal, Luc F. (2008-02). "Autoimmune Gastritis in Type 1 Diabetes: A Clinically Oriented Review". The Journal of Clinical Endocrinology & Metabolism (باللغة الإنجليزية). 93 (2): 363–371. doi:10.1210/jc.2007-2134. ISSN 0021-972X. مؤرشف من الأصل في 28 يونيو 2018. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ=(مساعدة) - Lahner, Edith; Annibale, Bruno (2009). "Pernicious anemia: New insights from a gastroenterological point of view". World Journal of Gastroenterology (باللغة الإنجليزية). 15 (41): 5121. doi:10.3748/wjg.15.5121. ISSN 1007-9327. مؤرشف من الأصل في 2 يونيو 2018. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Desai, H. G.; Gupte, P. A. (December 2007). "Helicobacter pylori link to pernicious anaemia". The Journal of the Association of Physicians of India. 55: 857–859. ISSN 0004-5772. PMID 18405134. مؤرشف من الأصل في 23 يوليو 2018. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Kaferle, Joyce; Strzoda, Cheryl E. (2009-02-01). "Evaluation of macrocytosis". American Family Physician. 79 (3): 203–208. ISSN 0002-838X. PMID 19202968. مؤرشف من الأصل في 12 أبريل 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة) - von Drygalski, Annette; Andris, Deborah A. (2009-04). "Anemia After Bariatric Surgery: More Than Just Iron Deficiency". Nutrition in Clinical Practice (باللغة الإنجليزية). 24 (2): 217–226. doi:10.1177/0884533609332174. ISSN 0884-5336. مؤرشف من الأصل في 08 مارس 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ=(مساعدة) - John, Seeniann; Hoegerl, Carl (November 2009). "Nutritional deficiencies after gastric bypass surgery". The Journal of the American Osteopathic Association. 109 (11): 601–604. ISSN 1945-1997. PMID 19948694. مؤرشف من الأصل في 21 أكتوبر 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Whittingham, Senga; Mackay, IanR.; Ungar, Berta; Mathews, J.D. (May 1969). "THE GENETIC FACTOR IN PERNICIOUS ANÆMIA". The Lancet. 293 (7602): 951–954. doi:10.1016/s0140-6736(69)91856-x. ISSN 0140-6736. مؤرشف من الأصل في 08 مارس 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Wangel, A. G.; Callender, S. T.; Spray, G. H.; Wright, R. (February 1968). "A Family Study of Pernicious Anaemia: II. INTRINSIC FACTOR SECRETION, VITAMIN B12ABSORPTION AND GENETIC ASPECTS OF GASTRIC AUTOIMMUNITY". British Journal of Haematology (باللغة الإنجليزية). 14 (2): 183–204. doi:10.1111/j.1365-2141.1968.tb01486.x. ISSN 0007-1048. مؤرشف من الأصل في 08 مارس 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Pernicious anemia: MedlinePlus Medical Encyclopedia". www.nlm.nih.gov (باللغة الإنجليزية). مؤرشف من الأصل في 05 يوليو 2016. اطلع عليه بتاريخ 12 مايو 2018. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ أرشيف=(مساعدة) - "Pernicious Anemia Clinical Presentation: History, Physical Examination". emedicine.medscape.com (باللغة الإنجليزية). مؤرشف من الأصل في 14 سبتمبر 2017. اطلع عليه بتاريخ 12 مايو 2018. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Hvas, Anne-Mette; Nexo, Ebba (November 2006). "Diagnosis and treatment of vitamin B12 deficiency--an update". Haematologica. 91 (11): 1506–1512. ISSN 1592-8721. PMID 17043022. مؤرشف من الأصل في 5 ديسمبر 2018. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Wickramasinghe, S.N. (2006-11). "Diagnosis of megaloblastic anaemias". Blood Reviews. 20 (6): 299–318. doi:10.1016/j.blre.2006.02.002. ISSN 0268-960X. مؤرشف من الأصل في 08 مارس 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ=(مساعدة) - O’Leary, Fiona; Samman, Samir (2010-03-05). "Vitamin B12 in Health and Disease". Nutrients. 2 (3): 299–316. doi:10.3390/nu2030299. ISSN 2072-6643. PMID 22254022. مؤرشف من الأصل في 06 يناير 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Oh, Robert; Brown, David L. (2003-03-01). "Vitamin B12 deficiency". American Family Physician. 67 (5): 979–986. ISSN 0002-838X. PMID 12643357. مؤرشف من الأصل في 27 نوفمبر 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Stover, Patrick J. (June 2004). "Physiology of folate and vitamin B12 in health and disease". Nutrition Reviews. 62 (6 Pt 2): S3–12, discussion S13. ISSN 0029-6643. PMID 15298442. مؤرشف من الأصل في 28 ديسمبر 2018. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Laboratory Diagnosis of Vitamin B12 and Folate Deficiency: A Guide for the Primary Care Physician | Nutrition | JAMA Internal Medicine | JAMA Network
- Laboratory diagnosis of vitamin B12 and folate deficiency: a guide for the primary care physician. - PubMed - NCBI نسخة محفوظة 16 فبراير 2017 على موقع واي باك مشين.
- https://doi.org/10.1186%2F1750-1172-1-17 نسخة محفوظة 2020-09-25 على موقع واي باك مشين.
- Laboratory Investigation of Vitamin B12 Deficiency | Laboratory Medicine | Oxford Academic نسخة محفوظة 2020-09-25 على موقع واي باك مشين.
- Oral vitamin B12 versus intramuscular vitamin B12 for vitamin B12 deficiency: a systematic review of randomized controlled trials. - PubMed - NCBI نسخة محفوظة 03 مايو 2018 على موقع واي باك مشين.
- Andres E., Serra K. (2012). "Optimal management of pernicious anemia". Journal of Blood Medicine. 3: 97–103.
- Stabler, Sally P.; Allen, Robert H. (2004-06-09). "Vitamin b12 deficiency as a worldwide problem". Annual Review of Nutrition. 24 (1): 299–326. doi:10.1146/annurev.nutr.24.012003.132440. ISSN 0199-9885. مؤرشف من الأصل في 05 مارس 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "isbn:0781765072 - بحث Google". www.google.com. مؤرشف من الأصل في 06 يوليو 2017. اطلع عليه بتاريخ 06 مايو 2018. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ أرشيف=(مساعدة) - Snow, Christopher F. (1999-06-28). "Laboratory Diagnosis of Vitamin B12 and Folate Deficiency". Archives of Internal Medicine (باللغة الإنجليزية). 159 (12): 1289. doi:10.1001/archinte.159.12.1289. ISSN 0003-9926. مؤرشف من الأصل في 28 يونيو 2018. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Efficacy of oral cobalamin (vitamin B12) therapy: Expert Opinion on Pharmacotherapy: Vol 11, No 2 نسخة محفوظة 10 يناير 2020 على موقع واي باك مشين.
- ANDRÈS, E.; DALI-YOUCEF, N.; VOGEL, T.; SERRAJ, K.; ZIMMER, J. (2009-01-11). "Oral cobalamin (vitamin B12) treatment. An update". International Journal of Laboratory Hematology (باللغة الإنجليزية). 31 (1): 1–8. doi:10.1111/j.1751-553x.2008.01115.x. ISSN 1751-5521. مؤرشف من الأصل في 08 مارس 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Carmel, Ralph (2008-09-15). "How I treat cobalamin (vitamin B12) deficiency". Blood. 112 (6): 2214–2221. doi:10.1182/blood-2008-03-040253. ISSN 0006-4971. PMID 18606874. مؤرشف من الأصل في 28 أغسطس 2017. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Redirecting". linkinghub.elsevier.com. مؤرشف من الأصل في 27 يونيو 2018. اطلع عليه بتاريخ 06 مايو 2018. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Fedosov, Sergey N.; Laursen, Niels B.; Nexo, Ebba; Moestrup, Soren K.; Petersen, Torben E.; Jensen, Erik O.; Berglund, Lars (2003-08). "Human intrinsic factor expressed in the plant Arabidopsis thaliana". European Journal of Biochemistry (باللغة الإنجليزية). 270 (16): 3362–3367. doi:10.1046/j.1432-1033.2003.03716.x. ISSN 0014-2956. مؤرشف من الأصل في 08 مارس 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ=(مساعدة) - Sharabi, Amir; Cohen, Eytan; Sulkes, Jaqueline; Garty, Moshe (2003-12). "Replacement therapy for vitamin B12 deficiency: comparison between the sublingual and oral route". British Journal of Clinical Pharmacology. 56 (6): 635–638. doi:10.1046/j.1365-2125.2003.01907.x. ISSN 0306-5251. PMID 14616423. مؤرشف من الأصل في 11 مارس 2017. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ=(مساعدة) - "Redirecting". linkinghub.elsevier.com. مؤرشف من الأصل في 13 يونيو 2018. اطلع عليه بتاريخ 06 مايو 2018. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Transdermal Patch and Method For Delivery Of Vitamin B12, مؤرشف من الأصل في 10 يناير 2020, اطلع عليه بتاريخ 06 مايو 2018 الوسيط
|CitationClass=تم تجاهله (مساعدة); الوسيط|separator=تم تجاهله (مساعدة)CS1 maint: ref=harv (link) - "Vitamin B12 loaded polycaprolactone nanofibers: A novel transdermal route for the water soluble energy supplement delivery". International Journal of Pharmaceutics (باللغة الإنجليزية). 444 (1–2): 70–76. 2013-02-28. doi:10.1016/j.ijpharm.2013.01.040. ISSN 0378-5173. مؤرشف من الأصل في 17 ديسمبر 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة)
- بوابة طب
