غلوبيولين مناعي م
الكريين المناعي م أو الغلوبولين المناعي م (IgM) اكتشف عام 1946، نسبته 5-10%، ويبلغ وزنه الجزيئي 1.000.000، يقدّر تركيزه في المصل 1غ/ل، يتجدّد كلّ 5 أيّام، يظهر مبكّرا في الجنين- يقوم بتثبيت المتمّمة- ينشّط البالعات الكبيرة ويوجد بغزارة على سطح الخلايا البائية.[1][2][3]
Immunoglobulin M (tetramer) | ||
 | ||
| Immunoglobulin M | ||
| − | ||
| نوع البروتين | جسم مضاد | |
| الوظيفة | ||
| − | ||
| اسم الوحدة الفرعية | الجين | الموقع الكروموسومي |
| Immunoglobulin heavy chain µ | IGH@ | |
| سلسلة خفيفة κ | IGK@ | |
| سلسلة خفيفة λ | IGL@ | |
التاريخ
بدأت دراسة المادة مع التقرير في عام 1937 أن الخيول التي تم إفراطها في التمنيع مع المكورات الرئوية متعددة السكاريد أنتجت الأجسام المضادة التي كانت أكبر بكثير من الأرنب النموذجي γ- الجلوبيولين، مع وزن جزيئي قدره 990,000 دالتون. وفقا لحجمها الكبير، كان يشار إلى الأجسام المضادة الجديدة في الأصل باسم γ-ماكروجليولين، ومن ثم في المصطلحات اللاحقة مثل ل "ماكرو". والمجالات V من الغلوبولين المناعي الطبيعي غير متجانسة للغاية، مما يعكس دورها في الحماية ضد مجموعة كبيرة ومتنوعة من الميكروبات المعدية، وهذا التغاير أعاق التحليل الهيكلي التفصيلي للمادة. تم اكتشاف مصدرين متجانسين من المادة في وقت لاحق. أولاً، تم التعرف على البروتينات الجزيئية العالية التي ينتجها بعض مرضى المايلوما المتعددة لتكون γ-ماكروجليبولين المنتجة للورم، ونحن نعلم الآن أنه بسبب أن الورم هو استنساخ المادة ينتجه متجانس. في الستينات، تم تطوير طرق لتحفيز الأورام المناعية المنتجة للغلوبولين (plasmacytomas) في الفئران، وبالتالي توفير مصدر للغلوبولين المناعي المتجانس من مختلف الأنماط، بما في ذلك المادة (استعرضت في). في الآونة الأخيرة، يمكن استخدام التعبير عن جينات الغلوبولين المناعية المهندسة في زراعة الأنسجة لإنتاج المادة مع التناوبات محددة، وبالتالي لتحديد المتطلبات الجزيئية للميزات ذات الاهتمام.
الهيكل
تشمل الغلوبولين المناعي سلاسل الضوء والسلاسل الثقيلة. سلسلة الضوء (λ أو κ) هو بروتين من ~ 220 الأحماض الأمينية، وتتألف من مجال متغير، VL (قطعة من حوالي 110 الأحماض الأمينية)، ومجال ثابت، CL (أيضا ما يقرب من 110 الأحماض الأمينية طويلة). سلسلة μ الثقيلة من غلوبيولين مناعي م هو بروتين من ~ 576 الأحماض الأمينية، ويشمل المجال متغير (VH ~ 110 الأحماض الأمينية), أربعة مجالات منطقة ثابتة متميزة (Cμ1, Cμ2, Cμ3, Cμ4, كل ~ 110 الأحماض الأمينية) و "ذيل" من ~20 الأحماض الأمينية. وتحمل السلسلة الثقيلة μ القلة القلوسكاشاريد عند خمس بقايا من الهليون. وقد تميزت oligosaccharides على الفأرة والإنسان غلوبيولين مناعي م جزئيا من قبل مجموعة متنوعة من التقنيات، بما في ذلك غلوبيولين مناعي م، lectin ملزمة، ونظم الكروماتوغرافية مختلفة وحساسية انزيمية (استعرضت في). يختلف هيكل oligosaccharides في كل موقع من حيث التفاصيل، وتختلف القلة المهيمنة - بيانتيناري، تريانتيناري، مانوس عالية بين المواقع.
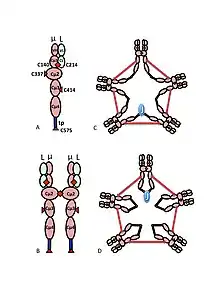
يتم عرض بنية متعددة الهجرات من غلوبيولين مناعي م في شكل تخطيطي في الشكل 1. ويبين الشكل 1A "الهتيروديمر" المكون من سلسلة ضوئية واحدة، تشير إلى L، وسلسلة ثقيلة واحدة، وهي μ. وتُعقد السلاسل الثقيلة والخفيفة معاً من خلال روابط ثاني كبريتيد (تُصوَّر على أنها مثلثات حمراء) وعن طريق التفاعلات غير التكافؤية.
ويبين الشكل 1باء وحدتين ميكرولتر يربطهما رابط من ثنائي الكبريت في المجالات Cμ2؛ غالباً ما يشار إلى هذا الهيكل (μL) 2 باسم غلوبيولين مناعي م "مونومر" ، كما هو مماثل في بعض الطرق لهيكل الغلوبولين المناعي G (IgG).
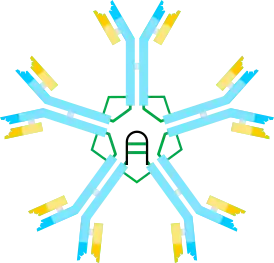
وعلى أساس سرعة الترسيب والمظهر في ميكروجرافات الإلكترون، استُدل على أن غلوبيولين مناعي م هو في الغالب "خماسي"، أي بوليمر يتكون من خمسة "مونومرات" [(ميكرولتر)2]5، وقد تم تصويره أصلاً من قبل النماذج في الشكلين 1C و1D، مع روابط كبريتيد بين المجالات Cμ3 وبين القطع التيل. كما يظهر أن غلوبيولين مناعي م الخماسي يتضمن بروتين ثالث، سلسلة J. تم اكتشاف سلسلة J (J للانضمام) كمكون مستعبد تساهمي من IgA البوليمرية وغلوبيولين مناعي م. سلسلة J هي صغيرة (~ 137 الأحماض الأمينية), حمضية البروتين. كما هو مبين، تنضم سلسلة J إلى سلسلتين μ عبر سندات ثاني كبريتيد تتضمن السيشتاينات في القطع التيل.
المتطلبات الجزيئية للتشكيل

كان من المتوقع في البداية أن سلسلة J ستكون مهمة لتشكيل الغلوبولينات المناعية البوليمرية، وفي الواقع البلمرة من IgA يعتمد بقوة (ولكن ليس على الإطلاق) على سلسلة J. في المقابل، IgM البوليمرية أشكال بكفاءة في غياب سلسلة J.
الشكل السائد من الإنسان والفأر IgM هو خماسي. وعلى سبيل المقارنة، فإن IgM من الضفدع (Xenopus) هو في الغالب هيكسمر، وIgM من الأسماك العظمية هي في الغالب رباعية، وIgM من الأسماك الكارتيلاجية (القرش) هي في الغالب خماسية. غلبة pentamer في IgM الماوس والإنسان على الرغم من أنه كان من الواضح أن هذه IgM يمكن أن توجد أيضا كما الهيكسمر. وأشارت الدراسات اللاحقة باستخدام أنظمة التعبير الحمض النووي المؤتلفة إلى أن الهيكسمر هو شكل رئيسي من أشكال IgM الماوس، عندما يتم إنتاج IgM في ظل ظروف يتم فيها منع دمج سلسلة J، إما عن طريق إنتاج IgM في الخلايا التي تفتقر إلى سلسلة J أو عن طريق إنتاج IgM مع سلسلة ثقيلة μ تفتقر إلى السيستين في الجزء الذيل. وباختصار، فإن IgM سداسية لا تحتوي على سلسلة J؛ يمكن تشكيل خماسي IgM بحيث تشمل أو لا تشمل سلسلة J.
12- وثمة فرق مهم بين μ وسلاسل γ الثقيلة هو توافر السيستينات لتشكيل روابط من حيث الكبريتيد بين السلاسل الثقيلة. في حالة γ سلسلة ثقيلة، يتم تشكيل السندات الوحيدة بين γ من قبل السيشتاينات في المفصل، وبناء على ذلك كل سلسلة γ يرتبط سلسلة واحدة فقط γ الأخرى. وعلى النقيض من ذلك، فإن نطاقي Cμ2 وCμ3 والقطعة ذيل كل منها تشمل السيستين التي تشكل رابطة من ثنائي الكبريت مع سلسلة μ أخرى. ال [cyستينس] في ال [ا] مجالات Cμ2 يتوسط التشكيل من [غم] أحاديّة (μL)2. الجزء الذيل جنبا إلى جنب مع السيستين وشملت ضرورية وكافية لتشكيل الغلوبولين المناعي البوليمرية. وهذا هو، حذف ذيل من سلسلة μ الثقيلة يمنع تشكيل IgM البوليمرية. [29] على العكس، الخلايا التي تعبر عن سلسلة γ الثقيلة التي تم تعديلها لتشمل ذيل تنتج IgG البوليمرية.
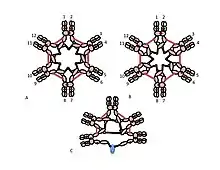
دور السيستين في المجال Cμ3 هو أكثر دهاء. ويمثل الشكلان 1C و 1D نماذج ممكنة لـ IgM الخماسية. ويتوخى في هذه النماذج ربط سلسلة μ سلسلتين μ آخرين. ومع ذلك، لا يمكن لأي من النموذجين وحدهما أن يفسرا بشكل كامل هيكل البوليمرية IgM. فعلى سبيل المثال، يتنبأ النموذج الوارد في الشكل 1C بأن رابطة التكبيد بين نطاقات Cμ2 ضرورية لصنع بوليمرية مستعبدة من مادة الـ "IgM" ذات الكبريتيد. ويتنبأ النموذج في الشكل 1D بأن رابطة التكلفيد بين مجالات Cμ3 أمر ضروري. في الواقع مستعبدين من كبريتيد، بوليمرية، يمكن أن لا يزال يتم إجراء IgM إذا كان أي واحد من cysteines الثلاثة غير موجودة. في سياق النماذج التي تتفاعل فيها كل سلسلة μ مع سلسلتين μ أخرى فقط، تشير هذه النتائج إلى أن بعض الجزيئات تشبه الشكل 1C وبعضها مثل الشكل 1D. غير أن توافر ثلاث cysteines للترابط بين μ السلسلة يشير إلى أن سلاسل μ قد تربط كل منها ثلاث سلاسل μ أخرى، كما هو موضح في الشكل 2. وبنفس الروح، يقدم الشكل 2C نموذجًا لخمامر يحتوي على سلسلة J يعكس الأدلة على أن سلسلة J تنضم إلى سلاسل μ التي لم يتم ربطها بسلاسل μ أخرى من قبل cysteines في مجالات Cμ3. وتناقش هذه وغيرها من النماذج، على حد سواء العادية وغير النظامية في مكان آخر.
مراجع
- Smith, R. I. F.; Coloma, M. J.; Morrison, S. L. (1995). "Addition of a mu-tailpiece to IgG results in polymeric antibodies with enhanced effector functions including complement-mediated cytolysis by IgG4". Journal of Immunology. 154 (5): 2226–2236. PMID 7868896. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Cattaneo, A.; Neuberger, M. S. (1987). "Polymeric immunoglobulin M is secreted by transfectants of non-lymphoid cells in the absence of immunoglobulin J chain". مجلة EMBO العلمية. 6 (9): 2753–2758. PMC 553699. PMID 3119328. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Mestecky, J.; Zikin, J.; Butler, W. T. (1971). "Immunoglobulin M an secretory immunoglobulin A: presence of common polypeptide chain different from light chains". ساينس. 171 (3976): 1163–1165. Bibcode:1971Sci...171.1163M. doi:10.1126/science.171.3976.1163. الوسيط
|CitationClass=تم تجاهله (مساعدة)
- بوابة علم الأحياء الخلوي والجزيئي
- بوابة طب
 صور وملفات صوتية من كومنز
صور وملفات صوتية من كومنز