عدم الانفصال
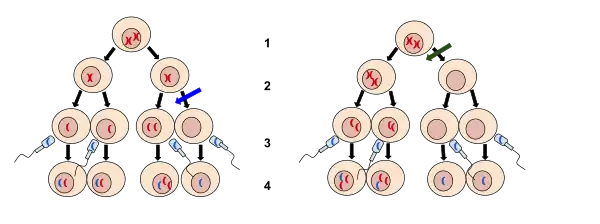
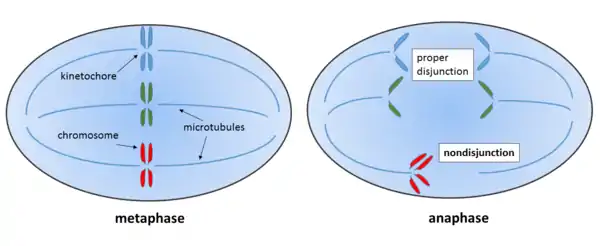
عدم الانفصال (بالإنجليزية: Nondisjunction)[1] هو فشل الكروموسومات المتماثلة أو الكروماتيدات الشقيقة في الانفصال بشكل صحيح أثناء انقسام الخلية. هناك ثلاثة أشكال من عدم الانفصال: فشل زوج من الكروموسومات المتماثلة في الانفصال أثناء الانقسام الميوزي I، وفشل الكروماتيدات الشقيقة في الانفصال أثناء الانقسام الميوزي II، وفشل الكروماتيدات الشقيقة في الانفصال أثناء الانقسام المتساوي (الانقسام الميتوزي).[2] [3][4] يمكن الإشارة إلى هذه الأنواع من عدم الانفصال بعدم الانفصال الميوزي الأول وعدم الانفصال الميوزي الثاني وعدم الانفصال الميتوزي، على التوالي. ينتج عن عدم الانفصال خلايا ابنة ذات عدد غير طبيعي من الكروموسومات (اختلال الصيغة الصبغية).[5]
يُنسب اكتشاف عدم الانفصال في الكروموسومات الجنسية عند ذبابة الفاكهة السوداء إلى كالفين بريدجز وتوماس هانت مورغان في ربيع عام 1913،[وثِّق المصدر] أثناء العمل في مختبر علم الحيوان بجامعة كولومبيا.[6][7][8]
الأنواع
بشكل عام، يمكن أن يحدث عدم الانفصال في أي شكل من أشكال الانقسام الخلوي الذي يتضمن التوزيع المنظم للمادة الصبغية. الحيوانات العليا لديها ثلاثة أشكال مميزة من هذه الانقسامات الخلوية: الانقسام الميوزي الأول والانقسام الميوزي الثاني هما شكلان متخصصان من الانقسام الخلوي يحدث أثناء توليد الجاميت (البويضات والحيوانات المنوية) للتكاثر الجنسي، والانقسام الميتوزي هو شكل الانقسام الخلوي الذي تستخدمه جميع الخلايا الأخرى في الجسم.
الانقسام الميتوزي
يسبق انقسام الخلايا الجسدية (انقسام ميتوزي) تضاعف المادة الوراثية في المرحلة S (طالع صفحة الطور البيني). نتيجةً لذلك، يصبح كل كروموسوم عبارة من كروماتيدين شقيقين متماسكتين معًا في منطقة السنترومير. أثناء طور الانفصال الميتوزي، تنفصل الكروماتيدات الشقيقة وتهاجر إلى أقطاب الخلية المعاكسة قبل انقسام الخلية. يؤدي عدم الانفصال أثناء هذه المرحلة الحاسمة إلى تلقي ابنة واحدة للكروماتيدات الشقيقة للكروموسوم المصاب بينما لا تحصل الأخرى على أي كروماتيدات.[4][3] يُعرف هذا باسم جسر الكروماتين أو جسر طور الانفصال. ينتج عن عدم الانفصال الميتوزي الفسيفساء الجسدية، حيث أن الخلايا الوليدة فقط التي تنشأ من الخلية التي حدث فيها عدم الانفصال سيكون لها عدد غير طبيعي من الكروموسومات.[3] يمكن أن يساهم عدم الانفصال أثناء الانقسام الميتوزي في تطور بعض أشكال السرطان، على سبيل المثال الورم الأرومي الشبكي (طالع الرسم البياني التوضيحي أدناه).[9] يمكن أن يُعزى عدم انفصال الكروموسوم في الانقسام الميتوزي إلى تعطيل نشاط توبويزوميراز II، أو كوندينسين، أو سيباريز (Separase).[10] تمت دراسة عدم الانفصال الميتوزي جيدًا في السكيراء الجعوية. تخضع هذه الخميرة للانقسام على غرار حقيقيات النوى الأخرى.[11] تحدث جسور الكروموسوم عندما يتم تجميع الكروماتيدات الشقيقة معًا بعد تضاعف الدنا بواسطة التشابك الطوبولوجي للحمض النووي DNA ومركب التماسك المدعو كوهيسين (cohesin). أثناء طور الانفصال، يتم شق الكوهيسين بواسطة إنزيم السيباريز.[12] التوبويزوميراز II، أو كوندينسين هما المسؤولان عن إزالة السلسلية.
الانقسام الميوزي I
يحدث عدم الانفصال أثناء الطور الانفصالي (طور الصعود)، عندما لا ينفصل زوج من الكروموسومات المتماثلة قبل أن يتم توزيعهما في خليتين ابنتين. في الخلايا الناتجة، تحتوي إحدى الخلايا على نسختين من الكروموسوم المتماثل، بينما لا تحتوي الخلية الأخرى على أي نسخة. عندما تنقسم كل واحدة من هذه الخلايا إلى خليتين خلال الانقسام الميوزي الثاني، فإن الخلايا الأربعة المنتجة ستصاب جميعها بتشوهات صبغية.[5]
الانقسام الميوزي II
يتم إيقاف البويضات المباضة في الانقسام الميوزي الثاني قبل بدأ التخصيب. يؤدي التخصيب فيما بعد إلى بدأ الانقسام الميوزي الثاني. على غرار أحداث الفصل في الانقسام الميتوزي، يتم فصل أزواج الكروماتيدات الشقيقة في الطور الانفصالي الثاني أثناء الانقسام الميوزي الثاني. هذه الكروماتيدات الشقيقة ناتجة عن فصل الكروموسومات المتثماثلة (ثنائي التكافؤ) في الطور الانفصالي الأول الذي قد حدث أثناء الانقسام الميوزي الأول.
من المهم ملاحظة الفرق بين الكروماتيدات الشقيقة في الانقسام الميتوزي والكروماتيدات الشقيقة في الانقسام الميوزي الثاني. الفرق الأساسي هو أنه في الانقسام الميتوزي، تكون الكروماتيدات الشقيقة متطابقة جينياً بسبب تضاعف المادة الجينية قبل بدأ عملية الانقسام في المرحلة S(طالع صفحة الطور البيني). في المقابل، لا تكون الكروماتيدات الشقيقة متطابقة جينياً في الانقسام الميوزي الثاني، وذلك بسبب التعابر الكروموسومي الذي قد حدث في الانقسام الميوزي الأول.
في البويضات، يتم فصل الكروماتيد الشقيق وتوزيعه إلى الجسم القطبي الثاني، بينما يبقى الكروماتيد الآخر داخل البويضة. أثناء تكوين الحيوانات المنوية، يكون كل انقسام ميوزي نموذجي، بحيث تؤدي كل خلية منوية أولية إلى ظهور خليتين منويتين ثانويتين بعد الانقسام الميوزي الأول، وفي النهاية 4 حيوانات منوية بعد الانقسام الميوزي الثاني. يؤدي عدم الانفصال الميوزي الثاني (II) أيضًا إلى متلازمات اختلال الصيغة الصبغية، ولكن بدرجة أقل بكثير من حالات عدم الانفصال الميوزي الأول (I).[13]
الآليات الجزيئية
الدور المركزي لنقطة تفتيش تجمع المغزل
نقطة تفتيش تجمع المغزل (SAC) هي آلية حماية جزيئية تتحكم بالفصل الصحيح للكروموسوم في الخلايا حقيقية النواة. يمنع SAC تقدم طور الانفصال حتى تتم محاذاة وترصيف جميع الكروموسومات المتماثلة (ثنائية التكافؤ في الانقسام الميوزي الأول) والكروماتيدات الشقيقة (في الانقسام الميوزي الثاني والانقسام الميتوزي) بشكل صحيح مع جهاز المغزل. عند تحقق ذلك فقط، تقوم SAC بتثبيط المركب والمعقد المعزز لطور الانفصال (APC)، والذي يؤدي بدوره إلى حدوث الطور الانفصالي.
الاختلافات الخاصة بالجنس في الانقسام الميوزي
أظهرت الدراسات الاستقصائية لحالات متلازمات اختلال الصيغة الصبغية أن معظمها مشتق من الأم.
هذا يثير السؤال: لماذا يكون الانقسام الميوزي الأنثوي أكثر عرضة للخطأ؟ يتمثل الاختلاف الأكثر وضوحًا بين تكون البويضات عند الإناث وتكون الحيوانات المنوية عند الذكور في التوقيف المطول للبويضات في المراحل المتأخرة من الطور التمهيدي الأول لسنوات عديدة تصل إلى عدة عقود. من ناحية أخرى، تمر الأمشاج الذكرية بسرعة بجميع مراحل الانقسام الميوزي الأول والثاني. إضافةً إلى ذلك، هناك اختلاف مهم آخر بين الانقسام الميوزي للذكور والإناث يتعلق بتكرار إعادة التركيب الجيني بين الكروموسومات المتماثلة: بشكل عام، يحدث إعادة التركيب بنسبة أكبر عند الإناث مقارنةً بالذكور.[14][15][16][17] تم توثيق حالات فشل إعادة التركيب أو عمليات التعابر غير الملائمة كمساهمين في حدوث عدم الانفصال في البشر، بمعنى أنه حدوث اختلال الصيغة الصبغية وعدم الانفصال الميوزي الأنثوي يكون أكثر شيوعاً بسبب زيادة نسبة إعادة التركيب مقارنة بالذكور.
فقدان روابط التماسك (Cohesin) المرتبط بالعمر
بسبب التوقيف المطول للبويضات البشرية في الانقسام الميوزي الأول، فإن ضعف الروابط المتماسكة التي تربط الكروموسومات مع بعضها بالإضافة إلى انخفاض نشاط SAC قد يساهم في حدوث أخطاء في التحكم بفصل الكروموسومات عن بعضها. يرتبط معدل حدوث هذه الأخطاء بعمر الأم.
يعتبر معقد كوهيسن (cohesin) مسؤولاً عن الحفاظ على تماسك الكروماتيدات الشقيقة معًا ويوفر مواقع ربط من أجل ارتباط المغزل. يتم تحميل Cohesin على الكروموسومات المنسوخة حديثًا في البويضات الأولية (oogonia) أثناء نمو الجنين. تتمتع البويضات الناضجة بقدرة محدودة على إعادة تحميل cohesin بعد الانتهاء من المرحلة S. قد يؤدي الإيقاف المطول للبويضات البشرية قبل الانتهاء من الانقسام الميوزي الأول إلى فقد كبير في التماسك بمرور الوقت. يُفترض أن فقدان التماسك يساهم في التعلق غير الصحيح للأنيبيات الحركية ويزيد من أخطاء فصل الكروموسوم أثناء الانقسامات الميوزية. [18]
الآثار
عدم الانفصال هو خطأ عشوائي (على الرغم من وجود بعض العوامل التي تزيد من نسبة حدوثه)، تكون نتيحة هذا الخطأ خلية فيها خلل في عدد الكروموسومات (طالع صفحة اختلال الصيغية الصبغية). ويقال أن هذه الخلية مختلة الصيغة الصبغية. في غالب الأحيان، تموت هذه الخلايا عن طريق الإجهاض مثلاً. ولكن في بعض الحالات، قد تكون قابلة للحياة. اختلال الصيغة الصبغية يمكن أن يحصل للصبغيات الجسمية أو الصبغيات الجنسية.
يُشار إلى فقدان كروموسوم واحد (2n-1)، بحيث يكون للخلية (الخلايا) الوليدة المصابة بالخلل كروموسوم واحد مفقود من أحد الأزواج باسم أحادي الصبغي (monosomy). ويشار إلى الحصول على كروموسوم واحد إضافي، بحيث يكون للخلية (الخلايا) الوليدة المصابة بالخلل كروموسوم واحد إضافي لأحد الأزواج باسم التثلث الصبغي.[3]في حالة تخصيب الأمشاج المختلة الصيغة الصبغية، فقد ينتج عن ذلك عدد من المتلازمات:
أحادي الصبغة
 مقالة مفصلة: أحاد الصبغي
مقالة مفصلة: أحاد الصبغي
فيما يخص أحادية الصبغة، الحالة الوحيدة المعروفة التي يمكن النجاة منها في البشر هي متلازمة تيرنر، حيث يكون الشخص المصاب أحادي الصبغة للكروموسوم X، أي أنه يوجد كروموسم X واحد (انظر أدناه)، وبالتالي فإن الحالة الوحيدة المعروفة لأحادية الصبغة تكون مرتبطة بالكروموسوم الجنسي (اختلال الصيغة الصبغية للصبغي الجنسي X). عادةً ما تكون أحاديات الصبغة الأخرى مميتة أثناء نمو الجنين المبكر، والبقاء على قيد الحياة ممكن فقط إذا لم تتأثر جميع خلايا الجسم في حالة الفسيفساء (انظر أدناه)، أو إذا تمت استعادة العدد الطبيعي للكروموسومات عن طريق تضاعف الكروموسوم أحادي الصبغة (وهذا ما يمكن تسميته "إنقاذ الكروموسوم").[4]
متلازمة تيرنر (X monosomy) (45 ، X0)
 مقالة مفصلة: متلازمة تيرنر
مقالة مفصلة: متلازمة تيرنر

يمثل الفقد الكامل لكروموسوم X (أي فقدانه بالكامل) حوالي نصف حالات متلازمة تيرنر.[19] يمكننا التشديد على أهمية وجود كل من الكروموسومات X أثناء التطور الجنيني من خلال ملاحظة أن الغالبية العظمى (أكثر من 99٪) من الأجنة مع كروموسوم X واحد فقط (النمط النووي 45 ، X0) يتم إجهاضها تلقائيًا.[20]بكلمات أخرى، يولد حوالي 0.5% فقط من الأجنة التي لديها كروموسوم X واحد فقط (النمط النووي 45 ، X0)، بالإضافة إلى 0.5% من الأجنة التي لديها كروموسوم X واحد وجزء من كروموسم إكس الآخر. هذا يعني أنه يمكن أن تحدث متلازمة تيرنر أيضًا إذا كان أحد الكروموسومات الجنسية مفقودًا جزئيًا أو أعيد ترتيبه بدلاً من أن يكون غائبًا أو مفقوداً بشكل كامل. تعاني بعض النساء المصابات بمتلازمة تيرنر من تغير في الكروموسومات في بعض خلاياهن فقط، وهو ما يُعرف باسم الفسيفساء. يقال إن النساء المصابات بمتلازمة تيرنر التي تسببها فسيفساء الكروموسوم X لديهن متلازمة تيرنر الفسيفسائية.[19]
التثلث الصبغي الجسمي
 مقالة مفصلة: تثلث صبغي
مقالة مفصلة: تثلث صبغي
يشير مصطلح التثلث الصبغي الجسمي إلى وجود كروموسوم آخر في الكروموسومات الجسيمة (غير الكروموسومات الجنسية X و Y) في 3 نسخ بدلاً من العدد الطبيعي 2 في الخلايا الضعفانية الطبيعية.
متلازمة داون (تثلث الصبغي 21)
 مقالة مفصلة: متلازمة داون
مقالة مفصلة: متلازمة داون
متلازمة داون، وهي تثلث صبغي للكروموسوم الجسمي 21، هي الاضطراب والاختلال الكروموسومي الأكثر شيوعًا لعدد الكروموسوم في البشر. تنجم غالبية الحالات عن عدم الانفصال أثناء الانقسام الميوزي عند الأم[20].[4]يحدث التثلث الصبغي في 0.3٪ على الأقل من الأطفال حديثي الولادة وحوالي 25٪ من حالات الإجهاض التلقائي. تعتبر السبب الرئيسي لإفساد الحمل وهي السبب الأكثر شيوعًا للتخلف العقلي.[21]من الموثق جيدًا أن عمر الأم المتقدم مرتبط بخطر أكبر بحدوث عدم الانفصال الميوزي الذي يؤدي إلى متلازمة داون. قد يترافق هذا مع الإيقاف الميوزي المطول للبويضات البشرية التي يحتمل أن تستمر لأكثر من أربعة عقود.[22]
متلازمة إدوارد (تثلث الصبغي 18) ومتلازمة باتو (تثلث الصبغي 13)
 مقالة مفصلة: متلازمة إدوارد
مقالة مفصلة: متلازمة إدوارد
 مقالة مفصلة: متلازمة باتو
مقالة مفصلة: متلازمة باتو
التثلث الصبغي الجسمي الثاني والثالث الأكثر شيوعاً (المتوافق مع الولادة الحية) هو متلازمة إدوارد (التثلث الصبغي 18) ومتلازمة باتو (التثلث الصبغي 13)، على التوالي. عادة ما يكون التثلث الصبغي الكامل للكروموسومات الأخرى غير قابلة للحياة وتمثل سببًا متكررًا نسبيًا للإجهاض.[4].[2]فقط في حالات نادرة من الفسيفساء، قد يدعم وجود خط خلوي طبيعي، بالإضافة إلى خط الخلية ثلاثي الذرات، تطوير تثلث صبغي قابل للحياة للكروموسومات الأخرى.[4] في الخلاصة، يمكن القول بأن الكروموسمات الجمسية 21 (الأكثر شيوعًا) و18، و13(الأقل شيوعاً) هي الكروموسومات الجسمية الوحيدة تقريباً التي يمكن أن يحدث فيها خلل أو اضطراب في عددها، بحيث تؤدي إلى ولادة إنسان قابل للحياة. أما الكروموسومات الجسمية الأخرى، فعلى الرغم من أنه من الممكن حدوث خلل أو اضطراب في عددها ولكنها تؤدي في نهاية المطاف إلى موت الجنين. يمكن عزو ذلك جزئياً إلى حجم وشكل الكروموسومات.[بحاجة لمصدر]
اختلال الصيغة الصبغية للصبغيات الجنسية
اختلال الصيغة الصبغية للصبغيات الجنسية هي الحالات التي تحتوي على عدد غير طبيعي من الصبغيات الجنسية، أي بخلاف XX (أنثى) أو XY (ذكر). بشكل عام، يمكن أيضًا تصنيف أحادي الصبغة X (متلازمة تيرنر، كما ذكرنا أعلاه، انظر قسم أحادي الصبغة) كشكل من أشكال اختلال الصيغة الصبغية للكروموسوم الجنسي.
متلازمة كلاينفيلتر (47 ، XXY)
 مقالة مفصلة: متلازمة كلاينفيلتر
مقالة مفصلة: متلازمة كلاينفيلتر
متلازمة كلاينفيلتر هي أكثر أنواع اختلال الصيغة الصبغية للكروموسوم الجنسي شيوعًا في البشر. يمثل السبب الأكثر شيوعًا لقصور الغدد التناسلية والعقم عند الرجال. تحدث معظم الحالات بسبب أخطاء غير مفصولة في الانقسام الميوزي الأبوي 1. حوالي ثمانين بالمائة من الأفراد المصابين بهذه المتلازمة لديهم كروموسوم X إضافي واحد مما يؤدي إلى النمط النووي XXY. تحتوي الحالات المتبقية إما على عدة كروموسومات جنسية إضافية (48 ، XXXY ، 48 ، XXYY ، 49 ، XXXXY)، أو فسيفساء (46 ، XY / 47 ، XXY) ، أو تشوهات بنيوية في الكروموسومات.[4]
(47,XYY) ذكر XYY
 مقالة مفصلة: متلازمة XYY
مقالة مفصلة: متلازمة XYY
تبلغ نسبة حدوث متلازمة XYY تقريبًا 1 في 800-1000 ولادة ذكور. تظل العديد من الحالات غير مشخصة بسبب مظهرها الطبيعي وخصوبتها وغياب الأعراض الشديدة. عادة ما يكون الكروموسوم Y الإضافي نتيجة لعدم الانفصال أثناء الانقسام الميوزي الأبوي.[4]
(47, XXX)التثلث الصبغي للصبغي X
هو شكل من أشكال اختلال الصيغة الصبغية للكروموسوم الجنسي حيث يكون للإناث ثلاثة بدلاً من اثنين من الكروموسومات X. يتأثر معظم المرضى بشكل طفيف بالأعراض النفسية والجسدية. لاحظت الدراسات التي فحصت أصل كروموسوم X الإضافي أن حوالي 58-63٪ من الحالات كانت ناتجة عن عدم الانفصال في الانقسام الميوزي الأول للأم، و16-18٪ بسبب عدم الانفصال في الانقسام الميوزي الثاني للأم، والحالات المتبقية عن طريق ما بعد اللاقحة، أي عدم الانفصال الميتوزي.[23]
ثنائي الصبغة، أحادي الأب أو الأم.
يشير الانقسام الأحادي الأبوي أو الأموي إلى الحالة التي يتم فيها وراثة كل من الكروموسومات لزوج كروموسوم من نفس الوالد وبالتالي تكون متطابقة. هذه الظاهرة هي على الأرجح نتيجة الحمل الذي بدأ في شكل تثلث صبغي بسبب عدم الانفصال. نظرًا لأن معظم حالات التثلث الصبغي مميتة، فإن الجنين يعيش فقط لأنه يفقد أحد الكروموسومات الثلاثة ويصبح قابل للحياة. يمكن هذه الحالة للكروموسوم 15، على سبيل المثال، في بعض حالات متلازمة برادر ويلي ومتلازمة أنجلمان.[20]
متلازمات الفسيفساء
يمكن أن تحدث متلازمات الفسيفساء بسبب عدم الانفصال الانقسامي في نمو الجنين المبكر. نتيجة لذلك، يتطور الكائن الحي كمزيج من خطوط الخلايا مع اختلاف الصيغة الصبغية (عدد الكروموسومات). قد توجد الفسيفساء في بعض الأنسجة، ولكن ليس في البعض الآخر. قد يكون لدى الأفراد المتأثرين مظهر غير مكتمل أو غير متماثل. تتضمن أمثلة متلازمات الفسيفساء متلازمة باليستر كيليان وسلس الصباغ المنقوص التلون.[20]
الفسيفساء في التحول الخبيث

غالبًا ما ينطوي تطور السرطان على تغييرات متعددة في الجينوم الخلوي (فرضية نودسون). يُعد الورم الأرومي الشبكي البشري مثالاً مدروسًا جيدًا لنوع السرطان حيث يمكن أن يساهم عدم الانفصال الميتوزي في التحول الخبيث: يمكن اكتشاف طفرات الجين RB1، الموجود على الكروموسوم 13 والذي يشفر بروتين الورم الأرومي الشبكي الكابت للورم، عن طريق التحليل الخلوي الوراثي في العديد من حالات الورم الأرومي الشبكي. أحيانًا تكون طفرات موضع RB1 في نسخة واحدة من الكروموسوم 13 مصحوبة بفقدان الصبغي 13 الآخر من النمط البري[24] من خلال عدم الانفصال الميتوزي. من خلال هذا المزيج من الآفات، تفقد الخلايا المصابة تمامًا التعبير عن البروتين العامل الكابت للورم.[25]
التشخيص
التشخيص الوراثي السابق للانغراس
التشخيص الوراثي السابق للانغراس(PGD أو PIGD) هو تقنية تستخدم لتحديد الأجنة الطبيعية وراثياً وهي مفيدة للذين لديهم تاريخ عائلي من الاضطرابات الوراثية. هذا خيار للأشخاص الذين يختارون الإنجاب من خلال الإخصاب في المختبر. يعتبر الPGD صعبًا نظرًا لكونه مضيعة للوقت وله معدلات نجاح لا تقارن إلا بIVF الروتيني.[26]
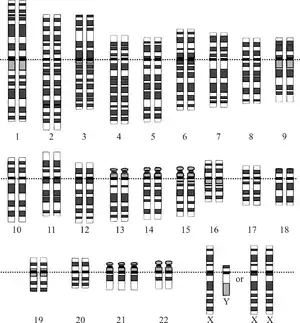
التنميط النووي
يتضمن التنميط النووي إجراء بزل السلى أو فحص الزغابات المشيمية[بحاجة لمصدر]من أجل دراسة خلايا الجنين أثناء الطور الأول. ويمكن استخدام الفحص المجهري الضوئي للكشف البصري عن وجود اختلال الصيغة الصبغية.[27]
تشخيص الجسم القطبي
يمكن استخدام تشخيص الجسم القطبي (PBD)[28]للكشف عن اختلال الصبغيات الصبغية المشتقة من الأمهات وكذلك عمليات الانتقال في البويضات. ميزة PBD مقارنةً ب PGD هي أنه يمكن إنجازه في فترة زمنية قصيرة. يتم تحقيق ذلك من خلال الحفر بالمنطقة zona drilling أو الحفر بالليزر laser drilling.[29]
خزعة قسيم أرومي
خزعة قسيم أرومي هي تقنية يتم فيها إزالة القسيم الأريمي من المنطقة الشفافة. يستخدم عادة للكشف عن اختلال الصيغة الصبغية.[30]يتم إجراء التحليل الجيني بمجرد اكتمال الإجراء. هناك حاجة لدراسات إضافية لتقييم المخاطر المرتبطة بهذا الإجراء.[31]
نمط الحياة / المخاطر البيئية
قد يؤدي تعرض الحيوانات المنوية لنمط الحياة والمخاطر البيئية و /أو المهنية إلى زيادة خطر اختلال الصيغة الصبغية. دخان السجائر هو معروف على أنه أحد عوامل تحفيز اختلال الصيغة الصبغية (aneugen). ويترافق مع زيادات في اختلال الصيغة الصبغية تتراوح من 1.5 إلى 3.0 أضعاف.[32][33]تشير دراسات أخرى إلى أن عوامل أخرى مثل استهلاك الكحول،[34]والتعرض المهني للبنزين،[35]والتعرض للمبيدات الحشرية فينفاليريت،[36] والكارباريل،[37] و البيسفينول A،[38] والمواد الكيميائية المسببة لاضطرابات الغدد الصماء أو الهرمونات الخارجية [39]واستخدام موانع الحمل الفموية والتعرض للإشعاع[39]أيضًا تزيد من احتمالية اختلال الصيغة الصبغية.
انظر أيضًا
المراجع
- Team, Almaany. "ترجمة و معنى nondisjunction بالعربي في قاموس المعاني. قاموس عربي انجليزي مصطلحات صفحة 1". www.almaany.com (باللغة الإنجليزية). مؤرشف من الأصل في 20 ديسمبر 2020. اطلع عليه بتاريخ 20 ديسمبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - D. Peter (2006). Principles of genetics. Hoboken, NJ : Wiley. ISBN 978-0-471-69939-2. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Strachan, Tom; Read, Andrew (2018-03-29). "Human Molecular Genetics". doi:10.4324/9780203833544. مؤرشف من الأصل في 25 ديسمبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة); Cite journal requires|journal=(مساعدة) - Robert M.; Stanton, Bonita F.; St. Geme, Joseph W.; Schor, Nina F. (2011). Nelson Textbook of Pediatrics. Elsevier. صفحات xxxiii. ISBN 978-1-4377-0755-7. مؤرشف من الأصل في 23 ديسمبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Ph.D, Katy McLaughlin (2016-10-27). "Nondisjunction". Biology Dictionary (باللغة الإنجليزية). مؤرشف من الأصل في 9 أغسطس 2019. اطلع عليه بتاريخ 20 ديسمبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Calvin Bridges Discovers Nondisjunction : History of Information". www.historyofinformation.com. مؤرشف من الأصل في 20 ديسمبر 2020. اطلع عليه بتاريخ 20 ديسمبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Calvin Bridges' Experiments on Nondisjunction as Evidence for the Chromosome Theory of Heredity (1913-1916) | The Embryo Project Encyclopedia". embryo.asu.edu. مؤرشف من الأصل في 30 سبتمبر 2020. اطلع عليه بتاريخ 20 ديسمبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Ganetzky, Barry; Hawley, R. Scott (2016-01-01). "The Centenary of GENETICS: Bridges to the Future". Genetics (باللغة الإنجليزية). 202 (1): 15–23. doi:10.1534/genetics.115.180182. ISSN 0016-6731. PMID 26733664. مؤرشف من الأصل في 29 أبريل 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "The Metabolic and Molecular Bases of Inherited Disease, 8th Edition 2001". Journal of Inherited Metabolic Disease. 24 (4): 519–520. 2001-07. doi:10.1023/a:1017409002434. ISSN 0141-8955. مؤرشف من الأصل في 23 ديسمبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ=(مساعدة) - Quevedo, Oliver; García-Luis, Jonay; Matos-Perdomo, Emiliano; Aragón, Luis; Machín, Félix (2012-02-16). "Nondisjunction of a Single Chromosome Leads to Breakage and Activation of DNA Damage Checkpoint in G2". PLoS Genetics. 8 (2). doi:10.1371/journal.pgen.1002509. ISSN 1553-7390. PMID 22363215. مؤرشف من الأصل في 9 مارس 2017. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Vaahtokari, A.; Aberg, T.; Thesleff, I. (1996-01). "Apoptosis in the developing tooth: association with an embryonic signaling center and suppression by EGF and FGF-4". Development (Cambridge, England). 122 (1): 121–129. ISSN 0950-1991. PMID 8565823. مؤرشف من الأصل في 20 ديسمبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ=(مساعدة) - Banks, Peter (1977-01-01). "Pulp changes after anterior mandibular subapical osteotomy in a primate model". Journal of Maxillofacial Surgery (باللغة الإنجليزية). 5: 39–48. doi:10.1016/S0301-0503(77)80074-X. ISSN 0301-0503. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Jones, Keith T.; Lane, Simon I. R. (2013-09-15). "Molecular causes of aneuploidy in mammalian eggs". Development (باللغة الإنجليزية). 140 (18): 3719–3730. doi:10.1242/dev.090589. ISSN 0950-1991. PMID 23981655. مؤرشف من الأصل في 20 نوفمبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Cahoon, Cori K.; Libuda, Diana E. (2019-09-01). "Leagues of their own: sexually dimorphic features of meiotic prophase I". Chromosoma (باللغة الإنجليزية). 128 (3): 199–214. doi:10.1007/s00412-019-00692-x. ISSN 1432-0886. PMID 30826870. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Sex Differences in Recombination in Sticklebacks" (PDF). مؤرشف من الأصل (PDF) في 21 ديسمبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة); Cite journal requires|journal=(مساعدة) - "The distribution of crossovers, and the measure of total recombination" (PDF). مؤرشف من الأصل (PDF) في 21 ديسمبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة); Cite journal requires|journal=(مساعدة) - Lenormand, Thomas; Dutheil, Julien (2005-3). "Recombination Difference between Sexes: A Role for Haploid Selection". PLoS Biology. 3 (3). doi:10.1371/journal.pbio.0030063. ISSN 1544-9173. PMID 15736976. مؤرشف من الأصل في 21 ديسمبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ=(مساعدة) - Jones, Keith T.; Lane, Simon I. R. (2013-09-15). "Molecular causes of aneuploidy in mammalian eggs". Development (باللغة الإنجليزية). 140 (18): 3719–3730. doi:10.1242/dev.090589. ISSN 0950-1991. PMID 23981655. مؤرشف من الأصل في 20 نوفمبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Turner syndrome: MedlinePlus Genetics". medlineplus.gov (باللغة الإنجليزية). مؤرشف من الأصل في 19 نوفمبر 2020. اطلع عليه بتاريخ 20 ديسمبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - H. William; Ballard, Roberta A.; Gleason, Christine A. (2005). Avery's Diseases of the Newborn. Elsevier. صفحات xxii–xxiii. ISBN 978-0-7216-9347-7. مؤرشف من الأصل في 27 ديسمبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Koehler, Kara E.; Hawley, R. Scott; Sherman, Stephanie; Hassold, Terry (1996-09-01). "Recombination and nondisjunction in humans and flies". Human Molecular Genetics (باللغة الإنجليزية). 5 (Supplement_1): 1495–1504. doi:10.1093/hmg/5.Supplement_1.1495. ISSN 0964-6906. مؤرشف من الأصل في 29 فبراير 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Eichenlaub-Ritter, Ursula (2013-01-29). "Oocyte ageing and its cellular basis". International Journal of Developmental Biology (باللغة الإنجليزية). 56 (10-11-12): 841–852. doi:10.1387/ijdb.120141ue. ISSN 0214-6282. PMID 23417406. مؤرشف من الأصل في 21 ديسمبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Tartaglia, Nicole R; Howell, Susan; Sutherland, Ashley; Wilson, Rebecca; Wilson, Lennie (2010-05-11). "A review of trisomy X (47,XXX)". Orphanet Journal of Rare Diseases. 5: 8. doi:10.1186/1750-1172-5-8. ISSN 1750-1172. PMID 20459843. مؤرشف من الأصل في 30 نوفمبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Team, Almaany. "ترجمة و معنى wild type بالعربي في قاموس المعاني. قاموس عربي انجليزي مصطلحات صفحة 1". www.almaany.com (باللغة الإنجليزية). مؤرشف من الأصل في 21 ديسمبر 2020. اطلع عليه بتاريخ 21 ديسمبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Harper, Peter S. (2002-01-23). "C.R. Scriver, A.L. Beaudet, W.S. Sly, D. Valle (eds.), B. Childs, K.W. Kinzler, B. Vogelstein (associate eds.): Molecular and metabolic bases of inherited disease, 8th edition". Human Genetics. 110 (2): 205–206. doi:10.1007/s00439-001-0669-z. ISSN 0340-6717. مؤرشف من الأصل في 2 يونيو 2018. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Harper, Joyce C.; Harton, Gary (2010-09). "The use of arrays in preimplantation genetic diagnosis and screening". Fertility and Sterility. 94 (4): 1173–1177. doi:10.1016/j.fertnstert.2010.04.064. ISSN 1556-5653. PMID 20579641. مؤرشف من الأصل في 21 ديسمبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ=(مساعدة) - "Karyotyping: MedlinePlus Medical Encyclopedia". medlineplus.gov (باللغة الإنجليزية). مؤرشف من الأصل في 7 نوفمبر 2020. اطلع عليه بتاريخ 20 ديسمبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - van der Ven, Katrin; Montag, Markus; van der Ven, Hans (2008-3). "Polar Body Diagnosis – A Step in the Right Direction?". Deutsches Ärzteblatt International. 105 (11): 190–196. doi:10.3238/arztebl.2008.0190. ISSN 1866-0452. PMID 19629197. مؤرشف من الأصل في 20 ديسمبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ=(مساعدة) - Montag, M.; van der Ven, K.; Rösing, B.; van der Ven, H. (2009). "Polar body biopsy: a viable alternative to preimplantation genetic diagnosis and screening". Reproductive Biomedicine Online. 18 Suppl 1: 6–11. doi:10.1016/s1472-6483(10)60109-5. ISSN 1472-6491. PMID 19281658. مؤرشف من الأصل في 20 ديسمبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Parnes, Y. M. (1989-03). "RCT controversy". Journal of obstetric, gynecologic, and neonatal nursing: JOGNN. 18 (2): 90. doi:10.1111/j.1552-6909.1989.tb00470.x. ISSN 0884-2175. PMID 2709181. مؤرشف من الأصل في 20 ديسمبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ=(مساعدة) - Yu, Yang; Zhao, Yue; Li, Rong; Li, Li; Zhao, Hongcui; Li, Min; Sha, Jiahao; Zhou, Qi; Qiao, Jie (2013-12-06). "Assessment of the risk of blastomere biopsy during preimplantation genetic diagnosis in a mouse model: reducing female ovary function with an increase in age by proteomics method". Journal of Proteome Research. 12 (12): 5475–5486. doi:10.1021/pr400366j. ISSN 1535-3907. PMID 24156634. مؤرشف من الأصل في 20 ديسمبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Rubes, J.; Lowe, X.; Moore, D.; Perreault, S.; Slott, V.; Evenson, D.; Selevan, S. G.; Wyrobek, A. J. (1998-10). "Smoking cigarettes is associated with increased sperm disomy in teenage men". Fertility and Sterility. 70 (4): 715–723. doi:10.1016/s0015-0282(98)00261-1. ISSN 0015-0282. PMID 9797104. مؤرشف من الأصل في 24 نوفمبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ=(مساعدة) - Shi, Q.; Ko, E.; Barclay, L.; Hoang, T.; Rademaker, A.; Martin, R. (2001-08). "Cigarette smoking and aneuploidy in human sperm". Molecular Reproduction and Development. 59 (4): 417–421. doi:10.1002/mrd.1048. ISSN 1040-452X. PMID 11468778. مؤرشف من الأصل في 20 أغسطس 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ=(مساعدة) - Benassi-Evans, Bianca; Fenech, Michael (2011-05). "Chronic alcohol exposure induces genome damage measured using the cytokinesis-block micronucleus cytome assay and aneuploidy in human B lymphoblastoid cell lines". Mutagenesis. 26 (3): 421–429. doi:10.1093/mutage/geq110. ISSN 1464-3804. PMID 21273273. مؤرشف من الأصل في 20 ديسمبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ=(مساعدة) - McHale, Cliona M.; Smith, Martyn T.; Zhang, Luoping (2014-3). "Application of toxicogenomic profiling to evaluate effects of benzene and formaldehyde: from yeast to human". Annals of the New York Academy of Sciences. 1310 (1): 74–83. doi:10.1111/nyas.12382. ISSN 0077-8923. PMID 24571325. مؤرشف من الأصل في 6 نوفمبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ=(مساعدة) - Xia, Yankai; Bian, Qian; Xu, Lichun; Cheng, Senping; Song, Lin; Liu, Jiayin; Wu, Wei; Wang, Shoulin; Wang, Xinru (2004-10-15). "Genotoxic effects on human spermatozoa among pesticide factory workers exposed to fenvalerate". Toxicology. 203 (1–3): 49–60. doi:10.1016/j.tox.2004.05.018. ISSN 0300-483X. PMID 15363581. مؤرشف من الأصل في 17 نوفمبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Xia, Yankai; Cheng, Senping; Bian, Qian; Xu, Lichun; Collins, Michael D.; Chang, Hebron C.; Song, Lin; Liu, Jiayin; Wang, Shoulin (2005-05). "Genotoxic effects on spermatozoa of carbaryl-exposed workers". Toxicological Sciences: An Official Journal of the Society of Toxicology. 85 (1): 615–623. doi:10.1093/toxsci/kfi066. ISSN 1096-6080. PMID 15615886. مؤرشف من الأصل في 21 أغسطس 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ=(مساعدة) - "Bisphenol A Exposure Causes Meiotic Aneuploidy in the Female Mouse". Current Biology (باللغة الإنجليزية). 13 (7): 546–553. 2003-04-01. doi:10.1016/S0960-9822(03)00189-1. ISSN 0960-9822. مؤرشف من الأصل في 5 ديسمبر 2012. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Nagaoka, So I.; Hassold, Terry J.; Hunt, Patricia A. (2012-06-18). "Human aneuploidy: mechanisms and new insights into an age-old problem". Nature reviews. Genetics. 13 (7): 493–504. doi:10.1038/nrg3245. ISSN 1471-0056. PMID 22705668. مؤرشف من الأصل في 11 ديسمبر 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة)
- بوابة طب
- بوابة علم الأحياء
- بوابة علم الأحياء الخلوي والجزيئي
- بوابة علم الوراثة
