تخصيب
التخصيب هي مجموعة من العمليات المتلاحقة التي تؤدي بالنهاية إلى تلاحم العروسين لتشكيل العضوية الحية. عند الحيوانات تكون هذه العملية بتلاحم النطفة مع البويضة والتي تؤدي في النتيجة إلى تشكل الجنين، و اعتماداً على نوع الحيوان قد تحصل هذه العملية داخل جسم الأنثى فتسمى عملية تخصيب داخلي، وقد تحصل خارج الجسم الحي فتسمى عملية تخصيب خارجي.
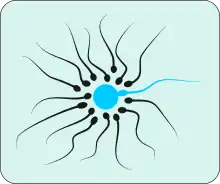
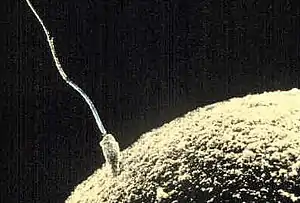
التخصيب عند الثدييات
التخصيب لدى الثدييات هو سلسلة من العمليات البيولوجية والفيزيائية المترابطة أكثر منه ظاهرة واحدة معزولة. وانقطاع أحد مكونات هذه السلسلة سيؤدي بالتأكيد إلى فشل الإخصاب. تبدأ السلسلة بمجموعة من التغيرات التي تؤثر على الحيوانات المنوية، والتي تعدها للمهمتها.
التخصيب الناجح لا يتطلب فقط التحام حيوان منوي وبويضة، بل ويشترط عدم التحام أكثر من حيوان منوي مع البويضة. فالتخصيب الناتج عن أكثر حيوان منوي - تعدد الإمناء (بالإنجليزية: polyspermy) - يؤدي حتما إلى الموت المبكر للجنين. ففي نهاية سلسلة عملية التخصيب توجد آليات لمنع حدوث تعدد إمناء البويضة.
بشكل عام، يمكن توصيف سلسلة التخصيب بالتالي:
- تفعيل الحيوانات المنوية.
- الحيوانات المنوية المقذوفة والطازجة ليست قادرة على إحداث التخصيب، وبأفضل الأحوال يمكن أن تؤدي إلى تخصيب فاشل. فلا بد من أن تخضع لسلسلة من التغييرات التي تعرف باسم تفعيل الحيوانات المنوية (بالإنجليزية: Capacitation). يرتبط تفعيل الحيوانات المنوية بإزالة بروتينات البلازما المنوية اللاصقة، وإعادة تنظيم دهون وبروتينات غشاء البلازما. كما يبدو (بدون إثباتات مخبرية) أن عملية التفعيل تنطوي أيضا على تدفق الكالسيوم إلى الخلية[1]، زيادة في أدينوزاين مونوفوسفات الحلقي[2][3]، وانخفاض في درجة الحموضة داخل الخلايا.[4][5] تفاصيل التفاعلات الجزيئية للتفعيل تختلف إلى حد ما بين أنواع الكائنات الحية.
- تفعيل الحيوانات المنوية يتم أثناء تواجدها ضمن الجهاز التناسلي للأنثى[6] و يأخذ ذلك فترة زمنية تختلف باختلاف الأنواع، ولكنه عادة ما يتطلب عدة ساعات.[7] ويمكن تفعيل الحيوانات المنوية للعديد من الثدييات، بما في ذلك البشر، من خلال سوائل تخصيب صناعية.[8][9][10]
- تصبح الحيوانات المنوية التي خضعت لللتفعيل مفرطة التنشيط (بالإنجليزية: hyperactiviated)، ومن بين خصائص عديدة جديدة، تصبح حركتها مفرطة.[11] إلا أن أهم أثر للتفعيل هو زعزعة استقرار غشاء الحيوانات المنوية لتمكين الجسيم الطرفي على رأس الحيوان المنوي من التفاعل مع البويضة.
- ترابط الحيوان المنوي مع المنطقة الشفافة المغلفة للبويضة.
- عملية ترابط الحيوانات المنوية مع الغطاء الشفاف هي تفاعل مستقبلات-ربيطة، و تعتمد بصورة عالية جدا على نوعية الكائن الحي. فمجموعات الكربوهيدرات على البروتينات السكرية لغطاء البويضة الشفاف تعمل كمستقبلات للحيوانات المنوية. لا يعرف (بصورة واضحة) مَن مِنَ الجزيئات على سطح الحيوانات المنوية يقوم بالارتباط مع هذه المستقبلات، وربما قد تتواجد العديد من البروتينات على سطح الحيوان المنوي التي يمكن أن تخدم هذه المهمة.
- تفاعل الجسيم الطرفي للحيوان المنوي
- ترابط الحيوانات المنوية مع المنطقة الشفّافّة هو الجزء السهل من عمليات سلسلة التخصيب. فالحيوانات المنوية تواجه الان مهمة صعبة تتمثل في اختراق المنطقة الشفافة للوصول إلى البويضة. و حل هذه المعضلة يتمثل في الجسيم الطرفي على واجهة الحيوان المنوي وهو جسيم حال ضخم ومعبئ بإنزيمات هاضمة للمنطقة الشفافة ويقع حول الجزء الأمامي من رأس الحيوان المنوي. و هي المنطقة التي يتواجد الحاجة لمثل هذه الانزيمات للتواجد بها.
- يوفر عمل الجسيم الطرفي للحيوانات المنوية ميكانيكية حفر أنزيمية لتمكينها من اختراق المنطقة الشفافة. نفس البروتينات السكرية ضمن المنطقة الشفافة المغلفة للغشاء البلازمي والتي تعمل كمستقبلات لتلاحم الحيوانات المنوية تقوم بعمل تحفيز لتفعيل سلسلة من العمليات التي تؤدي إلى العديد من مواقع الالتحام بين الغشاء البلازمي والغشاء الخارجي للجسيم الطرفي. مما يؤدي إلى انصهار غلاف الجسيم الطرفي المُستَقْبَل من طرف المنطقة الشفافة وتحوصله وبالتالي كشف محتويات الجسيم الطرفي وتسرب الانزيمات الهاضمة من رأس الحيوان المنوي (عملية إيماس).
- طوال مدة تفاعل الجسيم الطرفي للحيوان المنوي يتقدم الحيوان المنوي ويمر عبر المنطقة الشفافة، مما يؤدي إلى فقدان المزيد والمزيد من غشاء البلازما ومحتويات الجسيم الطرفي. بحلول الوقت وأثناء اختراق الحيوان المنوي للمنطقة الشفافة، يتم إستهلاك محتويات الجسيم الطرفي من أنزيمات وسطح خارجي وصولا إلى غشاء الجسيم الداخلي.
- الحيوانات المنوية التي تستنفذ الجسيم الطرفي قبل الوصول إلى البويضة داخل المنطقة الشفافة ستكون غير قادرة على إخصاب البويضة. و بشكل عام يتم تقييم سلامة الجسيم الطرفي للحيوانات المنوية عند إجراء تحليل السائل المنوي.
- اختراق المنطقة الشفافة
- بسبب القوة الدافعة المستمرة والنتاجة عن حركة ذيل الحيوانات المنوية، بالاشتراك مع إنزيمات الجسيم الطرفي الهاضمة، يتم شق قناة للعبور من خلال المنطقة الشفافة. هذين العاملين -الحركة وانزيمات الهضم- يسمحان للحيوانات المنوية باجتياز المنطقة الشفافة. بعض العلماء يعطون الأهمية الأضخم لحركة ذيل الحيوانات المنوية لاختراق المنطقة الشفافة، هذه الحركة تسمح لرأس الحيوان المنوي المشكل على هيئة سكين لدى الثديات بتقطيع المادة الشفافة وصنع ممر للعبور.
- اندماج (تلاحم) الحيوان المنوي مع الخلية البيضية
- فور اختراق أحد الحيوانات المنوية للمنطقة الشفافة، يقوم بالارتباط والاندماج مع غشاء البلازما للخلية البيضية. و يحدث الاندماج ضمن المنطقة ما بعد جسيم الطرفي على رأس الحيوان المنوي.
- لم يتم بعد إدراك الطبيعة الجزيئية الكاملة للروابط الناشئة بين رأس الحيوانات المنوية وغلاف البويضة. أحد أبرز الجزيئات المحتملة للقيام بتلك العملية في غلاف الحيوانات المنوية لدى بعض الكائنات الحية هو بروتين سكري يدعى فيرتلين (بالإنجليزية: fertilin)، و الذي يرتبط مع بروتين في غشاء البلازما للبويضة وربما يقوم بعملية الاندماج. من المثير للاهتمام، أن البشر والقرود لديهم طفرات جينية تعطل احدى الجينات المسؤلة عن قسم من الفيرتلين، مما يشير إلى أنهم يستخدمون جزيأت مختلفة لربط البويضات.
- تفعيل البويضة وتنشيط التفاعل القشري
- قبل إخصابها، تكون البويضة في حالة خمود، عالقة في الطور الثاني من الانقصام الانتصافي. و فور الاندماج مع الحيوان المنوي، تخضع البويضة بسرعة لعدد من التغييرات الأيضية والفيزيائية والتي تسمى مجتمعة تفعيل البويضة. الآثار الواضحة تشمل ارتفاعا في تركيز الكالسيوم داخل الخلايا، والانتهاء من الانقسام الانتصافي الثاني وبالتالي انتهاء التفاعل القشري.
- التفاعل القشري يشير إلى إيماس هائل من الحبيبات القشرية بعد لحظة من اندماج الحيوان المنوي والبويضة. الحبيبات القشرية تحتوي على خليط من الإنزيمات، بما في ذلك العديد من الإنزيمات البروتينية (البروتيازات)، والتي تنتشر في المنطقة الشفافة بسبب الإيماس الصادر عن البويضة البيض. هذه البروتيازات تغيير تركيب المنطقة الشفافة، الأمر الذي يؤدى إلى ما يعرف بتفاعل المنطقة الشفافة. مكونات الحبيبات القشرية قد تتفاعل أيضا مع غشاء البلازما للخلية البيضية.
انظر أيضا
قراءة إضافية
David R. Meldrum, M.D., R. Jeffrey Chang, M.D., Linda C. Giudice, M.D., Ph.D., Juan Balasch, M.D., and Robert L. Barbieri, M.D. Role of decreased androgens in the ovarian response to stimulation in older women
مراجع
- Zona pellucida from fertilised human oocytes induces a voltage-dependent calcium influx and the acrosome reaction in spermatozoa, but cannot be penetrated by sperm، Published online 2006 December 5. doi: 10.1186/1471-213X-6-59 نسخة محفوظة 9 يناير 2020 على موقع واي باك مشين.
- Calcium-dependent increase in adenosine 3′,5′-monophosphate and induction of the acrosome reaction in guinea pig spermatozoa Proc Natl Acad Sci U S A. 1979 November; 76(11): 5699–5703.PDF copy نسخة محفوظة 9 يناير 2020 على موقع واي باك مشين.
- Cryofixation: A Tool in Biological Ultrastructural Research, page 133, Academic Press, 1982 نسخة محفوظة 13 فبراير 2020 على موقع واي باك مشين.
- Intracellular pH controls protein synthesis rate in the sea urchin egg and early embryo، Developmental Biology, Volume 68, Issue 2, February 1979, Pages 396–406 نسخة محفوظة 14 مارس 2020 على موقع واي باك مشين.
- 31P NMR reveals increased intracellular pH after fertilization in Xenopus eggs Proc. Natl. Acad. Sci. USA, Vol. 76, No. 11, pp. 5699-5703, November 1979, Cell Biology نسخة محفوظة 9 يناير 2020 على موقع واي باك مشين.
- Sperm capacitation in the human female reproductive tract. Sperm capacitation in the human female reproductive tract, Fertility and sterility. 1985 Feb;43(2):325-7. نسخة محفوظة 9 يناير 2020 على موقع واي باك مشين.
- Dhastagir Sultan Sheriff and Elshaari Farag Ali, Perspective on plasma membrane cholesterol efflux and spermatozoal function, Journal of Human Reproductive Sciences, v.3(2); May-Aug 2010, PMC2970794 نسخة محفوظة 9 يناير 2020 على موقع واي باك مشين.
- Izquierdo D, Villamediana P, Palomo MJ, Mogas T, Paramio MT. Effect of sperm capacitation and fertilization media on IVF and early embryo development of prepubertal goat oocytes. Theriogenology. 1998 Jun;49(8):1501-13. نسخة محفوظة 9 يناير 2020 على موقع واي باك مشين.
- Parinaud J, Milhet P, Vieitez G, Richoilley G. Human sperm capacitation and in-vitro fertilization in a chemically defined and protein-free medium SMART1. Hum Reprod. 1998 Sep;13(9):2579-82. نسخة محفوظة 12 يوليو 2014 على موقع واي باك مشين.
- Arcelay E, Salicioni AM, Wertheimer E, Visconti PE. Identification of proteins undergoing tyrosine phosphorylation during mouse sperm capacitation. The International journal of developmental biology.. 2008;52(5-6):463-72. doi: 10.1387/ijdb.072555ea. "نسخة مؤرشفة". Archived from the original on 25 فبراير 2009. اطلع عليه بتاريخ 6 يناير 2013. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: BOT: original-url status unknown (link) - SUSAN S. SUAREZ, [www.andrologyjournal.org/cgi/reprint/17/4/331.pdf Hyperactivated Motility in Sperm], Journal of Andrology, Vol. 17, No. 4, July/August 1996> PDF file
- بوابة علم الأحياء
- بوابة طب
- بوابة علم الجنس
 صور وملفات صوتية من كومنز
صور وملفات صوتية من كومنز
