هيدروكسيلاز الحمض الأميني العطري المعتمد على البيوبتيرين
هيدروكسيلاز الحمض الأميني العطري المعتمد على البيوبتيرين واختصارا (AAAH) هي عائلة من إنزيمات الأحماض الأمينية العطرة التي تشمل: هيدروكسيلاز الفينيل ألانين، هيدروكسيلاز التيروسين وهيدروكسيلاز التريبتوفان. تقوم هذه الإنزيمات بإضافة مجموعة هيدروكسيل للأحماض الأمينية L-فينيل ألانين، L-تيروسين، L-تريبتوفان على التوالي.
| Biopterin_H | |
|---|---|
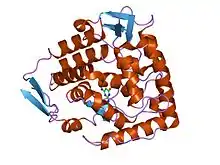 | |
| البنية البلورية لمركب ثالثي للنطاق المحفز من هيدروكسيلاز الفينيل ألانين البشري (Fe(II)) في مركب مع رباعي هيدرو البيوبترين و النورليوسين. | |
| معرف | |
| رمز | Biopterin_H |
| قاعدة بيانات عوائل البروتينات | PF00351 |
| إنتربرو | IPR019774 |
| بروسايت | PDOC00316 |
| قاعدة بيانات التصنيف الهيكلي للبروتينات | 1toh |
إنزيمات AAAH هي بروتينات ذات صلة وظيفية وبنيوية وتعمل كمحفزات محدِّدة للمعدل في مسارات أيضية مهمة.[1] يحتوي كل أنزيم من AAAH على الحديد ويحفز إضافة هيدروكسيل في الحلقة العطرية للأحماض الأمينية العطرية باستخدام رباعي هيدرو البيوبتيرين (BH4) كركيزة. تُنظَّم إنزيمات الـAAAH عبر فسفرة السيرين في نهاياتها الأمينية.
الدور في الأيض
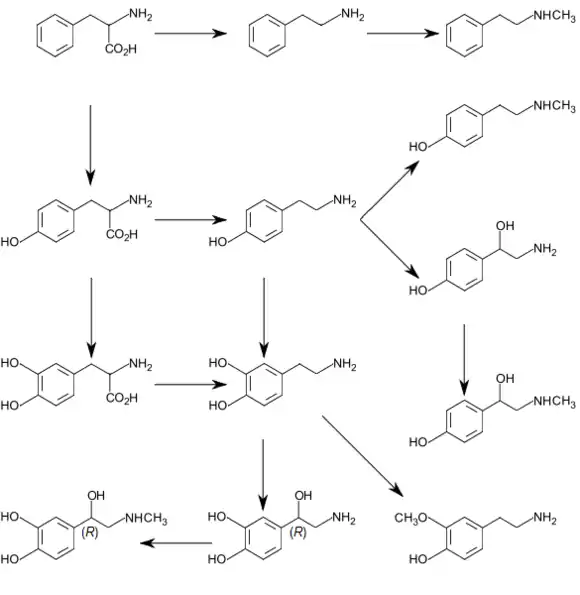
لدى البشر، يمكن أن يسبب عوز هيدروكسيلاز الفينيل ألانين بيلة الفينيل كيتون، وهو أشهر خطأ وراثي في أيض الأحماض الأمينية.[2] يحفز هيدروكسيلاز الفينيل ألانين تحويل L-فينيل ألانين إلى L-تيروسين. يحفز هيدروكسيلاز التيروسين مرحلة تحديد المعدل في التخليق الطبيعي للكاتيكولامينات: تحويل L-تيروسين إلى L-دوبا. بشكل مماثل يحفز هيدروكسيلاز التريبتوفان مرحلة تحديد المعدل في تخليق السيروتونين: تحويل L-تريبتوفان إلى 5-هيدروكسي-L-تريبتوفان.
البنية
تم اقتراح أن كل إنزيم من إنزيمات AAAH يحتوي على نطاق تحفيزي (C) محفوظ في النهاية الكربوكسيلية ونطاق تنظيمي (R) غير ذي صلة به في النهاية الأمينية. من الممكن أن النطاق التنظيمي نشأ من جينات تم توظيفها من مصادر مختلفة لتوليفها ومكاملتها مع الجين الأصلي الخاص بالنطاق المحفز. وعليه، بالتكامل مع نفس النطاق التحفيزي، حصلت هذه الإنزيمات على خصائصها التنظيمية الفريدة التي توفرها نطاقاتها التنظيمية المختلفة.
مراجع
- Grenett HE, Ledley FD, Reed LL, Woo SL (August 1987). "Full-length cDNA for rabbit tryptophan hydroxylase: functional domains and evolution of aromatic amino acid hydroxylases". Proc. Natl. Acad. Sci. U.S.A. 84 (16): 5530–4. doi:10.1073/pnas.84.16.5530. PMC 298896. PMID 3475690. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Erlandsen H, Fusetti F, Martinez A, Hough E, Flatmark T, Stevens RC (December 1997). "Crystal structure of the catalytic domain of human phenylalanine hydroxylase reveals the structural basis for phenylketonuria". Nat. Struct. Biol. 4 (12): 995–1000. doi:10.1038/nsb1297-995. PMID 9406548. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Broadley KJ (March 2010). "The vascular effects of trace amines and amphetamines". Pharmacol. Ther. 125 (3): 363–375. doi:10.1016/j.pharmthera.2009.11.005. PMID 19948186. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Lindemann L, Hoener MC (May 2005). "A renaissance in trace amines inspired by a novel GPCR family". Trends Pharmacol. Sci. 26 (5): 274–281. doi:10.1016/j.tips.2005.03.007. PMID 15860375. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Wang X, Li J, Dong G, Yue J (February 2014). "The endogenous substrates of brain CYP2D". Eur. J. Pharmacol. 724: 211–218. doi:10.1016/j.ejphar.2013.12.025. PMID 24374199. الوسيط
|CitationClass=تم تجاهله (مساعدة)
- بوابة علم الأحياء الخلوي والجزيئي
- بوابة الكيمياء الحيوية