استحداث الجلوكوز
استحداث الغلوكوز[1][2][3][4] أو دورة تخليق الجلوكوز أو استحداث السكر (بالإنجليزية: Gluconeogenesis) هي الدورة التي يتم فيها تخليق الجلوكوز من مواد كربونية غير سكرية مثل البيروفات والاكتات والجليسرول والأحماض الأمينية الجلوكوجينية. تتم غالبية الدورة في الكبد وإلى حد بسيط في قشرة الكليتين. تحدث هذه العملية خلال فترات الصيام والمجاعات أو التمرينات العنيفة. غالبا ما تكون مصحوبة بالكيتوسيس.
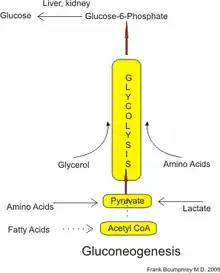
وهذه الركائز تأتي من تكسير البروتينات إلى الأحماض الأمينية الجلوكوجينية (على الرغم أنها ليست الأحماض الأمينية الكيتونية)؛ من تكسير الدهون (مثل الدهون الثلاثية)، مثل الجلسرين (وإن لم يكن حمضاً دهنياً )، ومن الخطوات الأخرى في عملية التمثيل الغذائي فإنها تشمل البيروفات واللاكتات.
استحداث الغلوكوز هي واحدة من العديد من الآليات الرئيسية التي يستخدمها البشر والعديد من الحيوانات لتنظيم مستويات السكر في الدم، وتجنب المستوى المنخفض أي (نقص السكر في الدم). وتشمل وسائل أخرى منها تكسير الجليكوجين (انحلال الجليكوجين) وهدم الأحماض الدهنية.
استحداث الغلوكوز هي عملية تحدث في كل مكان، موجودة في النباتات والحيوانات والفطريات والبكتيريا والكائنات الدقيقة الأخرى.[5] أما في الفقاريات، تحدث بشكل أساسي في الكبد، وبدرجة أقل، في قشرة الكلى. في كثير من الحيوانات الأخرى كالحيوانات المجترة[6]، تحدث هذه العملية خلال فترات الصيام والجوع و الوجبات الغذائية منخفضة الكربوهيدرات، أو ممارسةالتمارين الرياضية المكثفة.
وهذه العملية هي ماصة للطاقة بشكل عالي إلى أن يقترن بالتحلل المائي لجزيئات الطاقة (أدينوسين ثلاثي الفوسفات و أدينوسين ثنائي الفوسفات ) مما يجعلها عملية طاردة للطاقة بشكل فعال. على سبيل المثال، يتطلب المسار المؤدي من البيروفات إلى الجلوكوزسداسي الفوسفات لأربع جزيئات من الأدينوسين الثلاثي الفوسفات وجزيئين من الأدينوسن الثنائي الفوسفات للمضي قدما. وغالبا ما ترتبط هذه العملية بأجسام تدعى الكيتوز.
يهدف استحداث الغلوكوز أيضا إلى علاج النوع الثاني من داء السكري، مثلاً الأدوية المضادة للسكري، و الميتفورمين الذي يمنع تكوين سكر الجلوكوز ويحفز امتصاصه من الخلايا.[7] أما في الحيوانات المجترة، يحدث استحداث الغلوكوز بغض النظر عن الصيام، والوجبات الغذائية منخفضة الكربوهيدرات، وممارسة الرياضة، الخ، لأن الكربوهيدرات الغذائية تميل إلى أن يتم هضمها من قبل هذه الكائنات.[8]
الركائز الرئيسية
من النواتج الرئيسية في البشر لعملية استحداث الغلوكوز هي اللاكتات و الجلسرين (الذي هو جزء من جزيء ثلاثي الجليسيرول) والألانين والغلوتامين.
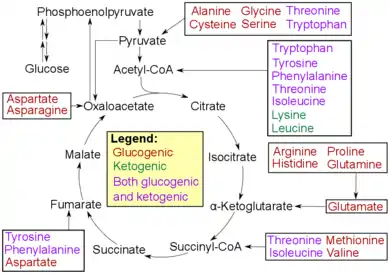
إجمالا، هذه النواتج تشكل أكثر من 90% من إجمالي نسبة نواتج العملية.[9] أما الأحماض الأمينية والمكونات الوسطية الناتجة خلال دورة حمض الستريك ، والتي تتحول إلى الأوكسالوأسيتيت، يمكن أن تعمل أيضا كركائز تساعد في تكوين الجلوكوز.[10] أما في الحيوانات المجترات، فإن مادة البروبيونات هي الركيزة الرئيسية لإنتاج الغلوكوز.[11] ولكن استهلاك هذه الركائز من الغذاء لا تؤدي إلى زيادة عملية استحداث الغلوكوز.[12]
بعدها يتم نقل اللاكتات مرة أخرى إلى الكبد حيث يتم تحويلها إلى البيروفات بواسطة حلقة كوري(دورة كوري) باستخدام إنزيم محلل اللاكتات. وبهذا يمكن استخدام البيروفيت لإنتاج الغلوكوز.[13]
إن عملية انتقال أو إزالة مجموعة الأمين (أي المكونة من النيتروجين) من الأحماض الأمينية تسهل من دخول هيكلها الكربوني إلى الدورة إما بشكل مباشر (أي على شكل البيروفات أو الأوكسالأسيتات) أو بشكل غير مباشرعن طريق دورة حمض الستريك.
وإن اللاكتات الناتج عن حلقة كوري يساهم في زيادة الإنتاج الكلي من الغلوكوز خلال مدة الصيام.[14] على وجه التحديد، بعد 12 و 20 و 40 ساعة من الصيام من قبل متطوعين بشريين، كانت مساهمة اللاكتات من دورة كوري في إنتاج الغلوكوز هي 41٪، 71٪، و 92% على الترتيب.[14]
وإن عملية "ما إذا كان يمكن تحويل الأحماض الدهنية ذات السلسلة المتسلسلة إلى جلوكوز في الحيوانات" كانت سؤالًا طويلًا في الكيمياء الحيوية. ومن المعروف أن الأحماض الدهنية ذات السلسلة الفردية يمكن أن تتأكسد لتنتج مركب propionyl-CoA، الذي ينتج فيما بعد مركب ا لـ succinyl-CoA، والذي يمكن تحويله إلى البيروفات لتدخل في تكوين الجلوكوز.
أما في النباتات، وخاصة الأشتال، يمكن استخدام دورة الغليوكسيلات لتحويل الأحماض الدهنية (الأسيتات) إلى مصدر الكربون الأساسي للكائن الحي. تنتج دورة glyoxylate أحماض كربوكسيلية رباعية الكربون يمكن أن تدخل عملية إنتاج الجلوكوز.
أما في عام 1995، حدد الباحثون دورة الغليكوسيلات في الديدان الخيطية.[15] بالإضافة إلى ذلك، تم العثور على أنزيمات الغليوكسيليت malate synthhase و lyase isocitrate في أنسجة الحيوانات.[16] وقد تم التعرف على تشفير الجينات لانزيم سينثاز مالات في غيرها من الحيوانات المختلفة الخلايا metazoans بما في ذلك المفصليات و نجم البحر، وحتى بعض الفقاريات.كما وجد أن الثدييات تشتمل على هذه الجينات أحادية النواة مثل (خلد الماء) والجرابيات (أبوسوم) ولكن ليسالثدييات المشيمية. تم العثور على جينات لاليز isucitrate فقط في الديدان الخيطية، والتي، من الواضح، أنها نشأت في نقل الجينات الأفقي من البكتيريا
لم يتم تأسيس وجود دورات الغليوكسيلات في البشر، ومن المعتقد على نطاق واسع أن الأحماض الدهنية لا يمكن تحويلها إلى الجلوكوز في البشر مباشرة. ومع ذلك، فقد تبين أن المركبات المكونة من أربعة عشر كربونة يتحول إلى الجلوكوز عندما تتوفر وتتواجد الأحماض الدهنية. على الرغم من هذه النتائج، فإنه من غير المحتمل أن ينتج مركب الأسيتيل مرافق الانزيم أ acetyl-CoA المشتق من أكسدة الأحماض الدهنية إنتاجية صافية من الجلوكوز عن طريق دورة حمض الستريك ولكن على أية حال، يمكن تحويل الأسيتيل مرافق الانزيم أ إلى البيروفات واللاكتات خلال مسار الكيتون. ببساطة، يستخدم حمض الأسيتيك (على شكل الأسيتيل مرافق الانزيم أ ) لإنتاج الجلوكوز جزئياً. يمكن لمجموعات الأسيتيل فقط أن تشكل جزءًا من جزيئات الجلوكوز (وليس ذرة الكربون الخامسة) وتتطلب ركائز إضافية (مثل البيروفات) لتشكيل بقية جزيء الجلوكوز. ولكن طريق الممر الدائري يؤدي من الأسيتيل مرافق الانزيم أ إلى البيروفيت، عبر الأسيتواسيتات والأسيتون والهيدروكسي أسيتون (الأسيتول) ومن ثم إما بروبيلين جليكول أو ميثيل جليوكسال.[17][18][19]
المسار
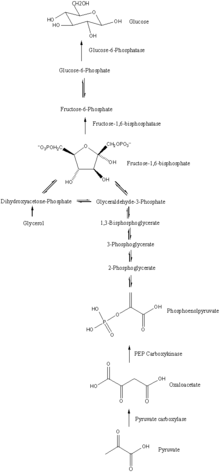
استحداث الغلوكوز هو مسار يتكون من سلسلة من أحد عشر تفاعلاً محفز الانزيم. يبدأ المسار إما في الكبد أو الكلية، في الميتوكوندريا أو السيتوبلازم لهذه الخلايا، وهذا يعتمد على الركيزة المستخدمة. العديد من التفاعلات هي عكس الخطوات الموجودة في تحلل السكر( تحلل الجلوكوز).
يبدأ استحداث الغلوكوز في الميتوكوندريا مع تشكيل مركب الأوكسالوأسيتيت oxaloacetate بواسطة عملية إضافة مجموعة الكربوكسيل carboxylation من البيروفات. هذا التفاعل يتطلب أيضا جزيء واحد من الأدينوسين ثلاثي الفوسفات ATP، ويتم تحفيزه بواسطة انزيم يدعى كربوكسيلاس بيروفات pyruvate carboxylase . و يتم تحفيز هذا الإنزيم من خلال التركيز العالي من مركب الأسيتيل مرافق الانزيم أ (الذي ينتج من عملية الأكسدة أكسدة الحمض الدهني في الكبد) ويتم تثبيطه بواسطة مستويات وتراكيز عالية من الأدينوسين ثنائي الفوسفات ADP و الجلوكوز.
الموقع
في الثدييات، يعتقد أن استحداث الجلوكوز يقتصر على الكبد[20]، الكلى[20]، الأمعاء[21] و العضلات، ولكن الأدلة الأخيرة تشير إلى حدوث استحداث الجلوكوز في الخلايا النجمية في الدماغ.[22] حيث ان هذه الاعضاء تستخدم سلائف مختلفة لاستحداث الجلوكوز حيث ان الكبد يفضل استخدام اللاكتات( lactate) والألانين( alanine) والجليسرول (وخاصة الألانين) في حين أن الكلى تفضل استخدام اللاكتات ( lactate)والجلوتامين والجليسرول (وخاصة الجلوتامين) (glutamine).[23]
حيث ان اللاكتات من دورة كوري هو أكبر مصدر لتكوبن الجلوكوز وخاصة بالنسبة للكلية. و يستخدم الكبد كلا من تحلل الجليكوجين واستحداث الجلوكوز لإنتاج الجلوكوز، في حين تستخدم الكلى فقط استحداث الجلوكوز..
بعد وجبة الطعام، يقوم الكبد بتكوين الجليكوجين، في حين أن الكلية تزيد من نسبة الجلوكوز.[24] حيث ان الأمعاء تستخدم غالبا الجلوتامين( glutamine) والجليسيرول(glycerol).
.البروبيونات (Propionate )هي الركيزة الأساسية لاستحداث الجلوكوز في كبد المجترات، ويقوم كبد المجترات بزيادة استخدام الأحماض الأمينية الجلوكوزية مثل الألانين وذلك عندما يزداد الطلب على الجلوكوز.[25]
و ان قدرة خلايا الكبد على استخدام اللاكتات من أجل استحداث الجلوكوز تقل من المرحلة البحتة إلى مرحلة المجترات في العجول والحملان[26] و في النسيج الكلوي للاغنام، ولوحظت معدلات عالية جدا لتكوين الجلوكوز من بروبيونات.[27]
في جميع الأنواع يقتصر تكوين الاوكسالواسيتيت ( oxaloacetate) في الميتوكندريا من البيروفيت ( pyruvate ) و دورة حمض الستريك. حيث يوجد في العصارة الخلوية الانزيمات التي تحوِّل حمض فوسفوفينيل بيروفيت( Phosphoenolpyruvic acid ) (PEP)إلى جلوكوز.[28]
إن موقع الإنزيم الذي يربط هذين الجزأين لإنتاج الجلوكوز يقوم بتحويل الاوكسالواسيتيت(oxaloacetate) إلى فوسفوفينيل بيروفيت(PEP) - فوسفوفينيل بيروفيت كربوكسي كاينيز( PEP carboxykinase) (PEPCK) و يمكن العثور عليه بشكل كامل داخل الميتوكندريا و أيضا داخل العصارة الخلوية[29]، أو يتوزع بالتساوي بين الاثنين، كما هو الحال في البشر.
و ينتقل فوسفوفينيل بيروفيت (Phosphoenolpyruvic acid )عبر غشاء الميتوكندريا بواسطة بروتينات نقل مخصصة لذلك ومع ذلك لا توجد مثل هذه البروتينات يمتلكها الاوكسالواسيتيات (oxaloacetate).[29]
لذلك في الأنواع التي تفتقر إلى فوسفوفينيل بيروفيت كربوكسي كاينيز(PEP carboxykinase) (PEPCK) داخل الميتوكندريا يجب تحويل الاوكسالواسيتيت إلى ماليت (malate ) أو أسبرتيت(aspartate) تنتقل من الميتوكندريا و يتم تحويلها مرة أخرى إلى اوكسالواسيتيت للسماح باستمرار عملية استحداث الجلوكوز.[29]
التنظيم
في حين أن معظم الخطوات في استحاث الجلوكوز هي عكس تلك الموجودة في تحلل الجلوكوز(glycolysis)، فإن ثلاثة تفاعلات قوية ماصة للطاقة يتم استبدالها بتفاعلات أكثر إيجابية من الناحية الحركية.
هيكسوكاينيز/جلوكوكانيز ( Hexokinase/glucokinase )، فوسفوفركتوكاينيز ( phosphofructokinase)، ويتم استبدال انزيم البيروفيت كاينيز ( pyruvate kinase )من تحلل الجلوكوز بانزيم جلوكوز -6-فوسفاتيز(glucose-6-phosphatase)، فركتوز-1،6 – بيسفوسفاتيز( fructose-1,6-bisphosphatase)، و فوسفوفينيل بيروفيت كربوكسي كاينيز/بيروفيت كربوكسي كاينيز( PEP)( carboxykinase/pyruvate carboxylase. ).
يتم تنظيم هذه الإنزيمات عادة عن طريق جزيئات مماثلة، ولكن مع نتائج معاكسة. على سبيل المثال، يقوم كل من اسيتيل مرافق الانزيم – أ- ( acetyl CoA ) و السيتريت(citrate) بتنشيط انزيمات تكوبن الجلوكوز (بيروفيت كربوكسيليز(pyruvate carboxylase) و فركتوز-1,6 – بيسفوسفاتيز( fructose-1,6-bisphosphatase)، على التوالي . بينما تمنع في نفس الوقت تثبيط إنزيم البيروفيت كاينيز (pyruvate kinase).يسمح نظام التحكم التبادلي بتحلل الجلوكوز واستحداث الجلوكوز لتثبيط بعضهما البعض ويمنع الدورة الغير مجدية(الحلقة المفرغة) ( futile cycle ) لتكوين الجلوكوزو ذلك من اجل تكسيره فقط.
تم العثور على غالبية الانزيمات المسؤولة عن تكوين الجلوكوز في العصارة الخلوية. حيث ان الاستثناءات كانت في انزيم البيروفيت كربوكسيليز(pyruvate carboxylase) في الميتوكندريا وانزيم فوسفوفينيل بيروفيت كربوكسي كاينيز( phosphoenolpyruvate carboxykinase) في الحيوانات. حيث يوجد انزيم فوسفوفينيل بيروفيت كربوكسي كاينيز( phosphoenolpyruvate carboxykinase) في كل من الميتوكندريا و العصارة الخلوية..[30]
و يتم التحكم في معدل تكوين الجلوكوز في النهاية من خلال عمل إنزيم رئيسي و هو فركتوز-1،6-بيسفوسفاتيز، والذي يتم تنظيمه أيضًا من خلال نقل الإشارة بواسطة أحادي فوسفات الأدينوسين الحلقي وفسفرته(phosphorylation).
جيث يتم التحكم في تنظيم تكوين الجلوكوز عن طريق الجلوكاجون (يتم افرازه عند انخفاض مستوى الجلوكوز في الدم) ؛ و هذا يسبب فسفرة الإنزيمات والبروتينات المنظمة من قبل بروتين كاينيز ألفا( Protein Kinase ) (أحادي فوسفات الأدينوسين الحلقي منظم الكاينيز) مما يؤدي إلى تثبيط تحلل السكر وتحفيز تكوينه.
حيث ان الانسولين يقاوم الجلوكاجون عن طريق تثبيط استحداث الجلوكوز. حيث ان النوع الثاني من داء السكري يتميز بزيادة الجلوكاجون ومقاومته للأنسولين في الجسم.[31] لم يعد الأنسولين يمنع تعبير الجينات للأنزيمات مثل فوسفوفينيل بيروفيت كربوكسي كاينيز(PEPCK ) و هذا يؤدي إلى ارتفاع السكر في الدم.[32]
وقد أظهرت الدراسات الحديثة إلى أن عدم وجود إنتاج الجلوكوز في الكبد ليس له تأثير كبير على تنظيم تركيز الجلوكوز في البلازما اثناء الصوم. يحدث التأثير التعويضي لتكوين الجلوكوز في الكليتين والأمعاء بواسطة الغلوكاجون (glucagon)، الجلايكورتيكويد ( glucocorticoids)، و الاحماض (acidosis.).[33]
انظر أيضاً
المراجع
- المعجم الطبي. نسخة محفوظة 03 يناير 2018 على موقع واي باك مشين.
- Mithieux G, Rajas F, Gautier-Stein A (2004). "A novel role for glucose 6-phosphatase in the small intestine in the control of glucose homeostasis". The Journal of Biological Chemistry. 279 (43): 44231–44238. doi:10.1074/jbc.R400011200. PMID 15302872. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Nuttall FQ, Ngo A, Gannon MC (2008). "Regulation of hepatic glucose production and the role of gluconeogenesis in humans: is the rate of gluconeogenesis constant?". DIABETES/METABOLISM RESEARCH AND REVIEWS. 24 (6): 438–458. doi:10.1002/dmrr.863. PMID 18561209. مؤرشف من الأصل (PDF) في 9 ديسمبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Gerich JE (2010). "Role of the kidney in normal glucose homeostasis and in the hyperglycaemia of diabetes mellitus: Therapeutic implications". Diabetic Medicine. 27 (2): 136–142. doi:10.1111/j.1464-5491.2009.02894.x. PMID 20546255. الوسيط
|CitationClass=تم تجاهله (مساعدة) - David L Nelson; Michael M Cox (2000). Lehninger Principles of Biochemistry. USA: Worth Publishers. p. 724. ISBN 1-57259-153-6.
- Young JW (1977). "Gluconeogenesis in cattle: significance and methodology". J. Dairy Sci. 60 (1): 1–15. doi:10.3168/jds.S0022-0302(77)83821-6. PMID 320235
- Hundal RS, Krssak M, Dufour S, Laurent D, Lebon V, Chandramouli V, Inzucchi SE, Schumann WC, Petersen KF, Landau BR, Shulman GI (2000). "Mechanism by Which Metformin Reduces Glucose Production in Type 2 Diabetes". Diabetes. 49 (12): 2063–69. doi:10.2337/diabetes.49.12.2063. PMC 2995498 . PMID 11118008
- Beitz, D. C. 2004. Carbohydrate metabolism. In: Reese, W. O. Dukes' physiology of domestic animals. 12th ed. Cornell Univ. Press. pp. 501–15.
- Gerich JE, Meyer C, Woerle HJ, Stumvoll M (2001). "Renal gluconeogenesis: Its importance in human glucose homeostasis" (PDF). Diabetes Care.
- Garrett, Reginald H.; Charles M. Grisham (2002). Principles of Biochemistry with a Human Focus. USA: Brooks/Cole, Thomson Learning. pp. 578, 585.
- Van Soest, P. J. 1994. Nutritional ecology of the ruminant. 2nd Ed. Cornell Univ. Press. 476 pp.
- Nuttall FQ, Ngo A, Gannon MC (2008). "Regulation of hepatic glucose production and the role of gluconeogenesis in humans: is the rate of gluconeogenesis constant?"(PDF). Diabetes/metabolism Research and Reviews.
- H., Garrett, Reginald (2002). Principles of biochemistry : with a human focus. Fort Worth: Harcourt College Publishers. ISBN 0030973694. OCLC 47844354. مؤرشف من الأصل في 10 ديسمبر 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Katz J, Tayek JA (1998). "Gluconeogenesis and the Cori cycle in 12-, 20-, and 40-h-fasted humans". American Journal of Physiology. 275 (3 Pt 1): E537–42. PMID 9725823.
- Liu F, Thatcher JD, Barral JM, Epstein HF (1995). "Bifunctional glyoxylate cycle protein of Caenorhabditis elegans: a developmentally regulated protein of intestine and muscle". Developmental Biology. 169 (2): 399–414
- Kondrashov FA, Koonin EV, Morgunov IG, Finogenova TV, Kondrashova MN (2006).
- Ruddick JA (1972). "Toxicology, metabolism, and biochemistry of 1,2-propanediol". Toxicol App Pharmacol. 21: 102–11. doi:10.1016/0041-008X(72)90032-4
- Miller ON, Bazzano G; Bazzano (1965). "Propanediol metabolism and its relation to lactic acid metabolism". Ann NY Acad Sci. 119 (3): 957–73. Bibcode:1965NYASA.119..957M. doi:10.1111/j.1749-6632.1965.tb47455.x. PMID 4285478.
- Glew RH (2010). "You can get there from here: acetone, anionic ketones and even-carbon fatty acids can provide substrates for gluconeogenesis". Niger J Physiol Sci. 25 (1): 2–4. PMID 22314896.
- P., Widmaier, Eric (2006). Vander's human physiology : the mechanisms of body function (الطبعة 10 ed.). Boston: McGraw-Hill. ISBN 0072827416. OCLC 57002446. مؤرشف من الأصل في 10 ديسمبر 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: نص إضافي (link) - Mithieux G, Rajas F, Gautier-Stein A (2004). "A novel role for glucose 6-phosphatase in the small intestine in the control of glucose homeostasis". The Journal of Biological Chemistry. 279 (43): 44231–38. doi:10.1074/jbc.R400011200. PMID 15302872. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Yip J, Geng X, Shen J, Ding Y (2017). "Cerebral Gluconeogenesis and Diseases". Frontiers in Pharmacology. 7: 521. doi:10.3389/fphar.2016.00521. PMC 5209353. PMID 28101056. مؤرشف من الأصل في 02 ديسمبر 2017. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Gerich JE (2010). "Role of the kidney in normal glucose homeostasis and in the hyperglycaemia of diabetes mellitus: Therapeutic implications". Diabetic Medicine. 27 (2): 136–142. doi:10.1111/j.1464-5491.2009.02894.x. PMC 4232006. PMID 20546255. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Nuttall FQ, Ngo A, Gannon MC (2008). "Regulation of hepatic glucose production and the role of gluconeogenesis in humans: is the rate of gluconeogenesis constant?" (PDF). Diabetes/metabolism Research and Reviews. 24 (6): 438–58. doi:10.1002/dmrr.863. PMID 18561209. مؤرشف من الأصل (PDF) في 28 يوليو 2017. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Overton, T. R., J. K. Drackley, C. J. Ottemann-Abbamonte, A. D. Beaulieu, L. S. Emmert and J. H. Clark. 1999. Substrate utilization for hepatic gluconeogenesis is altered by increased glucose demand in ruminants. J. Anim. Sci. 77: 1940–51.
- Donkin, S. S. and L. E. Armentano. 1995. Insulin and glucagon regulation of gluconeogenesis in preruminating and ruminating bovine. J. Anim. Sci. 73: 546–51.
- Donkin SS, Armentano LE (1995). "Insulin and glucagon regulation of gluconeogenesis in preruminating and ruminating bovine". J. Anim. Sci. 73 (2): 546–51. PMID 7601789. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Voet, Donald; Judith Voet; Charlotte Pratt (2008). Fundamentals of Biochemistry. John Wiley & Sons Inc. صفحة 556. ISBN 978-0-470-12930-2. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Donald., Voet, (2008). Fundamentals of biochemistry : life at the molecular level (الطبعة 3rd ed). Hoboken, NJ: Wiley. ISBN 9780470129302. OCLC 212432597. مؤرشف من الأصل في 10 ديسمبر 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة)CS1 maint: extra punctuation (link) صيانة CS1: نص إضافي (link) - Chakravarty K, Cassuto H, Reshef L, Hanson RW (2005). "Factors that control the tissue-specific transcription of the gene for phosphoenolpyruvate carboxykinase-C". Crit. Rev. Biochem. Mol. Biol. 40 (3): 129–54. doi:10.1080/10409230590935479. PMID 15917397. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Metformin and Insulin Suppress Hepatic Gluconeogenesis through Phosphorylation of CREB Binding Protein". Cell (باللغة الإنجليزية). 137 (4): 635–646. 2009-05-15. doi:10.1016/j.cell.2009.03.016. ISSN 0092-8674. مؤرشف من الأصل في 10 ديسمبر 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Hatting, Maximilian; Tavares, Clint D.J.; Sharabi, Kfir; Rines, Amy K.; Puigserver, Pere (2017-09-03). "Insulin regulation of gluconeogenesis". Annals of the New York Academy of Sciences (باللغة الإنجليزية). 1411 (1): 21–35. doi:10.1111/nyas.13435. ISSN 0077-8923. مؤرشف من الأصل في 10 ديسمبر 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Mutel E, Gautier-Stein A, Abdul-Wahed A, Amigó-Correig M, Zitoun C, Stefanutti A, Houberdon I, Tourette JA, Mithieux G, Rajas F (2011). "Control of blood glucose in the absence of hepatic glucose production during prolonged fasting in mice: induction of renal and intestinal gluconeogenesis by glucagon". Diabetes. 60 (12): 3121–31. doi:10.2337/db11-0571. PMC 3219939. PMID 22013018. الوسيط
|CitationClass=تم تجاهله (مساعدة)
.
- بوابة الكيمياء الحيوية
- بوابة الكيمياء
- بوابة طب
 صور وملفات صوتية من كومنز
صور وملفات صوتية من كومنز
