نظام المكافأة في الدماغ
"نظام المكافأة" هو مجموعة من الهياكل العصبية المسؤولة عن سمة الحوافز (أي الدافع والرغبة في المكافأة) والتعلم التعاوني (في المقام الأول التعزيز الإيجابي والإشراط كلاسيكي)، والمشاعر الإيجابية، وخاصة تلك التي تنطوي على المتعة كمكوّن أساسي.[1][2] المكافأة هي خاصية جذّابة وتحفيزية للمؤثر الذي يحفز سلوك الشهيّة -المعروف أيضًا باسم سلوك النهج- والسلوك الإكليلي.[1] وقد وصفت دراسة في علم الأعصاب المحفز المجزي (أي "المكافأة")، بأنه هو أي مؤثر أو حدث أو نشاط، يكون لديه القدرة على جعلنا نقترب منه ونستهلكه."[1][1][1] والمكافأة الأوليّة هي تلك اللازمة لبقاء الذات والذرية، وتشمل المحفزات الوضعية (مثل استساغة الغذاء والتناسلية (على سبيل المثال، الاتصال الجنسي والرعاية الأبوية).[1][3] المكافآت الجوهرية الداخلية هي مكافآت جذابة غير مشروطة تحفز السلوك لأنها ممتعة بطبيعتها.[1] المكافآت الخارجية (على سبيل المثال، المال) هي مكافآت مشروطة جذابة وتحفز السلوك، ولكنها ليست ممتعة بطبيعتها.[1] وتستمد المكافآت الخارجية قيمتها التحفيزية نتيجة التعلم التعاوني (أي التكييف) مع المكافآت الجوهرية.[1] قد تحصل المكافآت الخارجية أيضا على المتعة (على سبيل المثال، من كسب الكثير من المال في اليانصيب) بعد إشراط كلاسيكي مع المكافآت الجوهرية.[1]
|
البقاء على قيد الحياة لمعظم أنواع الحيوانات يعتمد على تعظيم الاتصال مع المحفزات المفيدة وتقليل الاتصال مع المحفزات الضارة. نظام المكافأة وإدراكه يعمل على زيادة احتمال البقاء على قيد الحياة والتكاثر من خلال التسبب في التعلم التجمعي، واستحضار النهج والسلوك التراكمي، وإثارة المشاعر الإيجابية.[1]
تعريف النظام
| فهرس الإدمان والاعتمادية[4][5][6][7] | |
|---|---|
| |
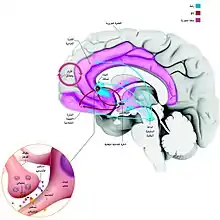
في علم الأعصاب، فإن نظام المكافأة هو عبارة عن مجموعة من هياكل الدماغ والمسارات العصبية التي هي مسؤولة عن الإدراك، بما في ذلك التعلم التعاوني(في المقام الأول الإشراط الكلاسيكي والتعزيز الفعال، (أي التحفيز و "الرغبة" في المكافأة) والمشاعر الإيجابية، ولا سيما العواطف التي تنطوي على المتعة.[1][2]
ْالمصطلحات التي تستخدم عادة لوصف السلوك المرتبط بمكون "الرغبة" أو الرغبة في المكافأة تشكل سلوك الشهية والسلوك التحضيري والسلوك الأساسي والسلوك الاستباقي والسعي.[8] أما المصطلحات التي يشيع استخدامها لوصف السلوك المتعلق ب "الميل والحب" أو عنصر المتعة للمكافأة فإنها تشمل سلوك الأخذ والتحقيق.[8]
وتتمثل الوظائف الرئيسية الثلاث للمكافآت في قدرتها على:
- إنتاج التعلم التعاوني والتعزيز الفعال;[1]
- التأثير على صنع القرار وتحفيز سلوك النهج للمؤثرات المجزية;[1]
- لإثار المشاعر الإيجابية.[1]
الوصف التشريحي

عندما تقوم بسلوك معين تحبه، يقوم هذا النظام بمكافأتك بتفعيل الدوائر العصبية المرتبطة بالشعور بالمتعة وبذلك يحفزك على أن تقوم به مرة آخرى. المكافأة أو التحفيز هي وسيلة متجردة لوصف قيمة إيجابية أن الفرد ينسب إلى كائن. مقدار المكافأة والمتعة المتولدة تختلف وفقاً لنوع المؤثر، مثلاً: المكافأت الأولية تتعلق ببقاء الأنواع، متمثلة بالطعام والجنس، أما المكافأت الثانوية فتشمل المال والاستماع إلى الموسيقى. الإدمان لا يختلف كثيراً لأنه يولد مقداراً كبيراً من المتعة والرضى النفسي للشخص، مما يدفعه إلى طلب المزيد سواء كان إدمان مخدرات أو طعام أو تدخين أو حتى الفيسبوك؛ لأنه يعطي قيمة بصرية خاطئة للتعبير عن القيمة الذاتية أهمها الأعجاب أو المتابعة. في دراسة علمية حديثة ظهر أن تعلم لغة جديدة ممكن أن يحفز نفس مناطق المتعة كما في المقامرة أو المخدرات. حيث طُلب من المشتركين أن يدخلوا في منافسات مقامرة وآخرى لتعلم اللغة، وعند النتائج شاهد الباحثون تحفز مناطق في الدماغ اسمها (ventral striatum) نفسها المرتبطة بنظام المكأفات. وكذلك وجدوا أن الأشخاص الذين لديهم وصلات عصبية أكثر بين مناطق تعلم اللغة والمناطق المرتبطة بهذا النظام قادرين على أن يتعلموا كلمات أكثر من زملائهم. يبدو أن تعلم كلمات جديدة بطريقة مشوقة يجعلنا نتذكرها بشكل أفضل. من الأمثلة الرائعة على الإدمان هو الطعام. السبب الرئيسي لزيادة الوزن هو الإدمان على الطعام؛ لأنه يولد مقداراً من المتعة خلال تناوله. فكر بالأمر خلال جلوسك لمشاهدة التلفاز أو شعورك بالملل أو محاولة دراستك لمادة لا تحبها، يحفزك الدماغ نحو كل أنواع الأكل في العالم؛ لأن دماغك يطلب منك أن تقوم بشيء أكثر متعة.[9][10] المدهش في هذا الأمر هو أمكانية أن تُحفز نفس المنطقة خلال تعلمك لغة جديدة أو دراسة مادة تحبها أو محادثة شخص تحبه أو قيامك بسلوك تحبه، مثل الرقص أو العزف على آلة موسيقية.. آلخ. ليس لأنك لن تزداد وزناً فقط وإنما لأنك سوف تتعلم لغة جديدة أو أشياء جديدة بالأضافة إلى أنك سوف تستمتع بالأمر دون أن تشعر بمرور الوقت.[11][12][13][12] تقع هياكل الدماغ التي تشكل نظام المكافأة في حلقة تتكون من القشرة المخية والمهاد والعقد القاعدية;[14] والعقد القاعدية هي جزء من حلقة محركات النشاط داخل نظام المكافأة.[14] معظم المسارات التي تربط المكونات داخل نظام المكافأة هي أعصاب جلوتامينية، وأعصاب شوكية متوسطة، وألياف إسقاط دوبامينية.[14][15] يتضمن نظام المكافأة المنطقة السفلية البطنية، والمخطط البطني (مثل النواة المتكئة)، والمخطط الظهري (مثل النواة الذنبية و البطامة، المادة السوداء، والقشرة الأمام جبهية، والقشرة الحزامية الأمامية، وقرن آمون ونواة تحت المهاد، والمهاد، ونواة أسفل المهاد، واللوزة الدماغية والفص الجزيري.[2][14][16][17][18][19][20]
النواة المتكئة هي منطقة بالمخ اسمها باللاتينية (Nucleus accumbens) ومنطقة "النواة المتكئة" منطقة مهمة.[21][22][23] وهذه المنطقة مسؤولة عن المكافآت بالدماغ البشري، وهي تنشط عند حصول الإنسان على الطعام الجيد أو المال، كما تنشط عند حصول الشخص على سمعة جيدة وثناء ومديح لشخصه.[24] نجد أن من صفات الإنسان الرئيسية سعيه الدائم لتحسين سمعته، وتبين للباحثين أن المنطقة المسؤولة عن المكافآت بالدماغ تكون في قمة نشاطها حين يتعلق الأمر باعتراف الآخرين بالشخص وتقديرهم له وأفعاله. أما ثناؤه على الآخرين فيلعب دورا أقل في تنشيط تلك المنطقة من دماغه.[14][14][14][25][26] [27]
مراكز المتعة
المتعة هو عنصر في نظام المكافأة، ولكن ليس كل المكافآت ممتعة (على سبيل المثال، المال لا يثير المتعة ما لم تكن الاستجابة مشروط).[1] إن المحفزات الممتعة بشكل طبيعي، وبالتالي تكون جذابة، تعرف باسم المكافآت الجوهرية، في حين أن المحفزات التي تكون جذابة وتحفز سلوك النهج، ولكنها ليست ممتعة في حد ذاتها، فإنها تسمى المكافآت الخارجية.[1] المكافآت الخارجية (على سبيل المثال، المال) مجزية نتيجة التعلم التعاوني مع المكافآت الجوهرية.[1][1]
نظام المكافأة يحتوي على مراكز المتعة، وهي هياكل في الدماغ تحقق شعور المتعة أو "الميل والحب" كنتيجة لشعور داخلي. وهذه المراكز تقع في جسر فارول والنواة المتكئة،[2][28] والفص الجزيري والقشرة الجبهية الحجاجية.[2] حقن أشباه الأفيونيات والكانابينويد، ولكن ليس الدوبامين، في المنطقة الأمامية من النواة المتكئة يؤدي إلي زيادة الشعور بالحب، في حين أن الحقن في مناطق أخرى قد ينتج عنه النفور، كما يفعل جقن الدوبامين.[29][30]
الرغبة
السمة المحفزة هي "الرغبة"، والتي تتضمن عنصرا تحفيزيا، يتم تحويله إلى حافز مجزي بواسطة النواة المتكئة.[1][31][32] درجة انتقال الدوبامين في المسارات العصبية إلي النواة المتكئة ترتبط ارتباطاً وثيقاً مع درجة الحافز.
تفعيل المنطقة الظهرية من النواة المتكئة يرتبط مع زيادات في الرغبة دون زيادات متزامنة في الحب أو الميل.[29] ومع ذلك، فإن انتقال الدوبامين في النواة المتكئة ليس مسؤولاً فقط عن الشهية والرغبة في المؤثرات المجزية، ولكن العكس أيضا، حيث يوجه السلوك بعيدا عن المحفزات غير مرغوب فيها.[33][34][35][34][35][36]
تاريخه
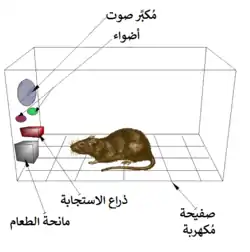
أول فكرة عن وجود نظام المكافأة في الدماغ جاءت بالصدفة مع اكتشاف من قبل جيمس أولدز وبيتر ميلنر في عام 1954. حيث اكتشفوا أن الفئران سوف تقوم ببعض السلوكيات مثل الضغط على شريط أو قطعة من الحديد، للحصول علي موجات من التحفيز الكهربائي إلى مواقع محددة في أدمغتهم. وتسمى هذه الظاهرة (التحفيز الذاتي داخل الجمجمة) أو (مكافأة التحفيز في الدماغ). الفئران سوف تضغط على الشريط أو مئات أو آلاف المرات في الساعة للحصول على هذا التحفيز في الدماغ، ولا يتوقفوا إلا عندما يتم استنفاد طاقتهم. أثناء محاولة تعليم الفئران كيفية حل المشاكل واستكشاف المتاهات بتحفيز مناطق معينة من الدماغ، وجد أن هذا التحفيز يبدو أنه يعطي المتعة للحيوانات. حاولوا نفس الشيء مع البشر وكانت النتائج متشابهة. تفسير ما حدث للحيوانات بالانخراط في سلوك لا قيمة له لبقائهم أو بقاء ذريتهم، هو أن تحفيز الدماغ هو تفعيل لنظام المكافأة.[37]
في اكتشاف أساسي في عام 1954، وجد الباحثون جيمس أولدز وبيتر ميلنر أن التحفيز الكهربائي المنخفض الجهد لبعض مناطق الدماغ في الفئران يعمل كنظام مكافأة في تعليم الحيوانات لحل المشاكل.[38][39] ويبدو أن تحفيز تلك الأجزاء من الدماغ أعطى متعة الحيوانات،[38] وفي وقت لاحق غندما قامت الأبحاث علي البشر تم ذكر أحاسيس ممتعة من مثل هذا التحفيز. عندما تم اختبار الفئران في مربع سكينر حيث يمكن أن تحفز نظام المكافأة عن طريق الضغط على رافعة، فإن الجرذان ضغطت لساعات.[39] وأثبتت الأبحاث التي أجريت في العقدين التاليين أن الدوبامين هو أحد المواد الكيميائية الرئيسية التي تساعد على الإشارة العصبية في هذه المناطق، واقترح الدوبامين ليكون "مادة كيميائية للمتعة" في الدماغ.[40][41]
الأهمية التطبيقية
الإدمان
(delta FosB) هو عامل نسخ جيني، حيث أنه هو العامل المشترك بين جميع أشكال الإدمان تقريبا (الإدمان السلوكي وإدمان المخدرات) فعندما يتم ترجمته في بعض الأعصاب الشوكية المتوسطو في النواة المتكئة، فإنه يدفع إلي السلوك المرتبط بالإدمان و اللدونة العصبية.[17][42][43][44][45][46]
علاقة الطعام بنظام المكافأة
تشير دراسة جديدة إلى أن أدمغة الأشخاص البدن (الذين يعانون من السمنة المفرطة) تنتج إشارات تشجع على الأكل حتى وإن لم يكن الجسم بحاجة للغذاء.[47] على الرغم من أن السمنة هي نتيجة تناول كميات كبيرة من الطاقة، فليس واضحاً حالياً لماذا بعض الأشخاص ميالون للإفراط في الأكل وزيادة الوزن.[48] أراد بعض الباحثين في جامعة توركو في فنلندا دراسة الاتصالات المتواجدة بين الخلايا العصبية في الدماغ لمعرفة ما إذا كانت هناك صلة بين نشاط الدماغ والسمنة. تم استعمال تقنيات تصويرية مختلفة لمقارنة نشاط دماغ الأشخاص البدن والنحفاء في مواقف مختلفة.[49] استُخدم التصوير بالرنين المغناطيسي لمراقبة نشاط الدماغ استجابة لرؤية صور مأكولات. وجد الفريق. الفنلندي أن أنظمة المكافأة لدى الأفراد البدن كانت أكثر نشاطاً وردّت بقوة أكثر لصور الأطعمة، سواء للمأكولات العالية السكر الفاتحة للشهية أو للأطعمة الصحية. وكانت الردود في المناطق المعاكسة من قشرة الدماغ، المسؤولة عن التعبير عن الشخصية، التحكم بالقرار واتخاذ القرارات، منخفضة أيضاً. وبعكس ذلك، كان لدى الأفراد الأصحاء اختلافا كبيراً في نشاط الدماغ بين الطعام الصحي والأطعمة الفاتحة للشهية، وأظهروا نشاطاً عادياً في قشرة الدماغ في الفص الجبهي الأمامي.[49] وقد بينت الدراسة كذلك أن للأفراد البدن ارتفاع في أيض. الجلوكوز في المناطق المسؤولة عن المكافأة في الدماغ مقارنةً بالأفراد النحفاء. بالإضافة إلى الرنين المغناطيسي الوظيفي، تم أيضاً استخدام التصوير المقطعي بالإصدار البوزيتروني لقياس هذا التأثير عند الأشخاص المشاركين خلال ظروف لا تكون فيها أجسادهم جائعة فعلياً.[50] والأكثر من ذلك، أظهر الأفراد البدن استجابة أكبر في الدماغ عند رؤية صور الاطعمة ونشاطا أقل في المناطق المتحكمة بالشهية والمشجعة على الشبع. وحسب ما قالت البروفسور لوري نومنما، الأستاذة المساعدة في جامعة توركو، فإن هذه النتيجة تشير إلى أن دماغ الأشخاص البدن قد يولد باستمرار إشارات تشجع على الأكل حتى ولو لم يكن الجسم يحتاج إلى استهلاك المزيد من الطاقة. “هذا يسلط الضوء على دور الدماغ في السمنة وزيادة الوزن. فقد تؤثر هذه النتائج بشكلٍ كبير على النموذج الحالي للبدانة، لكن أيضاً على صنع العلاجات الدوائية والنفسية للبدانة” تضيف الأستاذة نومنما.[51] تم ربط الخلل في نشاط الدماغ بالبدانة في الدراسات السابقة وقد اثبتت دراسات التصوير الوظيفي أن المكونات الفرعية. لدائرة المكافأة في المخ تساهم بمعالجة صور الأطعمة ويمكن ربط حدوث اختلال وظيفي في هذه الدائرة بالسمنة والإدمان على المخدرات.[52]
الدافع والمُحفز
الدافع في علم النفس هو الحالة التي تثير السلوك في ظروف معينة وتواصله حتى ينتهى إلى غاية معينة وفمثلا الطالب يذاكر دروسه بدافع الرغبة في النجاح.[53][54]
أولا: الدوافع الفطرية وهي الدوافع التي تنتقل عن طريق الوراثة فلا يحتاج الإنسان إلى اكتسابها، ويشترك الإنسان وعدد من الحيوانات في هذه الدوافع.
(الدوافع البيولوجية) وهي الدوافع التي تهدف إلى المحافظة على بقاء الفرد كالجوع والعطش والنوم.
(الدافع الجنسي) يهدف إلى المحافظة على بقاء النوع، ويعتبر من أقوى الدوافع لدى الإنسان، والدافع الجنسي مشترك عند الإنسان والحيوان، ولكن عند الحيوان يتوقف على الهرمونات التي تفرزها الغدد الجنسية فقد أتضح أن ازالة المبيض عند اناث الحيوانات يزيل الاهتمام الجنسي لديها، أما عند الإنسان فقد وجد أن ازالة الغدد الجنسية قبل البلوغ يمنع ظهور الصفات الجنسية وفقدان الدافع الجنسي، ولكن ازالتها بعد اليلوغ لا يؤثر في الدوافع الجنسية إلا قليلا.
(دافع الأمومة) ويعني العناية الصغار وحمايتهم واطعامهم، ولوحط في الحيوانات ان هذا الدافع يعتمد على هرمون البرولاكتين prolactin الذي يفرزه الفص الأمامي للغدة النخامية في وقت الحضانة، فقد لوحظ أن الفأرة غير الحبلى لا تهتم بصغار الفئران ولكن حقنها بهذا الهرمون يثير عندها دافع الأمومة ويجعلها تهتم بصغار الفئران، أما في الإنسان فلا يخضع دافع الأمومة خضوعا مباشرا لهذا الهرمون بل أنه يتضمن عوامل أخرى نفسية وأجتماعية.
(دافع الهرب)
(دافع الأستطلاع)
ثانيا: الدوافع المكتسبة
مراجع
- Schultz W (2015). "Neuronal reward and decision signals: from theories to data". Physiological Reviews. 95 (3): 853–951. doi:10.1152/physrev.00023.2014. PMC 4491543. PMID 26109341.
Rewards in operant conditioning are positive reinforcers. ... Operant behavior gives a good definition for rewards. Anything that makes an individual come back for more is a positive reinforcer and therefore a reward. Although it provides a good definition, positive reinforcement is only one of several reward functions. ... Rewards are attractive. They are motivating and make us exert an effort. ... Rewards induce approach behavior, also called appetitive or preparatory behavior, and consummatory behavior. ... Thus any stimulus, object, event, activity, or situation that has the potential to make us approach and consume it is by definition a reward. ... Rewarding stimuli, objects, events, situations, and activities consist of several major components. First, rewards have basic sensory components (visual, auditory, somatosensory, gustatory, and olfactory) ... Second, rewards are salient and thus elicit attention, which are manifested as orienting responses (FIGURE 1, middle). The salience of rewards derives from three principal factors, namely, their physical intensity and impact (physical salience), their novelty and surprise (novelty/surprise salience), and their general motivational impact shared with punishers (motivational salience). A separate form not included in this scheme, incentive salience, primarily addresses dopamine function in addiction and refers only to approach behavior (as opposed to learning) ... Third, rewards have a value component that determines the positively motivating effects of rewards and is not contained in, nor explained by, the sensory and attentional components (FIGURE 1, right). This component reflects behavioral preferences and thus is subjective and only partially determined by physical parameters. Only this component constitutes what we understand as a reward. It mediates the specific behavioral reinforcing, approach generating, and emotional effects of rewards that are crucial for the organism’s survival and reproduction, whereas all other components are only supportive of these functions. ... Rewards can also be intrinsic to behavior (31, 546, 547). They contrast with extrinsic rewards that provide motivation for behavior and constitute the essence of operant behavior in laboratory tests. Intrinsic rewards are activities that are pleasurable on their own and are undertaken for their own sake, without being the means for getting extrinsic rewards. ... Intrinsic rewards are genuine rewards in their own right, as they induce learning, approach, and pleasure, like perfectioning, playing, and enjoying the piano. Although they can serve to condition higher order rewards, they are not conditioned, higher order rewards, as attaining their reward properties does not require pairing with an unconditioned reward. ... These emotions are also called liking (for pleasure) and wanting (for desire) in addiction research (471) and strongly support the learning and approach generating functions of reward.
الوسيط|CitationClass=تم تجاهله (مساعدة) - Berridge KC, Kringelbach ML (May 2015). "Pleasure systems in the brain". Neuron. 86 (3): 646–664. doi:10.1016/j.neuron.2015.02.018. PMC 4425246. PMID 25950633.
In the prefrontal cortex, recent evidence indicates that the [orbitofrontal cortex] OFC and insula cortex may each contain their own additional hot spots (D.C. Castro et al., Soc. Neurosci., abstract). In specific subregions of each area, either opioid-stimulating or orexin-stimulating microinjections appear to enhance the number of liking reactions elicited by sweetness, similar to the [nucleus accumbens] NAc and [ventral pallidum] VP hot spots. Successful confirmation of hedonic hot spots in the OFC or insula would be important and possibly relevant to the orbitofrontal mid-anterior site mentioned earlier that especially tracks the subjective pleasure of foods in humans (Georgiadis et al., 2012; Kringelbach, 2005; Kringelbach et al., 2003; Small et al., 2001; Veldhuizen et al., 2010). Finally, in the brainstem, a hindbrain site near the parabrachial nucleus of dorsal pons also appears able to contribute to hedonic gains of function (Söderpalm and Berridge, 2000). A brainstem mechanism for pleasure may seem more surprising than forebrain hot spots to anyone who views the brainstem as merely reflexive, but the pontine parabrachial nucleus contributes to taste, pain, and many visceral sensations from the body and has also been suggested to play an important role in motivation (Wu et al., 2012) and in human emotion (especially related to the somatic marker hypothesis) (Damasio, 2010).
الوسيط|CitationClass=تم تجاهله (مساعدة) - "Dopamine Involved In Aggression". Medical News Today. 15 January 2008. مؤرشف من الأصل في 23 سبتمبر 2010. اطلع عليه بتاريخ 14 نوفمبر 2010. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Malenka RC, Nestler EJ, Hyman SE (2009). "Chapter 15: Reinforcement and Addictive Disorders". In Sydor A, Brown RY (المحررون). Molecular Neuropharmacology: A Foundation for Clinical Neuroscience (الطبعة 2nd). New York: McGraw-Hill Medical. صفحات 364–375. ISBN 9780071481274. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Nestler EJ (December 2013). "Cellular basis of memory for addiction". Dialogues Clin. Neurosci. 15 (4): 431–443. PMC 3898681. PMID 24459410.
Despite the importance of numerous psychosocial factors, at its core, drug addiction involves a biological process: the ability of repeated exposure to a drug of abuse to induce changes in a vulnerable brain that drive the compulsive seeking and taking of drugs, and loss of control over drug use, that define a state of addiction. ... A large body of literature has demonstrated that such ΔFosB induction in D1-type [nucleus accumbens] neurons increases an animal's sensitivity to drug as well as natural rewards and promotes drug self-administration, presumably through a process of positive reinforcement ... Another ΔFosB target is cFos: as ΔFosB accumulates with repeated drug exposure it represses c-Fos and contributes to the molecular switch whereby ΔFosB is selectively induced in the chronic drug-treated state.41. ... Moreover, there is increasing evidence that, despite a range of genetic risks for addiction across the population, exposure to sufficiently high doses of a drug for long periods of time can transform someone who has relatively lower genetic loading into an addict.
الوسيط|CitationClass=تم تجاهله (مساعدة) - "Glossary of Terms". Mount Sinai School of Medicine. Department of Neuroscience. اطلع عليه بتاريخ 09 فبراير 2015. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Volkow ND, Koob GF, McLellan AT (January 2016). "Neurobiologic Advances from the Brain Disease Model of Addiction". N. Engl. J. Med. 374 (4): 363–371. doi:10.1056/NEJMra1511480. PMID 26816013.
Substance-use disorder: A diagnostic term in the fifth edition of the Diagnostic and Statistical Manual of Mental Disorders (DSM-5) referring to recurrent use of alcohol or other drugs that causes clinically and functionally significant impairment, such as health problems, disability, and failure to meet major responsibilities at work, school, or home. Depending on the level of severity, this disorder is classified as mild, moderate, or severe.
الوسيط
Addiction: A term used to indicate the most severe, chronic stage of substance-use disorder, in which there is a substantial loss of self-control, as indicated by compulsive drug taking despite the desire to stop taking the drug. In the DSM-5, the term addiction is synonymous with the classification of severe substance-use disorder.|CitationClass=تم تجاهله (مساعدة) - Salamone JD, Correa M. "The Mysterious Motivational Functions of Mesolimbic Dopamine". Neuron. 76 (3): 470–485. doi:10.1016/j.neuron.2012.10.021. PMC 4450094. PMID 23141060. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Hyman, Steven E.; Malenka, Robert C.; Nestler, Eric J. (2006). "Neural mechanisms of addiction: the role of reward-related learning and memory". Annual Review of Neuroscience. 29: 565–98. doi:10.1146/annurev.neuro.29.051605.113009. PMID 16776597. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Steiner, Heinz; Van Waes, Vincent (2013). "Addiction-related gene regulation: Risks of exposure to cognitive enhancers vs. Other psychostimulants". Progress in Neurobiology. 100: 60–80. doi:10.1016/j.pneurobio.2012.10.001. PMC 3525776. PMID 23085425. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Wenzel JM, Rauscher NA, Cheer JF, Oleson EB (2015). "A role for phasic dopamine release within the nucleus accumbens in encoding aversion: a review of the neurochemical literature". ACS Chem Neurosci. 6 (1): 16–26. doi:10.1021/cn500255p. PMID 25491156. الوسيط
|CitationClass=تم تجاهله (مساعدة) -
Malenka RC, Nestler EJ, Hyman SE (2009). "Chapter 10: Neural and Neuroendocrine Control of the Internal Milieu". In Sydor A, Brown RY (المحرر). Molecular Neuropharmacology: A Foundation for Clinical Neuroscience (الطبعة 2nd). New York: McGraw-Hill Medical. صفحة 266. ISBN 978-0-07-148127-4.
Dopamine acts in the nucleus accumbens to attach motivational significance to stimuli associated with reward.
الوسيط|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) -
Malenka RC, Nestler EJ, Hyman SE (2009). Sydor A, Brown RY (المحرر). Molecular Neuropharmacology: A Foundation for Clinical Neuroscience (الطبعة 2nd). New York: McGraw-Hill Medical. صفحات 147–148, 367, 376. ISBN 978-0-07-148127-4.
VTA DA neurons play a critical role in motivation, reward-related behavior (Chapter 15), attention, and multiple forms of memory. This organization of the DA system, wide projection from a limited number of cell bodies, permits coordinated responses to potent new rewards. Thus, acting in diverse terminal fields, dopamine confers motivational salience (“wanting”) on the reward itself or associated cues (nucleus accumbens shell region), updates the value placed on different goals in light of this new experience (orbital prefrontal cortex), helps consolidate multiple forms of memory (amygdala and hippocampus), and encodes new motor programs that will facilitate obtaining this reward in the future (nucleus accumbens core region and dorsal striatum). In this example, dopamine modulates the processing of sensorimotor information in diverse neural circuits to maximize the ability of the organism to obtain future rewards. ...
الوسيط
The brain reward circuitry that is targeted by addictive drugs normally mediates the pleasure and strengthening of behaviors associated with natural reinforcers, such as food, water, and sexual contact. Dopamine neurons in the VTA are activated by food and water, and dopamine release in the NAc is stimulated by the presence of natural reinforcers, such as food, water, or a sexual partner. ...
The NAc and VTA are central components of the circuitry underlying reward and memory of reward. As previously mentioned, the activity of dopaminergic neurons in the VTA appears to be linked to reward prediction. The NAc is involved in learning associated with reinforcement and the modulation of motoric responses to stimuli that satisfy internal homeostatic needs. The shell of the NAc appears to be particularly important to initial drug actions within reward circuitry; addictive drugs appear to have a greater effect on dopamine release in the shell than in the core of the NAc.|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Yager LM, Garcia AF, Wunsch AM, Ferguson SM (August 2015). "The ins and outs of the striatum: Role in drug addiction". Neuroscience. 301: 529–541. doi:10.1016/j.neuroscience.2015.06.033. PMC 4523218. PMID 26116518.
[The striatum] receives dopaminergic inputs from the ventral tegmental area (VTA) and the substantia nigra (SNr) and glutamatergic inputs from several areas, including the cortex, hippocampus, amygdala, and thalamus (Swanson, 1982; Phillipson and Griffiths, 1985; Finch, 1996; Groenewegen et al., 1999; Britt et al., 2012). These glutamatergic inputs make contact on the heads of dendritic spines of the striatal GABAergic medium spiny projection neurons (MSNs) whereas dopaminergic inputs synapse onto the spine neck, allowing for an important and complex interaction between these two inputs in modulation of MSN activity ... It should also be noted that there is a small population of neurons in the [nucleus accumbens] NAc that coexpress both D1 and D2 receptors, though this is largely restricted to the NAc shell (Bertran- Gonzalez et al., 2008). ... Neurons in the NAc core and NAc shell subdivisions also differ functionally. The NAc core is involved in the processing of conditioned stimuli whereas the NAc shell is more important in the processing of unconditioned stimuli; Classically, these two striatal MSN populations are thought to have opposing effects on basal ganglia output. Activation of the dMSNs causes a net excitation of the thalamus resulting in a positive cortical feedback loop; thereby acting as a 'go’ signal to initiate behavior. Activation of the iMSNs, however, causes a net inhibition of thalamic activity resulting in a negative cortical feedback loop and therefore serves as a 'brake’ to inhibit behavior ... there is also mounting evidence that iMSNs play a role in motivation and addiction (Lobo and Nestler, 2011; Grueter et al., 2013). For example, optogenetic activation of NAc core and shell iMSNs suppressed the development of a cocaine CPP whereas selective ablation of NAc core and shell iMSNs ... enhanced the development and the persistence of an amphetamine CPP (Durieux et al., 2009; Lobo et al., 2010). These findings suggest that iMSNs can bidirectionally modulate drug reward. ... Together these data suggest that iMSNs normally act to restrain drug-taking behavior and recruitment of these neurons may in fact be protective against the development of compulsive drug use.
الوسيط|CitationClass=تم تجاهله (مساعدة) - Taylor SB, Lewis CR, Olive MF (2013). "The neurocircuitry of illicit psychostimulant addiction: acute and chronic effects in humans". Subst Abuse Rehabil. 4: 29–43. doi:10.2147/SAR.S39684. PMC 3931688. PMID 24648786.
Regions of the basal ganglia, which include the dorsal and ventral striatum, internal and external segments of the globus pallidus, subthalamic nucleus, and dopaminergic cell bodies in the substantia nigra, are highly implicated not only in fine motor control but also in [prefrontal cortex] PFC function.43 Of these regions, the [nucleus accumbens] NAc (described above) and the [dorsal striatum] DS (described below) are most frequently examined with respect to addiction. Thus, only a brief description of the modulatory role of the basal ganglia in addiction-relevant circuits will be mentioned here. The overall output of the basal ganglia is predominantly via the thalamus, which then projects back to the PFC to form cortico-striatal-thalamo-cortical (CSTC) loops. Three CSTC loops are proposed to modulate executive function, action selection, and behavioral inhibition. In the dorsolateral prefrontal circuit, the basal ganglia primarily modulate the identification and selection of goals, including rewards.44 The [orbitofrontal cortex] OFC circuit modulates decision-making and impulsivity, and the anterior cingulate circuit modulates the assessment of consequences.44 These circuits are modulated by dopaminergic inputs from the [ventral tegmental area] VTA to ultimately guide behaviors relevant to addiction, including the persistence and narrowing of the behavioral repertoire toward drug seeking, and continued drug use despite negative consequences.43–45
الوسيط|CitationClass=تم تجاهله (مساعدة) - Grall-Bronnec M, Sauvaget A (2014). "The use of repetitive transcranial magnetic stimulation for modulating craving and addictive behaviours: a critical literature review of efficacy, technical and methodological considerations". Neurosci. Biobehav. Rev. 47: 592–613. doi:10.1016/j.neubiorev.2014.10.013. PMID 25454360.
Studies have shown that cravings are underpinned by activation of the reward and motivation circuits (McBride et al., 2006, Wang et al., 2007, Wing et al., 2012, Goldman et al., 2013, Jansen et al., 2013 and Volkow et al., 2013). According to these authors, the main neural structures involved are: the nucleus accumbens, dorsal striatum, orbitofrontal cortex, anterior cingulate cortex, dorsolateral prefrontal cortex (DLPFC), amygdala, hippocampus and insula.
الوسيط|CitationClass=تم تجاهله (مساعدة) - Malenka RC, Nestler EJ, Hyman SE (2009). Sydor A, Brown RY, eds (المحررون). Molecular Neuropharmacology: A Foundation for Clinical Neuroscience (الطبعة 2nd). New York: McGraw-Hill Medical. صفحات 365–366, 376. ISBN 978-0-07-148127-4.
The neural substrates that underlie the perception of reward and the phenomenon of positive reinforcement are a set of interconnected forebrain structures called brain reward pathways; these include the nucleus accumbens (NAc; the major component of the ventral striatum), the basal forebrain (components of which have been termed the extended amygdala, as discussed later in this chapter), hippocampus, hypothalamus, and frontal regions of cerebral cortex. These structures receive rich dopaminergic innervation from the ventral tegmental area (VTA) of the midbrain. Addictive drugs are rewarding and reinforcing because they act in brain reward pathways to enhance either dopamine release or the effects of dopamine in the NAc or related structures, or because they produce effects similar to dopamine. ... A macrostructure postulated to integrate many of the functions of this circuit is described by some investigators as the extended amygdala. The extended amygdala is said to comprise several basal forebrain structures that share similar morphology, immunocytochemical features, and connectivity and that are well suited to mediating aspects of reward function; these include the bed nucleus of the stria terminalis, the central medial amygdala, the shell of the NAc, and the sublenticular substantia innominata.
الوسيط|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Luo M, Zhou J, Liu Z (August 2015). "Reward processing by the dorsal raphe nucleus: 5-HT and beyond". Learn. Mem. 22 (9): 452–460. doi:10.1101/lm.037317.114. PMC 4561406. PMID 26286655. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Moulton EA, Elman I, Becerra LR, Goldstein RZ, Borsook D (May 2014). "The cerebellum and addiction: insights gained from neuroimaging research". Addict. Biol. 19 (3): 317–331. doi:10.1111/adb.12101. PMC 4031616. PMID 24851284. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Caligiore D, Pezzulo G, Baldassarre G, Bostan AC, Strick PL, Doya K, Helmich RC, Dirkx M, Houk J, Jörntell H, Lago-Rodriguez A, Galea JM, Miall RC, Popa T, Kishore A, Verschure PF, Zucca R, Herreros I (February 2017). "Consensus Paper: Towards a Systems-Level View of Cerebellar Function: the Interplay Between Cerebellum, Basal Ganglia, and Cortex". Cerebellum. 16 (1): 203–229. doi:10.1007/s12311-016-0763-3. PMC 5243918. PMID 26873754. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Carlson, Neil R. Physiology of Behavior. 11th ed. Boston: Pearson, 2013. Print.
- Wise RA, Rompre PP (1989). "Brain dopamine and reward". Annual Review of Psychology. 40: 191–225. doi:10.1146/annurev.ps.40.020189.001203. PMID 2648975. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Wise RA (October 2002). "Brain reward circuitry: insights from unsensed incentives". Neuron. 36 (2): 229–240. doi:10.1016/S0896-6273(02)00965-0. PMID 12383779. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Nucleus Accumbens
- Trantham-Davidson H, Neely LC, Lavin A, Seamans JK (2004). "Mechanisms underlying differential D1 versus D2 dopamine receptor regulation of inhibition in prefrontal cortex". The Journal of Neuroscience. 24 (47): 10652–10659. doi:10.1523/jneurosci.3179-04.2004. PMID 15564581. الوسيط
|CitationClass=تم تجاهله (مساعدة) - You ZB, Chen YQ, Wise RA (2001). "Dopamine and glutamate release in the nucleus accumbens and ventral tegmental area of rat following lateral hypothalamic self-stimulation". Neuroscience. 107 (4): 629–639. doi:10.1016/s0306-4522(01)00379-7. PMID 11720786. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Kolb B, Whishaw IQ (2001). An Introduction to Brain and Behavior (الطبعة 1st). New York: Worth. صفحات 438–441. ISBN 9780716751694. مؤرشف من الأصل في 17 ديسمبر 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Richard JM, Castro DC, Difeliceantonio AG, Robinson MJ, Berridge KC (November 2013). "Mapping brain circuits of reward and motivation: in the footsteps of Ann Kelley". Neurosci. Biobehav. Rev. 37 (9 Pt A): 1919–1931. doi:10.1016/j.neubiorev.2012.12.008. PMC 3706488. PMID 23261404.
الوسيط
Figure 3: Neural circuits underlying motivated 'wanting' and hedonic 'liking'.|CitationClass=تم تجاهله (مساعدة) - Berridge KC, Kringelbach ML (1 June 2013). "Neuroscience of affect: brain mechanisms of pleasure and displeasure". Current Opinion in Neurobiology. 23 (3): 294–303. doi:10.1016/j.conb.2013.01.017. PMC 3644539. PMID 23375169.
For instance, mesolimbic dopamine, probably the most popular brain neurotransmitter candidate for pleasure two decades ago, turns out not to cause pleasure or liking at all. Rather dopamine more selectively mediates a motivational process of incentive salience, which is a mechanism for wanting rewards but not for liking them .... Rather opioid stimulation has the special capacity to enhance liking only if the stimulation occurs within an anatomical hotspot
الوسيط|CitationClass=تم تجاهله (مساعدة) - Kringelbach ML, Berridge KC (2012). "The Joyful Mind". Scientific American: 44–45. مؤرشف من الأصل (PDF) في 17 يونيو 2019. اطلع عليه بتاريخ 17 يناير 2017.
So it makes sense that the real pleasure centers in the brain – those directly responsible for generating pleasurable sensations – turn out to lie within some of the structures previously identified as part of the reward circuit. One of these so-called hedonic hotspots lies in a subregion of the nucleus accumbens called the medial shell. A second is found within the ventral pallidum, a deep-seated structure near the base of the forebrain that receives most of its signals from the nucleus accumbens. ...
الوسيط
On the other hand, intense euphoria is harder to come by than everyday pleasures. The reason may be that strong enhancement of pleasure – like the chemically induced pleasure bump we produced in lab animals – seems to require activation of the entire network at once. Defection of any single component dampens the high.
Whether the pleasure circuit – and in particular, the ventral pallidum – works the same way in humans is unclear.|CitationClass=تم تجاهله (مساعدة) - Berridge KC (April 2012). "From prediction error to incentive salience: mesolimbic computation of reward motivation". Eur. J. Neurosci. 35 (7): 1124–1143. doi:10.1111/j.1460-9568.2012.07990.x. PMC 3325516. PMID 22487042.
Here I discuss how mesocorticolimbic mechanisms generate the motivation component of incentive salience. Incentive salience takes Pavlovian learning and memory as one input and as an equally important input takes neurobiological state factors (e.g. drug states, appetite states, satiety states) that can vary independently of learning. Neurobiological state changes can produce unlearned fluctuations or even reversals in the ability of a previously learned reward cue to trigger motivation. Such fluctuations in cue-triggered motivation can dramatically depart from all previously learned values about the associated reward outcome. ... Associative learning and prediction are important contributors to motivation for rewards. Learning gives incentive value to arbitrary cues such as a Pavlovian conditioned stimulus (CS) that is associated with a reward (unconditioned stimulus or UCS). Learned cues for reward are often potent triggers of desires. For example, learned cues can trigger normal appetites in everyone, and can sometimes trigger compulsive urges and relapse in addicts.
الوسيط
Cue-triggered 'wanting’ for the UCS
A brief CS encounter (or brief UCS encounter) often primes a pulse of elevated motivation to obtain and consume more reward UCS. This is a signature feature of incentive salience.
Cue as attractive motivational magnets
When a Pavlovian CS+ is attributed with incentive salience it not only triggers 'wanting’ for its UCS, but often the cue itself becomes highly attractive – even to an irrational degree. This cue attraction is another signature feature of incentive salience ... Two recognizable features of incentive salience are often visible that can be used in neuroscience experiments: (i) UCS-directed 'wanting’ – CS-triggered pulses of intensified 'wanting’ for the UCS reward; and (ii) CS-directed 'wanting’ – motivated attraction to the Pavlovian cue, which makes the arbitrary CS stimulus into a motivational magnet.|CitationClass=تم تجاهله (مساعدة) - Malenka RC, Nestler EJ, Hyman SE (2009). Sydor A, Brown RY, eds (المحررون). Molecular Neuropharmacology: A Foundation for Clinical Neuroscience (الطبعة 2nd). New York: McGraw-Hill Medical. صفحات 147–148, 367, 376. ISBN 978-0-07-148127-4.
VTA DA neurons play a critical role in motivation, reward-related behavior (Chapter 15), attention, and multiple forms of memory. This organization of the DA system, wide projection from a limited number of cell bodies, permits coordinated responses to potent new rewards. Thus, acting in diverse terminal fields, dopamine confers motivational salience ("wanting") on the reward itself or associated cues (nucleus accumbens shell region), updates the value placed on different goals in light of this new experience (orbital prefrontal cortex), helps consolidate multiple forms of memory (amygdala and hippocampus), and encodes new motor programs that will facilitate obtaining this reward in the future (nucleus accumbens core region and dorsal striatum). In this example, dopamine modulates the processing of sensorimotor information in diverse neural circuits to maximize the ability of the organism to obtain future rewards. ...
الوسيط
The brain reward circuitry that is targeted by addictive drugs normally mediates the pleasure and strengthening of behaviors associated with natural reinforcers, such as food, water, and sexual contact. Dopamine neurons in the VTA are activated by food and water, and dopamine release in the NAc is stimulated by the presence of natural reinforcers, such as food, water, or a sexual partner. ...
The NAc and VTA are central components of the circuitry underlying reward and memory of reward. As previously mentioned, the activity of dopaminergic neurons in the VTA appears to be linked to reward prediction. The NAc is involved in learning associated with reinforcement and the modulation of motoric responses to stimuli that satisfy internal homeostatic needs. The shell of the NAc appears to be particularly important to initial drug actions within reward circuitry; addictive drugs appear to have a greater effect on dopamine release in the shell than in the core of the NAc.|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Salamone JD, Correa M (8 November 2012). "The mysterious motivational functions of mesolimbic dopamine". Neuron. 76 (3): 470–485. doi:10.1016/j.neuron.2012.10.021. ISSN 1097-4199. PMC 4450094. PMID 23141060. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Calipari ES, Bagot RC, Purushothaman I, Davidson TJ, Yorgason JT, Peña CJ, Walker DM, Pirpinias ST, Guise KG, Ramakrishnan C, Deisseroth K, Nestler EJ (March 2016). "In vivo imaging identifies temporal signature of D1 and D2 medium spiny neurons in cocaine reward". Proc. Natl. Acad. Sci. U.S.A. 113 (10): 2726–2731. doi:10.1073/pnas.1521238113. PMC 4791010. PMID 26831103.
Previous work has demonstrated that optogenetically stimulating D1 [medium spiny neurons] MSNs promotes reward, whereas stimulating D2 MSNs produces aversion. ... Studies using in vivo pharmacological approaches have demonstrated differential roles of NAc D1 and D2 receptors in drug conditioning by use of selective receptor agonists or antagonists, further supporting a role for both dopamine and D1 and D2 MSN subtypes in associative learning (27). Whereas this work has focused on the VTA-to-NAc dopamine circuit, tracking postsynaptic responses in NAc MSNs is particularly important because they integrate information not only from VTA dopamine neurons but also from numerous glutamatergic projections (28, 29). From a network perspective, D1 and D2 MSNs receive inputs from several regions known to encode and store information about context or context–drug associations such as the prefrontal cortex, basolateral amygdala, and hippocampus (30). ... Our data highlight the important role played by D1 MSNs in NAc core in establishing context–reward associations and in controlling the strength of these associations after cocaine exposure. ... Here we show that regulation of associative learning, and its dysregulation by cocaine, is driven primarily through alterations in D1 MSNs in NAc core, which both impair the extinction of previously learned associations and enhance reinstatement following abstinence.
الوسيط|CitationClass=تم تجاهله (مساعدة) - Baliki MN, Mansour A, Baria AT, Huang L, Berger SE, Fields HL, Apkarian AV (October 2013). "Parceling human accumbens into putative core and shell dissociates encoding of values for reward and pain". J. Neurosci. 33 (41): 16383–16393. doi:10.1523/JNEUROSCI.1731-13.2013. PMC 3792469. PMID 24107968.
Recent evidence indicates that inactivation of D2 receptors, in the indirect striatopallidal pathway in rodents, is necessary for both acquisition and expression of aversive behavior, and direct pathway D1 receptor activation controls reward-based learning (Hikida et al., 2010; Hikida et al., 2013). It seems we can conclude that direct and indirect pathways of the NAc, via D1 and D2 receptors, subserve distinct anticipation and valuation roles in the shell and core of NAc, which is consistent with observations regarding spatial segregation and diversity of responses of midbrain dopaminergic neurons for rewarding and aversive conditions, some encoding motivational value, others motivational salience, each connected with distinct brain networks and having distinct roles in motivational control (Bromberg-Martin et al., 2010; Cohen et al., 2012; Lammel et al., 2013). ... Thus, the previous results, coupled with the current observations, imply that the NAc pshell response reflects a prediction/anticipation or salience signal, and the NAc pcore response is a valuation response (reward predictive signal) that signals the negative reinforcement value of cessation of pain (i.e., anticipated analgesia).
الوسيط|CitationClass=تم تجاهله (مساعدة) - Berridge KC, Kringelbach ML (2008). "Affective neuroscience of pleasure: reward in humans and animals" (PDF). Psychopharmacology. 199 (3): 457–480. doi:10.1007/s00213-008-1099-6. ISSN 0033-3158. PMC 3004012. PMID 18311558. مؤرشف من الأصل (PDF) في 19 يونيو 2018. اطلع عليه بتاريخ 20 أكتوبر 2012. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Wise RA (1996). "Addictive drugs and brain stimulation reward". Annu. Rev. Neurosci. 19: 319–340. doi:10.1146/annurev.ne.19.030196.001535. PMID 8833446. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "human nervous system". مؤرشف من الأصل في 21 أكتوبر 2014. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Positive Reinforcement Produced by Electrical Stimulation of Septal Area and Other Regions of Rat Brain". مؤرشف من الأصل في 2 يوليو 2017. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "The Functional Neuroanatomy of Pleasure and Happiness". مؤرشف من الأصل في 26 يناير 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Ivan Petrovich Pavlov; G. V. Anrep (2003). Conditioned Reflexes. Courier Corporation. صفحات 1–. ISBN 978-0-486-43093-5. مؤرشف من الأصل في 17 ديسمبر 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Rang HP (2003). Pharmacology. Edinburgh: Churchill Livingstone. صفحة 596. ISBN 0-443-07145-4. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Goeders N.E., Smith J.E. (1983). "Cortical dopaminergic involvement in cocaine reinforcement". Science. 221: 773–775. doi:10.1126/science.6879176. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Goeders N.E., Smith J.E. (1993). "Intracranial cocaine self-administration into the medial prefrontal cortex increases dopamine turnover in the nucleus accumbens". J. Pharmacol. Exp. Ther. 265: 592–600. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Clarke, Hommer D.W., Pert A., Skirboll L.R. (1985). "Electrophysiological actions of nicotine on substantia nigra single units". Br. J. Pharmacol. 85: 827–835. doi:10.1111/j.1476-5381.1985.tb11081.x. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Westfall, C., Grant, H., Perry, H., 1988. Release of dopamine and 5-hydroxytryptamine from rat striatal slices following activation of nicotinic cholinergic receptors. Gen. Pharmacol. 14, 321–325.
- Pardee, R. L. (1990). Motivation Theories of Maslow, Herzberg, McGregor & McClelland. A Literature Review of Selected Theories Dealing with Job Satisfaction and Motivation.
- Ellliot, Andrew J; Covington, Martin. "Approach and Avoidance Motivation". Educational Psychology Review. 13 (2001): 2. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Maehr, Martin L; Mayer, Heather (1997). "Understanding Motivation and Schooling: Where We've Been, Where We Are, and Where We Need to Go". Educational Psychology Review. 9 (44). الوسيط
|CitationClass=تم تجاهله (مساعدة) - Robbins, Trevor W; Everitt, Barry J (1 May 1996). "Neurobehavioral Mechanisms of Reward and Motivation". ResearchGate. 6 (2): 228–236. doi:10.1016/S0959-4388(96)80077-8. ISSN 0959-4388. مؤرشف من الأصل في 24 يوليو 2018. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Berridge, Kent C; Kringelbach, Morten L. "Neuroscience of affect: brain mechanisms of pleasure and displeasure". Current Opinion in Neurobiology. 23 (3): 294–303. doi:10.1016/j.conb.2013.01.017. PMC 3644539. PMID 23375169. مؤرشف من الأصل في 23 فبراير 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Salamone, John D.; Correa, Mercè (8 November 2012). "THE MYSTERIOUS MOTIVATIONAL FUNCTIONS OF MESOLIMBIC DOPAMINE". Neuron. 76 (3): 470–485. doi:10.1016/j.neuron.2012.10.021. ISSN 0896-6273. PMC 4450094. PMID 23141060. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Cooper, John O (2007). Applied Behavior Analysis. Upper Saddle River, NJ, USA: Pearson Education. ISBN 0-13-129327-3. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Donahoe, J.W. (2004). Learning and Complex Behavior. Richmond, MA, USA: Ledgetop Publishing. ISBN 0-9762371-0-5. الوسيط
|CitationClass=تم تجاهله (مساعدة)
- بوابة علم الجنس
- بوابة علم الأحياء
- بوابة طب
- بوابة صيدلة
- بوابة علم النفس
- بوابة علوم عصبية




