نبيب مستعرض
النُبَيبات المُستَعرِضة (اختصارًا نُبَيبات T)(1) أو الأنيبيبات المُستعرضة(2) هي امتداداتٌ من الغشاء الخلوي نحو مركز خلايا العضلات الهيكلية والقلبية. تمتلك النُبيبات المُستعرضة أغشيةً تحتوي على تركيزاتٍ مرتفعةٍ من القنوات الأيونية والناقلات والمضخات، مما يسمح لجهد الفعل بالانتقال سريعًا نحو الخلية. تلعبُ النُبيبات المُستعرضة أيضًا دورًا هامًا في تنظيم تركيز الكالسيوم الخلوي، وعبر هذه الآليات فإنَّ النُبيبات المُستعرضة تسمحُ لخلايا العضلة القلبية بالانقباض بقوةٍ أكبر، وذلك عبر مُزامنة إطلاق الكالسيوم في جميع أنحاء الخلية.[2]
| نبيب مستعرض | |
|---|---|
| الاسم اللاتيني tubulus transversus | |
 عضلةٌ هيكلية، يظهرُ فيها نبيبٌ مُستعرضٌ مُكبرًا. | |
 هيكلُ نبيبٍ مُستعرض، وعلاقته مع الشبكة الهيولية العضلية في عضلةٍ هيكلية. هيكلُ نبيبٍ مُستعرض، وعلاقته مع الشبكة الهيولية العضلية في عضلةٍ هيكلية. | |
| تفاصيل | |
| نوع من | كيان تشريحي خلوي [1] |
| جزء من | الغشاء الخلوي لخلايا العضلات الهيكلية والقلبية. |
| معرفات | |
| ترمينولوجيا هستولوجيكا | H2.00.05.2.01018، وH2.00.05.2.02013 |
قد يتأثر هيكلُ النُبيبات المُستعرضة بالأمراض، مما قد يساهمُ في حدوث قصور القلب واضطرابات نظم القلب.[3][4] تتراوح التغيرات التي تظهرُ في المرض بين فقدانٍ كاملٍ للنُبيبات المُستعرضة إلى تغييراتٍ أكثر دقةٍ في اتجاهها أو أنماطها المُتفرعة.[5] لُوحظت النُبيبات المُستعرضة لأول مرةٍ عام 1897،[6] وعلى الرغم من هذا إلا أن الأبحاث الحيوية حولها ما زالت مُستمرةً.[7]
الهيكل
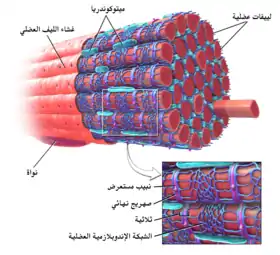
تتشكلُ النُبيبات المُستعرضة من نفس الطبقة المزدوجة الليبيدية الفسفورية الموجودة في الغشاء السطحي أو الغشاء الليفي العضلي لخلايا العضلات الهيكلية والقلبية.[2] ترتبط النُبيبات المُستعرضة مباشرةً مع إحدى نهايات الغشاء الليفي العضلي قبل توغلها في عمق الخلية، مُشكِلةً شبكةً من النُبيبات مع أقسامٍ تسيرُ إلى الغشاء الليفي العضلي، وتتخذ هذه الأقسام مسارًا عاموديًا (مُستعرضًا) ومتوازيًا (محوريًا).[2] نتيجةً لهذه الاتجاهات المُعقدة، يُشير البعض إلى النُبيبات المُستعرضة على أنها نظامٌ أنبوبيٌ مُستعرضٌ-محوريٌ.[8] يفتحُ تجويفُ النُبيب المُستعرض على سطح الخلية، وهذا يعني بأنَّ النُبيب المُستعرض مملوءٌ بسائلٍ يحتوي على نفس مكونات المحلول المُحيط بالخلية (السائل خارج الخلية). لا يقتصرُ عمل النبيب المُستعرض على كونه أنبوب توصيل لافاعل، حيثُ يكون الغشاء المُشكل للنُبيبات المُستعرضة نشطًا جدًا، فيكون مُرصعًا ببروتيناتٍ تتضمن قنوات الكالسيوم من نوع L، ومبادلات كالسيوم-صوديوم، وأتبازات الكالسيوم والمستقبلات الأدرينالينية.[2]
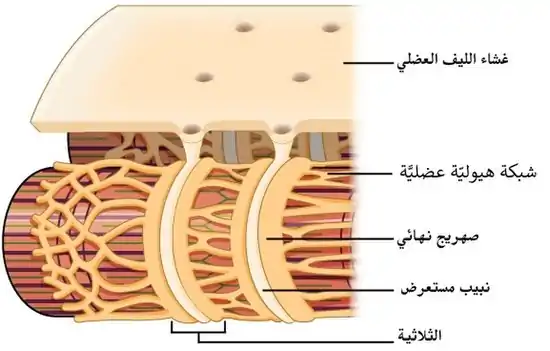
تُوجد النُبيبات المُستعرضة في خلايا العضلة القلبية الأذينية والبطينية، والتي تتطور في الأسابيع القليلة الأولى من الحياة.[9] لُوحظ وجود النُبيبات المُستعرضة في الخلايا العضلية البطينية لمعظم الأنواع، والخلايا العضلية الأذينية لدى الثدييات الكبيرة.[10] يبلغ قُطر النُبيبات المُستعرضة في خلايا العضلة القلبية ما بين 20 إلى 450 نانومترًا، وعادةً ما تُوجد في مناطقٍ تُسمى أقراص Z، وهي مناطق تركُز خيوط الأكتين داخل الخلية.[2] ترتبطُ النُبيبات المُستعرضة داخل القلب ارتباطًا وثيقًا بمخزن الكالسيوم داخل الخلايا، والذي يُعرف باسم الشبكة الهيولية العضلية، والتي توجد في مناطق محددةٍ يُشار إليها باسم الصهاريج النهائية. يُعرف ارتباط نبيبٍ مُستعرضٍ مع صهريجٍ نهائي باسم الثنائية.[3]
يتراوح قطر النُبيبات المُستعرضة في خلايا العضلة الهيكلية ما بين 20 إلى 40 نانومترًا، وعادةً ما تُوجد على جانبي قطعة الميوسين، عند تقاطع التداخل بين شريط A وشريط I. ترتبط النُبيبات المُستعرضة في العضلة الهيكلية بصهريجين نهائيين، وتُعرف باسم الثلاثية.[2][11]
المُنظمات
يُنتجُ شكل نظام النُبيبات المُستعرضة ويُحافَظُ عليه عبر مجموعةٍ متنوعةٍ من البروتينات. يُشفر بروتين أمفيفيسين-2 بواسطة جين BIN1، وهو مسؤولٌ عن تشكيل هيكل النُبيب المُستعرض والتأكد من أنَّ البروتينات المناسبة (خاصة قنوات الكالسيوم من نوع L) تقع داخل غشاء النُبيب المُستعرض.[12] يُشفر بروتين جنكتوفيلين-2 بواسطة جين JPH2، حيثُ يُساعد على تكوين تقاطعٍ بين غشاء النُبيب المُستعرض والشبكة الهيولية العضلية، وهذا الأمر مهمٌ لتقارن الاستثارة والتقلص.[3] يُشفر بروتين تيليثونين بواسطة جين TCAP، والذي يُساعد على تطور النُبيبات المُستعرضة ويحتمل أن يكون مسؤولًا عن زيادة عدد النُبيبات المُستعرضة التي تُرى مع نمو العضلات.[3]
الوظيفة
تقارن الاستثارة والتقلص
تُعتبر النُبيبات المُستعرضة رابطًا مهمًا في السلسلة التي تبدأ بالاستثارة الكهربائية للخلية وتنتهي بالتقلص الناتج عنه (تقارن الاستثارة والتقلص(3)). عند الحاجة إلى تقلص العضلة، يسبِّب تنبيهٌ أو استثارةٌ من عصبٍ أو خليةٍ مجاورةٍ تدفقًا مميزًا لجسيماتٍ مشحونةٍ عبر غشاء الخلية فيما يُسمى بجهد الفعل. عند استرخاء العضلة، توجد جزيئات مشحونة قليلة على الجانب الداخلي للغشاء مقارنةً بالجانب الخارجي، ويوصف الغشاء بأنه مُستقطبٌ. أثناء جهد الفعل، تتدفق الجزيئات الموجبة الشحنة (في الغالب أيونات الصوديوم والكالسيوم) عبر الغشاء من الخارج إلى الداخل، وهذا يعكس عدم التوازن الطبيعي للجزيئات المشحونة ويُشار إليه بإزالة الاستقطاب. بعدها تزيل منطقة من الغشاء استقطاب المناطق المجاورة وهكذا تنتشر موجة إزالة الاستقطاب الناتجة على طول غشاء الخلية.[13] يُستعاد استقطاب الغشاء مع تدفق أيونات البوتاسيوم بدورها عبر الغشاء من داخل الخلية إلى خارجها.
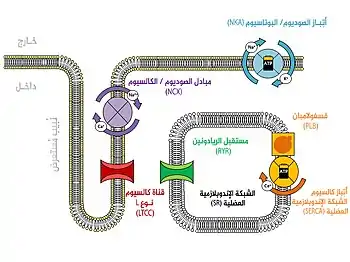
في الخلايا العضلية القلبية، يقوم جهد الفعل عند مروره أسفل النُبيب المُستعرض بتنشيط النوع L من قنوات الكالسيوم في غشاء النبيب، مما يسمحُ للكالسيوم بالمرور إلى الخلية. تحتوي النُبيبات المُستعرضة على تراكيزٍ كبيرةٍ من قنوات الكالسيوم من النوع L، وذلك أكثر من أي منطقة في غشاء الليف العضلي، وعليه فإنَّ معظم الكالسيوم الذي يدخل إلى الخلية يكون عبر هذه النُبيبات المُستعرضة.[14] يرتبط هذا الكالسيوم بمستقبل يُعرف باسم مستقبل الريانودين وينشطه، ويتواجد هذا المستقبل على مخزن الكالسيوم الداخلي في الخلية نفسها والذي يُعرف بالشبكة الهيولية العضلية. يُسبِّب تنشيط مستقبل الريانودين انطلاق الكالسيوم من الشبكة الهيولية العضلية وإحداث تقلص العضلة.[15] في الخلايا العضلية الهيلكية، ترتبط قنوات الكالسيوم L مباشرةً مع مستقبل الريانودين المتواجد على الشبكة الهيولية العضلية وهذا يسمح بتنشيط مستقبل الريانودين مباشرةً دون الحاجة إلى تدفق الكالسيوم للداخل.[16]
لا تقتصرُ أهمية النُبيبات المُستعرضة على وجود تراكيزٍ عاليةٍ من النوع L من قنوات الكالسيوم، بل تمتلكُ القدرة أيضًا على مزامنة تحرير الكالسيوم داخل الخلية. يؤدي الانتشار السريع لجهد الفعل على طول شبكة النُبيب المستعرض إلى تنشيط جميع قنوات الكالسيوم من النوع L بشكل شبه لحظي. ولأن النُبيبات المُستعرضة تُقرِّب غشاء الليف العضلي كثيرًا من الشبكة الهيولية العضلية في جميع مناطق الخلية، يمكن إفراز الكالسيوم من الشبكة الهيولية العضلية على طول الخلية في نفس الوقت. وتسمح مزامنة تحرير الكالسيوم هذهِ للخلايا العضلية بالتقلص بقوةٍ أكثر.[17] في الخلايا التي تنعدم فيها النُبيبات المُستعرضة مثل العضلات الملساء أو الخلايا العضلية القلبية المريضة أو الخلايا العضلية التي أزيلت فيها النُبيبات المُستعرضة اصطناعيًا، يجب على الكالسيوم الذي يدخل من غشاء الليف العضلي الانتشار تدريجيًا عبر الخلية، وعليه يقوم بتنشيط مستقبلات الريانودين بشكل أبطء بكثير وتؤدي موجة الكالسيوم الناتجة إلى تقلصٍ أقلَ قوة.[17]
بما أن النُبيبات المُستعرضة المنطقة الأساسية لتقارن الاستثارة والتقلص، فإن القنوات الأيونية والبروتينات التي لها دورٌ في هذه العملية تتركَّزُ فيها، فتكون أعداد قنوات الكالسيوم من النوع L المتواجدة على النُبيبات المُستعرضة ثلاث أضعاف أعدادها في أي مكانٍ آخر على غشاء الليف العضلي. علاوةً على هذا، فإنَّ المستقبلات الأدرينالية بيتا متركزةٌ بشدةٍ كذلك على غشاء النُبيبات المُستعرضة[18] وتنبيهها يزيد إطلاق الكالسيوم من الشبكة الهيولية العضلية.[19]
التحكم بالكالسيوم
بما أن الحيز داخل تجويف النُبيب المُستعرض امتدادًا للحيز الذي يُحيط بالخلية (الحيز خارج الخلية)، فإن تراكيز الأيونات بين هذين الحيزين متشابهةٌ جدًا. على الرغم من ذلك، وبسبب أهمية الأيونات داخل النُبيبات المُستعرضة (خصوصًا الكالسيوم في العضلة القلبية)، فإنهُ من الضروري جدًا أن تبقى هذه التراكيز ثابتةً نسبيًا. لأنَّ النُبيبات المُستعرضة رقيقةٌ جدًا فإنها تحتجز الأيونات بداخلها، وبغض النظر عن تراكيز الأيونات في أي منطقةٍ أُخرى في الخلية فإنَّ هذا الأمر يُعتبر هامًا لأنَّ النُبيبات المُستعرضة تحتوي على ما يكفي من أيونات الكالسيوم للسماح بتقلص العضلة. لذلك حتى لو انخفض تركيز الكالسيوم خارج الخلية (نقص كالسيوم الدم) فإنَّ تركيز الكالسيوم داخل النُبيب المُستعرض يبقى ثابتًا نسبيًا، مما يسمحُ باستمرار انقباض العضلات القلبية.[3]
تُعتبر النُبيبات المُستعرضة موقع دخول الكالسيوم إلى الخلية وهي كذلك موقع خروجه منها، وهذا مهمٌ لأنه يعني أن مستويات الكالسيوم داخل الخلية يمكن أن تُضبط بإحكام في منطقةٍ صغيرة (بين النُبيب المُستعرض والشبكة الهيولية العضلية، فيما يُعرف باسم التحكم المحلي أو المباشر).[20] تتواجد بروتينات مثل: مبادل الصوديوم-الكالسيوم وأتِباز غشاء الليف العضلي على غشاء النُبيب المُستعرض.[3] يزيل مبادل الصوديوم-الكالسيوم سلبيًا أيون كالسيوم واحد مُقابل ثلاث أيونات صوديوم، ولكونها عمليةٌ سلبية فإن بإمكانها السماح بتدفق الكالسيوم داخل أو خارج الخلية، وذلك حسب تركيبة التراكيز النسبية لهذين الأيونين والفولتية عبر جانبي غشاء الخلية (تدرج كهركيميائي).[13] يزيل أتباز الكالسيومِ الكالسيومَ من الخلية بشكلٍ نشط، باستخدام الطاقة الناتجة عن الأدينوسين ثلاثي الفوسفات (ATP).[13]
إزالة التنبيب
في سبيل دراسة وظيفة النُبيبات المُستعرضة، يمكن اصطناعيًا فكُ اقتران النبيبات عن الغشاء السطحي باستخدام تقنيةٍ تُسمى "إزالة التنبيب". يمكن إضافة مركباتٍ كيميائية مثل الغليسرول[21] (للعضلة الهيكلية) أو الفورماميد[17] (للعضلة القلبية) إلى المحلول الخارجي الذي يُحيط بالخلايا. تزيد هذه العوامل من التركيز الأسموزي الخاص بالمحلول خارج الخلية مسببةً انكماش الخلايا. حين إزالة هذه العوامل، تتسع الخلايا بشكلٍ سريع وتعود إلى حجمها الطبيعي. يسبب انكماش وإعادة توسع الخلايا انفصال النُبيبات المُستعرضة عن الغشاء السطحي.[22] بطريقة أخرى، يمكن تخفيض التركيز الأسموزي الخاص بالمحلول خارج الخلية باستخدام محلولٍ ملحي قليل الأسموزية، مما يُسبب انتفاخًا عابرًا للخلية. تسمح إعادة تركيز المحلول خارج الخلية إلى التركيز الأسموزي الطبيعي لعودة الخلايا إلى حجمها السابق، وهذا يؤدي إلى إزالة التنبيب.[23]
التاريخ
اقتُرِحت فكرة البُنية الخلوية التي أصبحت تُعرف لاحقًا باسم النُبيبات المُستعرضة أول مرةٍ عام 1881. التأخر الزمني القصير جدًا بين تنبيه خلية عضلية مخططة والانقباض الناتج عنه كان قصيرًا من أن يُحدِثه تأشير مركب كيميائي يقطع المسافة التي تفصل بين غشاء الليف العضلي والشبكة الهيولية العضلية، وعليه اقُترحَ أن جيوبًا من الغشاء تصل إلى داخل الخلية وهو أمر قد يُفسر بدء الانقباض السريع جدًا الذي تمت مُلاحظته.[24][25] استغرق الأمر حتى عام 1897 للتمكن من رؤية النُبيبات المُستعرضة باستخدام المجهر الضوئي أثناء دراسة العضلة القلبية المحقونة بحبرٍ هندي. مع تقدم تقنيات التصوير وظهور المجهر الإلكتروني النافذ المتقدم، أصبحت بنية النُبيبات المُستعرضة أكثر وضوحًا،[6] مما أدى إلى وصف المكون الطولي لشبكة النبيب المستعرض عام 1971.[26] في العقدين 1990 و2000 مكّن المجهر البؤري من إعادة البناء ثلاثي الأبعاد لشبكة نبيب مستعرض وتحديد حجم وكمية وتوزيع النُيببات المُستعرضة،[27] أما أهمية العلاقة بين النبيبات وإطلاق الكالسيوم فقد بدأت تتكشف مع اكتشاف شرارات الكالسيوم.[28] بينما ركزت الأبحاث الأولى على العضلة القلبية البطينية والعضلة الهيكلية، فإنهُ في عام 2009 لُوحظت شبكة نبيب مستعرض كثيفة في خلايا العضلة القلبية الأذينية.[4] تُركز البحوث الجارية على تنظيم بنية النبيب المستعرض وكيف تتأثر وتساهم النُبيبات المستعرضة بالأمراض القلبية الوعائية.[7]
الأهمية السريرية
قد يتغير هيكلُ النُبيبات المُستعرضة بسبب مرضٍ مُعين، مما قد يُساهم في ضعف عضلة القلب أو اضطرابات في نظم القلب. تتراوح التغيرات التي تظهرُ في المرض بين فقدانٍ كاملٍ للنُبيبات المُستعرضة إلى تغييراتٍ أكثر دقةٍ في اتجاهها أو أنماطها المُتفرعة.[5] قد تُفقد أو تتحطم النُبيبات المُستعرضة بعد حدوث نوبةٍ قلبية،[5] كما قد تتحطمُ في البُطينات لدى مرضى قصور القلب، مما يُساهم في تقليل قوة الانقباض وربما يقلل من فرص الشفاء.[29] يُمكن أن يسبب قصور القلب أيضًا فقدانًا شبه تامٍ للنُبيبات المُستعرضة من خلايا عضلة القلب الأذينية، مما يقلل من انقباض الأذين وربما يساهم في حدوث رجفانٍ أُذيني.[4]
قد تؤدي التغييرات الهيكلية في النُبيبات المُستعرضة إلى ابتعاد قنوات الكالسيوم من النوع L عن مستقبلات الريانودين، وهذا قد يؤدي إلى زيادة الوقت المستغرق في رفع مستويات الكالسيوم داخل الخلية، مما يُسبب انقباضاتٍ أقل واضطرابٍ في نظم القلب.[3][4] على الرغم من هذا، فإنَّ اضطراب هيكل النُبيبات المُستعرضة قد لا يكون دائمًا، حيثُ اقترح البعض أنَّ تغير هيكل النُبيبات المُستعرضة قد يُعكسُ عبر استخدام تدريب الفترة.[3]
هوامش
1. النُبَيبات المُسْتَعْرِضَة[ِ 1][ِ 2][ِ 3][ِ 4] (بالإنجليزية: Transverse tubules)، وتُسمى اختصارًا نُبَيبات T[ِ 4][ِ 3][ِ 5] (بالإنجليزية: T-tubules).
2. الأنيبيبات المستعرضة[30][31][32][33] أنبوب هو اسم خماسي لين الحرف الرابع، والصواب هو تصغيره على وزن فُعَيْعِل، على أن يقلب الحرف اللين ياءً إذا كان واواً أو ألفاً. وعليه فإن تصغير أنبوب لغة هو أُنَيْبِب،[34][35][36] ولكن شاع استخدام نُبَيْب تسهيلاً.[37]
3. تقارن الاستثارة والتقلص (بالإنجليزية: Excitation-contraction coupling).[ِ 6]
المراجع
بِاللُغة الإنجليزيَّة
- معرف أنطولوجية الجينات: http://amigo.geneontology.org/amigo/term/GO:0030315 — تاريخ الاطلاع: 12 أكتوبر 2019 — الاصدار 2019-10-07
- Hong, TingTing; Shaw, Robin M. (2017-01-01). "Cardiac T-Tubule Microanatomy and Function". Physiological Reviews (باللغة الإنجليزية). 97 (1): 227–252. doi:10.1152/physrev.00037.2015. ISSN 0031-9333. PMC 6151489. PMID 27881552. مؤرشف من الأصل في 1 ديسمبر 2017. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Ibrahim, M.; Gorelik, J.; Yacoub, M. H.; Terracciano, C. M. (2011-09-22). "The structure and function of cardiac t-tubules in health and disease". Proceedings of the Royal Society B: Biological Sciences (باللغة الإنجليزية). 278 (1719): 2714–2723. doi:10.1098/rspb.2011.0624. PMC 3145195. PMID 21697171. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Dibb, Katharine M.; Clarke, Jessica D.; Horn, Margaux A.; Richards, Mark A.; Graham, Helen K.; Eisner, David A.; Trafford, Andrew W. (سبتمبر 2009). "Characterization of an extensive transverse tubular network in sheep atrial myocytes and its depletion in heart failure". Circulation: Heart Failure. 2 (5): 482–489. doi:10.1161/CIRCHEARTFAILURE.109.852228. ISSN 1941-3297. PMID 19808379. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Pinali, Christian; Malik, Nadim; Davenport, J. Bernard; Allan, Laurence J.; Murfitt, Lucy; Iqbal, Mohammad M.; Boyett, Mark R.; Wright, Elizabeth J.; Walker, Rachel (2017-05-04). "Post-Myocardial Infarction T-tubules Form Enlarged Branched Structures With Dysregulation of Junctophilin-2 and Bridging Integrator 1 (BIN-1)". Journal of the American Heart Association. 6 (5). doi:10.1161/JAHA.116.004834. ISSN 2047-9980. PMC 5524063. PMID 28473402. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Lindner, E. (1957). "[Submicroscopic morphology of the cardiac muscle]". Zeitschrift für Zellforschung und Mikroskopische Anatomie. 45 (6): 702–746. ISSN 0340-0336. PMID 13456982. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Eisner, David A.; Caldwell, Jessica L.; Kistamás, Kornél; Trafford, Andrew W. (2017-07-07). "Calcium and Excitation-Contraction Coupling in the Heart". Circulation Research. 121 (2): 181–195. doi:10.1161/CIRCRESAHA.117.310230. ISSN 1524-4571. PMC 5497788. PMID 28684623. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Ferrantini, Cecilia; Coppini, Raffaele; Sacconi, Leonardo; Tosi, Benedetta; Zhang, Mei Luo; Wang, Guo Liang; Vries, Ewout de; Hoppenbrouwers, Ernst; Pavone, Francesco (2014-06-01). "Impact of detubulation on force and kinetics of cardiac muscle contraction". The Journal of General Physiology (باللغة الإنجليزية). 143 (6): 783–797. doi:10.1085/jgp.201311125. PMC 4035744. PMID 24863933. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Haddock, Peter S.; Coetzee, William A.; Cho, Emily; Porter, Lisa; Katoh, Hideki; Bers, Donald M.; Jafri, M. Saleet; Artman, Michael (1999-09-03). "Subcellular [Ca2+]i Gradients During Excitation-Contraction Coupling in Newborn Rabbit Ventricular Myocytes". Circulation Research (باللغة الإنجليزية). 85 (5): 415–427. doi:10.1161/01.RES.85.5.415. ISSN 0009-7330. PMID 10473671. مؤرشف من الأصل في 2 يونيو 2018. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Richards, M. A.; Clarke, J. D.; Saravanan, P.; Voigt, N.; Dobrev, D.; Eisner, D. A.; Trafford, A. W.; Dibb, K. M. (نوفمبر 2011). "Transverse tubules are a common feature in large mammalian atrial myocytes including human". American Journal of Physiology. Heart and Circulatory Physiology. 301 (5): H1996–2005. doi:10.1152/ajpheart.00284.2011. ISSN 1522-1539. PMC 3213978. PMID 21841013. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "4. Calcium reuptake and relaxation". www.bristol.ac.uk. مؤرشف من الأصل في 25 أبريل 2018. اطلع عليه بتاريخ 21 فبراير 2017. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Caldwell, Jessica L.; Smith, Charlotte E. R.; Taylor, Rebecca F.; Kitmitto, Ashraf; Eisner, David A.; Dibb, Katharine M.; Trafford, Andrew W. (2014-12-05). "Dependence of cardiac transverse tubules on the BAR domain protein amphiphysin II (BIN-1)". Circulation Research. 115 (12): 986–996. doi:10.1161/CIRCRESAHA.116.303448. ISSN 1524-4571. PMC 4274343. PMID 25332206. الوسيط
|CitationClass=تم تجاهله (مساعدة) - M., Bers, D. (2001). Excitation-contraction coupling and cardiac contractile force (الطبعة 2nd). Dordrecht: Kluwer Academic Publishers. ISBN 9780792371588. OCLC 47659382. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Scriven, D. R.; Dan, P.; Moore, E. D. (نوفمبر 2000). "Distribution of proteins implicated in excitation-contraction coupling in rat ventricular myocytes". Biophysical Journal. 79 (5): 2682–2691. doi:10.1016/S0006-3495(00)76506-4. ISSN 0006-3495. PMC 1301148. PMID 11053140. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Bers, Donald M. (2002-01-10). "Cardiac excitation-contraction coupling". Nature. 415 (6868): 198–205. doi:10.1038/415198a. ISSN 0028-0836. PMID 11805843. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Rebbeck, Robyn T.; Karunasekara, Yamuna; Board, Philip G.; Beard, Nicole A.; Casarotto, Marco G.; Dulhunty, Angela F. (2014-03-01). "Skeletal muscle excitation-contraction coupling: who are the dancing partners?". The International Journal of Biochemistry & Cell Biology. 48: 28–38. doi:10.1016/j.biocel.2013.12.001. ISSN 1878-5875. PMID 24374102. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Ferrantini, Cecilia; Coppini, Raffaele; Sacconi, Leonardo; Tosi, Benedetta; Zhang, Mei Luo; Wang, Guo Liang; de Vries, Ewout; Hoppenbrouwers, Ernst; Pavone, Francesco (2014-06-01). "Impact of detubulation on force and kinetics of cardiac muscle contraction". The Journal of General Physiology. 143 (6): 783–797. doi:10.1085/jgp.201311125. ISSN 1540-7748. PMC 4035744. PMID 24863933. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Laflamme, M. A.; Becker, P. L. (1999-11-01). "G(s) and adenylyl cyclase in transverse tubules of heart: implications for cAMP-dependent signaling". The American Journal of Physiology. 277 (5 Pt 2): H1841–1848. doi:10.1152/ajpheart.1999.277.5.H1841. ISSN 0002-9513. PMID 10564138. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Bers, Donald M. (2006-05-15). "Cardiac ryanodine receptor phosphorylation: target sites and functional consequences". Biochemical Journal. 396 (Pt 1): e1–3. doi:10.1042/BJ20060377. ISSN 0264-6021. PMC 1450001. PMID 16626281. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Hinch, R., Greenstein, J.L., Tanskanen, A.J., Xu, L. and Winslow, R.L. (2004) ‘A simplified local control model of calcium-induced calcium release in cardiac ventricular Myocytes’, 87(6).
- Fraser, James A.; Skepper, Jeremy N.; Hockaday, Austin R.; Huang1, Christopher L.-H. (1998-08-01). "The tubular vacuolation process in amphibian skeletal muscle". Journal of Muscle Research & Cell Motility (باللغة الإنجليزية). 19 (6): 613–629. doi:10.1023/A:1005325013355. ISSN 0142-4319. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Kawai M, Hussain M, Orchard CH. "Excitation-contraction coupling in rat ventricular myocytes after formamide-induced detubulation". Am J Physiol. 277(2): H603-9. PMID 10444485. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Moench, I.; Meekhof, K. E.; Cheng, L. F.; Lopatin, A. N. (يوليو 2013). "Resolution of hyposmotic stress in isolated mouse ventricular myocytes causes sealing of t-tubules". Experimental Physiology. 98 (7): 1164–1177. doi:10.1113/expphysiol.2013.072470. ISSN 1469-445X. PMC 3746342. PMID 23585327. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Huxley, A. F. (1971-06-15). "The activation of striated muscle and its mechanical response". Proceedings of the Royal Society of London. Series B, Biological Sciences. 178 (1050): 1–27. doi:10.1098/rspb.1971.0049. ISSN 0950-1193. PMID 4397265. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Hill, A. V. (أكتوبر 1949). "The abrupt transition from rest to activity in muscle". Proceedings of the Royal Society of London. Series B, Biological Sciences. 136 (884): 399–420. doi:10.1098/rspb.1949.0033. ISSN 0950-1193. PMID 18143369. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Sperelakis, N.; Rubio, R. (أغسطس 1971). "An orderly lattice of axial tubules which interconnect adjacent transverse tubules in guinea-pig ventricular myocardium". Journal of Molecular and Cellular Cardiology. 2 (3): 211–220. doi:10.1016/0022-2828(71)90054-x. ISSN 0022-2828. PMID 5117216. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Savio-Galimberti, Eleonora; Frank, Joy; Inoue, Masashi; Goldhaber, Joshua I.; Cannell, Mark B.; Bridge, John H. B.; Sachse, Frank B. (أغسطس 2008). "Novel features of the rabbit transverse tubular system revealed by quantitative analysis of three-dimensional reconstructions from confocal images". Biophysical Journal. 95 (4): 2053–2062. doi:10.1529/biophysj.108.130617. ISSN 1542-0086. PMC 2483780. PMID 18487298. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Cheng, H.; Lederer, W. J.; Cannell, M. B. (1993-10-29). "Calcium sparks: elementary events underlying excitation-contraction coupling in heart muscle". Science. 262 (5134): 740–744. doi:10.1126/science.8235594. ISSN 0036-8075. PMID 8235594. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Seidel, Thomas; Navankasattusas, Sutip; Ahmad, Azmi; Diakos, Nikolaos A.; Xu, Weining David; Tristani-Firouzi, Martin; Bonios, Michael J.; Taleb, Iosif; Li, Dean Y. (2017-04-25). "Sheet-Like Remodeling of the Transverse Tubular System in Human Heart Failure Impairs Excitation-Contraction Coupling and Functional Recovery by Mechanical Unloading". Circulation. 135 (17): 1632–1645. doi:10.1161/CIRCULATIONAHA.116.024470. ISSN 1524-4539. PMC 5404964. PMID 28073805. الوسيط
|CitationClass=تم تجاهله (مساعدة) - كتاب علم الأحياء، بيتر ريفن، جورج جونسون، جوناثان لوسوس، كينيث ماسون، سوزان سنجر، مكتبة العبيكان، صفحة 956. "الأنيبيبات+المستعرضة"&source=bl&ots=-VBvVq-l5U&sig=ACfU3U0dTw2pS9d1fof-tLr7ojBYAcMN_g&hl=ar&sa=X&ved=2ahUKEwigvcrTot_mAhVNCewKHSL6Ao4Q6AEwBHoECAoQAQ نسخة محفوظة 3 فبراير 2020 على موقع واي باك مشين.
- كتاب الأحياء للصف الحادي عشر، دولة الكويت، الطبعة الثانية 2017-2018، صفحة 34. نسخة محفوظة 31 ديسمبر 2019 على موقع واي باك مشين.
- جامعة بابل، الجهاز العضلي، كلية التربية الرياضية. نسخة محفوظة 6 مارس 2020 على موقع واي باك مشين.
- كتاب العلوم الحياتية للصف الحادي عشر، الجزء الأول، دولة فلسطين، 2017، صفحة 103. نسخة محفوظة 5 نوفمبر 2018 على موقع واي باك مشين.
- قاموس العلوم الموضح الجديد، ترجمة tubule. نسخة محفوظة 31 ديسمبر 2019 على موقع واي باك مشين.
- قاموس المصباح، ترجمة tubule. نسخة محفوظة 31 ديسمبر 2019 على موقع واي باك مشين.
- المغني الأكبر، ترجمة tubule. نسخة محفوظة 31 ديسمبر 2019 على موقع واي باك مشين.
- محمد أسعد النادري (1997). نحو اللغة العربية كتاب في قواعد النحو والصرف مفصلة موثقة مؤيدة بالشواهد والامثلة (الطبعة الثانية). شركة أبناء شريف الأنصاري. صفحة 286. مؤرشف من الأصل في 3 فبراير 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة)
بِاللُغة العربيَّة
- "ترجمة (transverse tubules) في المعجم الطبي الموحد". مكتبة لبنان ناشرون. مؤرشف من الأصل في 16 نوفمبر 2019. اطلع عليه بتاريخ 16 نوفمبر 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة) - يُوسف حِتّي; أحمَد شفيق الخَطيب (2008). قامُوس حِتّي الطِبي للجَيب. بيروت، لبنان: مكتبة لبنان ناشرون. صفحة 436. ISBN 995310235X. الوسيط
|CitationClass=تم تجاهله (مساعدة);|access-date=بحاجة لـ|url=(مساعدة) - "ترجمة (transverse tubules) على موقع القاموس". www.alqamoos.org. مؤرشف من الأصل في 17 ديسمبر 2019. اطلع عليه بتاريخ 16 نوفمبر 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "ترجمة (transverse tubules) في قاموس المعاني". www.almaany.com. مؤرشف من الأصل في 16 نوفمبر 2019. اطلع عليه بتاريخ 16 نوفمبر 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "ترجمة (T tubule) في قاموس ماراش الطبي الكبير". مكتبة لبنان ناشرون. مؤرشف من الأصل في 16 نوفمبر 2019. اطلع عليه بتاريخ 16 نوفمبر 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "ترجمة (Excitation-contraction coupling) في موقع القاموس". www.alqamoos.org. مؤرشف من الأصل في 17 ديسمبر 2019. اطلع عليه بتاريخ 18 نوفمبر 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة)
- بوابة تشريح
- بوابة علم الأحياء الخلوي والجزيئي
