تدرج كهركيميائي
تدرج كهركيميائي electrochemical gradient هو تدرج لجهد كهركيميائي electrochemical potential لأيونات يمكنها الانتقال عبر غشاء. يتكون التدرج من جزئين، تدرج كيميائي، بمعنى تدرج في تركيز مادة مذابة في محلول على ناحيتي غشاء، ومصحوبا بتدرج في الجهد الكهربي، بمعنى اختلاف في توزيع الشحنات عبر غشاء يسمح لبعض الشحنات (الأيونات) بالمرور عبره. يمر الأيون عبر الغشاء من منطقة فيها تركيز عال إلى منطقة أقل تركيزا للأيونات عن طريق انتشار جزيئي. الأيونات تحمل شحنات كهربية، بهذا يتكون تدرج كهركيميائي عبر الغشاء.[1] تنتشر تلك الظاهرة في الكائنات الحية، حيث تنتقل أيونات المواد بين الخلايا عبر أغشية الخلايا. كما تـُستغل تلك الظاهرة في تقنية تحلية مياه البحر بواسطة أغشية أصطناعية، حيث نفصل الملح من ماء البحر فنحصل على ماء خالي من الملح. وهذه العملية الصناعية تحتاج لرفع الضغط على الماء المالح فينفصل الماء الصافي عبر الغشاء بكفاءة أعلى.
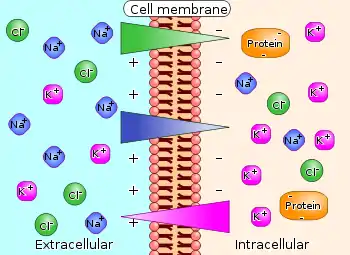
تدرج كهركيميائي في أنظمة الكائنات الحية
تنشأ التدرجات الكهركيمائية في أنظمة الخلايا الحية عبر الأغشية.
نأتي هنا ببعض الأمثلة:
- تدرج توزيع البروتونات (H+-Gradient) عبر أغشية متقدرة وكلوروبلاست، التي تساعد في سلسلة تنفس وفي التمثيل الضوئي حيث تتكون جزيئات ATP الحاملة للطاقة.
- تدرج كهركيمياي لأيونات البوتاسيوم K+ عبر أغشية الخلايا العصبية ، وبالتالي انتقال الإشارات عبر تلك الخلايا.
تدرج البروتونات عبر أغشية المتقدرات
 مقالة مفصلة: سلسلة تنفس
مقالة مفصلة: سلسلة تنفس
خلال سلسلة تنفس تتكون جزيئات أدينوسين ثلاثي الفوسفات ATP في الكائنات الحية عن طريق تدرج للبروتونات في الخلايا، (أي تدرج في تركيز الهيدروجين والأيونات الموجبة )؛ وفي التمثيل الضوئي في النبات يتم عن طريق تدرج للإلكترونات (أي تدرج في تركيز الأيونات السالبة).
تدرج K+ عبر أغشية الخلايا العصبية
في الخلية العصبية يكون توزيع أيونات البوتاسيوم K+ متساويا وهو المسؤول عن نشأة الجهد الكهربي السكوني عبر غشاء الخلية الذي يبلغ −70 مللي فولط.
يوجد في الخلية جزيئات عضوية ذات شحنة كهربية سالبة، مثل جزيئات البروتينات والإنزيمات . ونفترض أنه يوجد في إحدى الخلايا أيونات بوتاسيوم K+ كثيرة بحيث تعادل تلك الشحنات السالبة ويصبح جهد الغشاء 0 مللي فولط . سيتبع أيون K+ تدرج تركيز البوتاسيوم ويحاول مغادرة الخلية. وكلما زاد تركيز أيونات البوتاسيوم K+ كلما زادت أيضا تأثير "القوة الدافعة الكهربية " للجزيئات العضوية السالبة الشحنة في الخلية المؤثرة على الجزيء K+. فهذا الجزيء K+ يحاول العودة إلى خليته.
وبين تلك القوتين العاملتين علية تحدث حالة توازن . ويصل التدرج الكهركيميائي لـ K+ إلى 0 مللي فولط، ويتوقف انتقال أيونات البوتاسيوم +K إلى خلايا مجاورة. من ذلك يتكوّن جهد الغشاء الذي يبلغ −70 mV ويصبح تركيز البوتاسيوم +K داخل الخلية أعلى من تركيزه خارج الخلية.
هذا المثال يبين الفرق بين تدرج التركيز والتدرج الكهربي (الذي هو في الواقع جهد كهربي) والتدرج الكهركيميائي .
اقرأ أيضا
مراجع
- Nelson, David; Cox, Michael (2013). Lehninger Principles of Biochemistry. New York: W.H. Freeman. صفحة 403. ISBN 978-1-4292-3414-6. الوسيط
|CitationClass=تم تجاهله (مساعدة)
- بوابة الفيزياء
- بوابة الكيمياء
- بوابة كيمياء فيزيائية
- بوابة الكيمياء الحيوية
- بوابة علم الأحياء
