محب للإلكترون
المحب للإلكترونات (بالإنجليزية: Electrophile) إلكتروفيل هو مصطلح في الكيمياء، يعبر عن أي متفاعل ينجذب إلى الإلكترونات المشاركة في التفاعل الكيميائي باستقبال زوج من الإلكترونات للترابط مع شغوف بالنواة.[1] ولأن المتفاعلات الشغوفة بالإلكترونات تستقبل إلكترونات، فإنها تكوّن أحماض لويسية (شاهد نظرية تفاعل حمض-قاعدة). معظم المتفاعلات الشغوفة باللإلكترونات موجبة الشحنة.
ومن المتفاعلات الشغوفة بالإلكترونات المهمة الأيون الكربوني الموجب، ويستخدم في كثير من تفاعلات الكيمياء العضوية.
في الكيمياء ، المحبب الكهربائي الشغوف بالإلكترونات أو هو نوع كيميائي يشكل روابط مع محبي النيوكليوفيل بقبول زوج الإلكترون. [2] نظرًا لأن المركبات الكهربائية تقبل الإلكترونات، فهي أحماض لويس . [3] معظم المركبات الكهربائية مشحونة إيجابيا، ولها ذرة تحمل شحنة موجبة جزئية، أو لديها ذرة لا تحتوي على ثماني إلكترونات.
تتفاعل الإلكتروفيلات بشكل أساسي مع محبي النواة من خلال تفاعلات الإضافة والاستبدال. تشتمل المركبات الكهربائية التي يتم رؤيتها بشكل متكرر في التوليفات العضوية على الكاتيونات مثل H + و NO + ، والجزيئات المحايدة المستقطبة مثل HCl ، وهاليدات الألكيل ، وهاليدات الأسيل ، ومركبات الكربونيل ، والجزيئات المحايدة القابلة للاستقطاب مثل Cl 2 و Br 2 ، والعوامل المؤكسدة مثل الحموضة العضوية، والأنواع الكيميائية التي لا تفي بقاعدة الثمانيات مثل الكربينات والجذور ، وبعض أحماض لويس مثل BH 3 و هيدريد ثنائي إيزوبوتيل ألومنيوم.
الكيمياء العضوية
إضافة الهالوجينات
تحدث هذه بين الألكينات والمركبات الكهربائية، وغالبًا ما تكون الهالوجينات كما هو الحال في تفاعلات إضافة الهالوجين . تتضمن التفاعلات الشائعة استخدام ماء البروم للمعايرة مقابل عينة لاستنتاج عدد الروابط المزدوجة الموجودة. على سبيل المثال، إيثيلين + بروم → 1،2-ديبروموثان :
- C2H4 + Br2 → BrCH2CH2Br
- هذا يأخذ شكل 3 خطوات رئيسية موضحة أدناه ؛ [4]
- تشكيل مركب π
- يتفاعل جزيء Br-Br المحب للكهرباء مع جزيء ألكين غني بالإلكترون لتكوين مركب π 1 .
- تشكيل أيون برومونيوم ثلاثي الأعضاء
- يعمل الألكين كمانح للإلكترون والبروم ككهربائي. يتكون أيون البرومونيوم 2 المكون من ثلاث ذرات من ذرتين من الكربون وذرة بروم مع إطلاق Br - .
- مهاجمة أيون البروميد
- يتم فتح أيون البرومونيوم بهجوم Br - من الجانب الخلفي. هذه تعطي مجاور ثنائي البروميد مع انتيبيبلانار التكوين. عند وجود محبي نوكليوفيل أخرى مثل الماء أو الكحول، فقد تهاجم هذه الكائنات 2 لإعطاء الكحول أو الأثير.
تسمى هذه العملية آلية Ad E 2 ("إضافة، محبة للكهرباء، من الدرجة الثانية"). يتفاعل أيضًا اليود (I 2 ) ، والكلور (Cl 2 ) ، وأيون السلفينيل (RS + ) ، وكاتيون الزئبق (Hg 2+ ) ، وثنائي كلورو كاربين (: CCl 2 ) من خلال مسارات مماثلة. سيظهر التحويل المباشر من 1 إلى 3 عندما يكون Br - فائضًا كبيرًا في وسط التفاعل. قد يكون أيون-برومو كاربينيوم الوسيط سائدًا بدلاً من 3 إذا كان للألكين بديل مثبت للكاتيونات مثل مجموعة فينيل. يوجد مثال على عزل أيون البرومونيوم 2 . [5]
إضافة هاليدات الهيدروجين
تضاف هاليدات الهيدروجين مثل كلوريد الهيدروجين (HCl) إلى الألكينات لإعطاء هاليدات الألكيل في عملية الهالوجين المائي . على سبيل المثال، يؤدي تفاعل حمض الهيدروكلوريك مع الإيثيلين إلى إنتاج كلورو إيثان. يستمر التفاعل مع وسيط الكاتيون، ويكون مختلفًا عن إضافة الهالوجين المذكورة أعلاه. ويرد أدناه مثال على ذلك:
- يضيف البروتون (H + ) (من خلال العمل ككهربائي) إلى إحدى ذرات الكربون على الألكين لتكوين الكاتيون 1 .
- يتحد أيون الكلوريد (Cl - ) مع الكاتيون 1 لتشكيل التقريبين 2 و 3 .
بهذه الطريقة، تعتمد الانتقائية الفراغية للمنتج، أي من أي جانب Cl - على أنواع الألكينات المطبقة وظروف التفاعل. على الأقل، أي من ذرتي الكربون التي سيتم مهاجمتها بواسطة H + يتم تحديده عادةً بواسطة قاعدة ماركوفنيكوف . وهكذا، يهاجم H + ذرة الكربون التي تحمل بدائل أقل بحيث تتشكل الكربوهيدرات الأكثر استقرارًا (مع البدائل الأكثر استقرارًا).
هذا مثال آخر على آلية Ad E 2 . [6] يتفاعل فلوريد الهيدروجين (HF) ويوديد الهيدروجين (HI) مع الألكينات بطريقة مماثلة، وسيتم إعطاء منتجات من نوع ماركوفنيكوف. يأخذ بروميد الهيدروجين (HBr) هذا المسار أيضًا، ولكن في بعض الأحيان تتنافس عملية جذرية وقد يتشكل خليط من الأيزومرات. على الرغم من أن الكتب المدرسية التمهيدية نادرًا ما تذكر هذا البديل، [7] فإن آلية Ad E 2 تنافسية بشكل عام مع آلية Ad E 3 (الموصوفة بمزيد من التفصيل للألكينات، أدناه) ، حيث يحدث نقل البروتون والإضافة المحبة للنووية بطريقة منسقة . يعتمد مدى مساهمة كل مسار على العديد من العوامل مثل طبيعة المذيب (على سبيل المثال، القطبية) ، و نيوكليوفستي لأيون الهاليد، واستقرار الكربوهيدرات، والتأثيرات الفراغية. كأمثلة موجزة، فإن تكوين الكربوهيدرات المستقرة وغير المربوطة بشكل معقّم يفضل مسار Ad E 2 ، بينما يفضل أيون بروميد محب للنيوكليوفيل مسار Ad E 3 إلى حد أكبر مقارنة بالتفاعلات التي تتضمن أيون الكلوريد. [8]
في حالة الألكينات المستبدلة بالديالكيل (على سبيل المثال، 3-هيكسين) ، فإن كاتيون الفينيل الوسيط الذي سينتج عن هذه العملية يكون غير مستقر بدرجة عالية. في مثل هذه الحالات، يُعتقد أن البروتونات المتزامنة (بواسطة حمض الهيدروكلوريك) وهجوم الألكين بواسطة النوكليوفيل (Cl - ) يحدثان. يُعرف هذا المسار الميكانيكي بعلامة Ingold Ad E 3 ("إضافة، محبة للكهرباء، ترتيب ثالث"). نظرًا لأن التصادم المتزامن لثلاثة أنواع كيميائية في اتجاه تفاعلي غير محتمل، يُعتقد أنه يتم الوصول إلى حالة الانتقال الجزيئي عندما تهاجم النوكليوفيل ارتباطًا ضعيفًا متشكلًا بشكل عكسي للألكين و HCl. تتوافق هذه الآلية مع الإضافة المضادة في الغالب (> 15: 1 anti : syn للمثال الموضح) لمنتج المعالجة بالكلور وقانون المعدل الجزيئي، Rate = k [alkyne] [HCl] 2 . [9] [10] دعماً لترابط alkyne-HCl المقترح، تم تمييز مركب على شكل حرف T من alkyne و HCl من الناحية البلورية. [11]
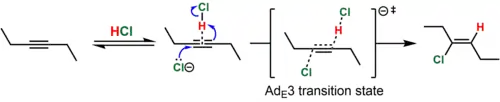
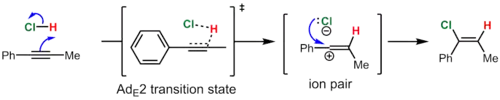
في المقابل، يتفاعل فينيلبروبين بواسطة آلية Ad E 2 ip ("إضافة، محبة للكهرباء، من الدرجة الثانية، زوج أيوني") لإعطاء منتج المزامنة في الغالب (~ 10: 1 syn : anti ). في هذه الحالة، يتم تكوين كاتيون الفينيل الوسيط بإضافة حمض الهيدروكلوريك لأنه يستقر بالرنين بواسطة مجموعة فينيل. ومع ذلك، فإن عمر هذه الأنواع عالية الطاقة قصير، وينهار زوج أيون أيون كلوريد الفينيل الناتج على الفور، قبل أن تتاح الفرصة لأيون الكلوريد لترك غلاف المذيب، لإعطاء كلوريد الفينيل. يتم استخدام قرب الأنيون من جانب فينيل الكاتيون حيث تمت إضافة البروتون لترشيد الغلبة المرصودة لإضافة التزامن. [8]
ترطيب
يستخدم حمض الكبريتيك كعامل مساعد في أحد تفاعلات الترطيب الأكثر تعقيدًا. يحدث هذا التفاعل بطريقة مشابهة لتفاعل الإضافة ولكن له خطوة إضافية يتم فيها استبدال مجموعة OSO 3 H بمجموعة OH ، مكونة كحول:
- C2H4 + H2O → C2H5OH
كما يتضح، يشارك H 2 SO 4 في التفاعل الكلي، ومع ذلك فإنه يظل دون تغيير لذلك يتم تصنيفه كعامل مساعد.
هذا هو رد الفعل بمزيد من التفصيل:
- جزيء H – OSO 3 H له شحنة δ + على ذرة H الأولية. ينجذب هذا إلى الرابطة المزدوجة ويتفاعل معها بنفس الطريقة كما كان من قبل.
- يتم ربط المتبقي (المشحون سالبًا) - OSO 3 H ion ثم بالتشكيل الكربوني ، مكونًا إيثيل هيدروجين سلفات (الطريق العلوي على المخطط أعلاه).
- عند إضافة الماء (H 2 O) وتسخين الخليط، يتم إنتاج الإيثانول (C 2 H 5 OH). تذهب ذرة الهيدروجين "الاحتياطية" من الماء إلى "استبدال" الهيدروجين "المفقود" ، وبالتالي إعادة إنتاج حمض الكبريتيك. من الممكن أيضًا وجود مسار آخر يتحد فيه جزيء الماء مباشرة مع الكربوهيدرات الوسيطة (الطريق السفلي). يصبح هذا المسار سائدًا عند استخدام حمض الكبريتيك المائي.
بشكل عام، تضيف هذه العملية جزيءًا من الماء إلى جزيء الإيثين.
يعد هذا تفاعلًا مهمًا في الصناعة، حيث إنها تنتج الإيثانول ، والتي تشمل أغراضها الوقود والمواد الأولية للمواد الكيميائية الأخرى.
مشتقات مراوان
العديد من المواد الكهربائية تكون مراوية ومستقرة بصريًا . عادةً ما تكون المواد الكهربائية اللولبية نقية بصريًا أيضًا.
أحد هذه الكواشف هو المحفز العضوي المشتق من الفركتوز المستخدم في شي إبوكسيد . [12] المحفز يمكن أن تنجزه الايبوكسيدات التماثلي للغاية من المتحولة -لغير المتحولة وثلاثي التبادل الألكينات. يتأكسد محفز شي، وهو كيتون ، بواسطة أوكسون متكافئ إلى شكل ديوكسيرين النشط قبل الشروع في الدورة التحفيزية.
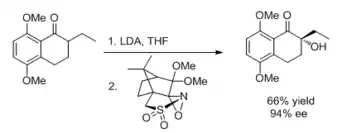
الأوكسازيريدينات مثل N- السلفونيلوكسازيريدين اللولبية تؤثر على أكسدة ألفا كيتون انتقائية في الطريق إلى شرائح إيه بي-رينج من مختلف المنتجات الطبيعية ، بما في ذلك γ-رودوميسيونون و α-سيتروميسينون. [13]
تؤثر المركبات الكهربائية السيلينيوم المتراصة بالبوليمر على تفاعلات السيلينيوم غير المتماثلة. [14] الكواشف هي بروميدات أريل سيلينيل، وقد تم تطويرها أولاً من أجل كيمياء طور المحلول ثم تم تعديلها لربط حبة الطور الصلب عبر جزء أريلوكسي. تم تطبيق الكواشف ذات الطور الصلب نحو سيلينيل العديد من الألكينات ذات انتقائية تماثلية جيدة. يمكن قطع المنتجات من الدعامة الصلبة باستخدام عوامل تقليل هيدريد القصدير العضوي. توفر الكواشف الصلبة مزايا تفوق كيمياء طور المحلول نظرًا لسهولة العمل والتنقية.
مقياس الكهرباء
| الفلور | 3.86 |
| الكلور | 3.67 |
| البروم | 3.40 |
| اليود | 3.09 |
| هيبوكلوريت | 2.52 |
| ثاني أكسيد الكبريت | 2.01 |
| ثاني كبريتيد الكربون | 1.64 |
| البنزين | 1.45 |
| صوديوم | 0.88 |
| بعض القيم المحددة [15] (بدون أبعاد) | |
توجد عدة طرق لتصنيف المواد الكهربية بالترتيب التفاعلي [16] وواحدة منها ابتكرها روبرت بار [15] بمؤشر محبة الكهرباء ω المعطى على النحو التالي:
عندما، الكهربية و صلابة كيميائية . ترتبط هذه المعادلة بالمعادلة الكلاسيكية للطاقة الكهربائية :
عندما هي المقاومة ( أوم أو Ω) و هو الجهد . وبهذا المعنى، فإن مؤشر المحبة الكهربائية هو نوع من الطاقة المحبة للكهرباء. تم العثور على ارتباطات بين الألفة الكهربية لمركبات كيميائية مختلفة ومعدلات التفاعل في الأنظمة الكيميائية الحيوية وظواهر مثل التهاب الجلد التماسي التحسسي.
يوجد أيضًا مؤشر محبة للكهرباء للجذور الحرة . [17] تتفاعل الجذور المحبة للكهرباء بقوة مثل الهالوجينات مع مواقع التفاعل الغنية بالإلكترون، وتتفاعل الجذور المحبة للنواة بقوة مثل 2-هيدروكسي بروبيل -2-yl وجذر ثلاثي بيوتيل مع تفضيل مواقع التفاعل الفقيرة بالإلكترون.
الكهرباء الفائقة
يتم تعريف المواد الكهربية الفائقة على أنها كواشف كاتيونية محبة للكهرباء مع تفاعلات محسنة بشكل كبير في وجود الأحماض الفائقة . تم وصف هذه المركبات لأول مرة من قبل جورج أ . [18] تتشكل المواد الكهربية الفائقة على شكل إلكترون فائق ينقصه الإلكترون بشكل مضاعف عن طريق الذوبان الأولي لمركب كهربائي كاتيوني. كما لاحظت Olah ، فإن خليط حمض الأسيتيك وثلاثي فلوريد البورون قادر على إزالة أيون هيدريد من الأيزوبيوتان عند دمجه مع حمض الهيدروفلوريك عن طريق تكوين حامض فائق من BF 3 و HF. الوسيط التفاعلي المسؤول هو [CH 3 CO 2 H 3 ] 2+ dication. وبالمثل، يمكن نترات الميثان إلى نيترو ميثان مع نترونيوم رباعي فلورو بورات NO
2 فرنك بلجيكي
4 فقط في وجود حمض قوي مثل حمض الفلوروسلفوريك عن طريق دهن النترونيوم البروتوني.
في الإلكترونيات الفائقة (بالإنجليزية: gitionic)، لا يتم فصل المراكز المشحونة بأكثر من ذرة واحدة، على سبيل المثال، أيون البروتونيترونيوم O = N + = O + -H ( أيون نترونيوم بروتوني ). وفي الكهربية الفائقة البعيدة ، يتم فصلها بواسطة ذرتين أو أكثر، على سبيل المثال، في كاشف الفلورة F-TEDA-BF 4 . [19]
انظر أيضا
- نيوكليوفيل.
- TRPA1 ، [20] [21] الهدف العصبي الحسي للمهيجات المحبة للكهرباء في الثدييات.
مراجع
- الاتحاد الدولي للكيمياء البحتة والتطبيقية. "electrophile". Compendium of Chemical Terminology Internet edition.
- "Nucleophiles and Electrophiles". butane.chem.uiuc.edu. مؤرشف من الأصل في 1 أغسطس 2020. اطلع عليه بتاريخ 21 سبتمبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Electrophile | chemistry". Encyclopedia Britannica (باللغة الإنجليزية). مؤرشف من الأصل في 14 أغسطس 2020. اطلع عليه بتاريخ 21 سبتمبر 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Lenoir, D.; Chiappe, C. (2003). "What is the Nature of the First-Formed Intermediates in the Electrophilic Halogenation of Alkenes, Alkynes, and Allenes?". Chem. Eur. J. 9 (5): 1036–1044. doi:10.1002/chem.200390097. PMID 12596140. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Brown, R. S. (1997). "Investigation of the Early Steps in Electrophilic Bromination through the Study of the Reaction with Sterically Encumbered Olefins". Acc. Chem. Res. 30 (3): 131–137. doi:10.1021/ar960088e. الوسيط
|CitationClass=تم تجاهله (مساعدة) - In analogy to aromatic substitution, this process has also been termed an A-SE2 mechanism.
- Vollhardt, K. Peter C.; Schore, Neil Eric. Organic chemistry : structure and function (الطبعة 7th). New York, NY. ISBN 978-1-4641-2027-5. OCLC 866584251. مؤرشف من الأصل في 11 أبريل 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - H., Lowry, Thomas (1987). Mechanism and theory in organic chemistry. Richardson, Kathleen Schueller. (الطبعة 3rd). New York: Harper & Row. ISBN 978-0060440848. OCLC 14214254. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Fahey, Robert C.; Lee, Do-Jae. (April 1968). "Polar additions to olefins and acetylenes. V. Bimolecular and termolecular mechanisms in the hydrochlorination of acetylenes". Journal of the American Chemical Society (باللغة الإنجليزية). 90 (8): 2124–2131. doi:10.1021/ja01010a034. ISSN 0002-7863. الوسيط
|CitationClass=تم تجاهله (مساعدة) - A., Carroll, Felix (2010). Perspectives on structure and mechanism in organic chemistry (الطبعة 2nd). Hoboken, N.J.: John Wiley. ISBN 9780470276105. OCLC 286483846. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Mootz, Dietrich; Deeg, Axel (July 1992). "2-Butyne and hydrogen chloride cocrystallized: solid-state geometry of Cl-H.cntdot..cntdot..cntdot..pi. hydrogen bonding to the carbon-carbon triple bond". Journal of the American Chemical Society (باللغة الإنجليزية). 114 (14): 5887–5888. doi:10.1021/ja00040a077. ISSN 0002-7863. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Wang, Z.; Tu, Y.; Frohn, M.; Zhang, J.; Shi, Y. (1997). "An Efficient Catalytic Asymmetric Epoxidation Method". J. Am. Chem. Soc. 119 (46): 11224–11235. doi:10.1021/ja972272g. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Davis, F. A.; Kumar, A.; Chen, B. C. (1991). "Chemistry of oxaziridines. 16. A short, highly enantioselective synthesis of the AB-ring segments of γ-rhodomycionone and α-citromycinone using (+)-[(8,8-dimethoxycamphoryl)sulfonyl]oxaziridine". J. Org. Chem. 56 (3): 1143–1145. doi:10.1021/jo00003a042. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Uehlin, L.; Wirth, T. (2001). "Novel Polymer-Bound Chiral Selenium Electrophiles". Org. Lett. 3 (18): 2931–2933. doi:10.1021/ol0164435. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Parr, R. G.; Szentpaly, L. v.; Liu, S. (1999). "Electrophilicity Index". J. Am. Chem. Soc. 121 (9): 1922–1924. doi:10.1021/ja983494x. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Chattaraj, P. K.; Sarkar, U.; Roy, D. R. (2006). "Electrophilicity Index". Chem. Rev. 106 (6): 2065–2091. doi:10.1021/cr040109f. PMID 16771443. الوسيط
|CitationClass=تم تجاهله (مساعدة) - De Vleeschouwer, Freija; Speybroeck, Veronique Van; Waroquier, Michel; Geerlings, Paul; De Proft, Frank (2007). "Electrophilicity and Nucleophilicity Index for Radicals". Org. Lett. 9 (14): 2721–2724. doi:10.1021/ol071038k. PMID 17559221. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Olah, George A.; Germain, Alain; Lin, Henry C.; Forsyth, David A. (1975). "Electrophilic reactions at single bonds. XVIII. Indication of protosolvated de facto substituting agents in the reactions of alkanes with acetylium and nitronium ions in superacidic media". J. Am. Chem. Soc. 97 (10): 2928–2929. doi:10.1021/ja00843a067. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Solingapuram Sai, Kiran Kumar; Gilbert, Thomas M.; Klumpp, Douglas A. (2007). "Knorr Cyclizations and Distonic Superelectrophiles". J. Org. Chem. 72 (25): 9761–9764. doi:10.1021/jo7013092. PMID 17999519. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Lin King, John V.; Emrick, Joshua J.; Kelly, Mark J. S.; Herzig, Volker; King, Glenn F.; Medzihradszky, Katalin F.; Julius, David (5 September 2019). "A Cell-Penetrating Scorpion Toxin Enables Mode-Specific Modulation of TRPA1 and Pain". Cell. 178 (6): 1362–1374.e16. doi:10.1016/j.cell.2019.07.014. ISSN 1097-4172. PMID 31447178. مؤرشف من الأصل في 3 أكتوبر 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Zhao, Jianhua; Lin King, John V.; Paulsen, Candice E.; Cheng, Yifan; Julius, David (2020-07-08). "Irritant-evoked activation and calcium modulation of the TRPA1 receptor". Nature. doi:10.1038/s41586-020-2480-9. ISSN 1476-4687. PMID 32641835. مؤرشف من الأصل في 8 يناير 2021. الوسيط
|CitationClass=تم تجاهله (مساعدة)
- بوابة علوم
- بوابة الفيزياء
- بوابة كيمياء فيزيائية
- بوابة الكيمياء
