تاريخ نظرية الجزيئات
في الكيمياء، يشير مصطلح تاريخ نظرية الجزيئات إلى تتبع أصول مفهوم أو فكرة وجود روابط كيميائية بين ذرتين أو أكثر. ترجع أصول المفهوم الحديث للجزيئات إلى فلاسفة ما قبل العلوم والفلاسفة اليونانيين أمثال ليوكيبوس الذي زعم بأن كل الكون يتكون من ذرات وفراغات. حوالي سنة 450 ق.م، افترض إيمبيدوكليس تصوّرًا للعناصر التقليدية (النار (![]() )، الأرض (
)، الأرض (![]() )، الهواء (
)، الهواء (![]() )، الماء (
)، الماء (![]() ))، و"قوى" تجاذب وتنافر تسمح للعناصر بالتفاعل. قبل ذلك، إدعى هرقليطس أن النار أو التغيير الذي نشأ من خلال الجمع بين الخصائص المتضادة كان أساسيًا لوجودنا.[1] نحى أفلاطون في محاورة طيماوس منحى فيثاغورس عندما اعتبر المكونات الرياضية كالأعداد والنقاط والخطوط والمثلثات لَبِنَات أو عناصر البناء الأساسية لهذا العالم سريع الزوال، واعتبر العناصر الأربعة النار والهواء والماء والأرض حالات للمادة يتحقق من خلالها المبادئ أو العناصر الرياضية الحقيقية.[2] كما اعتُبر عنصر خامس وهو الأثير الذي لا يفسد، جوهريًا ولبنة أساسية في الأجرام السماوية. تقبّل أرسطو نظرتي ليوكيبوس وإيمبيدوكليس إلى جانب فكرة الأثير، ثم نقلت عنهُ إلى أوروبا في القرون الوسطى وعصر النهضة. أما التأسيس للمفهوم الحديث للجزيئات، فقد بدأ يتطور في القرن التاسع عشر بالشواهد التجاربية التي لوحظت أثناء اكتشاف العناصر الكيميائية في صورتها النقية، وكيف أن الذرات الحرة للعناصر الكيميائية المختلفة مثل الهيدروجين والأكسجين يمكنها أن تتحد لتُشكّل جزيئات مستقرة كيميائيًا كجزيئات الماء.
))، و"قوى" تجاذب وتنافر تسمح للعناصر بالتفاعل. قبل ذلك، إدعى هرقليطس أن النار أو التغيير الذي نشأ من خلال الجمع بين الخصائص المتضادة كان أساسيًا لوجودنا.[1] نحى أفلاطون في محاورة طيماوس منحى فيثاغورس عندما اعتبر المكونات الرياضية كالأعداد والنقاط والخطوط والمثلثات لَبِنَات أو عناصر البناء الأساسية لهذا العالم سريع الزوال، واعتبر العناصر الأربعة النار والهواء والماء والأرض حالات للمادة يتحقق من خلالها المبادئ أو العناصر الرياضية الحقيقية.[2] كما اعتُبر عنصر خامس وهو الأثير الذي لا يفسد، جوهريًا ولبنة أساسية في الأجرام السماوية. تقبّل أرسطو نظرتي ليوكيبوس وإيمبيدوكليس إلى جانب فكرة الأثير، ثم نقلت عنهُ إلى أوروبا في القرون الوسطى وعصر النهضة. أما التأسيس للمفهوم الحديث للجزيئات، فقد بدأ يتطور في القرن التاسع عشر بالشواهد التجاربية التي لوحظت أثناء اكتشاف العناصر الكيميائية في صورتها النقية، وكيف أن الذرات الحرة للعناصر الكيميائية المختلفة مثل الهيدروجين والأكسجين يمكنها أن تتحد لتُشكّل جزيئات مستقرة كيميائيًا كجزيئات الماء.
القرن السابع عشر
كانت أقدم التصورات لشكل وطريقة الترابط بين الذرات تلك التي افترضها ليوكيبوس وديمقريطوس وإبيقور الذين اعتقدوا برؤية ديمقريطوس بأن هيئة المادة المصمتة ترجع إلى شكل الذرات التي تحتويها. لذا، فذرات الحديد صلبة وقوية بينها خطاطيف تجعلها متماسكة في صورة صلبة؛ وذرات الماء ناعمة ومنزلقة؛ وذرات الملح، نظرًا لطعمها، حادة وموجهة؛ وذرات الهواء خفيفة ومُلتفّة، وتحيط بكل المواد الأخرى.[3] وبالقياس اعتمادًا على التجربة عن طرق الحواس، قدّم ديمقريطوس صورة للذرة، يمكن تمييز بين الذرات من خلال أشكالها وأحجامها وترتيب أجزائها. وعلاوة على ذلك، قدم تفسيرًا لكيفية ترابط المواد حيث قال بأن الذرات المنفردة مزوّدة ببعض الإضافات كالخطاطيف والعيون، وذرات أخرى بكرات ومقابس (كما بالرسم).[4]
مع صعود المدرسية الفلسفية وزوال الإمبراطورية الرومانية، تم التخلي عن نظرية الذرات لعصور عديدة حيث فُضّلت نظريات العناصر الأربعة المختلفة، ثم النظريات الخيميائية. شهد القرن السابع عشر الميلادي انتعاشة لفكرة نظرية الذرات بدءًا من أعمال بيير جاسندي وإسحاق نيوتن. من بين علماء تلك الفترة، درس جاسندي بعمق التاريخ القديم، وكتب أعمال رئيسية حول فلسفة إبيقور الطبيعية فكانت دعاية كافية لتلك الفلسفة. وقال بأن حساب حجم وشكل ذرات التي تتحرك في الفراغ يُمكن من خلاله تفسير خصائص المادة. فقال بأن الحرارة ترجع إلى ذرات صغيرة ومستديرة؛ والبرودة إلى ذرات هرمية ذات أحرف حادة، تسبب الإحساس بوخز البرد القارس؛ وأن المواد الصلبة متماسكة من خلال خطاطيف متشابكة.[5] ورغم علم نيوتن بمختلف نظريات ترابط الذرات في ذلك الوقت، مثل «نظرية الخطاطيف» و«نظرية التلاصق» (الأجسام الساكنة)، ونظرية «التلاصق معًا من خلال حركات غامضة»، إلا أنه قال في المسألة 31 في كتابه الشهير البصريات الذي كتبه سنة 1704 م، أن الجسيمات تجذب بعضها البعض من خلال بعض القوى، التي «عند الاتصال المباشر تكون قوية للغاية، وعندما تكون المسافات صغيرة، تحدث التفاعلات الكيميائية، ولا يكون لها تأثير معقول بعيدًا عن الجسيمات».[6]
وبطريقة أكثر واقعية، تتبّع روبرت بويل مفهوم تجمّع أو اتحاد الذرات المتشابكة (الجزيئات) في فرضيته التي طرحها سنة 1661م في كتابه الشهير «الكيميائي المتشكك The Sceptical Chymist» وقال بأن المادة تتكون من تجمعات للجزيئات، وأن التغيرات الكيميائية تنتج من إعادة ترتيب تلك التجمعات. كما زعم بويل أن عناصر المادة الأساسية تتألف من أنواع وأحجام مختلفة من الجسيمات، سمّاها «corpuscles» يمكنها ترتيب نفسها في مجموعات. في سنة 1680 م، اعتمادًا على نظرية الانبعاث، قال الكيميائي الفرنسي نيكولا ليميري بأن حمضية أي مادة ترجع لجزيئاتها الحادة، أما قلويتها فناتجة مسامها مختلف الأحجام.[7] ووفقًا لهذه الرؤية، فإن الجزيء يتكوّن بالتشابك والتداخل الهندسي بين الجسيمات دون الذرية الحادة والمسامية.
القرن الثامن عشر
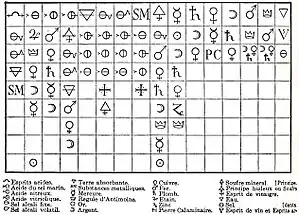
كانت نظرية «الاتحاد بالتآلف الكيميائي» واحدة من التصورات القديمة حول اتحاد الذرات. على سبيل المثال، في سنة 1718 م، وانطلاقًا من فكرة بويل حول اتحاد التجمعات، طرح الكيميائي الفرنسي إتيان فرانسوا جوفروا نظريات التآلف الكيميائي لتفسير اتحاد الجزيئات، وأرجع هذا التآلف إلى قوى خيميائية تجذب مكونات خيميائية معيّنة إلى بعضها البعض. ارتبط اسم جوفروا بجداوله للتآلف الكيميائي[8] التي قدّمها لأكاديمية العلوم الفرنسية سنتي 1718 و1720 م.
اُعدّت تلك الجداول من جمع الملاحظات حول تفاعل المواد مع بعضها، وتُظهر درجات التآلف الكيميائي المتفاوتة التي تظهر عند استخدام الكواشف الكيميائية المختلفة. احتفظت تلك الجداول ببريقها لبقية القرن، حتى استُبدلت بالمفاهيم الأعمق الذي عرضها كلود لوي برتوليه.
وفي سنة 1738 م، نشر الفيزيائي والرياضياتي السويسري دانييل برنولي كتابه «هيدروديناميكا» الذي وضع الأسس لنظرية الحركة الحرارية للغازات. في هذا العمل، وضع برنولي الفرضية، التي لا تزال صامدة إلى اليوم، بأن الغازات تتكون من عدد هائل من الجزيئات التي تتحرك في كل الاتجاهات، والتي يسبب تأثيرها على السطح تولّد ضغط الغاز المحسوس، وما نحس به من حرارة هو ببساطة الطاقة الحركية الحرارية الناتجة من حركتها. لم تُقبل تلك النظرية وقتها، نظرًا لكون قانون حفظ الطاقة لم يكن قد طُرح وقتها، ولم يكن واضحًا للفيزيائيين كيف أن التصادم بين الجزيئات مرن تمامًا.[9]:36–37
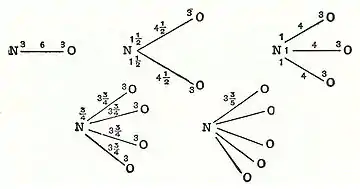
في سنة 1789 م، نشر ويليام هيجنز آرائه حول ما اسماه اتحاد الجسيمات «المُطلقة»، التي تنبأت بمفهوم نظرية رابطة التكافؤ. قال هيجنز، إذا كانت القوة بين الجسيمات المطلقة للأوكسجين والجسيمات المطلقة للنيتروجين على سبيل المثال 6، ستنقسم تلك القوة بينهم. (انظر إلى الرسم)
القرن التاسع عشر
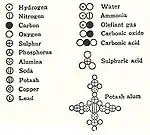
في سنة 1803 م، اتخذ جون دالتون من وزن ذرة الهيدروجين (أخف العناصر الكيميائية) كوحدة معيارية، واستخلص مثلاً أن ثلاثي أكسيد ثنائي النتروجين نسبة عناصره هي 2 إلى 3، فأعطاها الصيغة الكيميائية N2O3. ولكنه أخطأ عندما تخيّل أن الذرات متماسكة بخطاطيف لتكوين الجزيئات. لاحقًا في سنة 1808 م، نشر الرسم التوضيحي الشهير حول اتحاد العناصر.
في سنة 1811 م، نشر أميديو أفوجادرو ورقته البحثية «مقال حول معرفة الأوزان النسبية للجزيئات الأولية للأجسام». في تلك الورقة، قال مبدئيًا، ووفق ما ذكره المؤرخ «جيه آر بارتينجتون» «تاريخ مختصر للكيمياء» أن: «إن أصغر جسيمات الغازات ليست بالضرورة ذرات بسيطة، لكنها تتشكل من عدد معين من تلك الذرات متحدة بالتجاذب لتُكوّن جزيء واحد[10]».
استخدم أفوجادرو اللفظ «جزيء» للإشارة إلى كل من الذرات والجزيئات. واستخدم لفظ «جزيء أولي» للإشارة إلى الذرات، ولفظ «جزيء مركّب» إلى الأشكال الأكثر تعقيدًا من المادة. وخلال فترة إقامته في فيرتشيلي، كتب أفوجادرو مذكرة موجزة أعلن فيها عن فرضيته التي نعرفها اليوم باسم قانون أفوجادرو: «تحتوي الأحجام المتساوية من الغازات المختلفة عند نفس درجة الحرارة والضغط على عدد متساو من الجزيئات».[11] يعني ذلك أن العلاقة بين أوزان الأحجام المتساوية من الغازات المختلفة عند نفس الحرارة والضغط، تتوافق مع كتلاتها الجزيئية. وبالتالي، أوزان الجزيئات النسبية يمكن حسابها من أوزان عينات الغاز.
وضع أفوجادرو هذه الفرضية ليتوافق قانون لوي جوزيف غي لوساك الخاص بأحجام واتحاد الغازات الذي وضعه سنة 1808 م[12][13] مع النظرية الذرية لدالتون التي وضعها سنة 1803 م.[14] كان أصعب ما واجه أفوجادرو هو إيجاد حل لحالة الارتباك الكبيرة في ذلك الوقت حول مفهوم الذرات والجزيئات، حيث كان مكننا عمله هذا من التمييز بينهما، ومن الاعتراف بأن الجسيمات البسيطة من الممكن أن تتكون من جزيئات، التي بدورها تتكون من ذرات. غير أن دالتون لم يقتنع بهذه الفرضية، بل والغريب أن أفوجادرو نفسه اعتقد بأن الجزيئات تحتوي على أعداد زوجية فقط من الذرات، واستبعد أن تحتوي على أعداد فردية من الذرات.
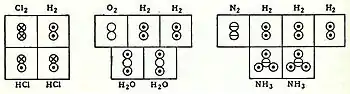
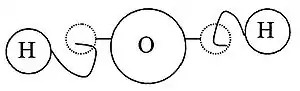
في سنة 1826 م، انطلاقًا من أعمال أفوجادرو، قال الكيميائي الفرنسي جان-باتيست دوما بأن: «الغازات في الظروف المتشابهة تتكون من جزيئات أو ذرات بينهما مسافات متساوية، فيمكننا القول أنه في الحجم معين سيحتوي على العدد نفسه من الجزيئات أو الذرات». وبالتوافق مع تلك المفاهيم، في سنة 1833 م قدّم الكيميائي الفرنسي مارك أنطوان أوغست غودان صياغة واضحة لفرضية أفوجادرو،[15] فلتوضيح الأوزان الذرية، استخدم «الرسوم التوضيحية الحجمية» التي توضّح أشكال هندسية شبه-صحيحة كجزيء الماء الخطي، وصيغ كيميائية صحيحة للجزيئات مثل H2O.
كان أوغست كيكولة أول من طرح نظرية حول كيفية ترابط الذرات في المركبات العضوية مع بعضها البعض، وذلك في ورقتين بحثيتين طرحهما سنتي 1857-1858 م، حيث افترض أن ذرات الكربون رباعية التكافؤ، ويمكنها التماسك مع بعضها لتشكيل هياكل من الجزيئات العضوية من الكربون.[16][17]
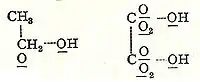
في سنة 1856 م، بدأ الكيميائي الإسكتلندي أرشيبالد سكوت كوبر أبحاثه حول هلجنة البنزين في معمل شارل فيرتز بباريس.[18] وبعد شهر من نشر كيكولة ورقته الثانية، نشر كوبر بصفة مستقلة نظريته حول بنية الجزيئات التي افترض فيها أن الذرات تترابط في بنيوات خاصة ثلاثية الأبعاد. كان كوبر أول من استخدم الخطوط للربط بين رموز الذرات للإشارة إلى الروابط، واستخدم السلاسل المستقيمة لتوضيح بنية بعض الجزيئات، والأشكال الحلقية لتوضيح بعض الجزيئات الأخرى مثل حمض الطرطريك وحمض السيانيك.[19] وفي منشورات تالية، استخدم كوبر خطوط متقطعة مستقيمة لتوضيح الروابط كما في الرسم المجاور للكحول وحمض الأكساليك.
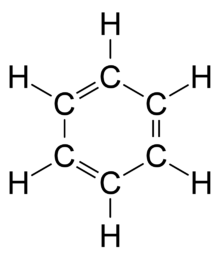
وفي سنة 1861 م، نشر مدرس نمساوي بإحدى المدارس الثانوية يدعى يوهان جوزيف لوشميت على نفقته الخاصة كُتيّب بعنوان «Chemische Studien I»، احتوى على صور رائدة للجزيئات توضّح كلا من البنى الحلقية والمزدوجة للجزيئات.[20] اقترح لوشميت أيضًا صيغة كيميائية محتملة للبنزين، ولكن دون حسم الصياغة. أما أول من افترض البنية الحديثة للبنزين، فكان كيكولة سنة 1865 م. وقد حُسمت الصيغة الحلقية للبنزين على يد عالمة البلورات كاثلين لونسدال.[21] كانت بنية البنزين تُمثّل معضلة خاصة للعلماء وقتها، فلكي تترابط كل الروابط، لا بد من وجود روابط مضاعفة بديلة للكربون (كما بالرسم المجاور). وفي سنة 1865 م، كان الكيميائي الألماني آوغست فيلهلم فون هوفمان أول من استخدم نماذج الكرة والعصا لتوضيح الجزيئات، وذلك في محاضرة ألقاها في معهد بريطانيا العظمى الملكي.

تبع هوفمان في هذا النموذج مقترح طرحه زميله ويليام أودلينغ سنة 1855 م بأن الكربون رباعي التكافؤ. ولا تزال اختيارت هوفمان لتمثيل الذرات مستخدمة إلى اليوم: نيتروجين = أزرق، أكسجين = أحمر، كلور = أخضر، كبريت = أصفر، هيدروجين = أبيض.[22] كانت أوجه قصور نموذج هوفمان الأساسية هندسية: فروابط كربون مثّلها مستوية، بدلاً من تمثيلها رباعية الأسطح، كذلك كانت الذرات غير متناسبة حجميًا، على سبيل المثال كانت ذرة الكربون أصغر من ذرة الهيدروجين. وفي سنة 1864 م، بدأ عالم الكيمياء العضوية الإسكتلندي ألكسندر كروم براون رسم صور للجزيئات مثّل فيها الذرات في صورة دوائر، واستخدم خطوط متكسرة لربط الذرات معًا بطريقة تتوافق مع تكافؤها.
كانت سنة 1873 م، سنة فارقة في تاريخ صياغة مفهوم «الجزيء»، حين نشر الفيزيائي الإسكتلندي المعروف جيمس كليرك ماكسويل مقالته الشهيرة ذات الثلاث عشرة ورقة «الجزيئات»، وذلك في عدد سبتمبر من مجلة نيتشر. قال ماكسويل في افتتاحيتها: «الذرة هي جسم لا يمكن تقسيمه إلى شطرين؛ بينما الجزيء فهو أصغر مُكوّن من مادة مُعيّنة.[23]» وبعد أن تحدث ماكسويل عن النظرية الذرية لديمقريطوس، قال ماكسويل بأن لفظ «الجزيء» هو لفظ حديث لم يرد في قاموس جونسون، وأن الأفكار التي يجسدها هذا المفهوم تنتمي للكيمياء الحديثة. لقد قيل لنا بأن الذرة هي النقطة الأساسية، محاطة بقوى محتملة، وأنه عندما تصطدم الجزيئات الطائرة في جسم صلب بتتابع ثابت، فسيُشكّل ما يسمى بضغط الهواء والغازات الأخرى. عندئذ، أشار ماكسويل إلى أنه الجزيء شئ غير ملموس، لم يسبق أن رآه أحد أو لمسه.
وفي سنة 1874 م، افترض كل من ياكوبس فانت هوف وجوزيف أشيل لو بل بصفة مستقلة أن ظاهرة التدوير الضوئي يمكن شرحها بافتراض أن الروابط الكيميائية لذرات الكربون وجيرانها تتوجه إلى أركان رباعي أوجه منتظم. أدى ذلك إلى فهم أفضل للطبيعة ثلاثية الأبعاد للجزيئات. طوّر هيرمان إميل فيشر تقنيته إسقاط فيشر لتوضيح الجزيئات ثلاثية الأبعاد على ورقة ثنائية الأبعاد.
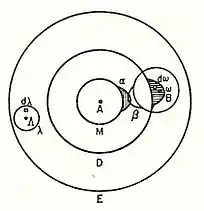
في سنة 1898 م، استخدم لودفيغ بولتزمان نظرية التكافؤ في محاضراته عن نظرية الغازات لشرح ظاهرة تفكك الجزيئات في أطوارها الغازية، ولتوضيح ذلك رسم إحدى أولى الرسومات التداخلية ليوضّح تداخل مدارات الذرات. موضّحًا الحقيقة المعروفة بأن بخار جزيء اليود يتحلل إلى ذرات عند درجات الحرارة المرتفعة. قال بولتزمان بأنه لا بد أن نتفهم وجود جزيئات تتكون من ذرتين، أو «الذرة المزدوجة» كما سمّاها بولتزمان وقتها، بينها قوى جذب تعمل بين الذرتين. كما أوضح أن التجاذب الكيميائي، الناتج من التكافؤ الكيميائي، لا بد وأن يُصاحبه منطقة نسبية صغيرة على سطح الذرة تسمى بـ «المنطقة الحساسة» التي تقع على سطح الذرة أو جزئيًا داخل الذرة، وترتبط بشدة بالذرة. وأضاف بأنه خاصةً: «فقط عندما تتموضع ذرتان بحيث تتصل منطقتيهما الحساستان، أو تتداخل جزئيًا، سينشأ تجاذب كيميائي بينهما. فيمكننا القول بأنهما ارتبطا كيميائيًا ببعضهما البعض». توضح الصورة المجاورة تداخل «المنطقة الحساسة-α» للذرة A مع «المنطقة الحساسة-β» للذرة B.[24]
القرن العشرون
في بداية القرن العشرين، بدأ الكيميائي الأمريكي جيلبرت نيوتن لويس استخدام النقاط أثناء محاضرة ألقاها على طلابه في جامعة هارفارد لتمثيل الإلكترونات حول الذرة. راقت طلابه تلك الرسوم، مما حفّزه لمواصلة جهوده في هذا الاتجاه. من خلال تلك المحاضرات، أشار لويس إلى أن عناصر ذات عدد معين من الإلكترونات يبدو أن لها استقرارًا خاصًا. كانت تلك الظاهرة قد أشار إليها الكيميائي الألماني ريتشارد أبيغ سنة 1904 م، وسمّاها لويس «قانون أبيغ للتكافؤ» (تُعرف اليوم باسم «قاعدة أبيغ»). تبيّن للويس أنه متى اجتمعت ثمانية إلكترونات حول النواة، تكتمل طبقة، ثم تبدأ أخرى من الإلكترونات. كما أشار لويس إلى أن العديد من الأيونات التي لها ثمانية إلكترونات تميل إلى الاستقرار الخاص. وبناءً على ذلك، افترض قاعدة الثمانيات: «إن الأيونات أو الذرات ذات الطبقة الممتلئة بثمانية إلكترونات لها استقرار خاص».[25]
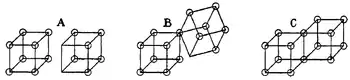
بالإضافة إلى ذلك، تصوّر لويس الذرة في صورة مكعب له ثمانية أركان تقبل تواجد الإلكترونات. ولاحقًا في سنة 1902 م، وضع تصوّره حول الذرات المكعبة التي تترابط عند أجنابها لتُكوّن جزيئات ذات بنية مكعبية. أو بعبارة أخرى، تنشأ روابط تساهمية عندما تتشارك ذرتان حافة مكعب، كما في البنية C بالرسم، فيتشاركان إلكترونين. وبالمثل، تتكون الروابط الأيونية عن طريق انتقال إلكترون من مكعب إلى آخر دون أن يتشاركا حافة A. كما افترض لويس وجود حالة وسيطة B عندما يتشارك المكعبان ركنًا واحدًا. وبالتالي، تتكون الروابط المضاعفة عندما تتشارك ذرتان مكعبتان أحد أوجه المكعب، فيتشاركان أربعة إلكترونات.
في سنة 1913 م، خلال عمله بقسم الكيمياء في جامعة كاليفورنيا ببيريكلي، قرأ لويس الخطوط العريضة لورقة بحثية للطالب الإنجليزي ألفريد لوك بارسون الذي كان في زيارة لبيركيلي لمدة عام. في تلك الورقة، اقترح بارسون أن الإلكترون ليس مجرد شحنة كهربائية، بل هو أيضًا مغناطيس صغير (أو كما سمّاه «مغناطيون»)، وعما ينشأ عن تبادل إلكترونين بين ذرتين رابطة كيميائية.[26] وبالتالي، كان ذلك يعني، بالنسبة للويس، أن الترابط حدث عندما تشارك إلكترونان حافة مكعبين (البنية C).

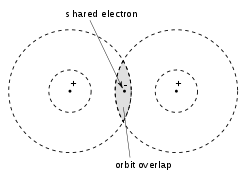
وبناءً على ذلك، قدّم لويس في مقالته الشهيرة «الذرة والجزيء» التي كتبها سنة 1916 م «بنية لويس» التي مثّل فيها الذرات والجزيئات، حيث استخدم النقاط للإشارة إلى الإلكترونات، والخطوط للإشارة إلى الروابط التساهمية، وهو المصطلح الذي صاغه لويس في تلك المقالة للإشارة إلى الرابطة التي تنتج من تشارك ذرتين لإلكترون وحتى ستة إلكترونات لتكوين الروابط أحادية الإلكترون والفردية والمزدوجة والثلاثية.[27] وعلى حد تعبير لويس: «قد يُشكّل الإلكترون جزء من غلاف ذرتين مختلفتين دون القول بأنه ينتمي لأحدهما دون الأخرى». بالإضافة إلى ذلك، افترض لويس أن الذرة تميل إلى اكتساب أو فقد عدد من الإلكترونات لتُكمل المكعب. لذا، فقد استخدم لويس في بنيواته الرموز الكيميائية للذرات لتوضيح بنية الجزيء. كما استخدم الخطوط للتوصيل بين الذرات المترابطة مع بعضها البعض؛ وأحيانًا، استخدم أزواج من النقاط بدلاً من الخطوط. تم تمثيل الإلكترونات الزائدة التي تشكل أزواجًا وحيدة بزوج من النقاط، توضع بجوار ذراتها (كما بالرسم). ولتلخيص آرائه حول نموذجه الجديد لترابط الذرات، قال لويس: «قد تتوافق ذرتان مع قاعدة الثمانيات، ليس فقط عن طريق نقل الإلكترونات من ذرة واحدة إلى أخرى، ولكن أيضًا من خلال تبادل زوج أو أكثر من الألكترونات... بالتالي يقترن زوج من الإلكترونات معًا، عندما يقعان بين مركزي ذرتين، ويبقيا مترابطان في غلاف الذرتين، وهو ما اعتبرته رابطة كيميائية. وبالتالي لدينا صورة ملموسة من هذا الكيان المادي، هذا هو "الخطاف والعين" التي هي جزء من عقيدة الكيمياء العضوية.[28]»
في السنة التالية 1917 م، أثناء دراسة لينوس باولنغ طالب الهندسة الكيميائية الأمريكي في جامعة ولاية أوريغون لنموذج ترابط الخطاف والعين الذي افترضه دالتون الذي كان يلقى رواجًا وقتئذ، وكانت فكرته أن كل ذرة لديها عدد معين من الخطاطيف التي تسمح لها بالالتصاق بالذرات الأخرى، وعدد آخر من العيون التي تسمح للذرات الأخرى للالتصاق بها، وأن الرابطة الكيميائية تحدث عند التقاء الخطاف والعين. لم يرُق لباولنغ هذه الطريقة القديمة، وتطلّع لاستخدام مجال ميكانيكا الكم الناشئ حديثًا لعمل نموذج جديد. في سنة 1927 م، استخدم الفيزيائيان فريتز لندن وفالتر هايتلر ميكانيكا الكم لدراسة مع قوى التجاذب والتنافر المُشبّعة غير الديناميكية (القوى التبادلية) لجزيء الهيدروجين. كانت دراستهم لرابطة التكافؤ في تلك المسألة، في ورقتهما المشتركة، علامة فارقة حيث أدخلت الكيمياء عالم ميكانيكا الكم. كان لعملهما هذا تأثيره على باولنغ، الذي كان قد حصل لتوه على شهادة الدكتوراه، وزار هايتلر ولندن في زيوريخ بعد أن حصل على زمالة غوغنهايم سنة 1926 م.[29]
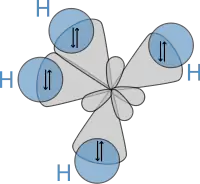
لاحقًا، سنة 1931 م، اعتمادًا على عمل هايتلر ولندن ونظريات لويس التي أوردها في مقالته الشهيرة، نشر باولنغ مقاله الرائد «طبيعة الرابطة الكيميائية».[30] (طالع: مخطوطته اليدوية) التي استخدم فيها ميكانيكا الكم لحساب خواص وبنيوات الجزيئات، كالزوايا بين الراوبط والدوران حولها. ووفق تلك المعطيات، وضع باولنغ نظرية التهجين لتفسير الروابط في جزيئات مثل CH4، الذي فيه أربعة مدارات مهجّنة sp³ تتداخل مع مدار ذرة هيدروجين 1s، فتنتج أربع روابط سيغما. الأربعة روابط لها نفس الطول والقوة، ونتج عنها بنية الجزيء. (انظر الرسم) نتيجة لتلك النظريات الاستثنائية، حصل باولنغ على جائزة نوبل في الكيمياء سنة 1954 م. والجدير بالذكر أنه الشخص الوحيد الذي حاز جائزتي نوبل منفردًا، وذلك بعد حصوله على جائزة نوبل للسلام سنة 1963 م.
في سنة 1926 م، حصل الفيزيائي الفرنسي جان بيرين على جائزة نوبل في الفيزياء لإثباته بشكل قاطع وجود الجزيئات. قام بذلك من خلال حساب ثابت أفوجادرو بثلاث طرق مختلفة، كلها تتضمن طور سائل. أولها باستخدام مستحلب الغامبوغ الذي يشبه الصابون، والثانية بعمل تجارب معملية على الحركة البراونية، والثالثة بإثبات نظرية أينشتاين حول دوران الجسيمات في طورها السائل.[31] وفي سنة 1937 م، استخدم الكيميائي كارل لوثر وولف مفهوم الجزيئات الضخمة لوصف الترابط الهيدروجيني في حمض الخليك ثنائي الوحدات.[32][33] مما فتح المجال أمام استكشاف كيمياء الجزيئات الضخمة. وفي سنة 1951 م، اخترع الفيزيائي إرفين فيلهام مولر المجهر الأيوني، فكان أول من يرى الذرات (على هيئة تجمعات ذرية مترابطة على طرف نقطة من معدن).[34]
في سنة 1999 م، سجل باحثون في جامعة فيينا نتائج تجاربهم على ازدواجية موجة-جسيم لجزيئات C60.[35] كانت النتائج التي نشرها تسيلنغر وآخرون متوافقة مع نتائج لويس دي بروي حول التداخل الموجي لجزيئات C60. وتعد هذه التجربة توسيعًا لقابلية تطبيق ازدواجية موجة-جسيم على المستوى المجهري.[36] وفي سنة 2009 م، تمكّن باحثون من آي بي إم من التقاط أول صورة لجزيء حقيقي حين استخدموا مجهر ذري القوة لتصوير كل ذرة ورابطة في جزيء البنتاسين.[37]
انظر أيضًا
المراجع
- Russell, Bertrand (2007). A History of Western Philosophy. Simon & Schuster. صفحة 41. ISBN 978-1-4165-5477-6. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Russell, Bertrand (2007). A History of Western Philosophy. Simon & Schuster. صفحة 145. ISBN 978-1-4165-5477-6. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Pfeffer, Jeremy, I.; Nir, Shlomo (2001). Modern Physics: An Introduction Text. World Scientific Publishing Company. صفحة 183. ISBN 1-86094-250-4. الوسيط
|CitationClass=تم تجاهله (مساعدة) - See testimonia DK 68 A 80, DK 68 A 37 and DK 68 A 43. See also Cassirer, Ernst (1953). An Essay on Man: an Introduction to the Philosophy of Human Culture. Doubleday & Co. صفحة 214. ISBN 0-300-00034-0. ASIN B0007EK5MM. مؤرشف من الأصل في 26 أبريل 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Leicester, Henry, M. (1956). The Historical Background of Chemistry. John Wiley & Sons. صفحة 112. ISBN 0-486-61053-5. الوسيط
|CitationClass=تم تجاهله (مساعدة) - (a) Isaac Newton, (1704). Opticks. (pg. 389). New York: Dover.
(b) Bernard, Pullman; Reisinger, Axel, R. (2001). The Atom in the History of Human Thought. Oxford University Press. صفحة 139. ISBN 0-19-515040-6. الوسيط|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Lemery, Nicolas. (1680). An Appendix to a Course of Chymistry. London, pgs 14-15.
- Eddy, Matthew Daniel (2014). "How to See a Diagram: A Visual Anthropology of Chemical Affinity". Osiris. 29: 178–196. doi:10.1086/678093. مؤرشف من الأصل في 10 مايو 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة) - L.I Ponomarev; I.V Kurchatov (1 يناير 1993). The Quantum Dice. CRC Press. ISBN 978-0-7503-0251-7. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Avogadro, Amedeo (1811). "Masses of the Elementary Molecules of Bodies". Journal de Physique. 73: 58–76. مؤرشف من الأصل في 12 مايو 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Definition". مؤرشف من الأصل في 5 أكتوبر 2016. اطلع عليه بتاريخ 3 فبراير 2016. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Gay-Lussac (1809) "Mémoire sur la combinaison des substances gazeuses, les unes avec les autres" (Memoir on the combination of gaseous substances with each other), Mémoires de la Société d'Arcueil 2: 207–234. Available in English at: Le Moyne College. نسخة محفوظة 13 فبراير 2014 على موقع واي باك مشين.
- "Joseph-Louis Gay-Lussac". chemistryexplained.com. مؤرشف من الأصل في 8 أكتوبر 2018. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Avogadro, Amedeo (1811). "Essay on a Manner of Determining the Relative Masses of the Elementary Molecules of Bodies, and the Proportions in Which They Enter into These Compounds". Journal de Physique. 73: 58–76. مؤرشف من الأصل في 12 مايو 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Seymour H. Mauskopf (1969). "The Atomic Structural Theories of Ampère and Gaudin: Molecular Speculation and Avogadro's Hypothesis". Isis. 60 (1): 61–74. doi:10.1086/350449. JSTOR 229022. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Aug. Kekulé (1857). "Über die s. g. gepaarten Verbindungen und die Theorie der mehratomigen Radicale". Annalen der Chemie und Pharmacie. 104 (2): 129–150. doi:10.1002/jlac.18571040202. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Aug. Kekulé (1858). "Ueber die Constitution und die Metamorphosen der chemischen Verbindungen und über die chemische Natur des Kohlenstoffs". Annalen der Chemie und Pharmacie. 106 (2): 129–159. doi:10.1002/jlac.18581060202. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Chemical Bonding Concepts – Oklahoma State University نسخة محفوظة 31 مايو 2017 على موقع واي باك مشين.
- Bowden, Mary Ellen (1997). Chemical achievers : the human face of the chemical sciences. Philadelphia, PA: Chemical Heritage Foundation. صفحات 90-93. ISBN 9780941901123. مؤرشف من الأصل في 10 يناير 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Bader, A. & Parker, L. (2001). "Joseph Loschmidt", Physics Today, Mar. [وصلة مكسورة] نسخة محفوظة 2 يناير 2009 على موقع واي باك مشين.
- Lonsdale, K. (1929). "The Structure of the Benzene Ring in C6 (CH3)6". Proceedings of the Royal Society A: Mathematical, Physical and Engineering Sciences. 123 (792): 494-515. Bibcode:1929RSPSA.123..494L. doi:10.1098/rspa.1929.0081. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Ollis, W. D. (1972). "Models and molecules". Proceedings of the Royal Institution of Great Britain. 45: 1–31. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Maxwell, James Clerk, "Molecules". Nature, September, 1873. نسخة محفوظة 22 يوليو 2007 على موقع واي باك مشين.
- Boltzmann, Ludwig (1898). Lectures on Gas Theory. Dover (reprint). ISBN 0-486-68455-5. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Cobb, Cathy (1995). Creations of Fire - Chemistry's Lively History From Alchemy to the Atomic Age. Perseus Publishing. ISBN 0-7382-0594-X. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Parson, A.L. (1915). "A Magneton Theory of the Structure of the Atom". Smithsonian Publication 2371, Washington.
- The Atom and the Molecule نسخة محفوظة 25 نوفمبر 2013 على موقع واي باك مشين.
- "Valence and The Structure of Atoms and Molecules", G. N. Lewis, American Chemical Society Monograph Series, page 79 and 81.
- Heitler, Walter; London, Fritz (1927). "Wechselwirkung neutraler Atome und homöopolare Bindung nach der Quantenmechanik". Zeitschrift für Physik. 44: 455–472. Bibcode:1927ZPhy...44..455H. doi:10.1007/BF01397394. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Pauling, Linus (1931). "The nature of the chemical bond. Application of results obtained from the quantum mechanics and from a theory of paramagnetic susceptibility to the structure of molecules". J. Am. Chem. Soc. 53: 1367–1400. doi:10.1021/ja01355a027. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Perrin, Jean, B. (1926). Discontinuous Structure of Matter, Nobel Lecture, December 11. نسخة محفوظة 26 يوليو 2020 على موقع واي باك مشين. [وصلة مكسورة]
- Wolf, K. L., Frahm, H. Harms, H. (1937). "The State of Arrangement of Molecules in Liquids". Z Phys. Chem., Abt. B, 36, 237–287.
- Historical Remarks on Supramolecular Chemistry – PDF (16 pg. paper) نسخة محفوظة 11 سبتمبر 2012 على موقع واي باك مشين.
- Mitch Jacoby, "Atomic Imaging Turns 50", Chemical & engineering News, 83:48, pp. 13–16, 28 November 2005 نسخة محفوظة 18 أكتوبر 2014 على موقع واي باك مشين.
- Arndt, M.; O. Nairz; J. Voss-Andreae; C. Keller; G. van der Zouw; A. Zeilinger (14 أكتوبر 1999). "Wave-particle duality of C60 molecules". Nature. 401 (6754): 680–682. Bibcode:1999Natur.401..680A. doi:10.1038/44348. PMID 18494170. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Rae, A. I. M. (14 أكتوبر 1999). "Quantum physics: Waves, particles and fullerenes". Nature. 401 (6754): 651–653. Bibcode:1999Natur.401..651R. doi:10.1038/44294. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Single molecule's stunning image. نسخة محفوظة 15 ديسمبر 2017 على موقع واي باك مشين.
للاستزادة
- Partington, J.R. (1989). A Short History of Chemistry. Dover Publications, Inc. ISBN 0-486-65977-1. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: التاريخ والسنة (link) - Atkins, Peter (2003). Atkins' Molecules, 2nd Ed. Cambridge University Press. ISBN 0-521-53536-0. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Sargent, Ted (2006). The Dance of Molecules - How Nanotechnology is Changing our Lives. Thunder's Mouth Press. ISBN 1-56025-809-8. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Scerri, Eric R. (2007). The Periodic Table, Its Story and Its Significance. Oxford University Press. ISBN 978-0-19-530573-9. الوسيط
|CitationClass=تم تجاهله (مساعدة)
وصلات خارجية
- Geometric Structures of Molecules - Middlebury College
- Atoms and Molecules - McMaster University
- 3D Molecule Viewer - The Wileys Family
- Molecule of the Month - School of Chemistry, University of Bristol
- Eric Scerri's history & philosophy of chemistry website
أنواع
- Antibody Molecule - The National Health Museum
- 15 Types of Molecules - IUPAC Definitions
تعريفات
- Molecule Definition - Frostburg State University (Department of Chemistry)
- Definition of Molecule - IUPAC
مقالات
- Molecules Used to Make Nano-sized Containers - TRN Newswire
- Molecular Computer Processors - HP Labs
- بوابة الكيمياء
- بوابة تاريخ العلوم