نموذج ملء الفراغ
نموذج ملء الفراغ هو نموذج ثلاثي الأبعاد يستخدم في الكيمياء، حيث تمثل كل كرة أحد ذرات المركب، بحيث تتناسب أقطار الكرات مع أقطار الذرات، وكذلك تتناسب المسافة بين مراكز الكرات مع المسافة بين أنوية الذرات بنفس مقياس الرسم، ويتم تمثيل العناصر المختلفة بكرات ذات ألوان مختلفة.
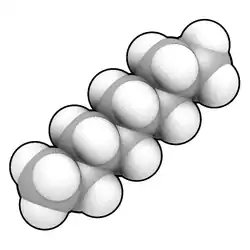
ملحوظة: الشكل الموضح يبين أحد أشكال الأيزوميرزم للجزيء، حيث تمنع طاقة جيبس الحرة الدوران حول رابطة "كربون-كربون".
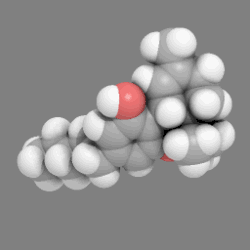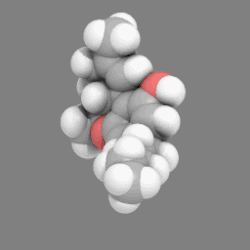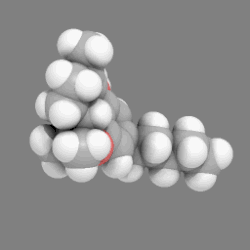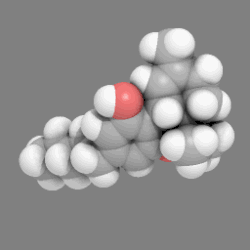
يعرف هذا النموذج أيضا باسم CPK models نسبة إلى الكيميائيين Robert Corey و Linus Pauling و Walter Koltunالذين قاموا بتطويره.[1] ويختلف هذا النموذج عن النماذج الأخرى مثل نموذج الكرة والعصا أو نموذج الصيغة الهيكلية باستخدام كرات تملء كامل الفراغ. ويعد هذا النموذج مهما لرؤية الشكل والأبعاد النسبية للجزيء، كما يمكن تمثيل الأيزوميرزم. على الجانب الآخر فهذا النموذج يغطي الروابط الكيميائية بين الذرات ويجعل من الصعب رؤية تركيب الجزيء المحجوب بالذرات القريبة من المشاهد من زاوية ما. ولذلك فإن هذا النموذج يصبح مهما إذا أمكن تحريكه لرؤية الزوايا الأخرى. (مثال: شاهد حركة النموذج لمركب رباعي هيدرو كانابينول واضعط على الصورة لدورانها).
التاريخ
ظهرت الحاجة إلى نموذج ملء الفراغ لتمثيل أسطح الجزيئات وكيف تتفاعل مع بعضها البعض. بيانات البلورات هي نقطة البداية لفهم التركيب الجزيئي الثابت، وتحتوي هذه البيانات على المعلومات المطلوبة بدقة لتوليد نموذج ملء الفراغ. ظهرت بيانات البلورات تاريخيا في صورة أقرب إلى نموذج الكرة والعصا. بينما تحتوي بيانات البلورات على المعلومات اللازمة لعمل نموذج ملء الفراغ، إلا أنها ظلت للأفراد الراغبين في نمذجة شكل ثابت فعال للجزيء، والمساحة التي يحتلها.
في عام 1952، ووصف روبرت كوري ولينوس بولينغ (Robert Corey and Linus Pauling ) نماذج مصغرة دقيقة من الجزيئات التي كانت قد بنيت في معهد كاليفورنيا للتكنولوجيا.[1] في تلك النماذج، تصوروا سطح الجزيء بأنه يمكن تحديده بواسطة نصف قطر فان دير فالس لكل ذرة من الجزيء، ووضعوا الذرات في شكل كرات الخشب الصلب بقطر يتناسب مع نصف قطر فان دير فالس لكل ذرة، بمقياس 1 بوصة = 1 Å (أنغستروم). وللسماح للروابط بين الذرات تم قطع جزء من كل كرة لإنشاء زوج من الوجوه المسطحة المتطابقة، وتحديد أبعاد القطع بحيث كانت المسافة بين مراكز الكرات تتناسب مع أطوال الأنواع القياسية من الروابط الكيميائية.[1] وقد تم تصميم وصلة معدنية تربط الكرات مثبتة في مركز الجزء المسطح. ثم تم تثبيت الكرتين معا بواسطة مسامير.
انظر أيضا
المراجع
- Corey, Robert B.; Pauling, Linus (1953). "Molecular models of amino acids, peptides, and proteins". Review of Scientific Instruments. 8 (24): 621–627. doi:10.1063/1.1770803. مؤرشف من الأصل (PDF) في 11 مايو 2020. اطلع عليه بتاريخ 23 يونيو 2015. الوسيط
|CitationClass=تم تجاهله (مساعدة)
صور
 نموذج ملء الفراغ لجزيء الهكسان الحلقي C6H12. واضح أن ذرات الكربون الرمادية قد تم تغطيتها جزئيا بذرات الهيدروجين البيضاء.
نموذج ملء الفراغ لجزيء الهكسان الحلقي C6H12. واضح أن ذرات الكربون الرمادية قد تم تغطيتها جزئيا بذرات الهيدروجين البيضاء. مثال ثلاثي الأبعاد، لنموذج ملء الفراغ من جزيء بسيط، ثاني أكسيد الكبريت، SO2، وتبين الكمون الكهربائي، المحسوب للجزيء باستخدام برمجيات من أدوات الكيمياء الحاسوبية، مظللة باللون الأزرق للمناطق موجبة الشحنة، إلى اللون الأحمر للمناطق سالبة الشحنة. تم إنشاء السطح عن طريق حساب طاقة التفاعل مع شحنة موجبة على صورة نقطة كروية (على سبيل المثال، بروتون، H+،) مع ذرات الجزيء والإلكترونات الرابطة، في سلسلة من الخطوات الحسابية المنفصلة. هنا، يؤكد السطح الكهربائي نقص الإلكترونات في ذرة الكبريت، مما يشير إلى التفاعلات الكيميائية التي قد تشارك فيها.
مثال ثلاثي الأبعاد، لنموذج ملء الفراغ من جزيء بسيط، ثاني أكسيد الكبريت، SO2، وتبين الكمون الكهربائي، المحسوب للجزيء باستخدام برمجيات من أدوات الكيمياء الحاسوبية، مظللة باللون الأزرق للمناطق موجبة الشحنة، إلى اللون الأحمر للمناطق سالبة الشحنة. تم إنشاء السطح عن طريق حساب طاقة التفاعل مع شحنة موجبة على صورة نقطة كروية (على سبيل المثال، بروتون، H+،) مع ذرات الجزيء والإلكترونات الرابطة، في سلسلة من الخطوات الحسابية المنفصلة. هنا، يؤكد السطح الكهربائي نقص الإلكترونات في ذرة الكبريت، مما يشير إلى التفاعلات الكيميائية التي قد تشارك فيها.
- بوابة الكيمياء
