التهاب الدماغ الياباني
التهاب الدماغ الياباني (بالإنجليزية: Japanese encephalitis) المعروفة سابقا باسم التهاب الدماغ الياباني باء لتمييزه عن Economo فون في اي التهاب الدماغ، هو مرض يسببه فيروس التهاب الدماغ الياباني الأمراض التي تنقلها البعوض. فيروس التهاب الدماغ الياباني هو فيروس من الفيروسات المصفرة الأسرية. الخنازير الداجنة والطيور البرية ومستودعات للفيروس ؛ انتقاله إلى البشر قد يسبب أعراض حادة. واحدة من المهم ناقلات معظم هذا المرض هو الكيولكس tritaeniorhynchus} البعوض. هذا المرض هو الأكثر انتشارا في جنوب شرق آسيا والشرق الأقصى. [4]
| التهاب الدماغ الياباني | |
|---|---|
| معلومات عامة | |
| الاختصاص | أمراض معدية |
| من أنواع | مرض فيروسي ، ومرض معدي مع الصرع ، ومرض فيروسي معدي ، واعتلال دماغي |
| الأسباب | |
| الأسباب | فيروس التهاب الدماغ الياباني |
| طريقة انتقال العامل المسبب للمرض | عبر البعوض |
| المظهر السريري | |
| الأعراض | حمى ، ونفضان ، وألم مفصلي ، وإعياء ، وصداع ، وتقيؤ [1]، وتيبس الرقبة [2]، وتشوش ذهني [3]، وغيبوبة [3] |
العلامات والأعراض
التهاب الدماغ الياباني لديه فترة الحضانة من 5 إلى 15 يوما بعد الإصابة، والغالبية العظمى من العدوى وأعراض : 1 فقط في 250 العدوى تتطور إلى التهاب الدماغ.
قسوة شديدة علامة ظهور هذا المرض لدى البشر. الحمى والصداع والشعور بالضيق وغيرها من الأعراض غير محددة من هذا المرض الذي قد يستمر لفترة تتراوح بين 1 و6 أيام. العلامات التي تنمي خلال المرحلة الحادة بالتهاب الدماغ وتشمل صلابة الرقبة، ودنف، فالج، والتشنجات، ودرجة حرارة الجسم التي أثيرت بين 38 و41 درجة مئوية. التخلف العقلي وضعت من هذا المرض عادة ما يؤدي إلى الغيبوبة. وفيات هذا المرض يختلف ولكن عموما أعلى بكثير لدى الأطفال. وقد لوحظ انتشار بطريق المشيمة. عصبية مثل هذه العيوب طويلة كما الصمم والعاطفي وlability فالج الحياة قد تحدث في أولئك الذين لديهم إصابة الجملة العصبية المركزية. في بعض الحالات المعروفة الآثار تشمل أيضا الغثيان والصداع والحمى والقيء وأحيانا تورم في الخصيتين.
تم العثور على زيادة تفعيل دبقية بعد العدوى JEV للتأثير على نتيجة إمراض الفيروسية. Microglias هي خلايا المناعة المقيم للنظام العصبي المركزي (المؤتمر الوطني السيادي)، ولها دور حاسم في الدفاع ضد غزو الكائنات المجهرية المضيف. السيتوكينات المنشط تفرز الخلايا الدبقية الصغيرة، مثل 1 - انترلوكين (ايل - 1) ألفا وعامل نخر الورم (تي. α)، والذي يمكن أن يسبب آثارا سامة في الدماغ. بالإضافة إلى ذلك، يفرز عوامل أخرى مثل ذوبان أعصاب، العصبية مثير، البروستاجلاندين، الأكسجين التفاعلية، وأنواع النيتروجين بواسطة الخلايا الدبقية الصغيرة تفعيلها.
في نموذج الفئران من التهاب الدماغ الياباني، ووجد أن في قرن آمون والمخطط، وعدد الخلايا الدبقية الصغيرة تنشيط كان أكثر من أي مكان آخر في الدماغ التي تليها في المهاد. في القشرة، وكان عدد من الخلايا الدبقية الصغيرة تنشيط أقل بكثير بالمقارنة مع مناطق أخرى من مخ الفأر. ولوحظ أيضا لمحة تعريفية الشاملة التعبير التفاضلية من السيتوكينات proinflammatory وchemokines من مناطق المخ المختلفة أثناء عدوى JEV التدريجي.
على الرغم من أن الأثر الصافي للوسطاء proinflammatory هو قتل الكائنات المعدية والخلايا المصابة، وكذلك لتحفيز إنتاج الجزيئات التي تضخيم الاستجابة المتزايدة للتلف، ومن الواضح أيضا أنه في الجهاز nonregenerating مثل المخ، وdysregulated المناعة الفطرية هل يكون الرد ضارة. التهاب الدماغ الياباني في تنظيم محكم تفعيل دبقية صغيرة على ما يبدو مضطربا، مما يؤدي إلى حلقة من التسمم الذاتي التنشيط دبقية الذي يؤدي ربما إلى المارة تلف الخلايا العصبية.
اضغط هنا للاطلاع على كيفية قراءة التصنيف فيروس التهاب الدماغ الياباني | |
|---|---|
 | |
| تصنيف الفيروسات | |
| المجموعة: | ((+)ssRNA) IV مجموعة |
| الفصيلة: | الفيروسات المصفرة |
| الجنس: | فيروسة مصفرة |
علم الفيروسات
 مقالة مفصلة: فيروس التهاب الدماغ الياباني
مقالة مفصلة: فيروس التهاب الدماغ الياباني
في المسبب للمرض فيروس التهاب الدماغ الياباني أن يكون وكيلا فيروس يلفها من الفيروسة المصفرة جنس؛ ذات الصلة عن كثب وللفيروس غرب النيل وسانت لويس التهاب الدماغ الفيروس. يتم حزم معنى واحد الإيجابية جينوم
الحمض النووي الريبي الذين تقطعت بهم السبل في قفيصة التي شكلتها والبروتين قفيصة. ويتكون المغلف الخارجي المغلف (ه) والبروتين هو مستضد واقية. أنها تساعد في دخول الفيروس إلى داخل الخلية. الجينوم بترميز أيضا البروتينات غير بنيوي عدة أيضا (ns1 وNS2a، NS2b، ns3، N4a، NS4b، NS5). ويتم إنتاج NS1 كما شكل أيضا إفرازية. ns3 هو helicase المفترضة، وNS5 هو بوليميريز الفيروسية. وقد لوحظ أن فيروس التهاب الدماغ الياباني (JEV) يصيب التجويف من الشبكة الإندوبلازمية (أوروبا) ويتراكم بسرعة كميات كبيرة من البروتينات الفيروسية لJEV.
يتم تشخيص التهاب الدماغ الياباني من خلال الكشف عن الأجسام المضادة في مصل الدم والسائل النخاعي (السائل النخاعي) عن طريق التقاط إليسا الغلوبولين المناعي.
الوقاية
عدوى مع JEV يمنح حصانة مدى الحياة. وتستند جميع اللقاحات الحالية على النمط الوراثي الثالث الفيروس. وأنتجت أول والفورمالين، المعطل الماوس والدماغ لقاح مشتقة في اليابان في 1930s وتم التحقق للاستخدام في تايوان في عام 1960 وفي تايلاند في عام 1980. وأدى الاستخدام الواسع النطاق للقاح والتحضر للسيطرة على هذا المرض في اليابان تايوان وكوريا وسنغافورة. إلى ارتفاع تكلفة اللقاح، الذي يزرع في الفئران الحية، يعني أن البلدان الفقيرة لم تكن قادرة على تحمل أن تقدم له كجزء من برنامج التحصين الروتينية.
في المملكة المتحدة، وثلاثة لقاحات المستخدمة (اثنان منها غير مرخص) والتي هي جي ميني كومبيوتر، والصليب الأخضر IXIARO (مرخص). جي ميني كومبيوتر subsequentally ومع ذلك فقد تمت إزالتها من السوق. جي ميني كومبيوتر والصليب الأخضر تتطلب ثلاث جرعات تعطى في الأيام 0، 7-14 و28-30. كانت الجرعة 1ml للأطفال والكبار، و0.5ml للرضع دون سن 36 شهرا من العمر. وقد تم إنتاج لقاح جديد IXIARO التي Intercell الطبية المحدودة، ويتطلب فقط 2 الجرعات، وغير المرخصة حاليا في الولايات المتحدة، وأوروبا (شركة المملكة المتحدة) وكندا وأستراليا.
الآثار الجانبية الأكثر شيوعا هي احمرار وألم في موقع الحقن. غير مألوف، يمكن رد فعل حول تطوير شروية بعد أربعة أيام من الحقن. لأن إنتاج لقاح من مخ الفأر، هناك خطر من المضاعفات العصبية الذاتية من حوالي 1 في مليون لقاح. ولكن في حالة IXIARO حيث لا تنتج اللقاح في أدمغة فئران المختبر باستخدام ولكن في ثقافة الخلية هناك الآثار الضارة قليلا مقارنة مع همي، الآثار الجانبية الرئيسية هي الصداع وألم عضلي.
تحييد الأجسام المضادة استمرت في التداول ما لا يقل عن 2-3 سنوات، وربما أطول. المدة الإجمالية للحماية غير معروف، ولكن بسبب عدم وجود أدلة قاطعة بشأن حماية تتجاوز ثلاث سنوات، وأوصى التعزيز كل ثلاث سنوات بالنسبة للأشخاص الذين لا يزالون في خطر [18]. وعلاوة على ذلك هناك أيضا لا تتوافر بيانات بشأن لقاحات التهاب الدماغ الياباني التبادلية الأخرى وIXIARO وأوصت تلك تحصينهم من قبل مع لقاحات التهاب الدماغ الياباني أخرى تلقي الصليب الأخضر أو التهاب الدماغ الياباني ميني كومبيوتر أو دورة الرئيسي للIXIARO.
وهناك عدد من اللقاحات الجديدة قيد التطوير. الماوس والدماغ لقاح مشتق من المرجح أن تحل محلها ثقافة خلية لقاح المستمدة على حد سواء وأكثر أمنا لإنتاج أرخص. المرخص الصين لقاح الحي الموهن في عام 1988 وأعطيت أكثر من 200 مليون جرعة، وهذا اللقاح متوفر في نيبال وسريلانكا وكوريا الجنوبية والهند. وهناك أيضا خيالية اللقاح الجديد على أساس اللقاح المضاد للحمى الصفراء التي 17D هي حاليا قيد التطوير.
العلاج
لا يوجد علاج محدد لالتهاب الدماغ الياباني والعلاج داعمة؛ مع المساعدة المقدمة من أجل التنفس والتغذية الاستيلاء أو السيطرة على النحو المطلوب. قد تمكنت يمكن رفع الضغط داخل الجمجمة مع مانيتول. وليس هناك انتقال من شخص لآخر، وبالتالي المرضى لا تحتاج إلى أن تكون معزولة.
ومن شأن تحقيق اختراق في مجال المداواة التهاب الدماغ الياباني هو تحديد مستقبلات بالعات مشاركة في شدة المرض. تقرير حديث لمجموعة الهندي يدل على تورط الوحيدات والبلاعم CLEC5A مستقبلات في استجابة التهابية شديدة العدوى في JEV من الدماغ. هذه الدراسة transcriptomic يوفر فرضية neuroinflammation وقيادة جديدة في تطوير ضد التهاب الدماغ الياباني العلاجية المناسبة.
معدلات انتشار المرض
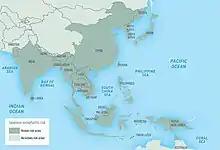
التهاب الدماغ الياباني (التهاب الدماغ الياباني) هو السبب الرئيسي لالتهاب الدماغ الفيروسي في آسيا، مع 30,000-50,000 الحالات المبلغ عنها سنويا. معدلات إماتة الحالات تتراوح بين 0,3 ٪ إلى 60 ٪ ويعتمد على السكان وعلى السن. حدثت فاشيات نادرة في الاراضي الاميركية في غرب المحيط الهادئ. سكان المناطق الريفية في مواقع المستوطنة هي الأكثر تعرضا للخطر ؛ التهاب الدماغ الياباني لا يحدث عادة في المناطق الحضرية. البلدان التي كان الأوبئة الرئيسية في الماضي، ولكن الذي كان يسيطر على المرض في المقام الأول من خلال التطعيم، وتشمل الصين وكوريا واليابان وتايوان وتايلاند. البلدان الأخرى التي لا تزال الأوبئة الدورية تشمل فيتنام وكمبوديا وميانمار، ونيبال والهند وماليزيا. وذكرت والتهاب الدماغ الياباني كان في جزر مضيق توريس وحالتا وفاة وأفيد في شمال أستراليا البر الرئيسى في عام 1998. انتشار الفيروس في أستراليا هو مصدر قلق خاص لمسؤولي الصحة الأسترالية بسبب إدخال غير المخطط للgelidus الكيولكس، ناقل محتمل للفيروس، من آسيا. ومع ذلك، فإن وجود الحالية في أستراليا البر الرئيسى هو الحد الأدنى. الإنسان والأبقار والخيول هي طريق مسدود المضيفين ويظهر مرض التهاب الدماغ والوفاة. الخنازير تقوم بدور المضيف، وتضخيم دور مهم جدا في الوبائي للمرض. العدوى في الخنازير غير متناظرة، باستثناء الحوامل يزرع، عندما الإجهاض والتشوهات الجنينية وعقابيل المشتركة. والمهم أكثر هو متجه جيم tritaeniorhynchus، الذي يتغذى على الماشية في تفضيل البشر، وكان قد اقترح نقل الخنازير بعيدا عن سكن الإنسان يمكن تحويل البعوض بعيدا عن البشر والخنازير. المضيف الطبيعي لفيروس التهاب الدماغ الياباني هو الطيور، وليس الإنسان، ويعتقد كثيرون أن ذلك الفيروس لا يمكن القضاء عليها تماما.
وقد أظهرت الأبحاث مؤخرا ميكروأري] كامل الجينوم من الخلايا العصبية في عدوى فيروس التهاب الدماغ الياباني أن الخلايا العصبية تلعب دورا هاما في على الدفاع عن نفسه ضد التهاب الدماغ الياباني عدوى فيروسية. ورغم أن هذا الاعتقاد التحديات منذ فترة طويلة أن الخلايا العصبية هي هادئة مناعيا، تحسين فهم الآثار proinflammatory المسؤولة عن مراقبة مناعية من العدوى الفيروسية والإصابات العصبية خلال العدوى JEV خطوة ضرورية لتطوير استراتيجيات للحد من شدة المرض الجهاز العصبي المركزي.
وهناك عدد من العقاقير التحقيق للحد من تكاثر الفيروس أو إما توفير الحماية العصبية في خطوط الخلايا أو الدراسات على الفئران. ودعا في الوقت الراهن لا يوجد في علاج المرضى من البشر.
- استخدام حمض rosmarinic، وarctigenin، [44] وقد ثبت أن تكون فعالة في نموذج الفأر من التهاب الدماغ الياباني، ولكن ليس هناك حتى الآن أي دليل سريري لدعم استخدامها.
- أظهرت الكركمين قد تم نقلها إلى الحماية العصبية ضد العدوى JEV في الدراسة في المختبر. الكركمين الأفعال ربما من خلال خفض مستوى رد الفعل الخلوية أنواع الأكسجين، واستعادة سلامة الغشاء الخلوي، وخفض الموالية لأفكارك جزيئات الإشارة، وتحوير مستويات البروتينات الخلوية المتصلة بالإجهاد. كان كما أظهرت أن من العدوى الفيروسية في السابق من الجزيئات المصابة هي الخلايا العصبية خفض الإنتاج، والذي يتحقق عن طريق تثبيط - proteasome نظام ubiquitin.
- المينوسكلين في الفئران أدى إلى انخفاض ملحوظ في مستويات عدة علامات، عيار الفيروسية، ومستوى وسطاء proinflammatory [48]، وكذلك يمنع تلف الدماغ حاجز الدم.
مراجع
- https://www.cdc.gov/japaneseencephalitis/symptoms/ — تاريخ الاطلاع: 26 يوليو 2017
- https://www.cdc.gov/japaneseencephalitis/symptoms/ — الرخصة: رخصة المشاع الإبداعي المُلزِمة بالنسب لمؤلِّف العمل
- معرف أنطولوجية المرض: http://www.disease-ontology.org/?id=DOID:10844 — تاريخ الاطلاع: 30 نوفمبر 2020 — الرخصة: CC0
- "التهاب الدماغ الياباني". مؤرشف من الأصل في 31 أغسطس 2018. اطلع عليه بتاريخ 9 مايو 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة)
الوصلات الخارجية
- Clark, Michael; Kumar, Parveen J. (2002). Clinical Medicine (الطبعة 5th). London: W B Saunders. ISBN 0-7020-2579-8. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - مراكز السيطرة على الأمراض والوقاية منها أسئلة وأجوبة حول التهاب الدماغ الياباني
- الحكومة الأسترالية لشؤون الصحة والشيخوخة، والتهاب الدماغ الياباني، 2004
- Monath, TP (1986). "Pathobiology of the flaviviruses". In Schlesinger, Milton J.; Schlesinger, Sondra (المحرر). The Togaviridae and Flaviviridae. New York: Plenum Press. صفحات 375–440. ISBN 0-306-42176-3. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المحررون (link) - وزارة الصحة البريطانية. (2006) التطعيم ضد الأمراض المعدية {0الفصل 20 : التهاب الدماغ الياباني
- منظمة الصحة العالمية
- التهاب الدماغ الياباني في مشروع باث
- التهاب الدماغ الياباني مكتبة الموارد[وصلة مكسورة]
- بوابة اليابان
- بوابة طب
- بوابة علم الفيروسات
- بوابة علوم عصبية
