إسترون
إيسترون ( E1 ) أو إسترون (بالإنجليزية: Estrone) هوعبارة عن ستيرويد وإستروجين ضعيف وهرمون جنسي بسيط للإناث،[1] وهو واحدًا من ثلاثة هرمونات الاستروجين الرئيسية ذات التنشؤ الداخلي، الهرمونان الآخران هما استراديول وإستريول،[1] يتكون الإيسترون وكذلك هرمونات الاستروجينات أخرى من الكوليسترول وتُفرز أساسًا من الغدد التناسلية على الرغم من أنها يمكن أيضا أن تتكون من أندروجينات الغدة الكظرية في الأنسجة الدهنية،[2] وبالنسبة للإستراديول فيكون لكل من الإسترون والإستريول نشاط أضعف بكثير مثل الإستروجين،[1] يمكن تحويل الإسترون إلى استراديول ويعمل بشكل رئيسي كمركب طليعي أو مرطب وسطي أيضي لاستراديول.[1][3] بالإضافة إلى دوره كهرمونات طبيعية فقد استخدم الإسترون كدواء، على سبيل المثال في علاج هرمون انقطاع الطمث.
النشاط البيولوجي
الإسترون هو هرمون الاستروجين وعلى وجه التحديد هو ناهض لمستقبلات هرمون الاستروجين ERα و ERβ،[1][4] وهرمون الاستروجين أقل فعالية بكثير من الاستراديول ولذلك فهو هرمون استروجين ضعيف نسبيا،[1][4][5] نظرًا للحقن تحت الجلد في الفئران يكون الاستراديول أكثر بعشرة أضعاف من الإسترون وحوالي 100 مرة أقوى من الإسترول،[6] ووفقًا لإحدى الدراسات كانت الربيطة لإسترون ERα و ERβ البشري 4.0% و 3.5% من تلك الموجودة في الإستراديول على التوالي، وكانت قدرات المعاملات النسبية للإسترون في ERα و ERβ البشري 2.6% و 4.3% من الاستراديول على التوالي،[4] وفقًا لذلك أثبتت التقارير أن النشاط الإستروجيني للإسترون هو حوالي 4% من نشاط الإراديول،[1] بالإضافة إلى قوته الاستروجينية المنخفضة، ولذلك فإن الإسترون على عكس الاستراديول والإستريول لا يتراكم في الأنسجة المستهدفة للإستروجين،[1] ونظرًا لأن الإسترون يمكن أن يتحول إلى استراديول فإن معظم الاستروجين في الإسترون في الجسم الحي يرجع في الواقع إلى التحول إلى استراديول،[1] على هذا النحو يعتبر الإسترون مقدمة أو طليعة لهرمون الاستراديول.[3]
أكدت التجارب السريرية طبيعة الإسترون كسلائف خاملة نسبياً للإستراديول،[1][7][8][9] مع إعطاء الاستراديول عن طريق الفم فإن نسبة مستويات الاستراديول إلى مستويات الإسترون تبلغ حوالي 5 مرات أعلى في المتوسط مما كانت عليه في ظل الظروف الفسيولوجية العادية لدى النساء قبل انقطاع الطمث، ومع الطرق الوريدية للإستراديول عن طريق الحقن،[1] إن تناول جرعات الاستراديول عن طريق الفم بعد انقطاع الطمث يؤدي إلى انخفاض مستويات المرحلة الجريبية للإستراديول في حين تشبه مستويات الإسترون المستويات المرتفعة التي شوهدت خلال الأشهر الثلاثة الأولى من الحمل،[1][10][11] على الرغم من المستويات المرتفعة بشكل ملحوظ من الإسترون مع الاستراديول عن طريق الفم ولكن ليس مع استراديول عبر الجلد فقد أظهرت الدراسات السريرية أن جرعات الاستراديول عن طريق الفم والجلد التي تحقق مستويات مماثلة من الإراديول تمتلك قوة مكافئة وليست ذات أهمية بشكل كبير من حيث التدابير بما في ذلك قمع الهرمون المنشط للجسم الأصفر ومستويات الهرمون المنشط للحوصلة، وتثبيط تشرب العظم، وتخفيف أعراض انقطاع الطمث مثل الهبات الساخنة،[1][7][8][9] بالإضافة إلى ذلك فإنه تم العثور على مستويات استراديول ترتبط مع هذه الآثار في حين أن مستويات الإسترون لم يفعل ذلك،[7][8] وتؤكد هذه النتائج على أن الاستروجين له نشاط استروجيني منخفض للغاية، وتشير أيضًا إلى أن الإسترون لا يقلل من النشاط الإستروجيني للإستراديول،[1][7][8][9] هذا يتناقض مع بعض الأبحاث المختبرية التي تشير إلى أن الإسترون قد يكون قادرًا على مناهضة تصرفات الإراديول جزئيًا.[12][13][14]
الكيمياء الحيوية
تخليق بيولوجي
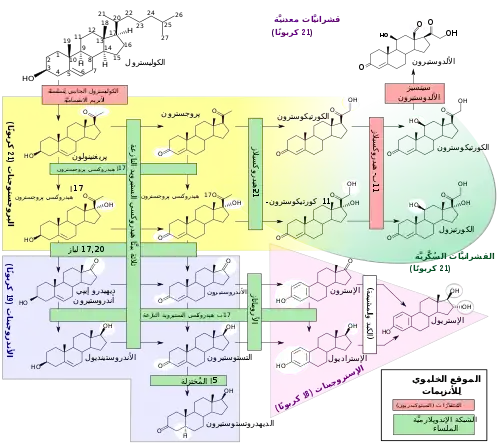
يتم اصطناع الاستروجين حيويًا من الكوليسترول، ويشمل المسار الرئيسي الاندروستيرون باعتبارها وسيط مع الاندروستيرون فيجري تحويلها إلى إيسترون من قبل انزيم الأروماتاز، يحدث هذا التفاعل في كل من الغدد التناسلية وفي بعض الأنسجة الأخرى وخاصة الأنسجة الدهنية ويتم إفراز الإسترون لاحقًا من هذه الأنسجة،[2] وبالإضافة إلى أرمتة أندروستندويون فإنه يتشكل إستيرون أيضًا بصورة عكسية من استراديول بواسطة إنزيم هيدروكس يستيرويد 17β في الأنسجة المختلفة بما في ذلك الكبد والرحم والغدة الثديية.[1]
توزيع
يرتبط الإسترون بنسبة 16% تقريبًا بالجلوبيولين المرتبط بالهرمونات الجنسية (SHBG) و 80% بالألبيومين في الدورة الدموية[1] مع الباقي (2.0 إلى 4.0٪) يتم تداوله بحرية أو بطريقة غير مُلزمة،[16] لديه حوالي 24% من تقارب ملزمة استراديول ل SHBG،[1] على هذا النحو لا يرتبط الإسترون بشكل سيئ نسبياً بـ SHBG.[17]
تمثيل غذائي
الإيسترون يتحول بيولوجيًا إلى إستروجين مقترن مثل كبريتات إيسترون و غلوكورونيد إيسترون ويمكن أيضا أن إضافة الهيدروكسيل إليه بواسطة إنزيمات سيتوكروم بي450 إلى استروجينات الكاتيكول مثل 2-هيدروكسي إسترون و 4-هيدروكسي إسترون أو إلى الايستريول،[1] كل من هذه التحولات تحدث في الغالب في الكبد،[1] كما يمكن أيضًا تحويل الإسترون إلى استراديول بواسطة 17β-HSD.[1]
المراجع
- "Pharmacology of estrogens and progestogens: influence of different routes of administration" (PDF). Climacteric. 8 Suppl 1: 3–63. أغسطس 2005. doi:10.1080/13697130500148875. PMID 16112947. مؤرشف من الأصل (PDF) في 27 مارس 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Hornstein T, Schwerin JL (1 يناير 2012). Biology of Women. Cengage Learning. صفحات 369–. ISBN 978-1-285-40102-7. مؤرشف من الأصل في 25 يناير 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - The Controversial Climacteric: The workshop moderators' reports presented at the Third International Congress on the Menopause, held in Ostend, Belgium, in June 1981, under the auspices of the International Menopause Society. Springer Science & Business Media. 6 ديسمبر 2012. صفحة 92. ISBN 978-94-011-7253-0. مؤرشف من الأصل في 25 يناير 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Evaluation of ligand selectivity using reporter cell lines stably expressing estrogen receptor alpha or beta". Biochemical Pharmacology. 71 (10): 1459–69. مايو 2006. doi:10.1016/j.bcp.2006.02.002. PMID 16554039. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Estrogen: physiology, pharmacology, and formulations for replacement therapy". Journal of Midwifery & Women's Health. 47 (3): 130–8. 2002. doi:10.1016/s1526-9523(02)00233-7. PMID 12071379. مؤرشف من الأصل في 10 ديسمبر 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة) - A. Labhart (6 ديسمبر 2012). Clinical Endocrinology: Theory and Practice. Springer Science & Business Media. صفحات 548–. ISBN 978-3-642-96158-8. مؤرشف من الأصل في 25 يناير 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Comparison of the effects of oral and transdermal oestradiol administration on oestrogen metabolism, protein synthesis, gonadotrophin release, bone turnover and climacteric symptoms in postmenopausal women". Clinical Endocrinology. 30 (3): 241–9. مارس 1989. doi:10.1111/j.1365-2265.1989.tb02232.x. PMID 2512035. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Pharmacokinetics and pharmacodynamics of transdermal dosage forms of 17 beta-estradiol: comparison with conventional oral estrogens used for hormone replacement". American Journal of Obstetrics and Gynecology. 152 (8): 1099–106. أغسطس 1985. doi:10.1016/0002-9378(85)90569-1. PMID 2992279. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Oestrogens, gonadotrophins and SHBG during oral and cutaneous administration of oestradiol-17 beta to menopausal women". Acta Endocrinologica. 101 (4): 592–6. ديسمبر 1982. doi:10.1530/acta.0.1010592. PMID 6818806. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Bio-identical steroid hormone replacement: selected observations from 23 years of clinical and laboratory practice". Annals of the New York Academy of Sciences. 1057: 506–24. ديسمبر 2005. doi:10.1196/annals.1356.039. PMID 16399916. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Hormone replacement with estradiol: conventional oral doses result in excessive exposure to estrone". Alternative Medicine Review. 10 (1): 36–41. مارس 2005. PMID 15771561. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Kloosterboer, HJ; Schoonen, WG; Verheul, HA (11 أبريل 2008). "Proliferation of Breast Cells by Steroid Hormones and Their Metabolites". In Pasqualini, Jorge R (المحرر). Breast Cancer: Prognosis, Treatment, and Prevention. CRC Press. صفحات 343–366. ISBN 978-1-4200-5873-4. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Estriol and estrone interaction with the estrogen receptor. II. Estriol and estrone-induced inhibition of the cooperative binding of [3H]estradiol to the estrogen receptor". The Journal of Biological Chemistry. 258 (13): 8118–22. يوليو 1983. PMID 6863280. مؤرشف من الأصل في 10 ديسمبر 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Estrone - a partial estradiol antagonist in the normal breast". Gynecological Endocrinology. 31 (9): 747–9. 2015. doi:10.3109/09513590.2015.1062866. PMID 26190536. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Häggström, Mikael; Richfield, David (2014). "Diagram of the pathways of human steroidogenesis". WikiJournal of Medicine. 1 (1). doi:10.15347/wjm/2014.005. ISSN 2002-4436. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Jameson JL, De Groot LJ (18 مايو 2010). Endocrinology – E-Book: Adult and Pediatric. Elsevier Health Sciences. صفحات 2813–. ISBN 978-1-4557-1126-0. مؤرشف من الأصل في 25 يناير 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - H.J. Buchsbaum (6 ديسمبر 2012). The Menopause. Springer Science & Business Media. صفحات 62, 64. ISBN 978-1-4612-5525-3. مؤرشف من الأصل في 25 يناير 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة)
- بوابة علم وظائف الأعضاء
- بوابة طب
- بوابة صيدلة
- بوابة الكيمياء الحيوية
- بوابة الكيمياء
- بوابة المرأة
 صور وملفات صوتية من كومنز
صور وملفات صوتية من كومنز