مناهضة (أدوية)
الضادة أو المناهضة أو معاكس المستقبلات (بالإنجليزية: Antagonist) مركب كيميائي قادر على الارتباط بالمستقبلات الدوائية دون إثارة أي تنبيه في هذه المستقبلات ومنع المحفزات الدوائية من الارتباط بهذه المستقبلات إما تنافسيٌا أو بشكل غير تنافسي.[1][2][3] وضواد المستقبلات الخلوية مواد قادرة على الارتباط بالمستقبلات الخلوية معيقةً الوظيفة الفسيولوجيّة العاديّة له.
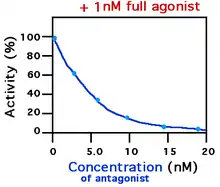
تؤثر هذه المركبات بشكل أساسي عن طريق منع ارتباط المستقبلات بمحرضاتها (شوادها) ويندرج ضمنها مجموعات كبيرة من الأدوية.
وتنقسم الضواد إلى ثلاث مجموعات:
- ضواد كيميائية
- ضواد دوائية
- ضواد فيزيولوجية
المستقبلات
المستقبلات الكيميائية الحيوية هي جزيئات بروتينية كبيرة يمكن أن تُفعَّل بارتباط ربيطة مثل هرمون أو دواء.[4] يمكن أن تكون المستقبلات مرتبطة بالغشاء كمستقبلات سطح الخلية، أو داخل الخلية كالمستقبلات داخل الخلوية مثل المستقبلات النووية بما فيها تلك الموجودة في الميتوكندريون (المتقدرة). يحدث الارتباط نتيجة للتآثرات غير التساهمية بين المستقبل وربيطته، في أماكن تُدعَى موقع الربط على المستقبل. قد يحوي المستقبل موقع ربط واحد أو أكثر لربائط مختلفة. ينظم الارتباط بالموقع الفعال للمستقبل تفعيل المستقبل بشكل مباشر. يمكن أن تُنظَّم فعالية المستقبلات بارتباط ربيطة بمواقع أخرى على المستقبل كما هو الحال في مواقع الربط التفارغية. تتواسط الضادات تأثيراتها عبر تفاعلات مع المستقبل بمنع الاستجابات المحرضة بالشادّات. قد ينجز هذا عن طريق الارتباط بالموقع الفعال أو الموقع التفارغي.[5] بالإضافة إلى ذلك، قد تتفاعل الضادات بشكل غير طبيعي مع مواقع ربط فريدة لا تكون مشاركة في الحالة الطبيعية بالتنظيم الحيوي لفعالية المستقبل لممارسة تأثيراتها.[6][7][8]
ابتكِر مصطلح الضاد في الأساس لوصف تعاريف مختلفة من التأثيرات الدوائية.[9] طرح أرينز وستيفانسون التعريف الكيميائي الحيوي لضاد المستقبل في خمسينيات القرن العشرين.[10] التعريف المقبول حاليًا لضاد المستقبل يعتمد على نموذج إشغال المستقبل. إنه يضيّق تعريف التضاد ليشمل فقط تلك المركبات ذات الفعاليات المتعاكسة على مستقبل واحد. كان يُعتقَد أن الضادات «تنبه» استجابة خلوية واحدة بارتباطها بالمستقبل، وبالتالي بدء آلية كيميائية حيوية للتغيير داخل الخلية. اعتقِد أن الضادات «توقف» هذه الاستجابة من خلال «حجب» المستقبل عن شادّه. يبقى هذا التعريف أيضًا مستخدمًا في حالة الضادات الفيزيولوجية، وهي مواد لها أفعال فيزيولوجية متعاكسة، لكنها تعمل على مستقبلات مختلفة. على سبيل المثال، يخفض الهستامين الضغط الشرياني من خلال التضييق الوعائي عبر مستقبل الهستامين H1، بينما يرفع الأدرينالين الضغط الشرياني من خلال التوسيع الوعائي المتواسط بتفعيل المستقبل الأدريناليني ألفا.
إن فهمنا لآليات تفعيل المستقبل المحرضة بالدواء، ونظرية المستقبل، والتعريف الكيميائي الحيوي لضاد المستقبل، مستمر بالتطور.[11] أفسح نموذج تفعيل المستقبل ثنائي الحالة المجال لنماذج متعددة الحالات ذات حالات مطابقة وسيطة. إن اكتشاف الانتقائية الوظيفية وأن تطابقات المستقبل النوعية للربيطة تحدث، ويمكن أن تؤثر على تفاعل المستقبلات مع أنظمة رسول ثانٍ مختلفة قد يعني أن الأدوية يمكن أن تُصمَّم لتفعيل بعض الوظائف الموافقة للمستقبل دون غيرها. هذا يعني أن الكفاءة قد تعتمد فعليًا على مكان التعبير عن المستقبل ما غيّر وجهة النظر القائلة بأن الكفاءة الدواء في مستقبل ما هي خاصية مستقلة عن المستقبل.[12]
مراجع
- Pharmacology Guide: In vitro pharmacology: concentration-response curves." غلاكسو سميث كلاين. Retrieved on December 6, 2007. نسخة محفوظة 13 يوليو 2017 على موقع واي باك مشين.
- "Failures and successes of NMDA receptor antagonists: molecular basis for the use of open-channel blockers like memantine in the treatment of acute and chronic neurologic insults". NeuroRx. 1 (1): 101–10. January 2004. doi:10.1602/neurorx.1.1.101. PMC 534915. PMID 15717010. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Memantine: a NMDA receptor antagonist that improves memory by restoration of homeostasis in the glutamatergic system—too little activation is bad, too much is even worse". Neuropharmacology. 53 (6): 699–723. November 2007. doi:10.1016/j.neuropharm.2007.07.013. PMID 17904591. الوسيط
|CitationClass=تم تجاهله (مساعدة) - T. Kenakin (2006) A Pharmacology Primer: Theory, Applications, and Methods. 2nd Edition Elsevier (ردمك 0-12-370599-1)
- "Allosteric modulation of G protein-coupled receptors". Current Pharmaceutical Design. 10 (17): 2003–13. 2004. doi:10.2174/1381612043384303. PMID 15279541. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Allosteric binding sites on cell-surface receptors: novel targets for drug discovery". Nature Reviews. Drug Discovery. 1 (3): 198–210. March 2002. doi:10.1038/nrd746. PMID 12120504. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Ligand identification for G-protein-coupled receptors: a lead generation perspective". Current Opinion in Chemical Biology. 8 (3): 287–96. June 2004. doi:10.1016/j.cbpa.2004.04.008. PMID 15183327. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "GPCR drug discovery through the exploitation of allosteric drug binding sites". Receptors & Channels. 8 (5–6): 261–8. 2002. doi:10.1080/10606820214640. PMID 12690954. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Some implications of receptor theory for in vivo assessment of agonists, antagonists and inverse agonists". Biochemical Pharmacology. 71 (12): 1663–70. June 2006. doi:10.1016/j.bcp.2005.12.038. PMC 1866283. PMID 16460689. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Affinity and intrinsic activity in the theory of competitive inhibition. I. Problems and theory". Archives Internationales de Pharmacodynamie et de Thérapie. 99 (1): 32–49. September 1954. PMID 13229418. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "G protein-coupled receptors: a count of 1001 conformations". Fundamental & Clinical Pharmacology. 19 (1): 45–56. February 2005. doi:10.1111/j.1472-8206.2005.00319.x. PMID 15660959. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Functional selectivity and classical concepts of quantitative pharmacology". The Journal of Pharmacology and Experimental Therapeutics. 320 (1): 1–13. January 2007. doi:10.1124/jpet.106.104463. PMID 16803859. مؤرشف من الأصل في 28 أبريل 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة)
