نقرس
النِقْرس (ويُعرف أيضاً بـ نِقْرس إبهام القدم عندما يصيب الأصبع الكبير للقدم)[3] هو حالة مرضية تتصف عادةً بتكرار حدوث الإصابة بالتهاب المفاصل الحاد (مفصل متورم يتصف بالإحمرار والمضض وارتفاع الحرارة). يُعد المفصل المشطي السلامي في قاعدة الإصبع الكبير للقدم أكثر الأماكن إصابة (نحو 50% من الحالات). ومع ذلك يمكن أن تكون الأعراض على هيئة توف (العقد) أو حصوات الكلى أو اعتلال الكلية اليوراتي. يرجع سبب الإصابة إلى ارتفاع مستوى حمض البول في الدم. يتبلور حمض البول ويترسب البلورات في المفاصل والأوتار والأنسجة المحيطة.
| داء النقرس | |
|---|---|
 مخلوق صغير ذو أسنان حادة يعض القدم المتورمة من مفصل الإصبع الكبير | |
| معلومات عامة | |
| الاختصاص | طب باطني |
| من أنواع | التهاب المفاصل ، واضطراب جيني ، واضطرابات ترسب البلورات ، واضطراب استقلابي |
| المظهر السريري | |
| الأعراض | ألم مفصلي [1]، وانصباب مفصلي [1]، وحمامى [1]، وتورم |
| الإدارة | |
| أدوية | ألوبيورينول ، وإيبوبروفين ، وبروبينسيد ، وإندوميتاسين ، وسولينداك ، ونابروكسين ، وسولفينبيرازون ، وأسبرين ، وفيبوكسوستات ، وديكلوفيناك ، وكولشيسين ، وبغلوتيكاز
|
| الوبائيات | |
| انتشار المرض | 0.015 [2] |
| التاريخ | |
| سُمي باسم | قطرة |
| وصفها المصدر | موسوعة بلوتو |
يتم تأكيد التشخيص السريري من خلال رؤية تلك بلورات اليورات في السائل المفصلي. العلاج بمضادات الالتهاب غير الستيرويدية (NSAIDs) أو الستيرويدات أو الكولشيسين يمكنه تحسين الأعراض. تنخفض مستويات حمض البول بعد زوال النوبة الحادة عن طريق تغيير نمط الحياة، أما مع الحالات التي تصاب بنوبات متكررة فتوفر ألوبيورينول أو بروبينسيد وقاية طويلة الأجل.
زادت معدلات الإصابة بالنِقْرس خلال العقود الأخيرة، حيث أُصيب ما يتراوح بين 1-2% من سكان الغرب في أحد مراحلهم العمرية. ويُعتقد أن هذه الزيادة ترجع إلى ارتفاع عوامل الخطورة بين السكان، مثل المتلازمة الأيضية وزيادة المتوسط المتوقع للأعمار وتغيير النظام الغذائي (الحمية). عُرف مرض النِقْرس تاريخياً بـ "داء الملوك" أو "مرض الأغنياء".
العلامات والأعراض
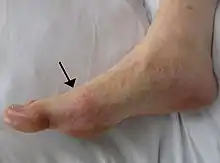
تظهر الإصابة بالنِقْرس في عدة أشكال، وإن كان أكثرها شيوعاً هو تكرار الإصابة بـ التهاب المفاصل (مفصل يتصف بالإحمرار والمضض وارتفاع الحرارة والتورم).[4] والمفصل المشطي السلامي، عند قاعدة الإصبع الكبير للقدم هو الأكثر عُرضة للإصابة، وذلك في نصف الحالات.[5] ويمكن أيضاً أن تصاب بعض المفاصل الأخرى، مثل مفاصل الكعب والركبة والمعصم والأصابع.[5] عادةً ما يستمر ألم المفاصل لمدة 2-4 ساعات وأثناء فترات الليل.[5] ويرجع سبب بدء الشعور بالألم أثناء الليل، إلى انخفاض درجة حرارة الجسم في ذلك الوقت.[3] ونادراً ما تظهر أعراض أخرى مصاحبة للشعور بالألم، منها التعب والحمى الشديدة.[3][5]
يمكن أن يؤدي استمرار الارتفاع في مستويات حمض البول (فرط حمض البول في الدم) لمدة طويلة، إلى ظهور أعراض أخرى، منها ترسبات صلبة غير مؤلمة من بلورات حمض البول، تُعرف بـ التوف. يمكن أن يؤدي انتشار التُوَف إلى الإصابة بـ التهاب المفاصل نتيجةً لتآكل العظام.[6] كما يمكن أن تتسبب المستويات المرتفعة من حمض البول إلى ترسب البلورات بالكلى مما يؤدي إلى تكوين حصوات وما يترتب عليها من الاعتلال الكلوي اليوراتي.[7]
عوامل الخطورة
هناك أشخاص معرضون أكثر من غيرهم لارتفاع مستوى حمض اليوريك في الدم، وبالتالي للإصابة بالنقرس. وهناك أمراض وراثية تزيد من سوية حمض اليوريك في الدم، إذ أن 6-18% من مرضى النقرس لديهم أشخاص آخرون في العائلة مصابون بالنقرس. إن تناول الكثير من الأطعمة الغنية بالبروتين يمكن أن يؤدي إلى إنتاج الجسم للمزيد من حمض اليوريك. ومن الأطعمة الغنية بالبروتين: المحار وللحوم الحمراء والأعضاء الداخلية للحيوانات مثل الكبد والكليتين والدماغ. كما أن الفول والحمص اليابس وسمك الأنشوفة أو البَلَم أطعمة غنية بالبورين. إن تناول الكحول يقلل من قدرة الجسم على التخلص من حمض اليوريك الفائض ويؤدي إلى ارتفاع حمض اليوريك في الدم. إن التعرض إلى مستويات عالية من الرصاص يزيد من مستوى حمض اليوريك في الدم. كما أن زيادة الوزن تزيد من خطر الإصابة بالنقرس. يزيد تناول بعض الأدوية من خطر فرط حمض اليوريك في الدم. إن الأدوية المدرة للبول تؤثر على قدرة الكليتين على طرح حمض اليوريك من الدم. وهذا يؤدي إلى زيادة مستوياته في الدم. تُعطى هذه الأدوية المدرة للبول للمرضى المصابين بارتفاع ضغط الدم وبالمشاكل القلبية. وهناك أدوية أخرى يمكن أن تزيد من مستويات حمض اليوريك في الدم مثل دواء ليفودوبا الذي يعطى لمرضى داء باركنسون، وكذلك الساليسيلات مثل الأسبرين. إن المرضى الذين يعالجون بالسيكلوسبورين معرضون كثيراً لخطر الإصابة بالنقرس. السيكلوسبورين دواء يعطى عادة لمرضى زرع الأعضاء وذلك لحمايتهم من رفض أجسامهم للأعضاء المزروعة.[8]
الأسباب
يُعد فرط حمض البول في الدم هو السبب الأساسي للإصابة بالنِقْرس. وهو ما يمكن أن يحدث نتيجةً لعدة أسباب، تتضمن النظام الغذائي أو الاستعداد الوراثي أو نقص إفراغ اليوُرات، وهي أملاح حمض البول.[4] يُعد نقص الإفراغ الكلوي لحمض البول السبب الرئيسي للإصابة بفرط حمض البول في الدم، وذلك في ما يقرب من 90% من الحالات، في حين يعتبر فرط إنتاجه هو السبب في أقل من 10% من الحالات.[9] يتعرض 10% من الأشخاص المصابين بفرط حمض البول في الدم للإصابة بالنِقْرس في مرحلة ما من حياتهم.[10] ومع ذلك تتفاوت احتمالات الإصابة وفقاً لمستوى فرط حمض البول في الدم. فعندما تتراوح تلك المستويات بين 415 و530 ميكرومول/ لتر (7 و8.9 ملجم/ ديسيلتر)، يبلغ احتمال الإصابة 0.5% سنوياً، أما لدى المصابين الذين يرتفع لديهم مستواه عن 535 ميكرومول/ لتر (9 ملجم/ ديسيلتر)، فيبلغ احتمال الإصابة 4.5% سنوياً.[3]
نمط الحياة
تُعد الأسباب المتعلقة بالنظام الغذائي مسؤولة عن 12% من حالات الإصابة بالنِقْرس[4] وترتبط الإصابة بعلاقة وطيدة مع تناول الكحوليات والمشروبات المحلاة بالفركتوز واللحوم والأطعمة البحرية.[6][11] وتتضمن الأسباب المحفزة الأخرى الرضوض الجسدية والخضوع للعمليات الجراحية.[9] كشفت الدراسات الحديثة أن العوامل الغذائية التي كان يعتقد أنها مشاركة في إحداث الإصابة هي في حقيقة الأمر غير مسؤولة عنها، وهذا يشمل تناول الخضروات الغنية بالبورين (مثل الفاصوليا والبازلاء والعدس والسبانخ) أو الغنية بالبروتين الخالص.[12][13] ويبدو أن تناول القهوة وفيتامين سي ومنتجات الألبان، بالإضافة إلى اللياقة البدنية، تعمل على خفض مخاطر التعرض للإصابة.[14][15][16] وهو ما يُعتقد بسبب تسببها الجزئي على خفض مقاومة الإنسولين.[16]
علم الوراثة
تُعزى الإصابة بالنِقْرس جزئياً إلى العوامل الوراثية التي تساهم في 60% من التنوع في مستوى حمض البول.[9] وجد أن هناك ثلاثة جينات يطلق عليها SLC2A9 وSLC22A12 وABCG2 ترتبط عادةً بالإصابة بالنِقْرس، ويمكن لهذه التنوعات الجينية أن تضاعف من إمكانية الإصابة.[17][18] فقدان الطفرات الوظيفية في جين SLC2A9 وجين SLC22A12 يؤدي إلى الفرط الوراثي في حمض البول في الدم، وذلك بإنقاص امتصاص اليورات وعدم منع إنتاجها.[18]
هناك عدة أمراض وراثية نادرة يرتبط وجودها بمرض النِقْرس، ومنها الاعتلال اليفعي العائلي للكلية بفرط حمض البول في الدم (بروتين تام-هورسفال) وداء الكلية اللبي الكيسي وفرط نشاط مخلقة فسفوريبوزيل البيروفسفات ونقص ناقلة فسفوريبوزيل هيبوزانتين-غوانين كما نرى في متلازمة لش-نيهان.[9]
الحالات الصحية
غالباً ما تحدث الإصابة بالنِقْرس بالاشتراك مع مجموعة من المشاكل الصحية. ونجد أن 75% من حالات الإصابة بالنِقْرس تصاحبها المتلازمة الأيضية والسمنة في منطقة البطن وارتفاع ضغط الدم ومقاومة الإنسولين ومستويات غير طبيعية من الدهون.[5]
ومن الحالات الصحية الأخرى التي تتفاقم مع الإصابة بالنِقْرس: كثرة كريات الدم الحمر والتسمم بالرصاص والفشل الكلوي وفقر الدم الإنحلالي والصدفية وزرع الأعضاء الصلبة.[9][19] كما أن مؤشر كتلة الجسم إذا كان مساوياً أو أكبر من 35 زاد احتمال إصابة الذكور بالنِقْرس بثلاثة أضعاف.[13] ويُعد التعرض المستديم للرصاص والكحول الملوّث بالرصاص من العوامل المساعدة على الإصابة بالنِقْرس، وذلك لتأثير الرصاص الضار على وظيفة الكلية.[20] وغالباً ما تقترن متلازمة لش-نيهان بالتهاب المفاصل النقرسي.
الأدوية
يرتبط تناول الأدوية المدرة للبول بالتعرض لهجمات النِقْرس. ولكن الجرعة الضئيلة من هيدروكلورثيازيد لا تبدو أنها ترفع خطر التعرض للإصابة.[21] تشمل الأدوية الأخرى المرتبطة بظهور المرض، النياسين والأسبرين (حمض أستيل ساليسيليك).[6] كما ترتبط بعض الأدوية الكابتة للمناعة مثل سيكلوسبورين وتاكروليموس بالإصابة بالنِقْرس،[9] ولا سيما إذا ما استخدم أولهما مع هيدروكلوروثيازيد.[22]
الفيزيولوجيا المرضية
يمثل النِقْرس خللا في أيض البورين،[9] ويحدث عندما يتبلور المستقلب النهائي من حمض البول على شكل يورات أحادية الصوديوم تترسب في المفاصل والأوتار والأنسجة المحيطة.[6] تعمل هذه البلورات لاحقاً على إثارة تفاعل التهابي مفعّل مناعياً[6] مع أحد البروتينات الرئيسية في المتعاقبة الالتهابية وهو انترلوكين 1β.[9] الفقدان التدريجي لإنزيم اليوريكاز، الذي يعمل على تفكيك حمض البول في الإنسان والرئيسيات العليا، يجعل هذه الحالة شائعة الحدوث.[9]
أما عن مثيرات ترسيب حمض البول فغير مفهومة عموماً. رغم إمكانية حدوث التبلور عند مستويات طبيعية، إلا أنه أكثر حدوثاً مع ارتفاع معدلاته.[6][23] وتعد الحرارة المنخفضة والتغير السريع في مستويات حمض البول والحماض[24][25] والتميه المفصلي وبروتينات نسيج خارج الخلية، مثل البروتيوغليكان والكولاجينات وسلفات الكوندرويتين من العوامل الأخرى التي يُعتقد أن لها أثراً كبيراً في إثارة هجمة حادة من التهاب المفاصل.[9] ويقدم الترسيب عند درجات حرارة منخفضة تفسيراً جزئياً عن سبب كون مفاصل القدم هي الأكثر تعرضاً للإصابة.[4]
يمكن أن تحدث التغيرات السريعة في مستويات حمض البول نتيجةً لعدد من العوامل، تشمل التعرض لإصابة رضية أو الخضوع لعملية جراحية أو العلاج الكيميائي، أو تناول الأدوية المدرة للبول أو التوقف عن تناول الألوبيورينول أو بدء تناوله.[3] و تُعد محصرات قنوات الكالسيوم واللوسارتان من أقل الأدوية تسبباً في حدوث الإصابة بالنِقْرس مقارنةً بالأدوية الأخرى التي تعالج ارتفاع ضغط الدم.[26]
التشخيص


يمكن تشخيص وعلاج النِقْرس بدون الحاجة لمزيد من الفحوصات إذا كان المريض مصاب بفرط حمض البول في الدم ونِقْرس إبهام القدم. وينبغي إجراء تحليل السائل الزلالي إذا لم يكن التشخيص مؤكداً.[3] ورغم الفائدة العائدة من استخدام الأشعة السينية للتعرف على الإصابة المزمنة بالنِقْرس، إلا أنها قليلة النفع في الإصابات الحادة.[9]
السائل الزلالي
يعتمد التشخيص النهائي لمرض النِقْرس على إثبات وجود بلورات اليورات أحادية الصوديوم في السائل الزلالي أو وجود التوف.[5] وينبغي فحص عينات السائل الزليلي التي تم الحصول عليها من المفاصل الملتهبة التي لم يتم تشخيص حالتها بعد، وذلك للتأكد من وجود هذه البلورات.[9] تتصف هذه البلورات بأشكال شبيهة بالأبر تحت عدسة مجهر الضوء المستقطب وهي ذات انكسار مزدوج سلبي قوي. يصعب إجراء هذا الفحص، ويتطلب الأمر مشرفاً حاصلاً على تدريب جيد.[27] كما يجب فحص السائل دون تأخير بعد الشفط، حيث تؤثر درجة الحرارة ودرجة الحموضة على قابلية البلورات على الذوبان.[9]
فحوصات الدم
فرط حمض البول في الدم هو أحد الخصائص التقليدية للنِقْرس، وإن كانت الإصابة بالنِقْرس تحدث بدون فرط حمض البول في الدم في ما يقرب من نصف الحالات، كما أن معظم الأشخاص الذين يعانون من ارتفاع مستويات حمض البول لا يصابون بالنِقْرس على الإطلاق.[5][28] تتصف أدوات التشخيص المساعدة بالمحدودية فيما يتعلق بقياس مستوى البول.[5] وتعتبر الحالة حالة فرط حمض البول في الدم إذا كان مستوى يورات البلازما أكثر من 420 ميكرومول/ لتر (7.0 ملغم/ ديسيلتر) لدى الذكور، و360 ميكرومول/ لتر (6.0 ملغم/ ديسيلتر) لدى الإناث.[29] ومن فحوصات الدم الأخرى الشائع إجراؤها عدد خلايا الدم البيضاء والكهرليات ووظيفة الكلية وسرعة ترسب الدم. ومع ذلك يمكن أن ترتفع عدد كرات الدم البيضاء أو معدل الترسيب نتيجةً للإصابة بالنِقْرس في حالة عدم وجود عدوى.[30][31] وقد تم تسجيل وصول عدد كرات الدم البيضاء إلى 40.0×109/لتر (40,000/مم3).[3]
التشخيص التفريقي
أهم تشخيص تفريقي للنِقْرس هو التهاب المفاصل الإنتاني.[5][9] وهو التشخيص الواجب أخذه بالاعتبار لدى الأشخاص الذين تظهر لديهم علامات الإصابة بالعدوى أو الذين لا تتحسن حالاتهم بالعلاج.[5] وللمساعدة على الوصول إلى تشخيص يمكن إجراء فحص صبغة غرام للسائل الزليلي وعمل استنبات بكتيري.[5] من ضمن الحالات الأخرى التي تبدو مشابهة هي النقرس الكاذب والتهاب المفاصل الروماتويدي.[5] إذا لم تكن مواضع التُوَف النقرسية في المفاصل فقد يحتمل تشخيصها خطأ على أنها سرطانة الخلايا القاعدية،[32] أو نوعاً آخر من الأورام.[33]
غذاء المصاب بالنقرس المزمن
يـُنصح بتناول غذاء فقير في البورينات فإن تناول اطعمة فقيرة بالبيورين تخفض من مستوى حمض البول في الدم.
محتوى الأغذية من البورينات و حمض البوليك:
- تركيز عال لحمض البوليك (فوق 200 مليجرام/100 جرام): بعض الأسماك النهرية، والهيرينغ، والسردين, والتونة، والدجاج المشوي، الكبد, الكلى، وشحم العجول، وبهريز اللحم، والخميرة.[34]
- تركيزات متوسطة لحمض البول (بين 80–150 مليجرام/100 جرام): اسماك القرموط، واللحم الخالي من الدهن (أبقار، عجول, دجاج), والبقوليات والفول السوداني[35]
- سكر ال فركتوز ، وهو يوجد بكثرة كإضافات لبعض منتجات الألبان، فهو يعمل على زيادة تركيز حمض البول في الجسم.[36]
- بالنسبة للمشروبا ت فهو موجود في البيرة (بين 10–23 مليجرام/100 جرام) وفي الكوكاكولا (10 مليجرام/100 جرام) حيث يكثر فيها البيورينات .[37] كما أن البيرة تحتوي على كحول وهو ضار للصحة.
- خالية أو تحتوي على القليل من حمض البول (بين 0–50 مليجرام/100 جرام): الحليب، والزبادي,و البيض، والقرع، والكوسة، والفلفل الرومي، والبطاطس والتفاح، والخبر المحتوي على الردة، والخبز، والجبن .[38]
- وما يوجد في القهوة , والشاي و الكاكاو من بيورين فهي لا تتحول في الجسم إلى حمض البول ; فتلك المشروبات ليست مضرة بالنسبة للنقرس.
الوقاية
يعمل كل من تغيير نمط الحياة والأدوية على خفض مستويات حمض البول. تتضمن الخيارات الفعالة من النظم الغذائية وأنماط الحياة، تقليل تناول اللحوم المدهنة والأحشاء الداخلية وبعض الأطعمة البحرية، وتناول كميات مناسبة من فيتامين ج، والحد من شرب الكحوليات ومن تناول الفركتوز (يوجد في كثير من المشروبات السكرية كالكوكاكولا، والفانتا وسيفين أب، والبيبسي كولا، وغيرها ) ، وتجنب السمنة وزيادة الوزن.[4] يساهم اتباع النظام الغذائي منخفض السعرات الحرارية لدى الذكور الذين يعانون من السمنة على خفض مستويات حمض البول بمقدار 100 ميكرومول/لتر (1.7 ملغم/ديسيلتر).[21] كما يعمل تناول فيتامين ج بمقدار 1,500 ملغم يومياً على خفض احتمال الإصابة بالنِقْرس بنسة 45%.[39] يرتبط تناول القهوة، والشاي، بالإصابة بالنِقْرس.[40]
كما يمكن أن يحدث النِقْرس نتيجة ثانوية لانقطاع النفس النومي وذلك عن طريق انطلاق البورين من الخلايا المفتقرة للأكسجين. ويمكن لعلاج انقطاع النفس النومي أن يقلل من حدوث نوبات النِقْرس.[41]
العلاج
إن الهدف الرئيسي للعلاج هو تهدئة أعراض النوبات الحادة.[42] يمكن الوقاية من النوبات المتكررة بواسطة العديد من العقاقير التي تستخدم لخفض مستويات حمض البول المصلي.[42] كما أن استخدام كمادات الثلج لمدة 20 إلى 30 دقيقة عدة مرات يومياً يعمل على تخفيف الألم.[4][43] تتضمن الخيارات العلاجية للنوبات الحادة العقاقير غير الستيرويدية المضادة للالتهابات (NSAIDs) والكولشيسين والستيرويدات،[4] في حين تشمل الخيارات العلاجية الوقائية الألوبيورينول والفيبوكسوستات والبروبينسيد. يمكن بخفض مستويات حمض البول أن يشفي المرض.[9] كما يُعد علاج الأمراض المصاحبة أمراً هاماً أيضاً.[9]
العقاقير غير الستيرويدية المضادة للالتهابات
تُعد العقاقير غير الستيرويدية المضادة للالتهابات الاختيار الأول المعتاد لعلاج النِقْرس، وليس هناك عامل معين أكثر أو أقل فاعلية من غيره.[4] يمكن ملاحظة التحسن خلال أربع ساعات، ويُنصح باستمرار العلاج لمدة أسبوع أو أسبوعين.[4][9] رغم هذا لا يوصى باستخدام هذه العقاقير لعلاج المرضى الذين يعانون من مشاكل صحية معينة، مثل النزف المعدي المعوي أو الفشل الكلوي أو قصور القلب.[44] ومع أن الإندوميتاسين يُعد الأكثر اسـتعمالاً تاريخياً من بين العقاقير غير الستيرويدية المضادة للالتهابات، إلا أنه يمكن تفضيل بدائل مثل الإيبوبروفين نظراً لأن آثارها الجانبية أفضل دون فاعلية أكبر.[21] يمكن إضافة مثبط مضخة البروتون للأشخاص المعرضين للإصابة بآثار جانبية معدية نتيجة تناول العقاقير غير الستيرويدية المضادة للالتهابات.[45]
الكولشيسين
يُعد الكولشيسين العلاج البديل للمرضى الذين لا يتحملون العقاقير غير الستيرويدية المضادة للالتهابات.[4] إلا أن الآثار الجانبية (اضرابات الجهاز الهضمي بشكل أساسي) تحدّ من استخدامه.[46] ومع هذا فإن اضطرابات الجهاز الهضمي تعتمد على الجرعة، ويمكن تجنبها عن طريق تناول جرعات فعالة أصغر.[21] يمكن للكولشيسين أن يتفاعل مع غيره من العقاقير الشائعة الاستخدام، ومن ضمنها الأتورفاستاتين والإريثروميسين.[46]
السترويدات
وجد أن السترويدات القشرية السكرية ذات فاعلية مماثلة للعقاقير غير الستيرويدية المضادة للالتهابات[47] ويمكن استخدامها في حالة وجود موانع لاستعمال العقاقير غير الستيرويدية المضادة للالتهابات.[4] كما أنها تؤدي إلى تحسن الحالة، ولكن يجب استبعاد الحقن داخل المفصل؛ في حالات الإصابة بعدوى المفاصل حيث تفاقم الستيرويدات من الحالة.[4]
البغلوتيكاز
تمت الموافقة على عقار البغلوتيكاز لمعالجة النِقْرس في الولايات المتحدة عام 2010.[48] ويمثل خياراً لنسبة 3% من المرضى، الذين لا يتحملون الأدوية الأخرى.[48] يتم إعطاء البغلوتيكاز عن طريق التسريب الوريدي كل أسبوعين،[48] وقد وجد أنه يعمل على خفض مستويات حمض البول لدى هذه الفئة من المرضى.[49]
الوقاية من المرض
هناك العديد من الأدوية المفيدة للوقاية من نوبات أخرى من النِقْرس، وتشمل مثبطات أكسيداز الزانتين (التي تتضمن بدورها الألوبيورينول والفيبوكسوستات) ومحفزات بيلة حمض اليوريك (منها البروبينسيد والسولفينبيرازون). عادةً لا يبدأ المريض في تناول هذه العقاقير إلا بعد مرور أسبوع أو أسبوعين على الإصابة بنوبة حادة، نظراً لمخاوف نظرية من تفاقم النوبة،[4] كما يتم تناولها غالباً مع العقاقير غير السترويدية المضادة للالتهابات أو الكولشيسين خلال الأشهر الثلاثة أو الستة الأولى.[9] ولا يوصى باستعمالها قبل أن يكون المريض قد تعرض لنوبتين من الإصابة بالنِقْرس،[4] إلا في حالة وجود تغيرات ضارة بالمفصل أو وجود تُوَف أو اعتلال الكلية اليوراتي،[7] وذلك لأن هذه الأدوية لم تثبت جدواها الاقتصادية حتى هذه المرحلة.[4] ينبغي زيادة تدابير خفض اليورات باستمرار إلى أن تصبح مستويات حمض البول المصلي أقل من 300–360 ميكرومول/لتر (5.0-6.0 ملغم/ديسيلتر).[4][9] ويُنصح بعدم الاستمرار بتناولها، إذا تزامن استعمالها مع حدوث النوبة.[5] إذا لم تنخفض المستويات عن 6.0 ملغم/ديسيلتر وكانت هناك معاودة للنوبات، يعد هذا فشلا للعلاج أو حالة من النقرس المستعصي.[50] وبشكل عام يبدو أن البروبينيسيد أقل فاعلية من الألوبيورينول.[4]
تفضل أدوية محفزات بيلة حمض اليوريك عادةً عندما يتم اكتشاف نقص إفراغ حمض البول، وهذا إذا ما أظهر تجميع نتائج فحوصات البول لمدة 24 ساعة كمية من حمض البول أقل من 800 ملغم.[51] وإن كان يوصى بعدم تناول هذه الأدوية إذا كان للشخص سجل مرضي من حصوات الكلى.[51] إذا زاد إفراز حمض البول خلال مدة 24 ساعة عن 800 ملغ، وهو ما يشير إلى فرط الإفراز، فيُفضل استعمال مثبطات أكسيداز الزانتين.[51]
تعمل مثبطات أكسيداز الزانتين (بما في ذلك الألوبيورينول والفيبوكسوستات) على منع إفراز حمض البول، ويُعد العلاج بواستطها لمدة طويلة آمناً ويمكن للمرضى تحمله، كما يمكن استعماله من قِبل الأشخاص الذين يعانون من القصور الكلوي أو الحصوات اليوراتية، ورغم هذا فقد تسبب الألوبيورينول في حدوث فرط حساسية لدى عدد قليل من الأشخاص.[4] وفي مثل هذه الحالات يُنصح باستعمال فيبوكسوستات عقاراً بديلاً.[52]
الإنذار
إذا تركت نوبة النقرس الحادة دون علاج فإنها تتراجع عادة في غضون 5-7 أيام. ومع ذلك، فإن 60٪ من الأشخاص يصابون بنوبة ثانية في غضون عام واحد.[3] المصابون بالنقرس أكثر عرضة لإمكانية الإصابة بارتفاع ضغط الدم ومرض السكري والمتلازمة الأيضية وأمراض القلب والشرايين والكلى وبالتالي فاحتمال وفاتهم أكبر.[9][53] وهذا قد يكون راجعاً جزئياً إلى ارتباطه بمقاومة الانسولين والسمنة، ولكن بعضاً من أسباب زيادة الخطر تبدو دون أسباب مرتبطة.[53]
كما أن نوبات النقرس الحادة إذا تركت دون معالجة فقد تتطور إلى مرض النقرس المزمن الذي يرافقه تدمير سطوح المفاصل وتشوه المفاصل والعقد (التوف) غير المؤلم.[9] هذه العقد (التوف) تظهر لدى 30٪ من الذين يبقون دون علاج لمدة خمس سنوات، ويكون ظهورها غالباً في الحلز من الأذن، على نتوء الزج أو على وتر أخيل [9] ومن الممكن أن تشفى بتأثير العلاج المكثف. في كثير من الأحيان يصاب المرضى بحصى الكلى أيضاً المرافق للنقرس، وتؤثر على ما بين 10 و40٪ من المصابين، وتحدث نتيجة لانخفاض درجة حموضة البول المعززة لترسب حمض اليوريك[9] ومن الممكن أن تحدث أشكال أخرى من الاضطرابات الوظيفية الكلوية المزمنة.[9]
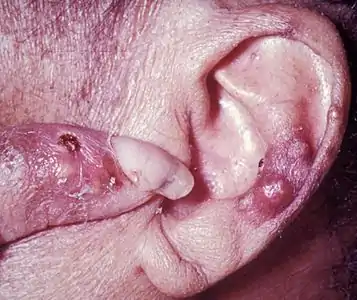 العقيدات على غضروف الأذن
العقيدات على غضروف الأذن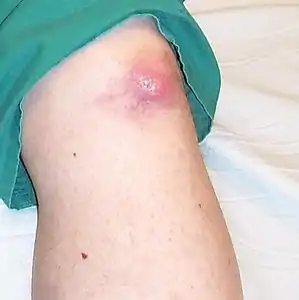 عقد في الركبة
عقد في الركبة عقد في أخمص القدمين، وعلى الكعب الخارجي
عقد في أخمص القدمين، وعلى الكعب الخارجي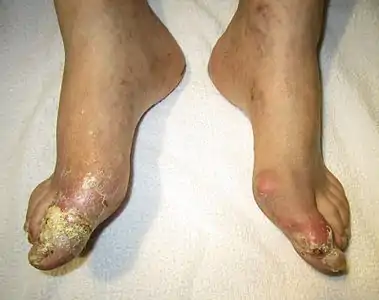 من اختلاطات النقرس بسبب تمزق للعقد(اختبارات ايجابية لبلورات حمض البول)
من اختلاطات النقرس بسبب تمزق للعقد(اختبارات ايجابية لبلورات حمض البول)
الوبائيات
يصيب النقرس حوالي 1-2٪ من سكان الغرب في مرحلة ما من حياتهم، وهو آخذ بالانتشار.[4][9] وقد تضاعفت معدلات النقرس تقريباً بين عامي 1990 و 2010.[6] ويعتقد أن هذا الارتفاع يرجع إلى ارتفاع متوسط العمر المتوقع والتغيرات في النظام الغذائي وزيادة الأمراض المرتبطة بالنقرس مثل المتلازمة الأيضية وارتفاع ضغط الدم.[13] وقد عثر على عدد من العوامل التي تؤثر على معدلات النقرس، بما في ذلك السن والعرق وموسم السنة. ويصل معدّل انتشار النقرس لدى الرجال فوق سن الثلاثين والنساء فوق سن الخمسين إلى 2٪.[44]
في الولايات المتحدة، يبلغ احتمال إصابة الذكور من أصول إفريقية بالنقرس ضعف احتمال إصابة الأميركيين من أصول أوروبية.[54] وترتفع معدلات الإصابة بين شعوب جزر المحيط الهادئ والماوري من نيوزيلندا، ولكنها نادرة الحدوث بين سكان أستراليا الأصليين رغم ارتفاع متوسط تركيز حمض اليوريك في المصل لديهم.[55] والنقرس شائع في الصين وبولينيزيا والمناطق الحضرية الأفريقية الواقعة جنوب الصحراء الكبرى.[9] وقد وجدت بعض الدراسات أن نوبات النقرس تحدث أكثر تكراراً في فصل الربيع. وقد يعزى ذلك إلى التغيرات الموسمية في النظام الغذائي واستهلاك الكحول والنشاط البدني ودرجة الحرارة.[56]
التاريخ

في اللغة الإنكليزية، استخدمت كلمة "Gout" في البداية من قبل رانددولفوس من بوكنغ في حدود عام 1200 م. وهي مستمدة من كلمة gutta اللاتينية، وتعني "قطرة" (من السائل).[57] ووفقاً لقاموس أوكسفورد بالإنكليزية، فهذا المصطلح مشتق من مذهب الأخلاط وتدل تقطير مادة ممرضة من الدم في المفاصل وحولها".[58]
ومع ذلك، فقد كان النقرس معروفاً منذ العصور القديمة. فتاريخياً، كان يشار إليه باسم ملك الأمراض ومرض الملوك[9][59] أو مرض الرجل الغني.[60] وكانت أول حالة موثقة من المرض في مصر في 2600 قبل الميلاد في وصف لالتهاب مفصل إصبع القدم الكبير. وقد علق الطبيب أبقراط الإغريقي حوالي عام 400 قبل الميلاد على ذلك في كتاب القول المأثور (باللاتينية: Aphorisms)، مشيراً إلى عدم وجوده لدى الخصيان والنساء قبل انقطاع الطمث.[57][61] وقدم آولوس كورنيليوس سلزوس (30م) وصفا لعلاقة النقرس بالكحول، بدؤه المتأخر لدى النساء، وأمراض الكلية المرتبطة بها:
| بول كثيف مرة أخرى، يحتوي على رواسب بيضاء، مما يشير إلى أن الألم والمرض موجودان في منطقة المفاصل أو الأحشاء ... مشاكل مفاصل اليدين والقدمين متكررة جداً ومستمرة، مثل تلك التي تحدث في حالات نقرس اليد ونقرس إصبع القدم. وهذه نادراً ما تصيب الخصيان أو الفتيان قبل البلوغ أو النساء ما عدا اللواتي توقف الحيض عندهن... وقد يكون لدى البعض مناعة مدى الحياة عن طريق الامتناع عن النبيذ والكحول والجماع.[62] |
في عام 1683 وصف الطبيب الإنجليزي توماس سيدنهام حدوث النقرس في الساعات الصباح الباكر وميله لإصابة الذكور الأكبر سناً:
| مرضى النقرس هم على العموم إما رجال كبار السن أو رجال ممن استهلكوا أنفسهم في الشباب وسرعوا من تقدمهم بالسن باتباع العادات الماجنة بمعدلات أكثر شيوعاً والانغماس المفرط في العلاقات الجنسية والعواطف الجياشة. يذهب الضحية إلى الفراش وينام وهو في صحة جيدة، وحوالي 2:00 صباحاً يستيقظ بسبب آلام حادة في إصبع القدم الكبير وبدرجة أكثر ندرة في الكعب أو الكاحل أو مشط القدم. الألم يشبه ألم خلع المفصل، ومع ذلك تبقى أماكن الألم كما لو أن ماء بارداً قد سكب عليها، ثم يلي ذلك القشعريرة والارتعاش،ذ وحمى بسيطة... وينقضي الليل في عذاب وأرق، وتحريك مستمر للجزء المصاب، مع تقلب الجسم المتواصل واستمرار ألم المفصل والذي يزداد سوءً عندما تأتي النوبة.[63] |
كان العالم الهولندي أنطوني فان ليفينهوك هو أول من وصف المظهر المجهري لبلورات اليورات في عام 1679.[57] وفي عام 1848، أدرك الطبيب الإنجليزي ألفريد بارينغ غارود أن هذا الفائض من حمض اليوريك في الدم هو سبب النقرس.[64]
في الحيوانات الأخرى
يعد النقرس مرضاً نادر الحدوث لدى معظم الحيوانات الأخرى بسبب قدرتها على إنتاج يوريكاز، الذي يفكك حمض اليوريك.[65] أما البشر وسواهم من القردة العليا فليس لديها هذه القدرة، وبالتالي فإن الإصابة بالنقرس شائعة بينها.[3][65] إلا أنه من المعتقد أن التيرانوصورس ريكس المعروف باسم "سو" قد عانى من مرض النقرس.[66]
بحوث
هناك عدد من الأدوية الجديدة قيد البحث لعلاج النقرس، بما في ذلك آناكينرا وكاناكينوماب وريلوناسيبت.[67] ويتوفر كل من مأشوب وأنزيم يوريكاز (راسبوريكاز) ولكن استخدامها محدود، حيث أنها تطلق استجابة المناعة الذاتية. هناك أنواع قليلة أخرى من الأجسام المضادة وحيدة النسيلة قيد التطوير.[3]
المصادر
- العنوان : Gout: an evidence-based review — المجلد: 14 — الصفحة: S55-S62 — العدد: Supplement — نشر في: Journal of Clinical Rheumatology — https://dx.doi.org/10.1097/RHU.0B013E3181896921 — https://pubmed.ncbi.nlm.nih.gov/18830092
- https://pubmed.ncbi.nlm.nih.gov/19692116
- Eggebeen AT (2007). "Gout: an update". Am Fam Physician. 76 (6): 801–8. PMID 17910294. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Chen LX, Schumacher HR (2008). "Gout: an evidence-based review". J Clin Rheumatol. 14 (5 Suppl): S55–62. doi:10.1097/RHU.0b013e3181896921. PMID 18830092. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Schlesinger N (2010). "Diagnosing and treating gout: a review to aid primary care physicians". Postgrad Med. 122 (2): 157–61. doi:10.3810/pgm.2010.03.2133. PMID 20203467. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Terkeltaub R (2010). "Update on gout: new therapeutic strategies and options". Nat Rev Rheumatol. 6 (1): 30–8. doi:10.1038/nrrheum.2009.236. PMID 20046204. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Tausche AK, Jansen TL, Schröder HE, Bornstein SR, Aringer M, Müller-Ladner U (2009). "Gout--current diagnosis and treatment". Dtsch Arztebl Int. 106 (34–35): 549–55. doi:10.3238/arztebl.2009.0549. PMC 2754667. PMID 19795010. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - موسوعة الملك عبدالله بن عبدالعزيز العربية للمحتوى الصحي
- Richette P, Bardin T (2010). "Gout". Lancet. 375 (9711): 318–28. doi:10.1016/S0140-6736(09)60883-7. PMID 19692116. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Vitart V, Rudan I, Hayward C; et al. (2008). "SLC2A9 is a newly identified urate transporter influencing serum urate concentration, urate excretion and gout". Nat. Genet. 40 (4): 437–42. doi:10.1038/ng.106. PMID 18327257. الوسيط
|CitationClass=تم تجاهله (مساعدة); Explicit use of et al. in:|مؤلف=(مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Weaver, AL (2008 Jul). "Epidemiology of gout". Cleveland Clinic journal of medicine. 75 Suppl 5: S9–12. PMID 18819329. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ=(مساعدة) - Choi HK, Atkinson K, Karlson EW, Willett W, Curhan G (2004). "Purine-rich foods, dairy and protein intake, and the risk of gout in men". N. Engl. J. Med. 350 (11): 1093–103. doi:10.1056/NEJMoa035700. PMID 15014182. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Weaver AL (2008). "Epidemiology of gout". Cleve Clin J Med. 75 Suppl 5: S9–12. PMID 18819329. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Hak AE, Choi HK (2008). "Lifestyle and gout". Curr Opin Rheumatol. 20 (2): 179–86. doi:10.1097/BOR.0b013e3282f524a2. PMID 18349748. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Williams PT (2008). "Effects of diet, physical activity and performance, and body weight on incident gout in ostensibly healthy, vigorously active men". Am. J. Clin. Nutr. 87 (5): 1480–7. PMID 18469274. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Choi HK (2010). "A prescription for lifestyle change in patients with hyperuricemia and gout". Curr Opin Rheumatol. 22 (2): 165–72. doi:10.1097/BOR.0b013e328335ef38. PMID 20035225. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Merriman, TR (2011 Jan). "The genetic basis of hyperuricaemia and gout". Joint, bone, spine : revue du rhumatisme. 78 (1): 35–40. doi:10.1016/j.jbspin.2010.02.027. PMID 20472486. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ=(مساعدة) - Reginato AM, Mount DB, Yang I, Choi HK (2012). "The genetics of hyperuricaemia and gout". Nat Rev Rheumatol. doi:10.1038/nrrheum.2012.144. PMID 22945592. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Stamp L, Searle M, O'Donnell J, Chapman P (2005). "Gout in solid organ transplantation: a challenging clinical problem". Drugs. 65 (18): 2593–611. PMID 16392875. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Loghman-Adham M (1997). "Renal effects of environmental and occupational lead exposure". Environ. Health Perspect. Brogan & Partners. 105 (9): 928–38. doi:10.2307/3433873. JSTOR 3433873. PMC 1470371. PMID 9300927. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Laubscher T, Dumont Z, Regier L, Jensen B (2009). "Taking the stress out of managing gout". Can Fam Physician. 55 (12): 1209–12. PMC 2793228. PMID 20008601. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Firestein, MD, Shaun; Budd, MD, Ralph C.; Harris Jr., MD, Edward D.; McInnes PhD, FRCP, Iain B.; Ruddy, MD; Sergent, MD, المحررون (2008). "Chapter 87: Gout and Hyperuricemia". KELLEY'S Textbook of Rheumatology (الطبعة 8th). Elsevier. ISBN 978-1-4160-4842-8. الوسيط
|CitationClass=تم تجاهله (مساعدة); الوسيط|editor1-first=و|editor-first=تكرر أكثر من مرة (مساعدة); الوسيط|editor3-given=و|editor3-first=تكرر أكثر من مرة (مساعدة) - Virsaladze DK, Tetradze LO, Dzhavashvili LV, Esaliia NG, Tananashvili DE (2007). "[Levels of uric acid in serum in patients with metabolic syndrome]" [Levels of uric acid in serum in patients with metabolic syndrome]. Georgian Med News (باللغة الروسية) (146): 35–7. PMID 17595458. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Moyer RA, John DS (2003). "Acute gout precipitated by total parenteral nutrition". The Journal of rheumatology. 30 (4): 849–50. PMID 12672211. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Halabe A, Sperling O (1994). "Uric acid nephrolithiasis". Mineral and electrolyte metabolism. 20 (6): 424–31. PMID 7783706. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Choi HK, Soriano LC, Zhang Y, Rodríguez LA (2012). "Antihypertensive drugs and risk of incident gout among patients with hypertension: population based case-control study". BMJ. 344: d8190. doi:10.1136/bmj.d8190. PMC 3257215. PMID 22240117. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Schlesinger N (2007). "Diagnosis of gout". Minerva Med. 98 (6): 759–67. PMID 18299687. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Sturrock R (2000). "Gout. Easy to misdiagnose". المجلة الطبية البريطانية. 320 (7228): 132–33. doi:10.1136/bmj.320.7228.132. PMC 1128728. PMID 10634714. مؤرشف من الأصل في 9 يوليو 2008. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Sachs L, Batra KL, Zimmermann B (2009). "Medical implications of hyperuricemia". Med Health R I. 92 (11): 353–55. PMID 19999892. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - "Gout: Differential Diagnoses & Workup - eMedicine Rheumatology". مؤرشف من الأصل في 22 ديسمبر 2010. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Gout and Pseudogout: Differential Diagnoses & Workup - eMedicine Emergency Medicine". مؤرشف من الأصل في 10 ديسمبر 2010. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Jordan DR, Belliveau MJ, Brownstein S, McEachren T, Kyrollos M (2008). "Medial canthal tophus". Ophthal Plast Reconstr Surg. 24 (5): 403–4. doi:10.1097/IOP.0b013e3181837a31. PMID 18806664. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Sano K, Kohakura Y, Kimura K, Ozeki S (2009). "Atypical Triggering at the Wrist due to Intratendinous Infiltration of Tophaceous Gout". Hand (N Y). 4 (1): 78–80. doi:10.1007/s11552-008-9120-4. PMC 2654956. PMID 18780009. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Tabelle der Lebensmittel mit hohem Harnsäuregehalt, (PDF; 85 kB) Bayerisches Staatsministeriums für Umwelt, Gesundheit und Verbraucherschutz. نسخة محفوظة 4 مارس 2016, على موقع واي باك مشين.
- Tabelle der Lebensmittel mit mittlerem Harnsäuregehalt, (PDF; 83 kB) Bayerisches Staatsministeriums für Umwelt, Gesundheit und Verbraucherschutz. نسخة محفوظة 4 مارس 2016 على موقع واي باك مشين.
- Duk-Hee Kang, Richard J. Johnson: Hyperuricemia, Gout, and the Kidney. In: Robert W. Schrier: Diseases of the kidney & urinary tract. 8. Auflage. Lippincott Williams & Wilkins, 2007, ISBN 978-0-7817-9307-0, S. 1986–1988.
- Nepomuk Zöllner, Brigitte Zöllner: Diät bei Gicht und Harnsäuresteinen. Falken Verlag, Niedernhausen/Ts. 1990, ISBN 3-8068-3205-6.
- Tabelle der Lebensmittel mit sehr geringem Harnsäuregehalt, (PDF; 198 kB) Bayerisches Staatsministeriums für Umwelt, Gesundheit und Verbraucherschutz. نسخة محفوظة 12 مايو 2016 على موقع واي باك مشين.
- Choi HK, Gao X, Curhan G (2009). "Vitamin C intake and the risk of gout in men: a prospective study". Arch. Intern. Med. 169 (5): 502–7. doi:10.1001/archinternmed.2008.606. PMC 2767211. PMID 19273781. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Choi HK, Curhan G (2007). "Coffee, tea, and caffeine consumption and serum uric acid level: the third national health and nutrition examination survey". Arthritis Rheum. 57 (5): 816–21. doi:10.1002/art.22762. PMID 17530681. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Abrams B (2005). "Gout is an indicator of sleep apnea". Sleep. 28 (2): 275. PMID 16171252. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Zhang W, Doherty M, Bardin T; et al. (2006). "EULAR evidence based recommendations for gout. Part II: Management. Report of a task force of the EULAR Standing Committee for International Clinical Studies Including Therapeutics (ESCISIT)". Ann. Rheum. Dis. 65 (10): 1312–24. doi:10.1136/ard.2006.055269. PMC 1798308. PMID 16707532. الوسيط
|CitationClass=تم تجاهله (مساعدة); Explicit use of et al. in:|مؤلف=(مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Schlesinger N; et al. (2002). "Local ice therapy during bouts of acute gouty arthritis". J. Rheumatol. 29 (2): 331–4. doi:10.1093/rheumatology/29.5.331. PMID 11838852. الوسيط
|CitationClass=تم تجاهله (مساعدة); Explicit use of et al. in:|مؤلف=(مساعدة) - Winzenberg T, Buchbinder R (2009). "Cochrane Musculoskeletal Group review: acute gout. Steroids or NSAIDs? Let this overview from the Cochrane Group help you decide what's best for your patient". J Fam Pract. 58 (7): E1–4. PMID 19607767. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Clinical Knowledge Summaries. "Gout - Management -- What treatment is recommended in acute gout?". المعهد الوطني للصحة وتفوق الرعاية. مؤرشف من الأصل في 16 ديسمبر 2008. اطلع عليه بتاريخ 26 أكتوبر 2008. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Information for Healthcare Professionals: New Safety Information for Colchicine (marketed as Colcrys)". إدارة الغذاء والدواء. مؤرشف من الأصل في 22 يوليو 2017. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Man CY, Cheung IT, Cameron PA, Rainer TH (2007). "Comparison of oral prednisolone/paracetamol and oral indomethacin/paracetamol combination therapy in the treatment of acute goutlike arthritis: a double-blind, randomized, controlled trial". Annals of Emergency Medicine. 49 (5): 670–7. doi:10.1016/j.annemergmed.2006.11.014. PMID 17276548. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - "FDA approves new drug for gout". FDA. مؤرشف من الأصل في 18 يناير 2017. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Sundy, JS (2011 Aug 17). "Efficacy and tolerability of pegloticase for the treatment of chronic gout in patients refractory to conventional treatment: two randomized controlled trials". JAMA: the Journal of the American Medical Association. 306 (7): 711–20. doi:10.1001/jama.2011.1169. PMID 21846852. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ=(مساعدة) - Ali, S (2009 Nov). "Treatment failure gout". Medicine and health, Rhode Island. 92 (11): 369–71. PMID 19999896. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ=(مساعدة) - Elizabeth D Agabegi; Agabegi, Steven S. (2008). Step-Up to Medicine (Step-Up Series). Hagerstwon, MD: Lippincott Williams & Wilkins. صفحة 251. ISBN 0-7817-7153-6. مؤرشف من الأصل في 8 نوفمبر 2014. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - "Febuxostat for the management of hyperuricaemia in people with gout (TA164) Chapter 4. Consideration of the evidence". Guidance.nice.org.uk. مؤرشف من الأصل في 14 مايو 2013. اطلع عليه بتاريخ 20 أغسطس 2011. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Kim SY, De Vera MA, Choi HK (2008). "Gout and mortality". Clin. Exp. Rheumatol. 26 (5 Suppl 51): S115–9. PMID 19026153. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Rheumatology Therapeutics Medical Center. "What Are the Risk Factors for Gout?". مؤرشف من الأصل في 1 يناير 2012. اطلع عليه بتاريخ 26 يناير 2007. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Roberts-Thomson RA, Roberts-Thomson PJ (1999). "Rheumatic disease and the Australian aborigine". Ann. Rheum. Dis. 58 (5): 266–70. doi:10.1136/ard.58.5.266. PMC 1752880. PMID 10225809. مؤرشف من الأصل في 19 يونيو 2006. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Fam AG (2000). "What is new about crystals other than monosodium urate?". Curr Opin Rheumatol. 12 (3): 228–34. doi:10.1097/00002281-200005000-00013. PMID 10803754. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Pillinger, MH (2007). "Hyperuricemia and gout: new insights into pathogenesis and treatment". Bulletin of the NYU Hospital for Joint Diseases. 65 (3): 215–221. PMID 17922673. مؤرشف من الأصل في 3 مارس 2016. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "gout, n.1". Oxford English Dictionary, Second edition, 1989. مؤرشف من الأصل في 24 مارس 2020. اطلع عليه بتاريخ 18 سبتمبر 2011. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Kubitz possibly has gout."The Disease Of Kings - Forbes.com". Forbes. مؤرشف من الأصل في 22 أبريل 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Rich Man's Disease - definition of Rich Man's Disease in the Medical dictionary - by the Free Online Medical Dictionary, Thesaurus and Encyclopedia". مؤرشف من الأصل في 11 يونيو 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "The Internet Classics Archive Aphorisms by Hippocrates". مؤرشف من الأصل في 29 ديسمبر 2018. اطلع عليه بتاريخ 27 يوليو 2010. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "LacusCurtius • Celsus — On Medicine — Book IV". الوسيط
|CitationClass=تم تجاهله (مساعدة) - "BBC - h2g2 - Gout - The Affliction of Kings". BBC. مؤرشف من الأصل في 18 مايو 2011. اطلع عليه بتاريخ 27 يوليو 2010. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Storey GD (2001). "Alfred Baring Garrod (1819-1907)". Rheumatology (Oxford, England). 40 (10): 1189–90. doi:10.1093/rheumatology/40.10.1189. PMID 11600751. مؤرشف من الأصل في 28 يونيو 2009. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Agudelo CA, Wise CM (2001). "Gout: diagnosis, pathogenesis, and clinical manifestations". Curr Opin Rheumatol. 13 (3): 234–9. doi:10.1097/00002281-200105000-00015. PMID 11333355. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Rothschild, BM (1997). "Tyrannosaurs suffered from gout". Nature. 387 (6631): 357. doi:10.1038/387357a0. PMID 9163417. مؤرشف من الأصل في 18 يناير 2016. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "New therapeutic options for gout here and on the horizon - The Journal of Musculoskeletal Medicine". مؤرشف من الأصل في 14 أكتوبر 2013. الوسيط
|CitationClass=تم تجاهله (مساعدة)
