مصفوفة ميتوكندرية
في الميتوكندريون، المصفوفة الميتوكندرية أو المتريكس هي الفضاء الذي يوجد داخل الغشاء الداخلي. كلمة "ماتريكس" تنبع من حقيقة أن هذا الفضاء لزج، بالمقارنة نسبيا مع السيتوبلازم المائي. المصفوفة الميتوكندرية تحتوي على ميتوكوندريات الحمض النووي والريبوسوم والأنزيمات القابلة للذوبان، وجزيئات عضوية صغيرة، والنوكليوتيدات عوامل مساعدة، والأيونات غير العضوية.[1] إن الأنزيمات في المتريكس تسهل التفاعلات المسؤولة عن إنتاج ATP، مثل دورة حمض الستريك والفسفرة المؤكسدة، وأكسدة حمض البيروفيك وأكسدة الأحماض الدهنية.[1]
| بيولوجيا الخلية | |
|---|---|
| الميتوكندريون (أو الحبيبات الخيطية) | |
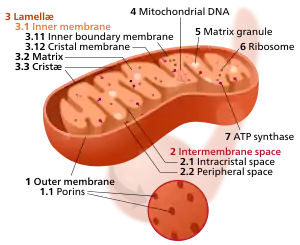 مكونات ميتوكوندريون نموذجي
2 حيز بين الغشاءين
3 صفيحة (طبقة رقيقة) (بالإنجليزية: Lamella)
4 الحمض النووي | |

1:غشاء داخلي
2:غشاء خارجي
3:الأعراف
4:الماتريكس
تكوين المتريكس على أساس هياكلها ومحتوياتها ينتج بيئة تسمح للمسارات الابتنائية والتقويضية باللمضي قدما بشكل إيجابي. سلسلة نقل الإلكترونات والإنزيمات في المتريكس تلعب دورا كبيرا في دورة حمض الستريك والفسفرة التأكسدية. فدورة حمض الستريك تنتج NADH وFADH2 من خلال الأكسدة التي سيتم تخفيضها في الفسفرة التأكسدية لإنتاج ATP.[2][3]
العصارة الخلوية، والحيز بين الغشاءين، مقصورتين لديهما محتوى الماء هو 3.8 ميكرولتر/ملغ في البروتين، بينما المصفوفة الميتوكندرية لديها 0.8 ميكرولتر/ملغ في البروتين.[4] ومن غير المعروف كيف أن الميتوكوندريا تحافظ على التوازن الأسموزي عبر الغشاء الداخلي للميتوكوندريا، على الرغم من أن الغشاء يحتوي على أكوابورينز التي يعتقد أنها قنوات لنقل المياه المنظمة. المصفوفة الميتوكندرية لديها درجة الحموضة من حوالي pH=7.8.[5] الحمض النووي تم اكتشافه من قبل ناش ومارجيت في عام 1963. فDNA واحدة من العديد من القطع المزدوجة التي لها قنوات دائرية موجودة في المصفوفة الميتوكندرية. DNA متقدرة هي 1% من مجموع DNA الخلية. فهي غنية المحتوى بالغوانين والسيتوزين. الميتوكوندريا عند الثدييات لديها 55 ريبوسوم.
التركيب
المستقلبات
المصفوفة هي مضيفة لمجموعة واسعة من المستقلبات التي تشارك في العمليات داخل المصفوفة. وتشمل دورة حمض الستريك وأسيل مرافق الإنزيم-أ، وحمض البيروفيك، وأسيتيل مرافق الإنزيم-أ، وحمض الليمون، وإيزوسيترات، وα- كيتوغلوتارات، وسوتسينيل-مرافق الإنزيم-أ، وحمض الفوماريك، وحمض السكسينيك، وحمض التفاح، وحمض أكسالوأسيتيك.[2] دورة اليوريا تستخدم من أورنيثين، وكربامويل الفوسفات، والسيترولين.[4] سلسلة نقل الإلكترون أكسدة الإنزيمات NADH وFADH2 لتركيب البروتين يستخدم DNA متوكندرية وDNA، وtRNA.[5] تنظيم العمليات يجعل من استخدام الأيونات(Ca2+/K+/Mg+).[6] المستقلبات الإضافية الموجودة في المصفوفة هي CO2، H2O، O2، ATP, ADP، و Pi.[1]
الإنزيمات
الانزيمات من العمليات التي تجري في المصفوفة. يتم تسهيل دورة حمض الستريك من قبل نازعة البيروفيك، وسترات سينثاس، وأكونيتاس، ونازعة إيزوسيترات، ونازعة α- كيتوغلوتارات، وسسينيل-مرافق الإنزيم-أ سينثيتاس، وفوماراز، ونازعة مالات ديهيدروجيناز.[2] يتم تسهيل دورة اليوريا من قبل کاربامویل فوسفات سينثاز I وأورنيثين ناقل الكربامويل.[4] β الأكسدة يستخدم كاربوكسيلاز البايروفات، نازعة أسيل-كوا، و- كيتوثيولاز.[2] يتم تسهيل إنتاج الأحماض الأمينية بواسطة ناقلة الأمين.[1]
مكونات الغشاء الداخلي
الغشاء الداخلي هو ليبيد ثنائي الطبقة يحتوي على مجمعات الفسفرة التأكسدية. الذي يحتوي على سلسلة نقل الإلكترونات التي وجدت على أعراف الغشاء الداخلي ويتكون من أربعة مجمعات البروتين وATP-سينثاز. هذه المجمعات هي مجمع البروتين الأول (NADH: الإنزيم Q أوكسيدوريدوكتاس)، ومجمع البروتين الثاني (سكسينات: موافق الإنزيم Q أوكسيدوريدوكتاس)، ومجمع البروتين الثالث (موافق الإنزيم Q: السيتوكروم C أوكسيدوريدوكتاس)، والمجمع البروتيني الرابع (السيتوكروم C أوكسيديز).[6]
الغشاء الداخلي يتحكم في تركيب المصفوفة
تعد سلسلة نقل الإلكترون مسؤولة عن تحديد درجة الحموضة والتدرج الكهروكيميائي الذي يسهل إنتاج ATP من خلال ضخ البروتونات. كما يوفر التدرج السيطرة على تركيز الأيونات مثل Ca2+ التي تكون مدفوعة بنفاذية غشاء الميتوكوندريا لها.[1] الغشاء يسمح فقط للجزيئات غير القطبية مثل CO2 و O2 والجزيئات القطبية الصغيرة غير المشحونة مثل H2O بالدخول للمصفوفة. تدخل الجزيئات وتخرج من مصفوفة الميتوكوندريا من خلال النقل البروتيني والنقل الأيوني. ثم تستطيع الجزيئات ترك الميتوكوندريا من خلال البورين.[7] هذه الخصائص المنسوبة تسمح للسيطرة على تركيزات الأيونات وميتابوليتسنيساري لتنظيم ويحدد معدل إنتاج ATP.[8][9]
العمليات في مصفوفة الميتوكوندريا
دورة حمض الستريك
بعد تنشيط التحلل، يتم تنشيط دورة حمض الستريك عن طريق إنتاج أسيتيل مرافق الإنزيم-أ. وأكسدة حمض البيروفيك من نازعة البيروفيك في المصفوفة لإنتاج CO2، والأسيتيل مرافق الإنزيم-أ، وNADH. الأكسدة بيتا للأحماض الدهنية بمثابة مسار تقويضي بديل والذي بواسطته يتم إنتاج أسيتيل مرافق الإنزيم-أ، وNADH، وFADH2. يبدأ إنتاج الأسيتيل مرافق الإنزيم-أ في دورة حمض الستريك في حين أن الأنزيمات المشتركة المنتجة تستخدم في سلسلة نقل الإلكترونات.[9]
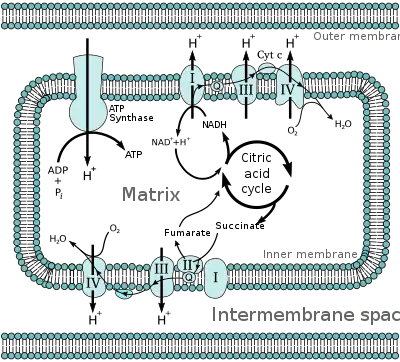
.
جميع الانزيمات لدورة حمض الستريك هي في المصفوفة (على سبيل المثال حمض الليمون، ومالات ديهيدروجيناز) باستثناء نازع هيدروجين السكسينات التي هي على الغشاء الداخلي وهي جزء من البروتين المعقد أي في سلسلة نقل الإلكترون. تنتج الدورة الإنزيمات الإنزيمية NADH و FADH2 من خلال أكسدة الكربونات في دورتين. أكسدة NADH و FADH2 تنتج غتب من سوتسينيل-مرافق الأنزيم-أ سينثيتاس.[2]
الفسفرة التأكسدية
يتم إنتاج NADH و FADH2 في المصفوفة أو نقلهما من خلال البورين وبروتينات النقل من أجل الخضوع للأكسدة من خلال الفسفرة التأكسدية.[1] NADH و FADH2 تخضع للأكسدة في سلسلة النقل الإلكتروني عن طريق نقل الإلكترونات لتجديد NADH و FADH2. يتم سحب البروتونات إلى الحيز بين الغشاءين بواسطة طاقة الإلكترونات التي تمر عبر سلسلة نقل الإلكترون. يتم قبول أربعة إلكترونات أخيرا بواسطة الأكسجين في المصفوفة لاستكمال سلسلة النقل الإلكتروني. عودة البروتونات إلى مصفوفة الميتوكوندريا من خلال البروتين ATP-سينثاز. يتم استخدام الطاقة من أجل تدوير ATP-سينثاز الذي يسهل مرور البروتون، وإنتاج ATP. الاختلاف في الرقم الهيدروجيني في المصفوفة والحيز بين الغشاءين يخلق التدرج الكهروكيميائي الذيي يمكن ATP-سينثاز من تمرير البروتون في المصفوفة بشكل إيجابي.[6]
دورة اليوريا
تتم أول خطوتين من دورة اليوريا داخل مصفوفة الميتوكوندريا من خلايا الكبد والكلى. في الخطوة الأولى يتم تحويل الأمونيا إلى فوسفات الكربامويل من خلال استثمار جزيئين من ATP. يتم تسهيل هذه الخطوة من قبل كاربامويل الفوسفات سينثيتاس I. الخطوة الثانية التي يسهلها أورنيثين ناقل الكربامويل لتحويل الفوسفات كاربامويل وأورنيثين إلى سيترولين. بعد هذه الخطوات الأولية تستمر دورة اليوريا في حيز الغشاء الداخلي حتى يدخل أورنيثين مرة أخرى للمصفوفة من خلال قناة النقل وذلك لمواصلة أول الخطوات داخل المصفوفة.[10]
نقل الأمين
α-كيتوغلوتارات وأكسالوأسيتيك يمكن تحويلهما إلى أحماض أمينية داخل المصفوفة من خلال عملية نقل الأمين. يتم تسهيل هذه التفاعلات بواسطة نقل الأمين من أجل إنتاج الأسبارتات وأسباراجين لنقل الأمين من α-كيتوغلوتارات وأكسالوأسيتيك لإنتاج الغلوتامات والبرولين والأرجينين. ثم يتم استخدام هذه الأحماض الأمينية إما داخل المصفوفة أو نقلها إلى السيتوسول لإنتاج البروتينات.[11][12]
التنظيم أو اللائحة
يتم التحكم في اللائحة بتنظيمها داخل المصفوفة عن طريق تركيز الأيونات، وتركيز المستقلبات ورسوم الطاقة. توافر الأيونات مثل Ca2+ السيطرة على وظائف مختلفة من دورة حمض الستريك. في المصفوفة تنشط نازعة البيروفيك، ونازعة إيزوسيترات، ونازعة هيدروجيناز ألفا كيتوغلوتارات مما يزيد من معدل التفاعل في الدورة.[13] التركيز الوسيط والانزيمات في المصفوفة هي أيضا تؤدي إلى زيادة أو نقصان في معدل إنتاج ATP بسبب التأثيرات أنابليروتيك وكاتابلوتيك. NADH يمكن أن تكون بمثابة مثبط لα-كيتوغلوتارات، ونازعة إيزوسيترات، وسترات سينثاز، ونازعة هيدروجين البيروفيك. يتم الحفاظ على تركيز الأكسالوسيتات المنخفض على وجه الخصوص، لذلك أي تقلبات في هذه التركيزات تعمل على دفع دورة حمض الستريك إلى الأمام.[2] إنتاج ATP أيضا بمثابة وسيلة للتنظيم من خلال العمل كمثبت لنازعة إيزوسيترات، ونازعة هيدروجيناز البيروفيك، والمجمعات البروتينية وسلسلة نقل الإلكترونات، و ATP سينثاز. بينما ADP يعمل كمنشط.[1]
بروتين سينثاز
الميتوكوندريا يحتوي على مجموعة خاصة من DNA المستخدمة لإنتاج البروتينات الموجودة في سلسلة نقل الإلكترونات. DNA الميتوكوندريا هي فقط رموز لحوالي ثلاثة عشر من البروتينات التي تستخدم في معالجة نصوص شريط الميتوكوندريا، والبروتين الريبوسومي، وRNA الريبوسومي، نقل الحمض النووي الريبوزي، والبروتينات الفرعية وجدت في المجمعات البروتينية لسلسلة النقل الإلكترون.[14][15]
انظر أيضا
مراجع
- Voet, Donald; Voet, Judith; Pratt, Charlotte (2013). Fundamentals of Biochemistry Life at the Molecular Level. New York City: John Wiley & Sons, Inc. صفحات 582–584. ISBN 1118129180. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Stryer, L; Berg, J; Tymoczko, JL (2002). Biochemistry. San Francisco: W.H. Freeman. صفحات 509–527, 569–579, 614–616, 638–641, 732–735, 739–748, 770–773. ISBN 0-7167-4684-0. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Mitchell, Peter; Moyle, Jennifer (1967-01-14). "Chemiosmotic Hypothesis of Oxidative Phosphorylation". Nature (باللغة الإنجليزية). 213 (5072): 137–139. doi:10.1038/213137a0. PMID 4291593. مؤرشف من الأصل في 22 يوليو 2017. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Soboll, S; Scholz, R; Freisl, M; Elbers, R; Heldt, H.W. (1976). Distribution of metabolites between mitochondria and cytosol of perfused liver. New york: Elsevier. صفحات 29–40. ISBN 978-0-444-10925-5. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Porcelli, Anna Maria; Ghelli, Anna; Zanna, Claudia; Pinton, Paolo; Rizzuto, Rosario; Rugolo, Michela (2005-01-28). "pH difference across the outer mitochondrial membrane measured with a green fluorescent protein mutant". Biochemical and Biophysical Research Communications. 326 (4): 799–804. doi:10.1016/j.bbrc.2004.11.105. PMID 15607740. مؤرشف من الأصل في 24 سبتمبر 2015. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Dimroth, P.; Kaim, G.; Matthey, U. (2000-01-01). "Crucial role of the membrane potential for ATP synthesis by F(1)F(o) ATP synthases". The Journal of Experimental Biology. 203 (Pt 1): 51–59. ISSN 0022-0949. PMID 10600673. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Alberts, Bruce; Johnson, Alexander; Lewis, julian; Roberts, Keith; Peters, Walter; Raff, Martin (1994). Molecular Biology of the Cell. New york: Garland Publishing Inc. ISBN 0-8153-3218-1. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Anderson, S.; Bankier, A. T.; Barrell, B. G.; de Bruijn, M. H. L.; Coulson, A. R.; Drouin, J.; Eperon, I. C.; Nierlich, D. P.; Roe, B. A. (1981-04-09). "Sequence and organization of the human mitochondrial genome". Nature (باللغة الإنجليزية). 290 (5806): 457–465. doi:10.1038/290457a0. PMID 7219534. مؤرشف من الأصل في 22 يوليو 2017. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Iuchi, S.; Lin, E. C. C. (1993-07-01). "Adaptation of Escherichia coli to redox environments by gene expression". Molecular Microbiology (باللغة الإنجليزية). 9 (1): 9–15. doi:10.1111/j.1365-2958.1993.tb01664.x. ISSN 1365-2958. PMID 8412675. مؤرشف من الأصل في 27 أكتوبر 2017. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Tuchman, Mendel; Plante, Robert J. (1995-01-01). "Mutations and polymorphisms in the human ornithine transcarbamylase gene: Mutation update addendum". Human Mutation (باللغة الإنجليزية). 5 (4): 293–295. doi:10.1002/humu.1380050404. ISSN 1098-1004. PMID 7627182. مؤرشف من الأصل في 06 أغسطس 2016. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Karmen, A.; Wroblewski, F.; Ladue, J. S. (1955-01-01). "Transaminase activity in human blood". The Journal of Clinical Investigation. 34 (1): 126–131. doi:10.1172/JCI103055. ISSN 0021-9738. PMC 438594. PMID 13221663. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Kirsch, Jack F.; Eichele, Gregor; Ford, Geoffrey C.; Vincent, Michael G.; Jansonius, Johan N.; Gehring, Heinz; Christen, Philipp (1984-04-15). "Mechanism of action of aspartate aminotransferase proposed on the basis of its spatial structure". Journal of Molecular Biology. 174 (3): 497–525. doi:10.1016/0022-2836(84)90333-4. PMID 6143829. مؤرشف من الأصل في 13 ديسمبر 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Denton, Richard M.; Randle, Philip J.; Bridges, Barbara J.; Cooper, Ronald H.; Kerbey, Alan L.; Pask, Helen T.; Severson, David L.; Stansbie, David; Whitehouse, Susan (1975-10-01). "Regulation of mammalian pyruvate dehydrogenase". Molecular and Cellular Biochemistry (باللغة الإنجليزية). 9 (1): 27–53. doi:10.1007/BF01731731. ISSN 0300-8177. PMID 171557. مؤرشف من الأصل في 14 يونيو 2018. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Fox, Thomas D. (2012-12-01). "Mitochondrial Protein Synthesis, Import, and Assembly". Genetics. 192 (4): 1203–1234. doi:10.1534/genetics.112.141267. ISSN 0016-6731. PMC 3512135. PMID 23212899. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Grivell, L.A.; Pel, H.J. (1994). "Protein synthesis in mitochondria". Mol. Biol. Rep. Swammerdam Institute for Life Sciences (19). الوسيط
|CitationClass=تم تجاهله (مساعدة)
- بوابة علم الأحياء الخلوي والجزيئي
- بوابة طب
- بوابة علم الأحياء
- بوابة الكيمياء الحيوية
