فيروس محلل للورم
الفيروس المحلل للورم أو الفيروس الحال للورم (بالإنجليزية: Oncolytic virus) هو فيروس يصيب ويقتل الخلايا السرطانية بشكل تفضيلي.[1][2] حيث يتم تدمير الخلايا السرطانية المصابة عن طريق التحلل، ثم تطلق جزيئات جديدة من الفيروسات المعدية أو الفيريونات للمساعدة في تدمير الورم المتبقي.[3][4] يعتقد أن الفيروسات المحللة للورم لا تؤدي فقط إلى التدمير المباشر للخلايا السرطانية، ولكنها أيضا تقوم بتحفيز استجابات المناعة المضادة للورم عند المضيف.[5][6]
اكتشفت لأول مرة إمكانات الفيروسات كعوامل مضادة للسرطان في أوائل القرن العشرين، على الرغم من أن جهود الأبحاث المنسقة لم تبدأ قبل الستينيات. [7]وقد تم الآن اختبار عدد من الفيروسات، بما في ذلك الفيروسات الغدية، والفيروسات التنفسية المعوية اليتيمة، والحصبة، والهربس البسيط، وفيروس نيوكاسل، والوقس كعوامل محللة للورم.[8] تم معالجة معظم الفيروسات الحالية هندسيا لتكون انتقائية تجاه الورم، على الرغم من أن هناك أمثلة تحدث بشكل طبيعي مثل فيروس ريوفيروس (الفيروسات التنفسية المعوية اليتيمة) وفيروس سينكافيروس،[9] مما أدى إلى التجارب السريرية.[10] أول فيروس محلل للورم معتمد من قبل وكالة تنظيمية وطنية لم يتم تعديله وراثيا هو إيكو-7 من سلالة الفيروس المعوي ريجفير (ريجا فيروس)، تم اعتماده في لاتفيا عام 2004 لعلاج سرطان الجلد الميلانيني.[11] في وقت لاحق (في 2015 و 2016 على التوالي) تمت الموافقة عليه أيضا في جورجيا [12]وأرمينيا. في عام 2005 سجلت الشركة الصينية، شنغهاي سونواي للتكنولوجيا الحيوية الفيروس الغدي المحلل، وهو فيروس غدي معدل وراثيا اسمه H101. واكتسب الموافقة التنظيمية في عام 2005 من إدارة الغذاء والداوء الصينية لعلاج سرطان الرأس والرقبة. [13] كان عقار تاليموجين لاهارباريبفيك (أونكوفيكس، تي- فيك) أول فيروس محلل للهربس (فيروس الهربس البسيط المعدل)، اعتُمد للاستخدام من قبل إدارة الغذاء والدواء (الولايات المتحدة) ووكالة الأدوية الأوروبية في الاتحاد الأوروبي في عام 2015 لعلاج سرطان الجلد المتقدم غير قابل للجراحة. وفي قرار مشترك، صوت أعضاء اللجنة الاستشارية المعنية بالأدوية التابعة للجنة إدارة الأغذية والأدوية واللجنة الاستشارية للعلاج الخلوي والأنسجة والجينات بأصوات 22-1 للتوصية بالموافقة على العلاج المناعي المُحلل.[14]
التاريخ
تم التنظير منذ فترة طويلة حول العلاقة بين تراجع السرطان والفيروسات، ظهرت تقارير حالة عن التراجع الملحوظ في سرطان عنق الرحم، وسرطان الغدد الليمفاوية بيركيت وسرطان الغدد الليمفاوية هودجكين، بعد التحصين أو العدوى مع فيروس غير ذات صلة في بداية القرن العشرين. [15] بدأت جهود علاج السرطان من خلال التحصين أو العلاج الفيروسي (عدوى متعمدة بالفيروس) في منتصف القرن العشرين. [15][16]وبما أن تقنية إنشاء فيروس مخصص لم تكن موجودة، فقد ركزت جميع الجهود المبكرة على إيجاد فيروسات محللة للورم طبيعيا. خلال الستينيات من القرن العشرين، كانت الأبحاث الواعدة تنطوي على استخدام فيروس شلل الأطفال،[17] والفيروس الغدي،[15] وفيروس كوكساكي، [18]و فيروس إيكو المعوي ريجا فيروس [19]وغيرها. [16]كانت المضاعفات المبكرة عبارة عن حالات عرضية للعدوى غير الخاضعة للسيطرة، مما أدى إلى معدلات مرض ووفيات كبيرة؛ التطور المتكرر جدا للاستجابة المناعية، في حين أنها غير مؤذية للمريض، [15]أدت إلى تدمير الفيروس، وبالتالي منعه من تدمير الورم.[17] أمكن علاج بعض أنواع السرطان فقط من خلال العلاج بالفيروسات مع تشخيص مبكر جدا. [18]وحتى عندما وجدت استجابة، فإن هذه الاستجابات لم تكن كاملة ولا دائمة. [15] تم التخلي عن مجال العلاج بالفيروسات تقريبا لبعض الوقت، حيث أن التكنولوجيا المطلوبة لتعديل الفيروسات لم تكن موجودة، والعلاج الكيميائي وتكنولوجيا العلاج الإشعاعي تمتعت بالنجاح المبكر. ومع ذلك، الآن وقد تم تطوير هذه التقنيات بدقة، والسرطان لا يزال سببا رئيسيا للوفيات، فلا تزال هناك حاجة لعلاجات السرطان الجديدة، وقد اكتسب الآن هذا العلاج الوليد اهتمام متجدد.[15][20]
فيروس الهربس البسيط
كان فيروس الهربس البسيط (HSV) واحدا من الفيروسات الأولى التي تم تكييفها لمهاجمة الخلايا السرطانية بشكل انتقائي، لأنه كان مفهوما جيدا، وسهل التلاعب به وغير مؤذي نسبيا في حالته الطبيعية ( يسبب فقط القروح الباردة) ومن المرجح أنه يشكل مخاطر أقل. يفتقر نوع فيروس الهربس البسيط 1 (HSV-1) المتحول 1716 إلى نسختين من الجين ICP34.5، ونتيجة لذلك لا يعد قادرا على التكاثر في خلايا متمايزة بشكل نهائي أو غير قابلة للانقسام، ولكن سوف يصيب ويسبب تحلل بكفاءة عالية في الخلايا السرطانية، وهو ما ثبت أنه استراتيجية فعالة لاستهداف الورم.[21][22] في مجموعة واسعة من النماذج السرطانية في الجسم الحي، تسبب فيروس HSV1716 في انحسار الورم وزيادة فترات البقاء على قيد الحياة. [23][24][25]
في عام 1996، أعطيت الموافقة الأولى في أوروبا لإجراء تجربة سريرية باستخدام فيروس هربس البسيط 1716. من عام 1997 إلى عام 2003، تم حقن سلالة HSV1716 في أورام المرضى الذين يعانون من ورم أرومي دبقي متعدد الأشكال، وهو ورم خبيث جدا في الدماغ، مع عدم وجود دليل على السمية أو الآثار الجانبية، ومع بعض الناجين على المدى الطويل. [26][27][28] استخدمت تجارب السلامة الأخرى HSV1716 لعلاج المرضى الذين يعانون من سرطان الجلد وسرطان الخلايا الحرشفية من الرأس والرقبة. [29][30]منذ ذلك الحين أظهرت دراسات أخرى أن الغلاف الخارجي لنوعيات HSV1716 يمكن أن يستهدف أنواع محددة من الخلايا السرطانية،[31] ويمكن استخدامه لتوصيل مجموعة متنوعة من الجينات الإضافية في الخلايا السرطانية، مثل الجينات التي تفتت الأدوية الأولية غير الضارة داخل الخلايا السرطانية لاطلاق سراح العلاج الكيميائي،[32] أو الجينات التي تصيب الخلايا السرطانية المصابة لتركز البروتين الموسوم مع اليود المشع، بحيث يتم قتل الخلايا السرطانية المنفردة عن طريق جرعة صغيرة من الإشعاع وكذلك عن طريق تحلل الخلايا الذي يسببه الفيروس.[33]
تم تطوير فيروسات أخرى على أساس فيروس الهربس البسيط وهي في مرحلة التجارب السريرية، وعلى الأخص أونكوفيكس جي إم - سي إس أف (فيروس الهربس المحلل للورم)، التي وضعتها شركة أمجن، والتي أكملت بنجاح المرحلة الثالثة المحورية من تجربة على سرطان الجلد المتقدم. وقد وصلت هذه الدراسة بنقطة النهاية المبدأية (معدل الاستجابة الدائمة) بدرجة عالية من الأهمية الإحصائية في مارس 2013، وهي أول دراسة إيجابية في المرحلة الثالثة لفيروس محلل للورم في العالم الغربي.
أونكورين (H101)
كان أول فيروس محلل للورم يتم اعتماده من قبل هيئة تنظيمية هو فيروس غدي معدل وراثيا اسمه H101 من قبل شركة شنغهاي سانواي للتكنولوجيا الحيوية. وحصل على الموافقة التنظيمية في عام 2005 من إدارة الغذاء والدواء التابعة للدولة (سفدا) لعلاج سرطان الرأس والرقبة.[13][34] سانواي H101 و المشابه له تماما أونيكس-15 قد تم تعديلهما لإزالة آلية الدفاع الفيروسية التي تتفاعل مع الجين البشري الطبيعي p53، [34]والذي هو في كثير من الأحيان لا ينتظم في الخلايا السرطانية. على الرغم من العمل الواعد في المختبر في وقت مبكر على الجسم الحي، فإن هذه الفيروسات لا تصيب الخلايا السرطانية على وجه التحديد، لكنها لا تزال تقتل الخلايا السرطانية بشكل تفضيلي. [34]في حين أن معدلات البقاء على قيد الحياة عموما غير معروفة، معدلات الاستجابة على المدى القصير تضاعفت تقريبا عند استخدام H101 بالإضافة إلى العلاج الكيميائي بالمقارنة مع العلاج الكيميائي وحده.[34] ويبدو أنه يعمل بشكل أفضل عندما يتم حقنه مباشرة في الورم، وعندما لا يتم قمع أي حمى ناتجة. [34][34] العلاج النظامي (مثل من خلال الحقن من خلال خط الوريد) مرغوب فيه لعلاج مرض الانبثاث.[35] و يتم تسويقه الآن تحت اسم العلامة التجارية أونكورين.[36]
آلية العمل
التحلل المباشر
كان التحلل المباشر، وهو التأثير القاتل للخلايا التي تنتجها العدوى الفيروسية على الخلايا السرطانية، هو المفهوم الأصلي للڤيروسات المحللة للورم. [1][2] عن طريق عدوى محددة في الخلايا السرطانية، يتضاعف الفيروس داخلها حتى يسبب تحلل الخلايا، وإطلاق الجيل الثاني من الفيروس ثم يصيب الخلايا المحيطة به.[3]
العلاج المناعي
مع التقدم في العلاج المناعي للسرطان مثل مثبطات حاجز المناعة، تم إعطاء اهتمام متزايد لاحتمالية كون الفيروسات المحللة للورم علاج مناعي. هناك نوعان من الاعتبارات الرئيسية للتفاعل بين الفيروسات المحللة للورم والجهاز المناعي.
المناعة كعقبة
الجهاز المناعي للمريض هو عقبة رئيسية لنجاح فيروسات محللة الورم الذي يحاول بطبيعة الحال يثبط أي فيروس. هذا يمكن أن يكون مشكلة خاصة للحقن في الوريد، حيث يجب على الفيروس التغلب أولا على التفاعلات مع النظام المتمم في الدم وتحييد الأجسام المضادة. [37] وقد تبين أن كبت المناعة عن طريق العلاج الكيميائي وتثبيط النظام المتمم يمكن أن تعزز العلاج بالفيروس المحلل للورم.[38][39][40]
يمكن تجنب المناعة الموجودة مسبقا باستخدام الفيروسات التي ليست من مسببات الأمراض البشرية الشائعة. ومع ذلك، هذا لا يتجنب توليد الأجسام المضادة لاحقا. مع ذلك، فقد أظهرت بعض الدراسات أن المناعة الموجودة ضد فيروسات تحلل الورم لا تسبب انخفاضا كبيرا في الفعالية.[41]
بدلا من ذلك، يمكن أن يكون الوسيط الفيروسي المغلف مع البوليمر مثل البولي ايثيلين جلايكول، وتدريعه من الأجسام المضادة، ولكن هذا أيضا يمنع بروتينات غلاف الفيروس من التمسك بالخلايا المضيفة. [42] هناك طريقة أخرى لمساعدة فيروسات الأورام لكي تصل إلى نمو السرطان بعد الحقن في الوريد، وهي إخفائها داخل البلاعم (وهو نوع من خلايا الدم البيضاء). البلاعم تهاجر تلقائيا إلى مناطق تدمير الأنسجة، وخاصة حيث تكون مستويات الأكسجين منخفضة، وهي سمة من سمات نمو السرطان، واستخدمت بنجاح في توصيل الفيروسات المحللة لسرطان البروستاتا في الحيوانات. [43]
المناعة كحليف
على الرغم من أنه يشكل عقبة من خلال تعطيل الفيروسات، يمكن للنظام المناعي للمريض أيضا أن يكون بمثابة حليف ضد الأورام. العدوى تجذب انتباه الجهاز المناعي إلى الورم، وقد تساعد على توليد مناعة مفيدة ومضاد للورم. وهو ما ينتج لقاح ضد السرطان خصيصا.[44][45]
تم تسجيل العديد من حالات التعافي التلقائي من السرطان، وإن لم تكن مفهومة تماما، يعتقد أنها من المرجح أن تكون نتيجة استجابة مناعية مفاجئة أو عدوى.[46] استخدمت الجهود المبذولة لتحفيز هذه الظاهرة لقاحات السرطان (المستمدة من الخلايا السرطانية أو المستضدات السرطانية المختارة)، أو العلاج المباشر مع العوامل المحفزة المناعية على سرطانات الجلد.[47] بعض فيروسات الأورام مناعية جدا، وربما عن طريق عدوى الورم، فتثير استجابة مناعية مضادة للورم، وخاصة الفيروسات التي تنقل السيتوكين أو غيرها من العوامل المحفزة للمناعة.[48]
السلوك المحلل لأنواع الفيروسات العنيفة
التهاب الفم الحويصلي
فيروس التهاب الفم الحويصلي (VSV) هو رابدوفيروس، ويتألف من 5 جينات مشفرة باتجاه سلبي، يتكون الجينوم الخاص به من الحمض النووي الريبي ذو الشريط الواحد . في الطبيعة، VSV يصيب الحشرات وكذلك الماشية، حيث يسبب مرض محدود نسبيا وغير مميت. يرجع انخفاض القدرة المرضية لهذا الفيروس في جزء كبير منه إلى حساسيته للإنترفيرون، وهو فئة من البروتينات التي يتم إطلاقها في الأنسجة ومجرى الدم أثناء العدوى. هذه الجزيئات تحفز برامج الدفاع الوراثية المضادة للفيروسات التي تحمي الخلايا من العدوى وتمنع انتشار الفيروس. مع ذلك، في عام 2000، أوضح ستوجدل، ليشتي وآخرون [49]أن العيوب في هذه المسارات تجعل الخلايا السرطانية لا تستجيب للآثار الوقائية للإنترفيرون، وبالتالي تكون حساسة للغاية لعدوى VSV. حيث أن فيروس التهاب الفم الحويصلي يخضع لدورة انحلال خلوي سريعة، فإن العدوى تؤدي إلى وفاة الخلايا الخبيثة وتضخيم ما يقرب من 1000 ضعف من الفيروس في غضون 24 ساعة. وبالتالي VSV مناسب تماما للتطبيق العلاجي، وقد اتجهت عدة مجموعات لإظهار أن الفيروسات التي تدار بشكل منهجي يمكن توصيلها إلى موقع الورم، حيث أنها تتضاعف وتحفز انحسار الورم، مما يؤدي في كثير من الأحيان إلى علاجات دائمة. [50][51][52][53]إضعاف الفيروس عن طريق الهندسة وحذف مِت-51 من مصفوفة البروتين يخفي تقريبا كل العدوى من الأنسجة الطبيعية، في حين أن النسخ في الخلايا السرطانية لا تتأثر. [50] أظهرت الأبحاث التي أجريت مؤخرا أن هذا الفيروس لديه القدرة على علاج أورام المخ، وذلك بفضل خصائصه في إحلال الخلايا الورمية.[54]
فيروس شلل الأطفال
فيروس شلل الأطفال هو ممرض عصبي طبيعي، مما يجعله خيارا واضحا للتتضاعف الانتقائي في الأورام المستمدة من الخلايا العصبية. فيروس شلل الأطفال لديه جينوم لحمض النووي الريبي زائد الشريط، الذي تعتمد ترجمته على الأنسجة الداخلية المحددة لموقع دخول الريبوسوم (إيريس) داخل المنطقة 5 'غير المترجمة من الجينوم الفيروسي، التي تنشط في الخلايا عصبية المنشأ، ويسمح بترجمة الجينوم الفيروسي دون الغطاء 5 '. استبدل غرومييه وآخرون عام 2000 [55] فيروس شلل الأطفال المعتاد بفيروس إيريس رينوفيروس، مما يغير خصوصية الأنسجة. وتمكن فيروس الناتج PV1 (ريبو) من تدمير خلايا الورم الخبيثة بشكل انتقائي، مع ترك الخلايا العصبية الطبيعية دون مساس.[56]
ريوفيروس
ريوفيروس، وهو اختصار لـ "الفيروس المعوي التنفسي اليتيم"، تصيب عادة الجهاز التنفسي والأمعاء في الثدييات. وقد تعرض معظم الناس لريوفيروس بحلول سن البلوغ؛ مع ذلك، فإن العدوى لا تنتج أعراض عادة. نشأ الرابط على قدرة ريوفيروس على تحليل الورم بعد أن اكُتشفت قدرته على التكاثر بشكل جيد في مختلف خطوط الخلايا السرطانية وتحليل هذه الخلايا. [57] ريوليسين هو صيغة من فيروس ريوفيروس الذي يستخدم حاليا في التجارب السريرية لعلاج مختلف أنواع السرطان.[58]
سينيكافيروس
سينيكافيروس، المعروف أيضا فيروس باسم سينيكا فالي، هو نوع طبيعي من نوع بيكورنافيروس المحلل للورم واكتشف في عام 2001 كتلوث في مزرعة أنسجة في شركة العلاج الجيني، SVV ـ001 تطور باعتباره العلاج المضاد للسرطان من قبل شركة نوتروبيكس، تحت اسم نتكس-010 للسرطانات ذات خواص الغدد الصماء العصبية بما في ذلك سرطان الخلايا الصغيرة في الرئة ومجموعة متنوعة من الأورام الصلبة للأطفال.
ريجفير
في السيتينيات، درست مجموعة من العلماء في لاتفيا برئاسة د. إينا موسينيس نشاط تحليل للورم في فيروسات إيكو، ولكن في عام 1968 بدأت تجربة سريرية من 5 سلالات من الفيروس المعوي إيكو (في التجارب شاركت في المرحلة الرابعة من مرضى السرطان المتطوعين). قرر العلماء مواصلة البحث في سلالة إيكو-7 من فيروس إيكو (الذي سُمّي في وقت لاحق ريجفير)، لأنه أظهر خصائص تحليل الورم بشكل أكثر وضوحا. بدأت تجارب المرحلة الثالثة في عام 1988 بهدف مقارنة تأثير العلاج بريجفير مع نتائج العلاج الكيميائي والعلاج الإشعاعي. في عام 2004 تم اعتماد ريجفير وتسجيلها في لاتفيا ومنذ ذلك الحين تم استخدامه في علاج السرطان. [19] تمت الموافقة على فيروس ريجفير في جورجيا في فبراير 2015، [12] ولكن في عام 2016 تمت الموافقة عليه أيضا في أرمينيا. كشفت الدراسة الارتجاعية الأخيرة التي نشرت في أبحاث الميلانوما أن مرضى سرطان الميلانوما IB-IIC الذين يعالجون بفيروس ريجفير المحلل للورم كانت لديهم 4.39-6.57 أضعاف وفيات أقل من أولئك الذين ـ وفقا للمبادئ التوجيهية العلاج سرطان الجلد ـ لم يتلقوا العلاج الفيروسي وتمت ملاحظتهم فقط. [59] في عام 2015 تم إدراج ريجفير في المبادئ التوجيهية الوطنية للاتفيا لعلاج سرطان الجلد والميلانوما، التي وضعتها فرقة عمل مستشفى جامعة ريغا الشرقية الإكلينيكية.[60] في يوليو 2016 نشرت نتائج إيجابية جديدة في مجلة أبميس حول فعالية ريجفير في علاج سرطان الرئة وساركوما المنسجة.[61]
فيروس سيمليكي فورست
فيروس سيمليكي فورست (س ف ف) هو فيروس يصيب بشكل طبيعي خلايا الجهاز العصبي المركزي ويسبب التهاب الدماغ. وقد تم اختبار الشكل المعدل وراثيا منه قبل ـ سريريا كفيروس محلل ضد ورم الدماغ الشديد ورم جليوبلاستوما . تم تعديل (س ف ف) وراثيا مع تسلسل يستهدف ميكرو RNA بحيث يتم تضاعفه فقط في الخلايا السرطانية في الدماغ وليس في خلايا الدماغ العادية. أدى الفيروس المعدل إلى تقليل نمو الورم وإطالة عمر الفئران مع أورام المخ. [62] وجد أيضا أن الفيروس المعدل يقتل خلايا الورم الدبقية البشرية بكفاءة.[62]
أخرى
يتم اختبار فيروس المارابا، الذي تم التعرف عليه لأول مرة في ذبابة الرمل البرازيلية، ويتم اختباره سريريا.[63][64]
هندسة الفيروسات المحللة للورم
التطور الموجه
المنهج المبتكر لتطوير العلاج المسمى "تطور موجه" ينطوي على إيجاد متغيرات فيروسية جديدة أو أنماط مصلية موجهة خصيصا ضد الخلايا السرطانية عن طريق جولات من الاختيار الموجه باستخدام مجموعات كبيرة من الفيروسات المولدة المؤتلفة بشكل عشوائي. يوفر التنوع البيولوجي المتزايد الناتج عن خطوة إعادة التوليف المثلي الأوّلي مجموعة عشوائية كبيرة من المرشحين الفيروسيين والتي يمكن بعد ذلك تمريرها من خلال سلسلة من خطوات الاختيار المصممة لتؤدي إلى نتيجة محددة سلفا (مثل نشاط الورم النوعي) دون الحاجة إلى أي معرفة سابقة بالآليات الفيروسية المسؤولة عن تلك النتيجة. يمكن بعد ذلك فحص مجموعة من الفيروسات المحللة للورم الناتجة في نماذج ما قبل السريرية لتحديد فيروس محلل للورم مع الخصائص العلاجية المطلوبة.[65] تم تطبيق التطور الموجه على الفيروس الغدي البشري، وهو واحد من العديد من الفيروسات التي يجري تطويرها كعوامل محللة للورم، لإنشاء لقاح انتقائي للغاية وفعال حتى الآن. كنتيجة لهذه العملية، تم إنشاء كولواد 1 (وهو عضو خيالي من مجموعة أدينوفيروسيس المجموعة ب). أظهر هذا الهجين من الأنماط المصلية Ad11p و Ad3 قوة أعلى بكثير وانتقائية الورم من فيروسات السيطرة (بما في ذلك Ad5، Ad11p و Ad3)، وأكد أنه يولد ما يقرب من اثنين من سجلات السلالة الفيروسية على أنسجة ورم القولون البشري المعزولة حديثا أكثر من مطابقة الأنسجة العادية .[65]
الإضعاف
الإضعاف/ التوهين ينطوي على حذف الجينات الفيروسية، أو المناطق الجينية، للقضاء على الوظائف الفيروسية التي يمكن إنفاقها في الخلايا السرطانية، ولكن ليس في الخلايا العادية، مما يجعل الفيروس أكثر أمانا ومحدد أكثر ضد الورم . الخلايا السرطانية والخلايا المصابة بالفيروسات تمر بتغيرات متماثلة في مسارات الإشارات الخلوية، وخاصة تلك التي تحافظ على التقدم خلال دورة الخلية.[66] الجينات الفيروسية التي من وظيفتها تغيير المسار يمكن الاستغناء عنها في الخلايا حيث يكون المسار معيبا، ولكن ليس في الخلايا التي يكون المسار فيها نشط.
الإنزيمات ثيميدين كاينيز و ريبونوكليوتيد ريدوكتاس في الخلايا هي المسؤولة عن تخليق الحمض النووي ويتم التعبير عنها فقط في الخلايا التي تتكاثر بنشاط.[67] هذه الانزيمات موجودة أيضا في جينومات بعض الفيروسات (على سبيل المثال فيروس الهربس البسيط، والوقس) وتسمح بتضاعف الفيروس في الخلايا الهادئة (غير المتضاعفة)، [68] لذلك إذا تم تعطيلها عن طريق الطفرات فإن الفيروس لن يكون قادرا على التضاعف إلا في الخلايا التكاثرية، مثل الخلايا السرطانية.
استهداف الورم
هناك نهجان رئيسيان لتوليد الانتقائية الورمية: الاستهداف الانتقالي وغير الانتقالي.
- الاستهداف الانتقالي ينطوي على تعديل غطاء البروتينات الفيروسي لاستهداف الخلايا السرطانية مع الحد من الدخول إلى الخلايا غير الورمية. وقد ركز هذا النهج من الانتقائية الورمية بشكل رئيسي على الفيروسات الغدية وفيروس الهربس البسيط -1، على الرغم من أنها صالحة تماما مع الفيروسات الأخرى.
- الاستهداف غير الانتقالي ينطوي على تغيير جينوم الفيروس بحيث يمكنه التضاعف فقط في الخلايا السرطانية، في معظم الأحيان كجزء من إضعاف الفيروس.
- يمكن أيضا استخدام استهداف النسخ، حيث يتم وضع أجزاء حاسمة من الجينوم الفيروسي تحت سيطرة المحفز الخاص بالورم. ينبغي أن يكون المحفز المناسب نشطا في الورم ولكن غير نشط في غالبية الأنسجة الطبيعية، وخاصة الكبد، لأنه الجهاز الأكثر عرضة للفيروسات المولدة بالدم. تم تحديد العديد من هذه المحفزات ودراستها لعلاج مجموعة من أنواع السرطان.
- وبالمثل، يمكن أن تنسخ الفيروس بدقة باستخدام مواقع ميكرو RNA (ميرنا) المستهدفة الاصطناعية أو عناصر استجابة ميكرو RNA (مريس). التعبير التفاضلي للميرنا بين الأنسجة السليمة والأورام تسمح بهندسة الفيروسات محللة الورم المستخرجة من بعض الأنسجة موضع الاهتمام مع السماح بتضاعفها في الخلايا السرطانية.
الاستهداف المزدوج باستخدام طرق الاستهداف الانتقالية وغير الانتقالية هو الأكثر فعالية من أي شكل من أشكال الاستهداف منفردا.[69]
الجينات المراسلة
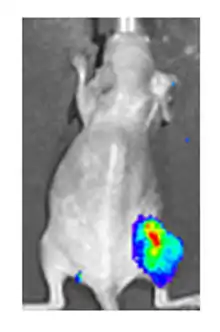
ويمكن القيام بذلك عن طريق تزويد الفيروس ب "الجينات المراسلة" التي لا تتواجد عادة في الجينوم الفيروسي، التي تعمل كعلامات ترميز بروتينية يمكن التعرف عليها بسهولة. أحد الأمثلة على هذه البروتينات هو GFP (بروتين الفلورسنت الأخضر) الذي، عند وجوده في الخلايا المصابة، سوف يسبب انبعاث الضوء الأخضر الفلورسنت عندما يتم تحفيزه بالضوء الأزرق. [70][71]ميزة هذه الطريقة هي أنه يمكن استخدامها على الخلايا الحية وفي المرضى الذين يعانون من إصابات سطحية، فإنها تتيح تأكيد سريع غير مخترق للعدوى الفيروسية.[72] مثال آخر على علامة مرئية مفيدة في الخلايا الحية هو لوسيفيراس، وهو إنزيم من اليراع الذي في وجود لوسيفيرين، يبعث ضوء يمكن اكتشافه بواسطة الكاميرات المتخصصة.[70]

يمكن أيضا ترميز إنزيمات القولونية بيتا جلوكورونيداز وبيتا غالاكتوزيداز عن طريق بعض الفيروسات. هذه الإنزيمات، في وجود ركائز معينة، يمكن أن تنتج مركبات كثيفة ملونة ، مفيدة لرؤية الخلايا المصابة وأيضا لقياس التعبير الجيني.
تعديلات لتحسين النشاط المحلل للورم
يمكن استخدام فيروسات محللة الأورام ضد السرطانات بطرق إضافية لتحليل الخلايا المصابة.
الجينات الانتحارية
يمكن استخدام الفيروسات كوسائط لتوصيل الجينات الانتحارية، وهي إنزيمات ترميزية يمكن أن تستقلب دواء غير سام متناول بشكل منفصل إلى سم خلوي قوي، والذي يمكن أن ينتشر في الخلايا المجاورة ويقتلها. تقدم فيروس واحد من الهربس البسيط، مع ترميز الثيميدين كيناز كجين انتحاري، إلى المرحلة الثالثة من التجارب السريرية. ثيميدين كيناز فيروس الهربس البسيط يفسفر الدواء الأولي ، غانسيكلوفير، والذي يتم دمجه بعد ذلك في الحمض النووي، ويمنع تخليق الحمض النووي. [73] تضمن الانتقائية الورمية لدى الفيروسات المحللة أن الجينات الانتحارية لا تعمل إلا في الخلايا السرطانية، ولكن تم وصف "تأثير المار" على الخلايا السرطانية المحيطة مع العديد من أنظمة الجينات الانتحارية. [74]
قمع الأوعية الدموية
تشكيل الأوعية الدموية هو جزء أساسي من تشكيل أجزاء الورم الكبيرة. يمكن تثبيط تشكيل الأوعية الدموية عن طريق عمل العديد من الجينات، والتي يمكن توصيلها إلى الخلايا السرطانية في ناقلات فيروسية، مما يؤدى إلى قمع تكوين الأوعية الدموية، والمجاعة الأكسجينية في الورم. إصابة الخلايا بالفيروسات التي تحتوي على الجينات لتصنيع أنجيوستاتين وإندوستاتين تحول دون نمو الورم في الفئران. تأكدت الأنشطة المعززة المضادة للورم في فيروس الوقس المؤتلف مع ترميز الأجسام المضادة العلاجية المضادة لتكوين الأوعية الدموية ومع البديل HSV1716 معربا عن نفسه كمثبط الأوعية الدموية[75][76]
الأيودين المشع
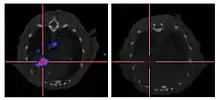
إضافة الجين رابط يوديد الصوديوم (نيس) إلى الجينوم الفيروسي يؤدي بالخلايا السرطانية المصابة للتعبير عن رابط يوديد الصوديوم ويراكم الأيودين. عندما يقترن العلاج باليود المشع فإنه يسمح بالعلاج الإشعاعي المحلي للورم، كما يستخدم لعلاج سرطان الغدة الدرقية. ويمكن أيضا استخدام اليود المشع لتصوير النسخ الفيروسي داخل الجسم عن طريق استخدام كاميرا غاما. [70] استخدم هذا النهج بنجاح قبل ـ سريريًا مع الفيروس الغدي، وفيروس الحصبة وفيروس الوقس.[77][78][79]
عوامل علاجية معتمدة
تاليموجين لاهارباريبفيك (أونكوفيكس GM-CSF)، ويعرف أيضا باسم T-فيك، من قبل شركة أمجن، أنهى تجارب المرحلة الثالثة لسرطان الجلد المتقدم (ميلانوما) بنجاح في مارس 2013. [80]في أكتوبر 2015، اعتمدت إدارة الأغذية والعقاقير الأمريكية T-فيك، مع اسم العلامة التجارية إيمليجيك، لعلاج سرطان الجلد في المرضى الذين يعانون من الأورام غير القابلة للجراحة. [81]ليصبح أول عامل محلل للورم معتمد في العالم الغربي. [82] وهو يقوم على فيروس الهربس البسيط (HSV-1). [83] كما تم اختباره في المرحلة الأولى من تجارب لسرطان البنكرياس والمرحلة الثالثة في تجارب سرطان الرأس والرقبة جنبا إلى جنب مع العلاج الكيميائي سيسبلاتين والعلاج الإشعاعي.[84]
البحث الإكلينيكي
في الفترة 2014-2016 تم البدء في عدد من التجارب السريرية لمجموعة واسعة من منتجات الفيروس المحلل للورم، مما يعكس التطور الإكلينيكي المستمر لهذه الفئة من العلاج.[85]
| العنصر | دواعي الاستخدام | المرحلة | الحالة | المسار | ملاحظات | المرجع |
|---|---|---|---|---|---|---|
| Ad5-yCD/mutTKSR39rep-hIL12 | سرطان البروستاتا | المرحلة الأولى | وظيفي | داخل البروستاتا | يستخدم منفردا | NCT02555397 |
| كافاتاك™ | سرطان المثانة | المرحلة الأولى | وظيفي | داخل المثانة | يعطى اختياريا مع جرعة صغيرة من ميتوسين C | NCT02316171 |
| ورم ميلاني | المرحلة الأولى | وظيفي | داخل الورم | يعطى مع إبيليموماب | NCT02307149 | |
| يعطى مع بيمبروليزوماب | NCT02565992 | |||||
| CG0070 | سرطان المثانة | المرحلة الثانية | لم يعد متاحا | داخل المثانة | يستخدم منفردا | NCT02143804 |
| وظيفي | داخل المثانة | يستخدم منفردا | NCT02365818 | |||
| دنكس-2401 | أورام المخ | المرحلة الأولى | وظيفي | داخل الورم | يعطى مع IFNγ | NCT02197169 |
| G207 | أورام المخ | المرحلة الأولى | غير مستخدم بعد | داخل الورم | يعطى اختياريا مع العلاج الإشعاعي | NCT02457845 |
| GL-ONC1 | سرطان المبيض | المرحلة الأولى b | وظيفي | داخل الصفاق | يعطى منفردا | NCT02759588 |
| HF10 | الورم الميلاني | وظيفي | المرحلة الثانية | داخل الورم | يعطى مع إبيليموماب | NCT02272855 |
| أورام صلبة | المرحلة الأولى | وظيفي | داخل الورم | يعطى منفردا | NCT02428036 | |
| Imlygic® | أورام الكبد | المرحلة الأولى | غير مستخدم بعد | داخل الورم | يعطى منفردا | NCT02509507 |
| ورم ميلاني | n.a. | التسجيل بواسطة الاستدعاء | داخل الورم | يعطى منفردا | NCT02173171 | |
| المرحلة الثانية | وظيفي | داخل الورم | يعطى منفردا | NCT02366195 | ||
| مقترنا بالجراحة | NCT02211131 | |||||
| المرحلة الثالثة | نشط ، غير موظف | داخل الورم | يعطى مع بيمبروليزوماب | NCT02263508 | ||
| متاح | داخل الورم | يعطى منفردا | NCT02147951 | |||
| NCT02297529 | ||||||
| ساركوما الأنسجة الرخوة | المرحلة الأولى / الثانية | وظيفي | داخل الورم | مقترنا بالعلاج الإشعاعي | NCT02453191 | |
| JX-594 | سرطان الكبد | المرحلة الثالثة | غير مستخدم بعد | داخل الورم | مقترنا مع سورافينيب | NCT02562755 |
| MG1-MA3 | الأورام الصلبة | المرحلة الأولى / الثانية | وظيفي | داخل الوريد | مقترنا مع ترميز الفيروس الغدي MAGEA3 | NCT02285816 |
| MV-NIS | الأورام النسائية | المرحلة الثانية | وظيفي | داخل الصفاق | يعطى منفردا | NCT02364713 |
| المايلوما المتعددة | المرحلة الثانية | وظيفي | داخل الوريد | مقترنا مع سيكلوفوسفاميد | NCT02192775 | |
| OBP-301 | أورام صلبة | I | غير موظف بعد | داخل الورم | يعطى منفردا | NCT02293850 |
| Reolysin® | أورام الدماغ | المرحلة الأولى | وظيفي | داخل الوريد | يعطى مع عامل تحفيز مستعمرات الخلايا المحببة الأكولة s.c. | NCT02444546 |
| المايلوما المتعددة | المرحلة الأولى | وظيفي | داخل الوريد | يعطى مع ديكساميثازون بالإضافة إلى مثبط البروتاسومال | NCT02101944 | |
| NCT02514382 | ||||||
| Toca 511 | أورام المخ | المرحلة الثانية/ الثالثة | غير مستخدم بعد | داخل الورم | يعطى مع 5-FC and والعلاج الكيميائي القياسي | NCT02414165 |
| الأورام الصلبة | المرحلة الأولى / الثانية | وظيفي | داخل الوريد ، داخل الورم | يعطى مع 5-FC | NCT02576665 | |
الاختصارات: 5-FC، 5-فلوروسيتوسين. GM-CSF، عامل تحفيز مستعمرات الخلايا المحببة الأكولة . IFNγ، إنتيرفيرون γ؛ MAGEA3، عائلة مستضد سرطان الجلد A3؛ ، s.c. تحت الجلد. * بدأت بين 2014 و 1 مارس و 2015، 31 أكتوبر.
معتمد في مكان ما
تمت الموافقة على تاليموجين لاهارباريبفيك من قبل إدارة الأغذية والعقاقير الأمريكية في عام 2015، مع اسم العلامة التجارية إيمليجيك، لعلاج سرطان الجلد في المرضى الذين يعانون من الأورام غير القابلة للجراحة. [81]في يناير 2016 تمت الموافقة عليه في أوروبا لبعض أنواع الميلانوما غير القابلة للجراحة.[86] أونكورين، تمت الموافقة عليه بواسطة شركة شنغهاي سونواي للتكنولوجيا الحيوية، في الصين لسرطان الرأس والرقبة في عام 2005.[87] يقوم أساسا على على الفيروس الغدي H101 . ريجفير، تمت الموافقة عليه كعلاج لسرطان الجلد في لاتفيا (2004) وجورجيا (2015) وأرمينيا (2016) لعلاج سرطان الجلد.
بدأ المرحلة الثالثة
ريوليسين، بواسطة شركة أونكوليتيكس للتكنولوجيا الحيوية، في المرحلة الثالثة لسرطان الرأس والرقبة.[88] أظهر إصدار مؤقت للبيانات أن هذه المرحلة الثالثة قد حققت بالفعل انكماش في الورم ذو دلالة إحصائية لدى المرضى في فحصهم لمدة 6 أسابيع، [89] على الرغم من أن التجربة لن تكتمل حتى تنضج بيانات البقاء على قيد الحياة بشكل عام. النتائج المبكرة مشجعة في سرطان القولون والمستقيم. [90][91]في المجموع هناك 31 من الدراسات السريرية إما مكتملة أو لا زالت جارية، بما في ذلك العديد من اختبار الريوليسين جنبا إلى جنب مع العلاج الكيميائي القياسي في مجموعة متنوعة من أنواع السرطان الصلبة. [92]
بدأ المرحلة الثانية
جكس-594، بواسطة جينيركس، حاليا في المرحلة الثانية لسرطان الكبد.[93] جكس-594 هو فيروس الوقس حذف منه الثيميدين كيناز، بالإضافة إلى GM-CSF. [94][95] فيروس سينيكا فالي (نتكس-010) و (س ف ف-001)، بيكورنافيروس المحلل للورم، هو في المرحلة الثانية لسرطان الخلايا الصغيرة في الرئة والورم العصبي. [9][87][96][97] تم تطوير ColoAd1 بواسطة معهد أبحاث بسيوكسوس ثيرابيوتيكش باستخدام عملية التطور الموجه. أكمل ColoAd1 توظيفه بنجاح في المرحلة الأولى من التجارب السريرية لل ColoAd1. شملت التجربة تعيين المرضى الذين يعانون من الأورام الصلبة الانبثاثية حيث لا توجد خيارات العلاج القياسية المعمول بها. وأظهرت عينات من هؤلاء المرضى أدلة على تضاعف الفيروس داخل مواقع الورم بعد توصيله عن طريق الوريد. وكان من المقرر أن تبدأ المرحلة الثانية من دراسة ColoAd1 في عام 2014، لدراسة فعاليته في المرضى الذين يعانون من سرطان القولون والمستقيم الانبثاثي. خلافا للعديد من الفيروسات المحللة للورم الأخرى ، يمكن أن يؤخذ ColoAd1 عن طريق الحقن في الوريد بدلا من أن يتطلب الحقن داخل الورم. تقوم تجربة ثانية بمقارنة فعالية الحقن الوريدي مقابل الحقن داخل الأورام مباشرة لتقييم الطريقة الأكثر فعالية لتقديم ColoAd1 لمرضى السرطان (انظر سجل تجارب الاتحاد الأوروبي السريرية لمزيد من التفاصيل). وهناك تجربة ثالثة تدرس الطريق داخل البريتوني لتوصيله للنساء في أخر مرحلة من سرطان المبيض.
- كافاتاك،[98][99] هو فيروس كوكساكي الذي هو في المرحلة الثانية من التجارب السريرية لعلاج سرطان الجلد الخبيث.[100]
بدأ المرحلة الأولى
- أكمل سيبرهفير (HSV-1716)، بواسطة فيرتو بيولوجيكس، [101]المرحلة الأولى في جلايوبلاستوما، وفي سرطان الخلايا الحرشفية من الرأس والرقبة، وفي سرطان الجلد. دراسة زيادة الجرعة في المرحلة الأولى من HSV-1716 داخل الورم في المرضى الأطفال / الشباب البالغين الذين يعانون من الأورام الصلبة في الجهاز العصبي غير المركزي وبدأت دراسة المرحلة الأولى I / IIa في ورم المتوسطة في عام 2012.[102][103]
- (CGTG-102 (Ad5/3-D24-GMCSF، بواسطة شركة أونكوس ثيرابيوتيكس،[104] بينما في المرحلة الأولى كان يستخدم بالفعل لعلاج 200 من مرضى السرطان المتقدمين في برنامج العلاج المتقدم للشركة. [105]
- غل-ONC1، بواسطة شركة جينيلوكس، في المرحلة Ib يؤخذ عن طريق الوريد للأورام الصلبة.[106] هناك تجارب إضافية جارية باستخدام أساليب بديلة للتناول بما في ذلك الحقن داخل الغشاء البلوري للمرضى الذين يعانون من الارتشاح البلوري الخبيث، [107]والحقن داخل الصفاق للمرضى الذين يعانون من السرطان البريتوني المتقدم،,[108] والحقن داخل الصفاق لسرطان المبيض [109] المتكرر، والحقن في الوريد في العلاج المركب في سرطان الرأس والرقبة.[110]
- MV-NIS، أثبت فيروس الحصبة المعدل هندسيا فعاليته في التدمير المستهدف لخلايا البلازما النخاعية. يوفر اليود الإشعاعي تقنية جديدة لمراقبة تعبير جين NIS.[111]
- دنكس-2401 هو فيروس غدي محلل للورم مع حالة الدواء اليتيم في الولايات المتحدة لورم دبقي.[112]
- أونكوس-102 هو النمط المصلي المعدل هندسيا مع الترميز 5/3 من الفيروس الغدي لعلاج GM-CSF البشري مُحسّن لتحفيز استجابة الخلايا T النظامية المضادة للورم في مرضى السرطان. وقد اكتملت المرحلة الأولى من التجربة وبدأت مرحلة أخرى لورم المتوسطة البلوري الخبيث .[113]
اقتران الفيروسات المحللة للورم بعلاجات السرطان الموجودة
بالاقتران مع العلاجات التقليدية للسرطان فقد أظهرت فيروسات المحللة للورم الأمل الأكبر، حيث عملت العلاجات مجتمعة بتناغم مع عدم وجود آثار سلبية واضحة. [114]
التجارب السريرية
أجريت على أونيكس-015 تجارب بالتزامن مع العلاج الكيميائي قبل أن يتم التخلي عنها في أوائل الألفينات. أعطى العلاج المشترك استجابة أكبر من أي علاج منفرد، ولكن النتائج لم تكن قاطعة تماما.[115] يخضع كلا من فيروس الهربس البسيط، والفيروس الغدي، فويروس ريوفيروس وفيروس لوكيميا الفئران لتجارب سريرية كجزء من العلاجات المركبة أيضا.[116]
البحوث ما قبل السريرية
استخدمت شركة تشن وآخرون. (2001)[117] CV706، وهو فيروس مختص بغدة البروستاتا، بالاقتران مع العلاج الإشعاعي على سرطان البروستاتا في الفئران. أدى العلاج المشترك إلى التعاون في زيادة موت الخلايا، فضلا عن زيادة كبيرة في حجم الانفجار الفيروسي (عدد جزيئات الفيروس الناتج عن كل تحلل خلوي). لم يلاحظ أي تغيير في خصوصية الفيروس.
أظهر سيبرهفير (HSV-1716) أيضا التعاون في البحوث ما قبل السريرية عندما يستخدم جنبا إلى جنب مع العديد من العلاجات الكيميائية للسرطان. [118][119]
أظهر العقار مضاد الأوعية الدموية بيفاسيزوماب (مكافحة فيغف الأجسام المضادة) قدرته على الحد من الاستجابة الالتهابية لفيروس الهربس البسيط (HSV) المحلل للورم وتحسين العلاج الفيروسي في الفئران.[120]
في الخيال العلمي
في الخيال العلمي، تم تقديم مفهوم الفيروس المحلل للأورام لأول مرة للجمهور في رواية جاك وليامسون "جزيرة التنين"، والتي نشرت في عام 1951، على الرغم من أن فيروس ويليامسون الخيالي كان يقوم على البكتيريا بدلا من فيروس الثدييات.[121] ومن المعروف أيضا أن جزيرة التنين هي مصدر مصطلح "الهندسة الوراثية". [122]
تستند حبكة فيلم هوليوود "أنا أسطورة" على فرضية أن وباء في جميع أنحاء العالم كان ناجما عن العلاج الفيروسي للسرطان.
مراجع
- Nemunaitis, John (1999). "Oncolytic viruses". Investigational New Drugs. 17 (4): 375–86. doi:10.1023/A:1006334404767. PMID 10759404. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Fillat, Cristina (2010). "Controlling Adenoviral Replication to Induce Oncolytic Efficacy" (PDF). The Open Gene Therapy Journal. 3: 15–23. doi:10.2174/1875037001003010015. مؤرشف من الأصل (PDF) في 6 يوليو 2017. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Ferguson, Mark S.; Lemoine, Nicholas R.; Wang, Yaohe (2012). "Systemic Delivery of Oncolytic Viruses: Hopes and Hurdles". Advances in Virology. 2012: 1–14. doi:10.1155/2012/805629. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Casjens S. In: Mahy BWJ and Van Regenmortel MHV. Desk Encyclopedia of General Virology. Boston: Academic Press; 2010. ISBN 0-12-375146-2. p. 167.
- Melcher, Alan; Parato, Kelley; Rooney, Cliona M; Bell, John C (2011). "Thunder and Lightning: Immunotherapy and Oncolytic Viruses Collide". Molecular Therapy. 19 (6): 1008–16. doi:10.1038/mt.2011.65. PMC 3129809. PMID 21505424. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Lichty, Brian D.; Breitbach, Caroline J.; Stojdl, David F.; Bell, John C. (2014). "Going viral with cancer immunotherapy". Nat Rev Cancer. 14 (8): 559–67. doi:10.1038/nrc3770. PMID 24990523. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Alemany, R. (2012). "Viruses in cancer treatment". Clinical and Translational Oncology. 15 (3): 182–8. doi:10.1007/s12094-012-0951-7. PMID 23143950. الوسيط
|CitationClass=تم تجاهله (مساعدة) - g. Donnelly, O.; Errington-Mais, F.; Prestwich, R.; Harrington, K.; Pandha, H.; Vile, R.; Melcher, A. (2012). "Recent Clinical Experience with Oncolytic Viruses". Current Pharmaceutical Biotechnology. 13 (9): 1834–41. doi:10.2174/138920112800958904. PMID 21740364. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Roberts, MS; Lorence, RM; Groene, WS; Bamat, MK (2006). "Naturally oncolytic viruses". Current opinion in molecular therapeutics. 8 (4): 314–21. PMID 16955694. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Rudin, Charles M.; John T. Poirier; Neil N. Senzer; Joseph Stephenson; David Loesch; Kevin D. Burroughs; P. Seshidhar Reddy; Christine L. Hann; Paul L. Hallenbeck (2011-02-15). "Phase I clinical study of Seneca Valley Virus (SVV-001), a replication-competent picornavirus, in advanced solid tumors with neuroendocrine features". Clinical Cancer Research. 17 (4): 888–895. doi:10.1158/1078-0432.CCR-10-1706. ISSN 1078-0432. PMID 21304001. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Rigvir šķīdums injekcijām". Medicinal product register of the Republic of Latvia. 2004-04-29. مؤرشف من الأصل في 10 مايو 2017. اطلع عليه بتاريخ 08 ديسمبر 2016. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Georgia Today". مؤرشف من الأصل في 28 مارس 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Frew, Sarah E; Sammut, Stephen M; Shore, Alysha F; Ramjist, Joshua K; Al-Bader, Sara; Rezaie, Rahim; Daar, Abdallah S; Singer, Peter A (2008). "Chinese health biotech and the billion-patient market". Nature Biotechnology. 26 (1): 37–53. doi:10.1038/nbt0108-37. PMID 18183014. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Broderick, Jason. "FDA Panels Support Approval of T-VEC in Melanoma". OncLive. مؤرشف من الأصل في 17 فبراير 2019. اطلع عليه بتاريخ 24 أغسطس 2015. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Kuruppu, Darshini; Tanabe, Kenneth K. (2005). "Viral oncolysis by herpes simplex virus and other viruses". Cancer Biology & Therapy. 4 (5): 524–31. doi:10.4161/cbt.4.5.1820. PMID 15917655. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Voroshilova, MK (1989). "Potential use of nonpathogenic enteroviruses for control of human disease". Progress in medical virology. 36: 191–202. PMID 2555836. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Pond, AR; Manuelidis, EE (1964). "Oncolytic Effect of Poliomyelitis Virus on Human Epidermoid Carcinoma (Hela Tumor) Heterologously Transplanted to Guinea Pigs". The American Journal of Pathology. 45 (2): 233–49. PMC 1907181. PMID 14202523. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Kunin, CM (1964). "Cellular Susceptibility to Enterovirus". Bacteriological reviews. 28 (4): 382–90. PMC 441234. PMID 14244713. مؤرشف من الأصل في 23 مارس 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Chumakov P, Morozova V, Babkin I, Baikov I, Netesov S, Tikunova N (2012). "Oncolytic enteroviruses" (PDF). Molecular Biology. 46 (5): 639–650. doi:10.1134/s0026893312050032. مؤرشف من الأصل (PDF) في 7 يوليو 2017. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Kelly, Elizabeth; Russell, Stephen J (2007). "History of Oncolytic Viruses: Genesis to Genetic Engineering". Molecular Therapy. 15 (4): 651–9. doi:10.1038/sj.mt.6300108. PMID 17299401. الوسيط
|CitationClass=تم تجاهله (مساعدة) - MacLean, A. R.; Ul-Fareed, M.; Robertson, L.; Harland, J.; Brown, S. M. (1991). "Herpes simplex virus type 1 deletion variants 1714 and 1716 pinpoint neurovirulence-related sequences in Glasgow strain 17+ between immediate early gene 1 and the 'a' sequence". Journal of General Virology. 72 (3): 631–639. doi:10.1099/0022-1317-72-3-631. PMID 1848598. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Brown, S. M.; Harland, J.; MacLean, A. R.; Podlech, J.; Clements, J. B. (1994). "Cell type and cell state determine differential in vitro growth of non-neurovirulent ICP34.5-negative herpes simplex virus types 1 and 2". Journal of General Virology. 75 (9): 2367–2377. doi:10.1099/0022-1317-75-9-2367. PMID 8077935. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Kesari, S; Randazzo, BP; Valyi-Nagy, T; Huang, QS; Brown, SM; MacLean, AR; Lee, VM; Trojanowski, JQ; Fraser, NW (1995). "Therapy of experimental human brain tumors using a neuroattenuated herpes simplex virus mutant". Laboratory Investigation. 73 (5): 636–48. PMID 7474937. الوسيط
|CitationClass=تم تجاهله (مساعدة) - McKie, EA; MacLean, AR; Lewis, AD; Cruickshank, G; Rampling, R; Barnett, SC; Kennedy, PGE; Brown, SM (1996). "Selective in vitro replication of herpes simplex virus type 1 (HSV-1) ICP34.5 null mutants in primary human CNS tumours - evaluation of a potentially effective clinical therapy". British Journal of Cancer. 74 (5): 745–52. doi:10.1038/bjc.1996.431. PMC 2074706. PMID 8795577. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Randazzo, Bruce P; Bhat, Mulki G; Kesari, Santosh; Fraser, Nigel W; Brown, S Moira (1997). "Treatment of Experimental Subcutaneous Human Melanoma with a Replication-Restricted Herpes Simplex Virus Mutant". Journal of Investigative Dermatology. 108 (6): 933–7. doi:10.1111/1523-1747.ep12295238. PMID 9182825. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Rampling, R; Cruickshank, G; Papanastassiou, V; Nicoll, J; Hadley, D; Brennan, D; Petty, R; MacLean, A; Harland, J; McKie, E; Mabbs, R; Brown, M (2000). "Toxicity evaluation of replication-competent herpes simplex virus (ICP 34.5 null mutant 1716) in patients with recurrent malignant glioma". Gene Therapy. 7 (10): 859–66. doi:10.1038/sj.gt.3301184. PMID 10845724. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Papanastassiou, V; Rampling, R; Fraser, M; Petty, R; Hadley, D; Nicoll, J; Harland, J; Mabbs, R; Brown, M (2002). "The potential for efficacy of the modified (ICP 34.5−) herpes simplex virus HSV1716 following intratumoural injection into human malignant glioma: A proof of principle study". Gene Therapy. 9 (6): 398–406. doi:10.1038/sj.gt.3301664. PMID 11960316. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Harrow, S; Papanastassiou, V; Harland, J; Mabbs, R; Petty, R; Fraser, M; Hadley, D; Patterson, J; Brown, S M; Rampling, R (2004). "HSV1716 injection into the brain adjacent to tumour following surgical resection of high-grade glioma: Safety data and long-term survival". Gene Therapy. 11 (22): 1648–58. doi:10.1038/sj.gt.3302289. PMID 15334111. الوسيط
|CitationClass=تم تجاهله (مساعدة) - MacKie, Rona M; Stewart, Barry; Brown, S Moira (2001). "Intralesional injection of herpes simplex virus 1716 in metastatic melanoma". The Lancet. 357 (9255): 525–6. doi:10.1016/S0140-6736(00)04048-4. PMID 11229673. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Mace, Alastair T. M.; Ganly, Ian; Soutar, David S.; Brown, S. Moira (2008). "Potential for efficacy of the oncolytic Herpes simplex virus 1716 in patients with oral squamous cell carcinoma". Head & Neck. 30 (8): 1045–51. doi:10.1002/hed.20840. PMID 18615711. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Conner, J; Braidwood, L; Brown, S M (2008). "A strategy for systemic delivery of the oncolytic herpes virus HSV1716: Redirected tropism by antibody-binding sites incorporated on the virion surface as a glycoprotein D fusion protein". Gene Therapy. 15 (24): 1579–92. doi:10.1038/gt.2008.121. PMID 18701918. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Braidwood, L; Dunn, PD; Hardy, S; Evans, TR; Brown, SM (2009). "Antitumor activity of a selectively replication competent herpes simplex virus (HSV) with enzyme prodrug therapy". Anticancer research. 29 (6): 2159–66. PMID 19528476. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Sorensen, A.; Mairs, R. J.; Braidwood, L.; Joyce, C.; Conner, J.; Pimlott, S.; Brown, M.; Boyd, M. (2012). "In Vivo Evaluation of a Cancer Therapy Strategy Combining HSV1716-Mediated Oncolysis with Gene Transfer and Targeted Radiotherapy". Journal of Nuclear Medicine. 53 (4): 647–54. doi:10.2967/jnumed.111.090886. PMID 22414636. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Garber, K. (2006). "China Approves World's First Oncolytic Virus Therapy for Cancer Treatment". JNCI Journal of the National Cancer Institute. 98 (5): 298–300. doi:10.1093/jnci/djj111. PMID 16507823. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Ayllón Barbellido, S; Campo Trapero, J; Cano Sánchez, J; Perea García, MA; Escudero Castaño, N; Bascones Martínez, A (2008). "Gene therapy in the management of oral cancer: Review of the literature" (PDF). Medicina oral, patologia oral y cirugia bucal. 13 (1): E15–21. PMID 18167474. مؤرشف من الأصل (PDF) في 11 فبراير 2012. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Guo, J.; Xin, H. (2006). "CHINESE GENE THERAPY: Splicing Out the West?". Science. 314 (5803): 1232–5. doi:10.1126/science.314.5803.1232. PMID 17124300. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Schmidt, C. (2013). "Awaiting a Moment of Truth for Oncolytic Viruses". JNCI Journal of the National Cancer Institute. 105 (10): 675–6. doi:10.1093/jnci/djt111. PMID 23650626. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Kottke, T.; Thompson, J.; Diaz, R. M.; Pulido, J.; Willmon, C.; Coffey, M.; Selby, P.; Melcher, A.; Harrington, K.; Vile, R. G. (2009). "Improved Systemic Delivery of Oncolytic Reovirus to Established Tumors Using Preconditioning with Cyclophosphamide-Mediated Treg Modulation and Interleukin-2". Clinical Cancer Research. 15 (2): 561–9. doi:10.1158/1078-0432.CCR-08-1688. PMC 3046733. PMID 19147761. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Lolkema, M. P.; Arkenau, H.-T.; Harrington, K.; Roxburgh, P.; Morrison, R.; Roulstone, V.; Twigger, K.; Coffey, M.; Mettinger, K.; Gill, G.; Evans, T. R. J.; De Bono, J. S. (2010). "A Phase I Study of the Combination of Intravenous Reovirus Type 3 Dearing and Gemcitabine in Patients with Advanced Cancer". Clinical Cancer Research. 17 (3): 581–8. doi:10.1158/1078-0432.CCR-10-2159. PMID 21106728. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Magge, D; Guo, Z S; O'Malley, M E; Francis, L; Ravindranathan, R; Bartlett, D L (2013). "Inhibitors of C5 complement enhance vaccinia virus oncolysis". Cancer Gene Therapy. 20 (6): 342–50. doi:10.1038/cgt.2013.26. PMC 4060830. PMID 23661042. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Heo, Jeong; Reid, Tony; Ruo, Leyo; Breitbach, Caroline J; Rose, Steven; Bloomston, Mark; Cho, Mong; Lim, Ho Yeong; Chung, Hyun Cheol; Kim, Chang Won; Burke, James; Lencioni, Riccardo; Hickman, Theresa; Moon, Anne; Lee, Yeon Sook; Kim, Mi Kyeong; Daneshmand, Manijeh; Dubois, Kara; Longpre, Lara; Ngo, Minhtran; Rooney, Cliona; Bell, John C; Rhee, Byung-Geon; Patt, Richard; Hwang, Tae-Ho; Kirn, David H (2013). "Randomized dose-finding clinical trial of oncolytic immunotherapeutic vaccinia JX-594 in liver cancer". Nature Medicine. 19 (3): 329–36. doi:10.1038/nm.3089. PMC 4268543. PMID 23396206. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Wonganan, Piyanuch; Croyle, Maria A. (2010). "PEGylated Adenoviruses: From Mice to Monkeys". Viruses. 2 (2): 468–502. doi:10.3390/v2020468. PMC 3185605. PMID 21994645. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Muthana, M.; Rodrigues, S.; Chen, Y.-Y.; Welford, A.; Hughes, R.; Tazzyman, S.; Essand, M.; Morrow, F.; Lewis, C. E. (2012). "Macrophage Delivery of an Oncolytic Virus Abolishes Tumor Regrowth and Metastasis after Chemotherapy or Irradiation". Cancer Research. 73 (2): 490–5. doi:10.1158/0008-5472.CAN-12-3056. PMID 23172310. الوسيط
|CitationClass=تم تجاهله (مساعدة) - w. Tong, Alex; Senzer, Neil; Cerullo, Vincenzo; Templeton, Nancy; Hemminki, Akseli; Nemunaitis, John (2012). "Oncolytic Viruses for Induction of Anti-Tumor Immunity". Current Pharmaceutical Biotechnology. 13 (9): 1750–60. doi:10.2174/138920112800958913. PMID 21740355. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Naik, J. D.; Twelves, C. J.; Selby, P. J.; Vile, R. G.; Chester, J. D. (2011). "Immune Recruitment and Therapeutic Synergy: Keys to Optimizing Oncolytic Viral Therapy?". Clinical Cancer Research. 17 (13): 4214–24. doi:10.1158/1078-0432.CCR-10-2848. PMC 3131422. PMID 21576084. الوسيط
|CitationClass=تم تجاهله (مساعدة) - O'Regan, Brendan; Hirshberg, Caryle (1993). Spontaneous remission : an annotated bibliography. Sausalito, California: Institute of Noetic Sciences. ISBN 0943951178. مؤرشف من الأصل في 21 مارس 2015. الوسيط
|CitationClass=تم تجاهله (مساعدة)[بحاجة لرقم الصفحة] - Lattime, E (2013). Gene Therapy of Cancer: Translational Approaches from Preclinical Studies to Clinical Implementation. Academic Press. ISBN 0123942950. مؤرشف من الأصل في 09 يونيو 2016. الوسيط
|CitationClass=تم تجاهله (مساعدة)[بحاجة لرقم الصفحة] - Mastrangelo, Michael J; Lattime, Edmund C (2002). "Virotherapy clinical trials for regional disease: In situ immune modulation using recombinant poxvirus vectors". Cancer Gene Therapy. 9 (12): 1013–21. doi:10.1038/sj.cgt.7700538. PMID 12522440. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Bell, John C.; Lichty, David F.; Knowles, Brian; Marius, Shane; Atkins, Ricardo; Sonenberg, Harold; Bell, Nahum (2000). "Exploiting tumor-specific defects in the interferon pathway with a previously unknown oncolytic virus". Nature Medicine. 6 (7): 821–5. doi:10.1038/77558. PMID 10888934. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Stojdl, David F; Lichty, Brian D; Tenoever, Benjamin R; Paterson, Jennifer M; Power, Anthony T; Knowles, Shane; Marius, Ricardo; Reynard, Jennifer; Poliquin, Laurent; Atkins, Harold; Brown, Earl G; Durbin, Russell K; Durbin, Joan E; Hiscott, John; Bell, John C (2003). "VSV strains with defects in their ability to shutdown innate immunity are potent systemic anti-cancer agents". Cancer Cell. 4 (4): 263–75. doi:10.1016/S1535-6108(03)00241-1. PMID 14585354. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Ahmed, M; Cramer, S; Lyles, D (2004). "Sensitivity of prostate tumors to wild type and M protein mutant vesicular stomatitis viruses". Virology. 330 (1): 34–49. doi:10.1016/j.virol.2004.08.039. PMID 15527832. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Ebert, Oliver; Harbaran, Sonal; Shinozaki, Katsunori; Woo, Savio L C (2004). "Systemic therapy of experimental breast cancer metastases by mutant vesicular stomatitis virus in immune-competent mice". Cancer Gene Therapy. 12 (4): 350–8. doi:10.1038/sj.cgt.7700794. PMID 15565179. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Porosnicu, M; Mian, A; Barber, GN (2003). "The oncolytic effect of recombinant vesicular stomatitis virus is enhanced by expression of the fusion cytosine deaminase/uracil phosphoribosyltransferase suicide gene". Cancer Research. 63 (23): 8366–76. PMID 14678998. مؤرشف من الأصل في 23 مارس 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Bridle, Byram W; Stephenson, Kyle B; Boudreau, Jeanette E; Koshy, Sandeep; Kazdhan, Natasha; Pullenayegum, Eleanor; Brunellière, Jérôme; Bramson, Jonathan L; Lichty, Brian D; Wan, Yonghong (2010). "Potentiating Cancer Immunotherapy Using an Oncolytic Virus". Molecular Therapy. 18 (8): 1430–9. doi:10.1038/mt.2010.98. PMC 2927075. PMID 20551919. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Gromeier, M.; Lachmann, S.; Rosenfeld, M. R.; Gutin, P. H.; Wimmer, E. (2000). "Intergeneric poliovirus recombinants for the treatment of malignant glioma". Proceedings of the National Academy of Sciences. 97 (12): 6803–8. Bibcode:2000PNAS...97.6803G. doi:10.1073/pnas.97.12.6803. JSTOR 122718. PMC 18745. PMID 10841575. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Goetz, Christian; Gromeier, Matthias (2010). "Preparing an oncolytic poliovirus recombinant for clinical application against glioblastoma multiforme". Cytokine & Growth Factor Reviews. 21 (2–3): 197–203. doi:10.1016/j.cytogfr.2010.02.005. PMID 20299272. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Lal, R; Harris, D; Postel-Vinay, S; De Bono, J (2009). "Reovirus: Rationale and clinical trial update". Current opinion in molecular therapeutics. 11 (5): 532–9. PMID 19806501. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Thirukkumaran, Chandini; Morris, Don G. (2009), "Oncolytic Viral Therapy Using Reovirus", Methods in molecular biology, 542: 607–34, doi:10.1007/978-1-59745-561-9_31, ISBN 978-1-934115-85-5, PMID 19565924 الوسيط
|CitationClass=تم تجاهله (مساعدة); الوسيط|separator=تم تجاهله (مساعدة)CS1 maint: ref=harv (link) - Doniņa, Simona; Strēle, Ieva; Proboka, Guna; Auziņš, Jurģis; Alberts, Pēteris; Jonsson, Björn; Venskus, Dite; Muceniece, Aina (2015). "Adapted ECHO-7 virus Rigvir immunotherapy (oncolytic virotherapy) prolongs survival in melanoma patients after surgical excision of the tumour in a retrospective study". Melanoma Research. 25 (5): 421–426. doi:10.1097/CMR.0000000000000180. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Cancer Virotherapy Journal | https://www.cancervirotherapy.eu/cancer-virotherapy-pdf-version.php | accessed 23 November 2015
- Alberts, Pēteris; Olmane, Evija; Brokāne, Linda; Krastiņa, Zanda; Romanovska, Māra; Kupčs, Kārlis; Isajevs, Sergejs; Proboka, Guna; Romualds, Erdmanis; Jurijs, Nazarovs; Dite, Venskus (2016). "Long-term treatment with the oncolytic ECHO-7 virus Rigvir of a melanoma stage IV M1c patient, a small cell lung cancer stage IIIA patient, and a histiocytic sarcoma stage IV patient-three case reports". APMIS. 124 (9): 896–904. doi:10.1111/apm.12576. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Ramachandran, Mohanraj; Yu, Di; Dyczynski, Matheus; Baskaran, Sathishkumar; Zhang, Lei; Saul, Sirle; Lulla, Aleksei; Lulla, Valeria; Nelander, Sven (2016-01-01). "Safe and effective treatment of experimental neuroblastoma and glioblastoma using systemically administered triple microRNA-detargeted oncolytic Semliki Forest virus". Clinical Cancer Research (باللغة الإنجليزية): clincanres.0925.2016. doi:10.1158/1078-0432.CCR-16-0925. ISSN 1078-0432. PMID 27637889. مؤرشف من الأصل في 8 يونيو 2019. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Ottawa research into cancer vaccine gets funding boost نسخة محفوظة 09 أكتوبر 2016 على موقع واي باك مشين.
- MG1 Maraba/MAGE-A3, With and Without Adenovirus Vaccine, With Transgenic MAGE-A3 Insertion in Patients With Incurable MAGE-A3-Expressing Solid Tumours (I214) نسخة محفوظة 20 يونيو 2017 على موقع واي باك مشين.
- Kuhn I, Harden P, Bauzon M, Chartier C, Nye J, Thorne S, Reid T, Ni S, Lieber A, Fisher K, Seymour L, Rubanyi GM, Harkins RN, Hermiston TW (2008). "Directed evolution generates a novel oncolytic virus for the treatment of colon cancer". PLoS ONE. 3 (6): e2409. doi:10.1371/journal.pone.0002409. PMC 2423470. PMID 18560559. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Chow, Amy. "Cell Cycle Control by Oncogenes and Tumor Suppressors: Driving the Transformation of Normal Cells into Cancerous Cells". Nature Education. مؤرشف من الأصل في 03 أبريل 2019. اطلع عليه بتاريخ 05 أبريل 2013. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ أرشيف=(مساعدة) - kinase "Medical Dictionary" تحقق من قيمة
|مسار أرشيف=(مساعدة). Merriam-Webster. مؤرشف من الأصل في 17 فبراير 2019. اطلع عليه بتاريخ 05 أبريل 2013. الوسيط|CitationClass=تم تجاهله (مساعدة) - Gentry, Glenn A. (1992). "Viral thymidine kinases and their relatives". Pharmacology & Therapeutics. 54 (3): 319–355. doi:10.1016/0163-7258(92)90006-L. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Davydova, J.; Le, LP; Gavrikova, T; Wang, M; Krasnykh, V; Yamamoto, M (2004). "Infectivity-Enhanced Cyclooxygenase-2-Based Conditionally Replicative Adenoviruses for Esophageal Adenocarcinoma Treatment". Cancer Research. 64 (12): 4319–27. doi:10.1158/0008-5472.CAN-04-0064. PMID 15205347. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Haddad, Dana; Chen, Chun-Hao; Carlin, Sean; Silberhumer, Gerd; Chen, Nanhai G.; Zhang, Qian; Longo, Valerie; Carpenter, Susanne G.; Mittra, Arjun; Carson, Joshua; Au, Joyce; Gonen, Mithat; Zanzonico, Pat B.; Szalay, Aladar A.; Fong, Yuman (2012). Gelovani, Juri G (المحرر). "Imaging Characteristics, Tissue Distribution, and Spread of a Novel Oncolytic Vaccinia Virus Carrying the Human Sodium Iodide Symporter". PLoS ONE. 7 (8): e41647. doi:10.1371/journal.pone.0041647. PMC 3422353. PMID 22912675. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Poirier, J. T.; Reddy, P. S.; Idamakanti, N.; Li, S. S.; Stump, K. L.; Burroughs, K. D.; Hallenbeck, P. L.; Rudin, C. M. (2012). "Characterization of a full-length infectious cDNA clone and a GFP reporter derivative of the oncolytic picornavirus SVV-001". Journal of General Virology. 93 (Pt 12): 2606–13. doi:10.1099/vir.0.046011-0. PMID 22971818. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Yu, Yong A; Shabahang, Shahrokh; Timiryasova, Tatyana M; Zhang, Qian; Beltz, Richard; Gentschev, Ivaylo; Goebel, Werner; Szalay, Aladar A (2004). "Visualization of tumors and metastases in live animals with bacteria and vaccinia virus encoding light-emitting proteins". Nature Biotechnology. 22 (3): 313–20. doi:10.1038/nbt937. PMID 14990953. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Freeman, SM; Whartenby, KA; Freeman, JL; Abboud, CN; Marrogi, AJ (1996). "In situ use of suicide genes for cancer therapy". Seminars in oncology. 23 (1): 31–45. PMID 8607030. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Duarte, Sónia; Carle, Georges; Faneca, Henrique; De Lima, Maria C. Pedroso de; Pierrefite-Carle, Valérie (2012). "Suicide gene therapy in cancer: Where do we stand now?". Cancer Letters. 324 (2): 160–70. doi:10.1016/j.canlet.2012.05.023. PMID 22634584. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Frentzen, A.; Yu, Y. A.; Chen, N.; Zhang, Q.; Weibel, S.; Raab, V.; Szalay, A. A. (2009). "Anti-VEGF single-chain antibody GLAF-1 encoded by oncolytic vaccinia virus significantly enhances antitumor therapy". Proceedings of the National Academy of Sciences. 106 (31): 12915–20. Bibcode:2009PNAS..10612915F. doi:10.1073/pnas.0900660106. JSTOR 40484625. PMC 2722284. PMID 19617539. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Conner, J; Braidwood, L (2012). "Expression of inhibitor of growth 4 by HSV1716 improves oncolytic potency and enhances efficacy". Cancer Gene Therapy. 19 (7): 499–507. doi:10.1038/cgt.2012.24. PMID 22595793. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Grünwald, G K; Klutz, K; Willhauck, M J; Schwenk, N; Senekowitsch-Schmidtke, R; Schwaiger, M; Zach, C; Göke, B; Holm, P S; Spitzweg, C (2012). "Sodium iodide symporter (NIS)-mediated radiovirotherapy of hepatocellular cancer using a conditionally replicating adenovirus". Gene Therapy. 20 (6): 625–33. doi:10.1038/gt.2012.79. PMID 23038026. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Penheiter, Alan R.; Wegman, Troy R.; Classic, Kelly L.; Dingli, David; Bender, Claire E.; Russell, Stephen J.; Carlson, Stephanie K. (2010). "Sodium Iodide Symporter (NIS)-Mediated Radiovirotherapy for Pancreatic Cancer". American Journal of Roentgenology. 195 (2): 341–9. doi:10.2214/AJR.09.3672. PMC 3117397. PMID 20651188. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Li, H; Peng, K-W; Dingli, D; Kratzke, R A; Russell, S J (2010). "Oncolytic measles viruses encoding interferon β and the thyroidal sodium iodide symporter gene for mesothelioma virotherapy". Cancer Gene Therapy. 17 (8): 550–8. doi:10.1038/cgt.2010.10. PMC 2907639. PMID 20379224. الوسيط
|CitationClass=تم تجاهله (مساعدة) - موقع التجارب السريرية NCT00769704 Efficacy and Safety Study of OncoVEXGM-CSF Compared to GM-CSF in Melanoma
- "FDA approves Amgen's Injected Immunotherapy for Melanoma". Reuters. 27 October 2015. مؤرشف من الأصل في 23 نوفمبر 2015. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Sheridan, Cormac (2015). "First oncolytic virus edges towards approval in surprise vote". Nature Biotechnology. 33 (6): 569–570. doi:10.1038/nbt0615-569. ISSN 1087-0156. PMID 26057953. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Amgen, Form 8-K, Current Report, Filing Date Jan 26, 2012" (PDF). secdatabase.com. مؤرشف من الأصل (PDF) في 30 سبتمبر 2018. اطلع عليه بتاريخ Jan 8, 2013. الوسيط
|CitationClass=تم تجاهله (مساعدة) - موقع التجارب السريرية NCT01161498 Study of Safety and Efficacy of OncoVEXGM-CSF With Cisplatin for Treatment of Locally Advanced Head and Neck Cancer
- Pol, Jonathan; Buqué, Aitziber; Aranda, Fernando; Bloy, Norma; Cremer, Isabelle; Eggermont, Alexander; Erbs, Philippe; Fucikova, Jitka; Galon, Jérôme; Limacher, Jean-Marc; Preville, Xavier; Sautès-Fridman, Catherine; Spisek, Radek; Zitvogel, Laurence; Kroemer, Guido; Galluzzi, Lorenzo (8 December 2015). "Trial Watch—Oncolytic viruses and cancer therapy". OncoImmunology. 5 (2): e1117740. doi:10.1080/2162402X.2015.1117740. PMID 27057469. مؤرشف من الأصل في 23 مارس 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Metastatic Melanoma Therapy, Imlygic, Now Available in EU نسخة محفوظة 27 أبريل 2016 على موقع واي باك مشين.
- Schmidt, Charlie (2011). "Amgen spikes interest in live virus vaccines for hard-to-treat cancers". Nature Biotechnology. 29 (4): 295–6. doi:10.1038/nbt0411-295. PMID 21478830. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Intravenous Administration of REOLYSIN® in Combination with Paclitaxel and Carboplatin for Patients with Platinum-Refractory Head and Neck Cancers". مؤرشف من الأصل في 04 نوفمبر 2013. اطلع عليه بتاريخ 31 مايو 2013. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ أرشيف=(مساعدة) - http://www.oncolytics.com/news_items/details?press_release_id=1916%5Bاستشهاد+منقوص+البيانات%5D
- "Oncolytics Biotech® announces positive data from translational clinical trial investigating REOLYSIN® in Patients with Metastatic Colorectal Cancer" (Press release). Biofind. 21 April 2011. مؤرشف من الأصل في 9 أبريل 2016. اطلع عليه بتاريخ 07 أغسطس 2011. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Adair, R. A.; Roulstone, V.; Scott, K. J.; Morgan, R.; Nuovo, G. J.; Fuller, M.; Beirne, D.; West, E. J.; Jennings, V. A.; Rose, A.; Kyula, J.; Fraser, S.; Dave, R.; Anthoney, D. A.; Merrick, A.; Prestwich, R.; Aldouri, A.; Donnelly, O.; Pandha, H.; Coffey, M.; Selby, P.; Vile, R.; Toogood, G.; Harrington, K.; Melcher, A. A. (2012). "Cell Carriage, Delivery, and Selective Replication of an Oncolytic Virus in Tumor in Patients". Science Translational Medicine. 4 (138): 138ra77. doi:10.1126/scitranslmed.3003578. PMC 3893925. PMID 22700953. الوسيط
|CitationClass=تم تجاهله (مساعدة), cited in "Oncolytics Biotech® Inc. Announces Publication of Translational Clinical Trial Results in Science Translational Medicine" (Press release). Biofind. 13 June 2012. مؤرشف من الأصل في 4 مارس 2016. اطلع عليه بتاريخ 16 يونيو 2012. الوسيط|CitationClass=تم تجاهله (مساعدة) - Reolysin Clinical Trials at NIH نسخة محفوظة 20 ديسمبر 2016 على موقع واي باك مشين.
- موقع التجارب السريرية NCT01387555 A Phase 2b Study of Vaccinia Virus to Treat Advanced Liver Cancer (TRAVERSE)
- موقع التجارب السريرية NCT00625456 Safety Study of Recombinant Vaccinia Virus to Treat Refractory Solid Tumors
- j. Breitbach, Caroline; Thorne, Steve; Bell, John; Kirn, David (2012). "Targeted and Armed Oncolytic Poxviruses for Cancer: The Lead Example of JX-594". Current Pharmaceutical Biotechnology. 13 (9): 1768–72. doi:10.2174/138920112800958922. PMID 21740365. الوسيط
|CitationClass=تم تجاهله (مساعدة) - موقع التجارب السريرية NCT01048892 Seneca Valley Virus-001 and Cyclophosphamide in Treating Young Patients With Relapsed or Refractory Neuroblastoma, Rhabdomyosarcoma, or Rare Tumors With Neuroendocrine Features, October 2012
- موقع التجارب السريرية NCT01017601 Seneca Valley Virus-001 After Chemotherapy in Treating Patients With Extensive-Stage Small Cell Lung Cancer
- Oncolytic activity of Coxsackievirus A21 (CAVATAK™) in human pancreatic cancer. (June 2011 poster) نسخة محفوظة 09 أكتوبر 2016 على موقع واي باك مشين.
- موقع التجارب السريرية NCT00832559 A Study of the Intratumoural Administration of CAVATAK to Head and Neck Cancer Patients
- موقع التجارب السريرية NCT01227551 A Study of Intratumoral CAVATAK in Patients With Stage IIIc and Stage IV Malignant Melanoma
- "Virttu.com". مؤرشف من الأصل في 13 أكتوبر 2018. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Seprehvir, Virttu Biologics نسخة محفوظة 03 مارس 2016 على موقع واي باك مشين.
- Oncolytic Virus Specialist Virttu Biologics Initiates Phase I/II SEPREHVIR™ Study in Mesothelioma, BioSpace, 11 September 2012 نسخة محفوظة 19 يونيو 2017 على موقع واي باك مشين.
- "Oncos.net". مؤرشف من الأصل في 18 ديسمبر 2014. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Oncolytic viruses mediating anti-tumor immunity in human cancer patients" (Press release). Oncos Therapeutics. 19 May 2010. مؤرشف من الأصل في 24 ديسمبر 2016. الوسيط
|CitationClass=تم تجاهله (مساعدة) - موقع التجارب السريرية NCT00794131 Safety Study of GL-ONC1, an Oncolytic Virus, in Patients With Advanced Solid Tumors
- موقع التجارب السريرية NCT01766739 Intra-pleural Administration of GL-ONC1, a Genetically Modified Vaccinia Virus, in Patients With Malignant Pleural Effusion: Primary, Metastases and Mesothelioma
- موقع التجارب السريرية NCT01443260 A Study of GL-ONC1, an Oncolytic Vaccinia Virus, in Patients With Advanced Peritoneal Carcinomatosis
- نسخة محفوظة 04 مارس 2017 على موقع واي باك مشين.
- موقع التجارب السريرية NCT01584284 Safety Study of Attenuated Vaccinia Virus (GL-ONC1)With Combination Therapy in Head & Neck Cancer
- Russell SJ, Federspiel MJ, Peng KW, Tong C, Dingli D, Morice WG, Lowe V, O'Connor MK, Kyle RA, Leung N, Buadi FK, Rajkumar SV, Gertz MA, Lacy MQ, Dispenzieri A (2014-07-01). "Remission of Disseminated Cancer After Systemic Oncolytic Virotherapy". Mayo Clinic Proceedings. 89 (7): 926–933. doi:10.1016/j.mayocp.2014.04.003. ISSN 0025-6196. PMC 4225126. PMID 24835528. مؤرشف من الأصل في 17 ديسمبر 2019. اطلع عليه بتاريخ 21 أغسطس 2014. الوسيط
|CitationClass=تم تجاهله (مساعدة) - نسخة محفوظة 30 يونيو 2017 على موقع واي باك مشين.
- Targovax recruits the first patient in a trial with the oncolytic virus ONCOS-102 in malignant pleural mesothelioma [وصلة مكسورة] نسخة محفوظة 22 أغسطس 2016 على موقع واي باك مشين.
- Ottolino-Perry, Kathryn; Diallo, Jean-Simon; Lichty, Brian D; Bell, John C; McCart, J (2009). "Intelligent Design: Combination Therapy with Oncolytic Viruses". Molecular Therapy. 18 (2): 251–63. doi:10.1038/mt.2009.283. PMC 2839289. PMID 20029399. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Khuri, Fadlo R.; Nemunaitis, John; Ganly, Ian; Arseneau, James; Tannock, Ian F.; Romel, Larry; Gore, Martin; Ironside, Janet; MacDougall, R.H.; Heise, Carla; Randlev, Britta; Gillenwater, Ann M.; Bruso, Patricia; Kaye, Stanley B.; Hong, Waun Ki; Kirn, David H. (2000). "A controlled trial of intratumoral ONYX-015, a selectively-replicating adenovirus, in combination with cisplatin and 5-fluorouracil in patients with recurrent head and neck cancer". Nature Medicine. 6 (8): 879–85. doi:10.1038/78638. PMID 10932224. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Suryawanshi, Yogesh R.; Zhang, Tiantian; Essani, Karim (2017-03-01). "Oncolytic viruses: emerging options for the treatment of breast cancer". Medical Oncology (باللغة الإنجليزية). 34 (3): 43. doi:10.1007/s12032-017-0899-0. ISSN 1357-0560. مؤرشف من الأصل في 18 يونيو 2018. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Chen, Y; Deweese, T; Dilley, J; Zhang, Y; Li, Y; Ramesh, N; Lee, J; Pennathur-Das, R; Radzyminski, J; Wypych, J; Brignetti, D; Scott, S; Stephens, J; Karpf, DB; Henderson, DR; Yu, DC (2001). "CV706, a prostate cancer-specific adenovirus variant, in combination with radiotherapy produces synergistic antitumor efficacy without increasing toxicity". Cancer Research. 61 (14): 5453–60. PMID 11454691. مؤرشف من الأصل في 23 مارس 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Mace, A.T.M.; Harrow, S.J.; Ganly, I.; Brown, S.M. (2007). "Cytotoxic effects of the oncolytic herpes simplex virus HSV1716 alone and in combination with cisplatin in head and neck squamous cell carcinoma". Acta Oto-laryngologica. 127 (8): 880–7. doi:10.1080/00016480601075381. PMID 17763002. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Toyoizumi, Takane; Mick, Rosemarie; Abbas, Abbas E.; Kang, Eugene H.; Kaiser, Larry R.; Molnar-Kimber, Katherine L. (1999). "Combined Therapy with Chemotherapeutic Agents and Herpes Simplex Virus Type 1 ICP34.5 Mutant (HSV-1716) in Human Non-Small Cell Lung Cancer". Human Gene Therapy. 10 (18): 3013–29. doi:10.1089/10430349950016410. PMID 10609661. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Currier, Mark A; Eshun, Francis K; Sholl, Allyson; Chernoguz, Artur; Crawford, Kelly; Divanovic, Senad; Boon, Louis; Goins, William F; Frischer, Jason S; Collins, Margaret H; Leddon, Jennifer L; Baird, William H; Haseley, Amy; Streby, Keri A; Wang, Pin-Yi; Hendrickson, Brett W; Brekken, Rolf A; Kaur, Balveen; Hildeman, David; Cripe, Timothy P (2013). "VEGF Blockade Enables Oncolytic Cancer Virotherapy in Part by Modulating Intratumoral Myeloid Cells". Molecular Therapy. 21 (5): 1014–23. doi:10.1038/mt.2013.39. PMC 3666636. PMID 23481323. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Williamson, Jack (2002). Dragon's Island and other stories. Waterville, Me.: Five Star. ISBN 0786243147. الوسيط
|CitationClass=تم تجاهله (مساعدة)[بحاجة لرقم الصفحة] - Stableford, Brian M. (2004). Historical dictionary of science fiction literature. صفحة 133. ISBN 9780810849389. مؤرشف من الأصل في 23 مارس 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة)
- بوابة طب
