ثنائي كبريتيت
ثنائي كبريتيت (أو ميتابيكبريتيت أو بيروكبريتيت) هو أنيون أكسجيني للكبريت صيغته 2−S2O5، وهو ينتج نظرياً من نزع بروتونين من حمض ثنائي الكبريتوز (H2S2O5).
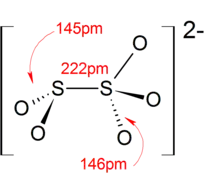
بنية أنيون ثنائي الكبريتيت
من الأمثلة على هذه الأملاح كل من ثنائي كبريتيت الصوديوم وثنائي كبريتيت البوتاسيوم، والتي تعطي عند انحلالها في الماء أنيون بيكبريتيت -HSO3؛ بالتالي فهذه الأملاح تعد ذات صلة كيميائية لكل من بيكبريتيت الصوديوم وبيكبريتيت البوتاسيوم على الترتيب.[1]
الخواص
تبلغ حالة أكسدة الكبريت الوسطية في هذا الأنيون مقدار +4، حيث أن حالة أكسدة ذرة الكبريت المرتبطة بثلاث ذرات أكسجين تبلغ +5، في حين أن الأخرى المرتبطة بذرتي أكسجين تبلغ حالة الأكسدة فيها +3.[5]
يحوي هذا الأنيون في بنيته على رابطة كبريت-كبريت مركزية؛ ويبلغ طولها 2.22 أنغستروم.[6]
طالع أيضاً
مراجع
- Johnstone, H. F. (1946). "Sulfites and Pyrosulfites of the Alkali Metals". Inorganic Syntheses. 2: 162–167. doi:10.1002/9780470132333.ch49. ISBN 9780470132333. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Barberá, José Jiménez; Metzger, Adolf; Wolf, Manfred (2005), "Sulfites, Thiosulfates, and Dithionitesl Chemistry", موسوعة أولمان للكيمياء الصناعية, فاينهايم: وايلي-في سي إتش, doi:10.1002/14356007.a25_477 الوسيط
|CitationClass=تم تجاهله (مساعدة); الوسيط|separator=تم تجاهله (مساعدة)CS1 maint: ref=harv (link) - Bassam Z. Shakhashiri: Chemical demonstrations: a handbook for teachers of chemistry The University of Wisconsin Press, 1992, p.9 نسخة محفوظة 1 مايو 2020 على موقع واي باك مشين.
- Karl-Heinz Lautenschläger, Werner Schröter; Taschenbuch der Chemie, S. 501; ISBN 978-3817117611.
- Lindqvist, I.; Mörtsell, M. "The Structure of Potassium Pyrosulfite and the Nature of the Pyrosulfite Ion". Acta Crystallogr. (1957". 10: 406–409. doi:10.1107/S0365110X57001322. الوسيط
|CitationClass=تم تجاهله (مساعدة); Cite journal requires|journal=(مساعدة) - K. L. Carter, T. A. Siddiquee, K. L. Murphy, D. W. Bennett "The surprisingly elusive crystal structure of sodium metabisulfite" Acta Crystallogr. (2004). B60, 155–162. doi:10.1107/S0108768104003325
- بوابة الكيمياء
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.
