توازن سائل وبخاره
في الكيمياء و الديناميكا الحرارية يشكل السائل وتوازنه مع بخاره ظاهرة يفاد منها في احوال عديدة.
| مفاهيم في التوازن الكيميائي |
|---|
| ثابت تفكك الحمض |
| ثابت الترابط |
| محلول منظم |
| توازن كيميائي |
| استقرار كيميائي |
| ثابت انحلال |
| معامل التوزيع |
| ثابت التوازن |
| توازن ناشر |
| طبق نظري |
| استخلاص سائل-سائل |
| مخطط الطور |
| مخطط السيطرة |
| قاعدة الطور لجيبس |
| حاصل قسمة التفاعل |
| تطايرية نسبية |
| توازن الانحلالية
انحلالية مولية |
| ثابت الانحلالية |
| ثوابت استقرارية المعقدات |
| توازن دينامي حراري |
| توازن سائل وبخاره |
و ظاهرة توازن السائل وبخاره هي حالة تواجد السائل و بخاره في نظام بحيث يكون معدل تبخر السائل مساويا لمعدل تكثف البخار إلى السائل .[1][2][3] ويحدث هذا التوازن عندما نترك السائل وبخاره في وعاء أو قارورة مغلقة بعض الوقت في تلامس مع بعضهما بدون تغيير ظروفهما من الخارج (مثل عدم تغير درجة الحرارة ).
تفسير الظاهرة
يُسمى تركيز بخار سائل يكون في حالة تلامس مع السائل عند تواجدهم في حالة الاتزان ب ضغط البخار . وقد يكون بخار السائل ضغطا جزئيا في حالة تواجد غازات أخرى بالإضافة إلى بخار السائل . وتوازن ضغط البخار مع السائل يعتمد على درجة الحرارة . وفي حالة تواجد مخلوط من السوائل يعتمد تركيز أبخرة السوائل في الحالة الغازية على تركيز مكونات السائل المخلوط ودرجة الحرارة . وعادة يختلف تركيز البخار في الحالة الغازية عن تركيز السائل، ولكنها ترتبط بعضها البعض بعلاقات محددة دقيقة. ويمكن تعيين تلك النسب بالوسائل التجربية لمخلوطات للمواد التي تهمنا . كما يمكن حسابها بالاستعانة ببعض النظريات العلمية التي تهتم بمخلوطات المواد مثل قانون دالتون أو قانون هنري .
استخدامات الظاهرة
ما نحصل عليه من معلومات بشأن توازن السائل مع بخاره يفيدنا عند إجراء التقطير لفصل مخلوط من السوائل . ويعتمد عمل المهندس الكيميائي على معرفة ذلك التوازن . فتكرير البترول يعتمد على استغلال تلك الظاهرة لفصل السوائل المختلفة من النفط ، مثل البنزين والديزل و الشحوم . وهنا يبدأ المهندس الكيميائي بتسخين المخلوط حتي درجة الغليان ويتبع ذلك بتكثيف البخار الناتج، حيث تكون نسبة المادة ذات درجة غليان منخفضة في البخار أعلى من نسبتها في السائل . أي أن نسبتها بعد التقطير تكون أعلى من نسبتها قبله . وبتكرار العملية خلال عدة مراحل يمكن الحصول على سائل عالي النقاوة .
المخلوط وبخاره
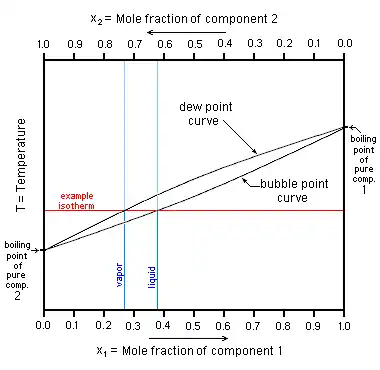
يمكن أن يتكون المخلوط من سائلين ، ويمكن أن يكون المخلوط مكونا من ثلاثة سوائل مختلفة . وعادة ما تجري عملية التقطير في الضغط الجوي . كما يمكن خفض الضغط فوق السائل فتسهل عملية فصل السائلين حيث أن درجة الغليان تعتمد على الضغط . فدرجة غليان الماء تحت الضغط الجوي تكون عند 100 درجة مئوية ، أما إذا خفّضنا الضغط فوق الماء بواسطة مخلخلة الهواء، يغلى الماء عند درجة حرارة تحت 100 درجة مئوية.
عندما نجري العملية عند درجة حرارة معينة يصبح مجموع الضغوط الجزئية للمكونات مساويا للضغط الكلي،
أي أن إذا كان لدينا محلول من ماء و كحول في قارورة مفتوحة ووضعنا القارورة بمحتوياتها تحت ناقوس يصبح الضغط الكلي P داخل الناقوس:
P = P1 + P2 + P air
حيث:
P1 ضغط بخار الماء
P2 ضعط بخار الكحول
P air ضغط الهواء.
عند درجة الغليان سائل نقي يصبح ضغط بخار السائل مساويا 1 ضغط جوي. وتسمى درجة الغليان عندما يكون ضغط البخار مساويا 1 ضغط جوي (3و101 كيلو باسكال يعادل 760 مليمتر زئبق )درجة الغليان العادية .
1 ضغط جوي = 3و101 كيلو باسكال
- =760 مليمتر زئبق .
مراجع
- Seader, J. D. & Henley, Ernest J. (1998). Separation Process Principles. New York: Wiley. ISBN 0-471-58626-9. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Kister, Henry Z. (1992). تصميم التقطير (الطبعة 1st). McGraw-hill. ISBN 0-07-034909-6. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Perry, R.H.; Green, D.W., المحررون (1997). Perry's Chemical Engineers' Handbook (الطبعة 7th). McGraw-hill. ISBN 0-07-049841-5. الوسيط
|CitationClass=تم تجاهله (مساعدة)
- بوابة الفيزياء
- بوابة كيمياء فيزيائية
- بوابة الكيمياء
