بورين (بروتين)
البورينات هي بروتينات برميل بيتا تعبر الغشاء الخلوي وتعمل كمسام ، والتي من خلالها يمكن أن تنتشر الجزيئات . [1] على عكس بروتينات النقل الغشائية الأخرى ، فالخزانات كبيرة بما يكفي للسماح بالانتشار السلبي ، أي أنها تعمل كقنوات خاصة بأنواع مختلفة من الجزيئات. كانت موجودة في الغشاء الخارجي من البكتيريا سالبة الجرام وبعض إيجابية الجرام مايكوباكتيريا (التي تحتوي على حمض mycolic الفطريات الشعاعية )، والغشاء الخارجي لل الميتوكوندريا ، و الغشاء الخارجي بلاستيدات الخضراء .
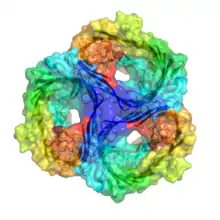
| Gram-negative porin | |
|---|---|
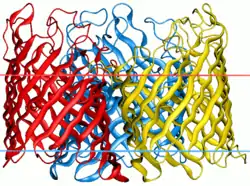 | |
| معرف | |
| رمز | Porin_1 |
| قاعدة بيانات عوائل البروتينات | PF00267 |
| قاعدة بيانات عوائل البروتينات clan | CL0193 |
| إنتربرو | IPR001702 |
| بروسايت | PDOC00498 |
| قاعدة بيانات التصنيف الهيكلي للبروتينات | 1mpf |
| قاعدة بيانات تصنيف الناقل [الفرنسية] | 1.B.1 |
| قاعدة بيانات توجهات البروتينات في الأغشية | 31 |
| قاعدة بيانات توجهات البروتينات في الأغشية | 1pho |
بناء
تتكون البورصات من صفائح بيتا (β صفائح) تتكون من خيوط بيتا (β خيوط) ترتبط ببعضها البعض من خلال تحويلات بيتا على الجانب السيتوبلازمي وحلقات طويلة من الأحماض الأمينية من جهة أخرى. تكمن خيوط β بطريقة مضادة للتوازي وتشكل أنبوبًا أسطوانيًا يسمى برميل بيتا (β برميل). [2] تكون تركيبة الأحماض الأمينية لشرائط البوران فريدة من نوعها حيث تتناوب البقايا القطبية وغير القطبية على طولها. هذا يعني أن البقايا اللاقطبية تواجه الخارج بحيث تتفاعل مع الدهون غير القطبية في الغشاء الخارجي ، في حين أن البقايا القطبية تواجه الداخل في وسط برميل بيتا لإنشاء القناة المائية . تحدد الأحماض الأمينية المحددة في القناة خصوصية البوران لجزيئات مختلفة.
تتكون البراميل المكونة من البوران من ثمانية خيوط إلى ما يصل إلى اثنين وعشرين ضفيرة. يتم ربط الخيوط الفردية ببعضها بواسطة حلقات ومنعطفات. [3] غالبية بورينس هي مونومرات . ومع ذلك، بعض مثنوي تم اكتشاف porins، فضلا عن octameric PORIN. [4] اعتمادًا على حجم الخزف ، قد يكون الجزء الداخلي من البروتين إما مملوءًا بالماء أو ما يصل إلى شطرين مطويين في الداخل أو يحتوي على قطعة "سدادة" تتكون من خيوط β.
تشكل جميع البورصات homotrimers في الغشاء الخارجي ، مما يعني أن ثلاث وحدات بورين متطابقة تتحد معًا لتشكل بنية فائقة من البوران مع ثلاث قنوات. [5] يضمن الترابط الهيدروجيني وتفاعلات ثنائي الأقطاب بين كل مونومر في جهاز الهوموتريم أنها لا تتفكك وتبقى معًا في الغشاء الخارجي.
تم استخدام العديد من المعلمات لوصف بنية بروتين porin. وهي تشمل زاوية الإمالة (α) ورقم القص (S) ورقم السلاسل (n) ونصف قطر البرميل (R). [6] تشير زاوية الإمالة إلى الزاوية المتعلقة بالغشاء. رقم القص (S) هو عدد بقايا الأحماض الأمينية الموجودة في كل β جدائل. رقم السلك (n) هو مقدار β الجدائل في الخزان ، ويشير نصف قطر البرميل (R) إلى نصف قطر فتحة الخزان. ترتبط هذه المعلمات عبر الصيغ التالية:
و ،
باستخدام هذه الصيغ ، يمكن تحديد بنية porin من خلال معرفة عدد قليل فقط من المعلمات المتاحة. في حين تم تحديد بنية العديد من الخزف باستخدام تقنية البلورات بالأشعة السينية ، يمكن أيضًا استخدام الطريقة البديلة لتسلسل البنية الأولية للبروتين بدلاً من ذلك.
الأدوار الخلوية
البورينات عبارة عن مسام وقنوات مملوءة بالماء موجودة في أغشية البكتيريا وحقيقيات النوى. كما تم اكتشاف قنوات تشبه البورين في الأركيا. [7] لاحظ أن مصطلح " nucleoporin " يشير إلى البروتينات غير ذات الصلة التي تسهل النقل عبر المسام النووية في الغلاف النووي .
تشارك البورين في المقام الأول في النقل السلبي لجزيئات محبة للماء من مختلف الأحجام والشحنات عبر الغشاء. [8] للبقاء على قيد الحياة ، يجب نقل بعض العناصر الغذائية والركائز المطلوبة إلى الخلايا. وبالمثل ، يجب نقل السموم والنفايات لتجنب التراكم السام. [9] بالإضافة إلى ذلك ، يمكن للبورينات تنظيم النفاذية ومنع التحلل عن طريق الحد من دخول المنظفات إلى الخلية.
يوجد نوعان من البورات لنقل المواد المختلفة - عام وانتقائي. لا تحتوي السلالات العامة على خصوصيات الركيزة ، على الرغم من أن بعضها يظهر تفضيلات طفيفة للأنيونات أو الكاتيونات. [8] البورات الانتقائية أصغر من البورات العامة ولها خصائص خاصة بالأنواع الكيميائية. يتم تحديد هذه الخصائص من خلال الأحجام العتبية للأحواض ، وبقايا الأحماض الأمينية المبطنة لها. [5]
في البكتيريا سالبة الجرام ، الغشاء الداخلي هو حاجز النفاذية الرئيسي. [10] الغشاء الخارجي أكثر نفاذية للمواد المحبة للماء ، بسبب وجود الخزانات. [5] تحتوي البورنيات على أحجام عتبات من الجزيئات المنقولة التي تعتمد على نوع البكتيريا والبورين. بشكل عام ، يمكن فقط نشر المواد التي يقل حجمها عن 600 دالتون . [8]
تنوع
تم اكتشاف البورات لأول مرة في البكتيريا سالبة الجرام ، ولكن تم العثور على بكتيريا موجبة الجرام مع كلا النوعين من البورات. [9] لديهم وظائف نقل مماثلة ولكن لديهم مجموعة محدودة أكثر من البورصات ، مقارنة بالتوزيع الموجود في البكتيريا سالبة الجرام. تفتقر البكتيريا إيجابية الجرام إلى الأغشية الخارجية ، لذا فإن قنوات البوران هذه مرتبطة بدهنًا بدهون معينة داخل جدران الخلايا. [7]
تم العثور على البورينات أيضًا في حقيقيات النوى ، خاصة في الأغشية الخارجية للميتوكوندريا والبلاستيدات الخضراء . [9] [10] تحتوي العضيات على بورسينات عامة تشبه الهيكلية والوظيفية البكتيرية. هذه التشابهات دعمت نظرية إندوسيموبيوتيك ، التي نشأت من خلالها عضيات حقيقية النواة من البكتيريا سالبة الجرام. ومع ذلك ، فإن السلالات حقيقية النواة تظهر نفس التنوع المحدود مثل البورنين الموجبة للجرام ، وتعرض أيضًا دورًا أكبر يعتمد على الجهد أثناء عملية التمثيل الغذائي.
تحتوي الأركيا أيضًا على قنوات أيونية نشأت من البورنات العامة. [7] تم العثور على القنوات في غلاف الخلية وتساعد على تسهيل نقل المذاب. لديهم خصائص مماثلة مثل البورات البكتيرية والميتوكوندريا ، مما يشير إلى التداخلات الفسيولوجية على جميع مجالات الحياة الثلاثة.
مقاومة المضادات الحيوية
العديد من البورسينات هي أهداف للخلايا المناعية المضيفة ، مما يؤدي إلى مسارات إشارة تؤدي إلى تدهور البكتيريا. تُستخدم العلاجات العلاجية ، مثل اللقاحات والمضادات الحيوية ، لتكملة هذه الاستجابة المناعية. [5] تم تصميم مضادات حيوية معينة للتنقل عبر الأوعية الدموية لتثبيط العمليات الخلوية. [8]
ومع ذلك ، بسبب الضغط الانتقائي ، يمكن للبكتيريا تطوير المقاومة من خلال الطفرات في جين البوران. [5] قد تؤدي الطفرات إلى فقدان البورنين ، مما يؤدي إلى انخفاض نفاذية المضادات الحيوية أو استبعادها تمامًا من النقل. وقد ساهمت هذه التغيرات في ظهور مقاومة المضادات الحيوية على الصعيد العالمي ، وزيادة معدلات الوفيات من العدوى.
اكتشاف
وقد نُسب اكتشاف بورينات إلى هيروشي نيكيدو ، الملقب بـ "اختصاصي البورينا". [11]
تصنيف
وفقًا لـ TCDB ، هناك خمس عوائل سطحية مستقلة تطوريًا من البورات. تشتمل عائلة Porin الفائقة I على 47 عائلة من البوران مع مجموعة من أرقام خيوط β عبر الغشاء (β-TMS). وتشمل هذه مجموعات الجنيه الإسترليني ، والليرة السورية ، والـ RPP. في حين أن PSF I يشمل 47 عائلة ، فإن PSF II-V يحتوي كل منها على عائلتين فقط. في حين أن PSF I يستمد أعضاء من البكتيريا سالبة الجرام في المقام الأول عائلة واحدة من بورينات الميتوكوندريا حقيقية النواة ، فإن PSF II و V porins مشتقة من Actinobacteria. PSF III و V مستمدة من عضيات حقيقية النواة.
Porin Superfamily I
1. ب 1 - عائلة البوران البكتيرية العامة </br> 1. B.2 - عائلة Chlamydial Porin (CP) </br> 1. B.3 - عائلة بوران السكر (SP) </br> 1. B.4 - عائلة Brucella-Rhizobium porin (BRP) </br> 1. B.5 - عائلة Pseudomonas OprP Porin (POP) </br> 1. B.6 - عائلة Porp (OOP) OmpA-OmpF </br> 1. باء -7 أفراد عائلة بوروداكتر بوركا بوران (RPP) </br> 1. باء -8 عائلة الميتوكوندريا والخزف البلاستيدي (MPP) </br> 1. B.9 عائلة بروتين الفاضل FadL </br> 1. B.10 عائلة بورين الغشائية الخارجية المكونة للقناة الخاصة (Nxleoside) </br> 1. B.11 الغشاء الخارجي لجراب بورين (FUP) </br> 1. B.12 عائلة ناقل سيارات 1 (AT-1) </br> 1. B.13 عائلة ألجينات التصدير للخزف (AEP) </br> 1. B.14 عائلة مستقبلات الغشاء الخارجي (OMR) </br> 1. B.15 عائلة رافينوز بوران (رافي) </br> 1. باء -16 أميد سلسلة قصيرة وعائلة بورين (SAP) </br> 1. B.17 عائلة عامل الغشاء الخارجي (OMF) </br> 1. B.18 عائلة البروتينات المساعدة للغشاء الخارجي (OMA) </br> 1. B.19 عائلة OprB porin (OprB) الانتقائية للجلوكوز </br> 1. B.20 عائلة إفراز الشريكين </br> 1. B.21 عائلة OmpG porin (OmpG) </br> 1. B.22 عائلة الغشاء البكتيري الخارجي (سيكرين) </br> 1. B.23 عائلة البوران البكتيرية (CBP) </br> 1. باء .24 فطريات البكتريا </br> 1. B.25 عائلة الغشاء الخارجي (Opr) </br> 1. B.26 عائلة Cyclodextrin porin (CDP) </br> 1. B.31 العطيفة العطيفة الخارجية الرئيسية (PorP) </br> 1. B.32 عائلة بورين الغشاء الخارجي البكتيري (FomP) </br> 1. B.33 عائلة بروتين إدخال الغشاء الخارجي (مجمع بام) (OmpIP) </br> 1. B.34 porins Corynebacterial </br> 1. B.35 عائلة البورجين (KdgM) </br> 1. B.39 البوران البكتيري ، عائلة OmpW (OmpW) </br> 1. B.42 - عائلة بورين تصدير عديد السكاريد الدهنية الخارجي (LPS-EP) </br> 1. B.43 - والكوكسيلا PORIN P1 (CPP1) عائلة </br> 1. B.44 - بروتين محتمل لنقل عائلة البورفيوموناس اللثة (PorT) </br> 1. B.49 - عائلة بورن Anaplasma P44 (A-P44) </br> 1. B.54 - Intimin / Invasin (Int / Inv) أو Autotransporter-3 family </br> 1. B.55 - عائلة بولي أسيتيل جلوكوزامين بورين (PgaA) </br> 1. B.57 - عائلة بروتين الفيلقية الرئيسية (LM-OMP) </br> 1. B.60 - عائلة Omp50 Porin (Omp50 Porin) </br> 1. B.61 - عائلة دلتا بروتوباكتيريا بورين (دلتا بورين) </br> 1. B.62 - عائلة البورين البكتيرية المفترضة (PBP) </br> 1. B.66 - عائلة بيتا البرميل 2 (BBP2) المفترضة </br> 1. B.67 - عائلة البرميل المفترضة بيتا 4 (BBP4) </br> 1. B.68 - الفصيلة Beta Barrel Porin-5 (BBP5) الفصيلة </br> 1. B.70 - عائلة قناة الغشاء الخارجي (OMC) </br> 1. B.71 - عائلة البوران البكتيرية / الميكروبية </br> 1. B.72 - عائلة بورين الغشائية الخارجية (PomS / T) </br> 1. B.73 - عائلة الكبسولة / التجميع البيولوجي (CBA) </br> 1. B.78 - DUF3374 عائلة بورين المرتبطة بنقل الإلكترون (ETPorin)
Porin Superfamily II (MspA Superfamily)
1. B.24 - بوران المتفطرة </br> 1. B.58 - قناة جدار الخلية Nocardial Hetero-oligomeric الخلوي (NfpA / B)
Porin Superfamily III
1. B.28 - المغلف الخارجي بلاستيد من عائلة 24 كيلو دالتون (OEP24) </br> 1. B.47 - غلاف بلاستيد الخارجي من عائلة 37 كيلو دالتون (OEP37)
Porin Superfamily IV (Tim17 / OEP16 / PxMPL (TOP) Superfamily)
تشتمل هذه الفصيلة الفائقة على بروتين يشتمل على مسام في بروتينات بروتينات متعددة المكونات على النحو التالي: 3. A.8 - [Tim17 (P39515) Tim22 (Q12328) Tim23 (P32897)] ؛ 1. B.69 - [PXMP4 (Q9Y6I8) PMP24 (A2R8R0)] ؛ 3. D.9 - [مكون NDH 21.3 كيلو دالتون (P25710)]
1. B.30 - غلاف بلاستيد الخارجي من عائلة 16 كيلو دالتون (OEP16) </br> 1. B.69 - عائلة غشاء البيروكسيزومال بورن 4 (PxMP4) </br> 3. أ 8 - عائلة بروتين الميتوكوندريا (MPT)
Porin Superfamily V (Corynebacterial PorA / PorH Superfamily)
1. B.34 - عائلة Porin A (PorA) 1. B.59 - بوران الغشاء الخارجي ، عائلة بوره
انظر أيضا
- قناة أنيون تعتمد على الجهد
- أكوابورين
المراجع
 صور وملفات صوتية من كومنز
صور وملفات صوتية من كومنز
- بوابة علم الأحياء الدقيقة
- Porins في المَكتبة الوَطنية الأمريكية للطب نظام فهرسة المواضيع الطبية (MeSH).
- "General and specific porins from bacterial outer membranes". Journal of Structural Biology. 121 (2): 101–9. 1998. doi:10.1006/jsbi.1997.3946. PMID 9615433. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Folding and assembly of beta-barrel membrane proteins". Biochimica et Biophysica Acta. 1666 (1–2): 250–63. November 2004. doi:10.1016/j.bbamem.2004.06.011. PMID 15519319. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "The structure of a mycobacterial outer-membrane channel". Science. 303 (5661): 1189–92. February 2004. Bibcode:2004Sci...303.1189F. doi:10.1126/science.1094114. PMID 14976314. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Microbe-host interactions: structure and role of Gram-negative bacterial porins". Current Protein & Peptide Science. 13 (8): 843–54. December 2012. doi:10.2174/138920312804871120. PMID 23305369. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Schulz GE (2004). "Chapter 2: The Structures of General Porins". In Benz (المحرر). Bacterial and eukaryotic porins: structure, function, mechanism. Weinheim: Wiley-VCH. صفحات 26–29. ISBN 978-3-527-30775-3. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Voltage-dependent porin-like ion channels in the archaeon Haloferax volcanii". The Journal of Biological Chemistry. 272 (2): 992–5. January 1997. doi:10.1074/jbc.272.2.992. PMID 8995393. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Nonspecific Porins of the Outer Membrane of Gram-Negative Bacteria: Structure and Functions". Biologicheskie Membrany. 3 (1): 3–15. 2009. doi:10.1134/S1990747809010024. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Protein-translocating outer membrane porins of Gram-negative bacteria". Biochimica et Biophysica Acta. 1562 (1–2): 6–31. May 2002. doi:10.1016/s0005-2736(02)00359-0. PMID 11988218. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Porins from Mitochondrial and Bacterial Outer Membranes: Structural and Functional Aspects". Anion Carriers of Mitochondrial Membranes. Berlin, Heidelberg: Springer. 1989. صفحات 199–214. doi:10.1007/978-3-642-74539-3_16. ISBN 978-3-642-74541-6. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "The porinologist". Journal of Bacteriology. 187 (24): 8232–6. December 2005. doi:10.1128/JB.187.24.8232-8236.2005. PMID 16321927. الوسيط
|CitationClass=تم تجاهله (مساعدة)
