مقاومة المضادات الحيوية
تحدث مقاومة المضادات الحيوية حين تطور الكائنات الدّقيقة الآليات التي تحميها من تأثير المضادات الحيوية. تتميز الكائنات الدقيقة المقاومة بكونها أصعب في العلاج، احتياجها إلى جرعات أعلى أو ضرورة اللجوء إلى علاجات بديلة والتي ربما تكون أكثر سمية، وكذلك أكثر تكلفة. يطلق على الكائنات الدقيقة القادرة على مقاومة العديد من المضادات الحيوية أنها عديدة المقاومة. جميع أنواع الكائنات الدقيقة تستطيع تطوير تلك القدرة على المقاومة؛ فالفطريات تطور مقاومة ضد مضادات الفطريات، الفيروسات تطور مقاومة ضد مضادات الفيروسات، الكائنات الأولية تطور مقاومة ضد مضادات الكائنات الأولية، وعلى نفس النمط فالبكتريا تطور مقاومة ضد المضادات الحيوية.

مقاومة المضادّات الحيويّة
تنشأ المقاومة إما بصورة طبيعية عن طريق الطفرات الجينية وإما عن طريق انتقال المقاومة من جنس اكتسبها إلى جنس آخر لم يكتسبها بعد.[1]كما أنها قد تظهر لحظيا نتيجة للطفرات الجينية، إلا أن استعمال المضادات الحيوية لفترات طويلة يبدو أنه يحفز ظهور الطفرات في الجينات المسببة للمقاومة على وجه الخصوص. وبناءا عليه يعد تقليل سوء استخدام المضادات الحيوية عن طريق عدم استخدامها إلا حين الحاجة الحقيقية إليها أمرا ملحا.[2][3]كما أن استخدام المضادات الحيوية ضيقة المدى مفضل على المضادات الحيوية واسعة المدى لكون الأولى تستهدف الكائن الدقيق المسئول عن المرض بكفاءة أكبر ناهيك عن أعراضها الجانبية الأقل.[4][5]أما بالنسبة للمرضى الذين يتناولون تلك العقاقير بالمنزل دون استشارة الطبيب فيعد تثقيفهم عن الطريقة الصحيحة لإستخدامها أمرا في غاية الأهمية.
بإمكان العاملين بالمجال الصحي المساعدة في تقليل هذه المشكلة عن طريق إتباع إجراءات النظافة العامة والتعقيم الطبي والتي يتمثل أبسطها في إجراء غسل اليدين المتكرر وتشجيع المرضى وأقاربهم والمحيطين بهم على تكرار ذلك.[6]
غير أنّه بالإمكان هندستها بتطبيق ضغط نشوئيّ على مجموعة الكائنات الحيّة الدّقيقة. عندما يتمّ تكوّن الجينة الجديدة، تستطيع البكتيريا تحويل المعلومات الوراثيّة بطريقة أفقيّة (ما بين الكائنات الدّقيقة) بواسطة تبادل البلازميد (الحمض النّووي الدّائريّ). إذا كانت البكتيريا تحمل عدّة جينات مقاومة، يتمّ تسميتها بكتيريا متعدّدة المقاومة أو بلغة أخرى البكتيريا المتفوّقة.
الأسباب
تظهر مقاومة المضادّات الحيويّة نتيجة النّشوء عن طريق الاصطفاء الطّبيعي. يشكل مفعول المضاد الحيوي ضغطا بيئيّا على البكتيريا لكن الطفرات التي تظهر في بعض الخلايا البكتيريّة تجعلها تنجو من مفعول المضاد الحيوي. بعد ذلك، تنتقل هذه الميزة إلى النّسل التالي الّذي يتميّز بكونه جيلا ذا مقاومة كاملة للمضاد الحيوي. بيّنت عدّة دراسات أنّ طريقة استعمال المضادات الحيوية تؤثّر بصفة كبيرة على تطوّر عدد الكائنات الحيّة الدّقيقة المقاوِمة. فرط استعمال المضادات الحيوية ذات الطيف الواسع، مثل سيفالوسبورين من الجيل الثّاني والثّالت، يسرّع عمليّة تطوّر مقاومة المثيسلين. هناك عوامل أخرى تتمثّل في التّشخيص الطّبّي غير الدّقيق، وصف الطّبيب أدوية غير ضروريّة، الاستعمال غير المناسب للمضادّات الحيويّة من طرف المريض، إلى جانب استعمال المضادّات الحيويّة كموادّ إضافيّة لطعام المواشي لتشجيع نموّها.
أكّد العلماء مؤخّرا أنّ البروتين البكتيري LexA يلعب دورا هامّا في التّغيّر الوراثي البكتيري.[7]
بعض الحقائق عن مقاومة المضادات
تشكل الجراثيم الممرضة التي صارت مقاومة للعلاج بالأدوية مشكلةً صحيةً متفاقمةً وعامةً، فعلى سبيل المثال تمثل أمراض السل والسيلان والملاريا والتهابات الأذن عند الأطفال بعض الأمثلة للأمراض التي يزداد علاجها صعوبةً بالمضادات الحيوية.
يعود جزء من المشكلة إلى أن البكتريا والعضويات الدقيقة الأخرى المسببة للأخماج شديدة التكيف وبإمكانها تطوير طرق للنجاة من الأدوية التي تستهدف قتلها أو إضعافها.
بعض الحقائق :
- تعطى الحيوانات المنتجة للغذاء مضادات حيوية للعلاج أو الوقاية من الأمراض أو حتى لزيادة الإنتاج.
وغنيٌ عن الشرح الأثر السيئ لهذا الاستخدام في جعل الجرثوم مقاوماً للأدوية المستخدمة لعلاج الحيوان وبالتالي يصبح علاج أمراض البشر أصعب.
- 70 % من الجراثيم المسببة للأخماج في المشافي مقاومة على الأقل لنوع واحد من الصادات الشائعة في علاج الأخماج.
- بعض الجراثيم مقاوم لجميع الأدوية المسموح باستخدامها ويلجأ الأطباء لعلاجها إلى استخدام الأدوية قيد التجربة أو الشديدة السمية.
- تشير الدراسات ألي أن المرضى يُعطون المضادات الحيوية بتكرار أكثر مما تجيزه توصيات السلطات الصحية ومنظمات رعاية الصحة.
كثيراً ما يطلب المرضى من أطبائهم مضاداً حيوياً لأمراض مثل الزكام أو السعال أو الكريب وكلها أمراض فيروسية لا تتجاوب مع المضاد الجرثومي.
وأيضاً، لا يلتزم المرضى بأخذ كامل الجرعة الموصوفة لهم من المضادات الحيوية مما يسهم في زيادة مقاومة الجراثيم للدواء.
- وما لم يتم متابعة حالات مقاومة الدواء حين تنشأ ومن ثم اتخاذ اللازم من الإجراءات لاحتوائها فهناك إحتمال كبير أن يواجه العالم أمراضاً تستعصي على العلاج مجدداً رغم أنها كانت قابلة للعلاج في السابق، وهو ما يعيد إلى الأذهان الفترة التي سبقت تطور المضادات الحيوية حين كانت الأخماج غير قابلة للعلاج.
آليّة عمليّة مقاومة المضادّات الحيويّة
مقاومة المضادّات الحيويّة تتمّ عبر أربع طرق:
- تثبيط أو تغيير المضادّ الحيويّ: مثل التّثبيط الإنزيمي للبنسلين ج Penicillin G عند بعض البكتيريا المقاومة للبنسلين عن طريق تصنيع بيتا لكتاميز ß-lactamases
- تغيير موقع الهدف (موقع فعاليّة المضادّ الحيويّ): مثل تغيير ال PBP –موقع فعاليّة البنسلين- عند نوع من البكتيريا يدعى العنقوديات الذهبية المقاومة للمثسلين MRSA، كذلك عند بكتيريا أخرى مقاومة للبنسلين.
- تغيير الطّريق الأيضيّ: بارا أمينو بنزويك أسيد PABA هو عامل مهمّ لصنع حمض الفوليك والأحماض النّوويّة لدى البكتيريا، يمكن تثبيط هذا العامل عن طريق السّلفوناميد. غير أنّ بعض البكتيريا المقاومة للسّلفوناميد تستغني عن هذا العامل الأساسيّ عن طريق استعمال حمض الفوليك الجاهز (بأخذه مباشرة من محيطها مثلا)، تماما مثل الخلايا الحيوانيّة.
- التّقليل من تراكم المضادّ الحيويّ: عن طريق التّقليل من نفاذيّة المضادّ الحيويّ إلى داخل الخليّة و/أو تسريع التّدفّق النّشط (الضّخّ إلى المحيط) للأدوية عبر الغشاء الخلويّ البكتيريّ.
الكائنات الحيّة الدّقيقة الممرضة والمقاومة
العنقوديات الذهبية

العنقوديات الذهبية أو بلغة مختصرة ستاف أوريوس أو عدوى السّتاف هي واحدة من أهمّ الكائنات الحيّة الدّقيقة الممرضة والمقاومة. تتواجد هذه البكتيريا على البشرة والأغشية المخاطيّة لثلث السّكّان تقريبا. هذا النّوع من البكتيريا يتكيّف إلى حدّ كبير مع ضغط المضادّات الحيويّة. تعدّ العنقوديات الذهبية أوّل بكتيريا طوّرت مقاومة ضدّ البنسلين في عام 1948م أعواما قليلة (أربع سنوات) بعد بيع البنسلين بكمّيّات كبيرة. بعد تطوّر المقاومة ضدّ البينيسيلين، تمّ استعمال الميثيسيلين بدلا عن البينيسيلين لكن بسبب ظهور عرض جانبي خطير وهو تسمّم الكليتين نتيجة استعمال الميثيسيلين، تمّ استبداله هو الآخر بالأوكساسيلين. تمّ اكتشاف العنقوديات الذهبية المقاومة للمثسلين MRSA لأوّل مرّة في بريطانيا عام 1961م. تعدّ العنقوديات الذهبية المقاومة للميثيسيلين مسؤولة عن 37% من الحالات القاتلة لتسمّم الدّمّ في بريطانيا في عام 1999م بعدما كانت لا تزيد عن 4% عام 1991م، أما الآن فقد صارت هذه الظّاهرة منتشرة بحدّة في المستشفيات.
نصف حالات عدوى العنقوديات الذهبية بالولايات المتّحدة الأمريكيّة مقاومة للبنسلين، الميثيسيلين، التتراسيكلين، والإريثروميسين.
و بالتّالي فإنّ الفانكومايسن يعدّ المضادّ الحيوي الوحيد ذا الفعاليّة في وقتنا المعاصر. وإن كان قد تمّ اكتشاف عنقوديات ذهبية مقاومة للفانكومايسين باليابان عام 1996م. كما عثر عليها كذلك ببعض مستشفيات بريطانيا، الولايات المتّحدة الأمريكيّة وفرنسا. وقد أطلقت أسماء أخرى على العنقوديات الذهبية المقاومة للفانكومايسين مثل ببتيد سكّري-وسيط العنقوديات الذهبية أو العنقوديات الذهبية الغير حسّاسة للفانكومايسين. وهو ما يشير بوضوح إلى مقاومة كلّ المضادّات الحيويّة ذات الطّبيعة الببتيدو سكّريّة.
تمّ تطوير صنف جديد من المضادّات الحيويّة، الأكزازولدينون الّذي أصبح جاهزا في التّسعينيّات. وأوّل أكزازولدينون تمّ طرحه في الأسواق يسمّى لنزوليد الّذي يمكن مقارنته مع الفانكومايسين من حيث الفعّاليّة ضدّ العنقوديات الذهبية المقاومة للميثيسلين MRSA. للأسف، تمّ تسجيل أول حالة عنقوديات ذهبية مقاومة للّينيزوليد عام 2003م.
انبثقت العنقوديات الذهبية المقاومة للمثيسيلين المكتسبة من المجتمع كوباء متسبّب في أمراض مستفحلة ومميتة مثل ذات الرّئة المتنكرزة/النّاخرة، الإنتان الخطير، التهاب اللّفافة النّآخر/المتنكرز.[8]
إنّ وباء العدوى الّتي تعود إلى العنقوديات الذهبية المقاومة للميثيسيلين يتغيّر بسرعة. يوجد نسيلتان من العنقوديات الذهبية المقاومة للميثيسيلين بالولايات المتّحدة الأمريكيّة، هذان النّسيلتان هما USA400 (فصيلةMW2، سلالةST1) وUSA300 وتعدّان مسؤولتين عن الأمراض المتفشّية بالمجتمع.تحتوي النّسيلتان في أغلب الأحيان على جينات بانتون-فالونتاين لوكوسيدين (PVL) كما تعلّق وجود هذين النّسيلتين بالعدوى المرتبطة بالجلد والأنسجة الرّخوة. تمّ تسجيل حالات أوبئة عدوى العنقوديات الذهبية المقاومة للميثيسيلين المتفشّية بالمجتمع في السجون، عند الفرق الرّياضيّة، القوّات العسكريّة، الأطفال المولودين حديثا بدور الحضانة واللّواطيّين.[9]
أونتيروكوكوس فاريسيوم
أونتيروكوكوس فاريسيوم هي بكتيريا أخرى متعدّدة المقاومة متواجدة بالمستشفيات. لوحظت الأونتيروكوكوس المقاومة للبنسلين في عام 1983م أمّا الأونتيروكوكوس المقاومة للفانكومايسن فقد لوحظت عام 1987م والأونتيروكوكوس المقاومة للّنيزوليد في أواخر التّسعينيّات.
العقديّات المقيّحة
يمكن علاج عدوى مجموعة A عقديّات(GAS) بمضادّات حيويّة مختلفة. يمكن للعلاج المبكّر أن يخفّض خطر الموت جرّاء العدوى بمجموعة A للعقديّات الغزويّة. بالنّسبة للأشخاص المصابين بعدوى خطيرة جدّا فإنّ الرّعاية بمراكز العناية المركّزة ضروريّة. أمّا الأشخاص المصابين بالتهاب اللّفافة النّآخر/المتنكرز فإنّهم يحتاجون لعمليّة جراحيّة لإزالة الأنسجة المخرّبة. ظهرت فصائل العقديّات المقيّحة المقاومة للمضادّ الحيويّ ماكرولايد، غير أنّ كلّ فصائل العقديّات المقيّحة تعدّ حسّاسة للبنسلين.[10]
العقديّات الرّئويّة
مقاومة العقديّات الرّئويّة للبنسلين والمضادّات الحيويّة من صنف بيتا لاكتام في ازدياد في العالم. من أهمّ آليّة عمليّة المقاومة الطّفرات الوراثيّة بالجينات النّاسخة للبروتينات المرتبطة بالبنسلين. يلعب الضّغط الانتقائي دورا مهمّا كما يعدّ استعمال المضادّات الحيويّة من صنف بيتا لاكتام عامل خطر للإصابة بالعدوى. تعدّ العقديّات الرّئويّة مسؤولة عن الأمراض التّإليه: ذات الرئة، تجرثم الدّمّ، الْتهاب الأذن الوسطى، التهاب السحايا، التهاب الجيوب، الْتهاب الصفاق، التهاب المفاصل.[10]
تمّ اكتشاف العقديّات الرّئويّة المقاومة للبنسلين لأوّل مرّة عام 1967م.
المتقلّبة
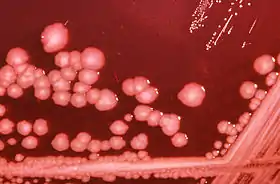
يمكن للمتقلّبة أن تسبّب عدوى بالمسالك البوليّة إلى جانب العدوى المكتسبة من المستشفيات. المتقلّبة فريدة من نوعها لأنّها كثيرة الحركة كما أنّها تشكّل مستعمرات غير منتظمة. في الحقيقة، تشكّل المتقلّبة ما هو معروف بالمستعمرات غير المنتظمة والمتسلّقة عندما يتمّ زرعها على وسط غير مثبّط. من أهمّ أعضاء عائلة المتقلّبة المتقلّبة الرّائعة الّتي تسبّب عدوى الجروح وعدوى المسالك البوليّة. معظم فصائل المتقلّبة الرّائعة حسّاسة للأنبسلن والسّيفالوسبورين. لكن المتقلّبة الاعتياديّة ليست حسّاسة لهذه المضادّات الحيويّة كما أنّها توجد بقلّة وتتواجد بكثرة بالأشخاص مكبوتي المناعة. توجد المتقلّبة الاعتياديّة طبيعيّا في أمعاء الإنسان كذلك في أنواع مختلفة من الحيوانات، السّماد العضوي، التّربة والمياه الملوّثة.
أكثر من 80% من عدوى المسالك البوليّة في الإنسان تعود إلى وجود البكتيريا الإشريكيّة القولونيّة لكن عدوى المسالك البوليّة النّاتجة عن المتقلّبة الرّائعة منتشرة أيضا. عندما تلتصق المتقلّبة الرّائعة بجدران المسالك البوليّة فإنّه يوجد احتمال من أن تصيب المتقلّبة الرّائعة الكليتين أكبر من الإشريكيّة القولونيّة. تنتمي المتقلّبة الرّائعة إلى عائلة الأمعانيّات، وهي عبارة عن بكتيريا من نوع السّلبيّة الغرام، متحرّكة ومتسلّقة كذلك. تتواجد المتقلّبة الرّائعة ككائنات حيّة دقيقة حرّة بالمياه والتّربة لكنّها تعدّ طفيليّة إذا تواجدت بالمسالك البوليّة العليا لدى الإنسان.
الزّائفة
تعدّ الزّائفة الزّنجاريّة نموذجا مثاليّا للممرضات الانتهازيّة. من الخصائص المقلقة الّتي تتميّز بها الزّائفة الزّنجاريّة قلّة حساسيّتها وتأثّرها بالمضادّات الحيويّة. هذه الخاصّيّة يعود سببها إلى المضخّات المتواجدة على مستوى غشاء الخليّة والّتي تعمل على ضخّ عدّة أدوية، من بينها المضادّات الحيويّة، إلى خارج الخليّة. إلى جانب ذلك، فإنّ الزّائفة الزّنجاريّة تطوّر المقاومة المكتسبة بسهولة، عن طريق الطّفرات الوراثيّة بالجينات الصّبغيّة، أو عن طريق تحويل جينات المقاومة للمضادّات الحيويّة بطريقة أفقيّة من خليّة إلى خليّة.
بعض الدّراسات الحديثة بيّنت أنّ المقاومة النّمطيّة المتعلّقة بتكوّن البيوفيلم أو ببزوغ مستعمرات صغيرة ومتفاوتة يمكن أن تكون ضروريّة لاستجابة ومدى تأثّر الزّائفة الزّنجاريّة بالعلاج بالمضادّات الحيويّة.[11]
الكائنات المجهريّة وعلاقتها بالحيوانات
العنقوديات الذهبية المقاومة للميثيسيلين معروفة على أنّها كائنات متعايشة مع الإنسان وفي نفس الوقت ممرضة له. وجدت العنقوديات الذهبية المقاومة للميثيسيلين في القطط والكلاب والأحصنة حيث تتسبّب في نفس أعراض المرض الّتي تظهر بالإنسان. يمكن لعدوى العنقوديات الذهبية المقاومة للميثيسيلين أن تنتقل من الإنسان إلى الحيوان أو العكس، لكنّ الشّائع هو أنّ هذه العدوى انتقلت من الإنسان إلى الحيوان.
حاليا، توجد نسبة معتبرة من المضادّات الحيويّة المدمجة في طعام الحيوانات مثل الدّجاج، الخنازير والمواشي لأغراض غير طبّيّة بالولايات المتّحدة الأمريكيّة. تمّ الرّبط بين استعمال المضادّات الحيويّة في طعام الحيوانات وظهور فصائل بكتيريّة مقاومة للمضادّات الحيويّة مثل: السّلمونيلة، العطيفة، الإشريكيّة القولونيّة والمكوّرات المعويّة.
هناك دلائل هامّة من الولايات المتّحدة الأمريكيّة وآلاتّحاد الأوروبي تؤكّد على أنّ البكتيريا المقاومة تسبّب العدوى المقاومة للمضادّات الحيويّة في الإنسان. دعت كل من الجمعيّة الأمريكيّة للمكروبيولوجيا، آلاتّحاد الأمريكي للصّحّة العامّة والاتّحاد الطّبّي الأمريكي إلى تقييد استعمال المضادّات الحيويّة في طعام الحيوانات مع وضع نهاية لكلّ الاستعمالات غير العلاجيّة.
غير أنّ الشّركات الصّيدلانيّة وشركات صنع طعام الحيوانات احتجّت على هذه القوانين الجديدة الّتي تحدّ من استعمال المضادّات الحيويّة في طعام الحيوانات. مثلا في عام 2000م، أعلنت الإدارة الأمريكيّة للأغذية والأدوية عزمها على إلغاء التّصديق على استعمال الفلوروكوينولون لدى الدّواجن لأنّه وجدت أدلّة قويّة تربط بين هذا الاستعمال وظهور عدوى العطيفة المقاومة للفلوروكوينولون لدى الإنسان. القرار الأخير لمنع استعمال الفلوروكوينولون لدى الدّواجن لم يتمّ تطبيقه إلاّ بعد 5 سنوات من إصداره بسبب التّحدّيات من طرف الشّركات الصّيدلانيّة وشركات صنع طعام الحيوانات.[12]
الوقاية من مقاومة المضادات الحيويّة
يمكن لاجتناب استعمال المضادّات الحيويّة، في بعض الحالات، أن يخفّض من فرص الإصابة بالعدوى ببكتيريا مقاومة للمضادّات الحيويّة. أثبتت إحدى الدّراسات أنّ استعمال الفلوروكوينولون مرتبط بشكل واضح بعدوى المطثيّة العسيرة الّتي تعدّ المسبّب الرّئيسي للإسهال المستشفوي بالولايات المتّحدة الأمريكيّة والمسبّب الخطير للموت في العالم.[13]
ليس للّقاحات مشاكل فيما يخصّ المقاومة لأنّ اللّقاح يزيد من المناعة الطّبيعيّة للجسم بينما يعمل المضادّ الحيوي بمعزل عن هذه المناعة. ومع ذلك، فإنّ فصائل بكتيريّة جديدة تتطوّر بحيث تفلت من المناعة النّاتجة عن اللّقاح.
بعض اللّقاحات المضادّة للعنقوديّات أظهرت فعاليّة محدودة بسبب التّغيّر المناعي ما بين سلالات العنقوديّات المختلفة إضافة إلى مدّة الفعاليّة المحدودة للأجسام المضادّة النّاتجة. تطوير واختبار لقاحات أكثر فعاليّة في طور الإنجاز.
العلاج بالعاثية
تمّت عدّة أبحاث لدراسة هذه الطّريقة العلاجيّة بشكل شامل وتمّ استعمالها لمدّة تزيد عن 60 عاما خاصّة بالاتّحاد السّوفيتي. العلاج بالعاثية يمكن استعماله بدل المضادات الحيويّة وبالتّالي التّقليل من مشاكل المقاومة.
استعمل العلاج بالعاثية بشكل واسع في الولايات المتّحدة الأمريكيّة حتى تم اكتشاف المضادّات الحيويّة في أوائل الأربعينيّات.
العاثيات عبارة عن فيروسات تغزو الخلايا البكتيريّة، وفي حالة العاثيات المحدثة لانحلال الخلايا، فإنّ العمليّة الأيضيّة لدى البكتيريا تتعطّل فيما يتسبّب في انحلال البكتيريا.[14][15][16]
يعدّ العلاج بالعاثية طريقة بديلة مهمّة عن المضادات الحيويّة في عصر كثرت فيه الكائنات المجهريّة المتعدّدة المقاومة. مراجعة بعض الدّراسات الّتي تناولت الاستعمال الطّبّي للعلاج بالعاثية من عام 1966م إلى 1996م وبعض أحدث المشاريع حول العلاج بالعاثية أظهرت أنّ العاثيات استعملت عن طريق الفم، الطّريق الموضعيّ إضافة إلى الاستعمال الشّامل (غير الموضعيّ) في دراسات بولنديّة وسوفياتيّة. قدّرت نسبة النّجاح في هذه الدّراسات ب 80% إلى 95% مع وجود بعض الأعراض الجانبيّة مثل المعدمعويّة والحساسيّة.
بيّنت الأبحاث البريطانيّة فعاليّة معتبرة للعاثيات ضدّ الإشريكيّة القولونيّة، فصائل الرّاكدة، فصائل الزّائفة والعنقوديات الذهبية. أمّا الأبحاث الأمريكيّة فقد ركّزت على تحسين التَوافر البيولوجيّ للعاثيات.[17][18]
تطبيقات مفيدة لمقاومة المضادّات الحيويّة
تستعمل مقاومة المضادات الحيويّة كأداة مفيدة في مجال الهندسة الوراثيّة. مثلا يتمّ صنع بلازميد يحتوي على مورّثة مقاومة المضادّات الحيويّة إضافة إلى المورّثات المرغوب في ترجمتها، بهذه الطّريقة يتمكّن الباحث من التّأكد ّ من أنّ عند تكاثر الخلايا البكتيريّة فإنّ فقط البكتيريا الحاملة للبلازميد يمكنها العيش أمّا الأخرى فتموت بسبب تأثير المضادّ الحيويّ. وهكذا يمكن لهذه الطّريقة أن تؤكّد أنّ الجينات المرغوب في ترجمتها تنتقل عبر الخلايا عند تكاثرها. في الغالب، المضادّات الحيويّة المستعملة في مجال الهندسة الوراثيّة قديمة كما أنّها لم تعد تستعمل لمعالجة المرضى مثل: الأنبيسيلين، كاناميسين، تتراسيكلين، كلورامفينيكول. يعدّ استعمال طريقة مقاومة المضادّات الحيويّة طريقة غير مفضّلة في المجال الصّناعيّ إذ أنّها تستهلك كمّيّات هائلة من المضادّات الحيويّة. بدلا عن ذلك، يمكن استعمال الفصائل البكتيريّة الأكسوتروفيّة (غير قادرة على صنع مركّب عضوي مهمّ لنموّها).
المصادر
- Alter, Nora M. (2015-01). "Two or Three Things I Know about Harun Farocki". October. 151: 151–158. doi:10.1162/octo_a_00206. ISSN 0162-2870. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ=(مساعدة) - "Active reviewers (from October 1, 2017 through September 30, 2018)". Pediatric Radiology. 48 (13): 1827–1830. 2018-11-16. doi:10.1007/s00247-018-4299-1. ISSN 0301-0449. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Swedish work on containment of antibiotic resistance. Folkhälsomyndigheten. 2014-05-15. ISBN 978-91-7603-011-0. OCLC 943501259. مؤرشف من الأصل في 17 يناير 2021. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "NPS MedicineWise: reducing antibiotic resistance". JAC-Antimicrobial Resistance. 1 (1). 2019-01-01. doi:10.1093/jacamr/dlz020. ISSN 2632-1823. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Gerber, Jeffrey S.; Ross, Rachael K.; Bryan, Matthew; Localio, A. Russell; Szymczak, Julia E.; Wasserman, Richard; Barkman, Darlene; Odeniyi, Folasade; Conaboy, Kathryn (2017-12-19). "Association of Broad- vs Narrow-Spectrum Antibiotics With Treatment Failure, Adverse Events, and Quality of Life in Children With Acute Respiratory Tract Infections". JAMA. 318 (23): 2325. doi:10.1001/jama.2017.18715. ISSN 0098-7484. الوسيط
|CitationClass=تم تجاهله (مساعدة) - CDC Features – Mission Critical: Preventing Antibiotic Resistance".www.cdc.gov. 4 April 2018. Archived from the original on 8 November 2017. Retrieved22 July 2015
- Cirz RT, Chin JK, Andes DR, de Crécy-Lagard V, Craig WA, Romesberg FE (2005). "Inhibition of mutation and combating the evolution of antibiotic resistance". PLoS Biol. 3 (6): e176. doi:10.1371/journal.pbio.0030176. PMID 15869329. مؤرشف من الأصل في 23 يناير 2009. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Boyle-Vavra S, Daum RS (2007). "Community-acquired methicillin-resistant Staphylococcus aureus: the role of Panton-Valentine leukocidin". Lab. Invest. 87 (1): 3–9. doi:10.1038/labinvest.3700501. PMID 17146447. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Maree CL, Daum RS, Boyle-Vavra S, Matayoshi K, Miller LG (2007). "Community-associated methicillin-resistant Staphylococcus aureus isolates causing healthcare-associated infections". Emerging Infect. Dis. 13 (2): 236–42. PMID 17479885. مؤرشف من الأصل في 29 ديسمبر 2010. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Albrich WC, Monnet DL, Harbarth S (2004). "Antibiotic selection pressure and resistance in Streptococcus pneumoniae and Streptococcus pyogenes". Emerging Infect. Dis. 10 (3): 514–7. PMID 15109426. مؤرشف من الأصل في 10 أبريل 2011. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Cornelis P (editor). (2008). Pseudomonas: Genomics and Molecular Biology (الطبعة 1st ed.). Caister Academic Press. ISBN [[Special:BookSources/978-1-904455-19-6 ]|978-1-904455-19-6 ]]] تأكد من صحة
|isbn=القيمة: invalid character (مساعدة). مؤرشف من الأصل في 12 سبتمبر 2016. الوسيط|CitationClass=تم تجاهله (مساعدة)صيانة CS1: نص إضافي (link) نسخة محفوظة 12 سبتمبر 2016 على موقع واي باك مشين. - Nelson JM, Chiller TM, Powers JH, Angulo FJ (2007). "Fluoroquinolone-resistant Campylobacter species and the withdrawal of fluoroquinolones from use in poultry: A public health success story". Clin Infect Dis. 44: 977–80. مؤرشف من الأصل في 26 مايو 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Frost F, Craun GF, Calderon RL (1998). "Increasing hospitalization and death possibly due to Clostridium difficile diarrheal disease". Emerging Infect. Dis. 4 (4): 619–25. PMID 9866738. مؤرشف من الأصل في 4 يونيو 2011. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - N Chanishvili, T Chanishvili, M. Tediashvili, P.A. Barrow (2001). "Phages and their application against drug-resistant bacteria". J. Chem. Technol. Biotechnol.). 76: 689–699. مؤرشف من الأصل في 21 نوفمبر 2018. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - D. Jikia, N. Chkhaidze, E. Imedashvili, I. Mgaloblishvili, G. Tsitlanadze (2005). "The use of a novel biodegradable preparation capable of the sustained release of bacteriophages and ciprofloxacin, in the complex treatment of multidrug-resistant Staphylococcus aureus-infected local radiation injuries caused by exposure to Sr90". Clinical & Experimental Dermatology. 30: 23. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Weber-Dabrowska B, Mulczyk M, Gorski A. (2003). "Bacteriophages as an efficient therapy for antibiotic-resistant septicemia in man". Transplant Proc. مؤرشف من الأصل في 12 مايو 2007. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Mathur MD, Vidhani S, Mehndiratta PL. (2003). "Bacteriophage therapy: an alternative to conventional antibiotics". J Assoc Physicians India. 51: 593–6. مؤرشف من الأصل في 26 أبريل 2007. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Mc Grath S and van Sinderen D (editors). (2007). Bacteriophage: Genetics and Molecular Biology (الطبعة 1st ed.). Caister Academic Press. (ردمك 978-1-904455-14-1) . مؤرشف من الأصل في 22 أكتوبر 2016. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: نص إضافي (link) نسخة محفوظة 22 أكتوبر 2016 على موقع واي باك مشين.
- بوابة صيدلة
- بوابة طب
- بوابة علم الأحياء
- بوابة علم الأحياء التطوري
- بوابة علم الأحياء الخلوي والجزيئي
- بوابة علم الأحياء الدقيقة

.svg.png.webp)