بريميدون
هو دواء مضاد للتشنجات والاختلاجات من عائلة الباربيتورات. وهو نظير هيكلي من الفينوباربيتال ويعد من مضادات التشنج المشتقه من الباربيتيورات . ومن المواد النشطة التي تنتج منه بعمليات الايض : الفينوباربيتال والبيتا هيدروكسي فينوباربيتال والفينيل ايثيل مالونامايند واللذين يعدوا ايضا من مضادات التشنج .
هذا وقد كان البيريميدون العلاج الرئيسي لعلاج نوبات الصرع الكليه العامة والجزئيه وكان العلاج الأمثل للاختلاجات المعممة بشكل ثانوي والتي تنشأ في الفص الصدغي، خاصة عند اخذه مع الفينيتوئين، ولكن بحلول أوائل الثمانينات، كان الكاربامازبين قد تجاوزه في الشعبية لانه اثره المنوم والمهدئ كان اقل .
| بريميدون | |
|---|---|
 | |
 بريميدون | |
| الاسم النظامي | |
| 5-Ethyl-5-phenyl-1,3-diazinane-4,6-dione | |
| يعالج | |
| اعتبارات علاجية | |
| اسم تجاري | Lepsiral, Mysoline, Resimatil, Primaclone |
| مرادفات | desoxyphenobarbital, desoxyphenobarbitone |
| ASHPDrugs.com | أفرودة |
| فئة السلامة أثناء الحمل | D (الولايات المتحدة) |
| إدمان المخدرات | Moderate-highقالب:Medcn |
| طرق إعطاء الدواء | Oral |
| بيانات دوائية | |
| توافر حيوي | ~100%[2] |
| ربط بروتيني | 25%[2] |
| استقلاب (أيض) الدواء | كبد |
| عمر النصف الحيوي | Primidone: 5-18 h, Phenobarbital: 75-120 h,[2] PEMA: 16 h[3] Time to reach steady state: Primidone: 2-3 days, Phenobarbital&PEMA 1-4weeks[4] |
| إخراج (فسلجة) | كلية |
| معرّفات | |
| CAS | 125-33-7 |
| ك ع ت | N03N03AA03 AA03 |
| بوب كيم | CID 4909 |
| ECHA InfoCard ID | 100.004.307 |
| درغ بنك | DB00794 |
| كيم سبايدر | 4740 |
| المكون الفريد | 13AFD7670Q |
| كيوتو | D00474 |
| ChEBI | CHEBI:8412 |
| ChEMBL | CHEMBL856 |
| ترادف | desoxyphenobarbital, desoxyphenobarbitone |
| بيانات كيميائية | |
| الصيغة الكيميائية | C12H14N2O2 |
| الكتلة الجزيئية | 218.252 g/mol |
مع مرور الوقت وظهور المزيد من مضادات الاختلاج في السوق، تم دفع بريديمون أبعد وأبعد عن مكان الصدارة السابق، وأصبحت شركات الأدوية الغربية الكبرى أقل اهتماما بصناعته وبيعه. فلقد انخفض إلى حد كبير في العالم المتطور مع دخول المزيد والمزيد من مضادات الاختلاج إلى السوق، وتم سحبها من الأسواق المختلفة في جميع أنحاء العالم.
الاستخدامات الطبية
الصرع
رخص استخدام بيريميدون لحالات النَوبَةٌ تَوَتُّرِيَّةٌ-رَمَعِيَّة والنوبات الجزئية المعقدة في المملكة المتحدة.[5] في الولايات المتحدة، تمت الموافقة على البيريميدون كعلاج مساعد ( بقرنه مع أدوية أخرى) والعلاج الفردي (وحده) في النوبات التوتونية الارتعاشية العامة، والنوبات الجزئية البسيطة، والنوبات الجزئية المعقدة الجزئية، والنوبات الرمعية.[5] في الصرع الفتوي الارتجاجي العضلي يستخدم عندما لا تعمل هذه العلاجات : فالبرواتيز واللاموتريجين وحينها معالجات الخط الثاني كالاسيتازولامايد تعمل .[6]
اقترحت سلسلة حالات العلبة المفتوحة أن البراميدون فعال في علاج الصرع.[7][8][9][10][11] تمت مقارنة البريميدون مع الفينيتوين، [12] الفينوباربيتال، [12] ميثارابيتال وايثوتيون، ميفوباربيتال، وميفينيتوين.[12] في تجارب المقارنة بين البالغين، وجد أن البريتيدون فعال بنفس القدر.[12]
حالات الرعاش والرجفة
ويعتبر بريميدون علاج الخط الأول للرجفة والهزة جنبا إلى جنب مع بروبرانولول. من ناحية تقليل مدى الهزة، فهي بنفس فعالية البروبرانولول، مما يقلل من نسبة 50٪.و يتم دراسة كل من هذين العقارين بشكل جيد لهذه الحالة، على عكس العلاجات الأخرى، وينصح بهما للعلاج الأولي. 25 ملغم / يوم (جرعة منخفضة من العلاج) وهو جيد ايضا ك 75 ملغ / يوم (جرعة عالية العلاج).[13]
بريميدون ليس هو مضاد الاختلاج الوحيد المستخدم للارتعاش والرجفان. بل يوجد علاجات غيره ك توبيراميت (توباماكس) ونيوروتين \ قابابينتين . وتشمل العلاجات الدوائية الأخرى ايضا ألبرازولام (زاناكس) ، كلونازيبام (كلونوبن) ، أتينولول، سوتالول، نادولول، كلوزابين، نيموديبين، وتوكسين البوتينيوم . العديد من هذه الأدوية كانت أقل فعالية (وفقا للجدول 1 ، ولكن عدد قليل منها لم يكن كذلك. تمت مقارنة بروبرانولول فقط مع بريميدون في تجربة سريرية.[13]
متلازمة طول فترة ال كيو - تي
تقرير الحالة الأول الذي تم فيه توثيق تقصير فترة كيو تي بواسطة بريميدون، تم نشره في عدد يوليو عام 1980 ، شملت ثلاثة مرضى، امرأة تبلغ من العمر 31 عامًا، وابن أخوها البالغ من العمر 15 عامًا، أخته البالغة من العمر 16 عامًا. لا تزال المرأة تعاني من الرجفان البطيني والإغماء والنوبات حتى بعد إزالة العقدة النجمية اليسرى وتسلسلها الصدري. وقد سبق أن جربت المرأة على مزيج من الفينوباربيتال والفينيتوين عندما كان يعتقد أن لديها نوبات فقط، تليها الفينوتوين فينوباربيتال مجتمعة وبروكاينامايد . تم استبدال البروكيناميد بالبروبانولول، والذي بدوره حل محل البروبانولول عندما جلبت هذه الأخيرة تسرع القلب مرة واحدة تقريبا على الفور عند الجرعة الأولى. ثم تم الجمع بين الفينوباربيتال والفينيتوين مع الأتروبين والأسيتيل ستروفانثيادين . عندما فشل هذا، تم استبدال الأتروبين والأستيل ستروفانثيدين مع يدوكائين قبل الجراحة. بعد الجراحة، عادت الاطاله لفترة ال كيو - تي، لذلك تم مضاعفة الفينيتوين إلى 200 ملغ أربع مرات يومياً. وبعد شهر، تم إدخالها إلى المستشفى بسبب سمية الفينيتوين، حيث وجد أنها تعاني من ارتفاع بطيء ونشاط موجات فاشلة في الفص الصدغي الأيسر. كان بعد ذلك أن تم استبدال البدائي لفينيتوين. قمع بريميدون الرجفان وطول فترة كيو تي لمدة عامين وثمانية أشهر في المريض. بدأت ابنة أختها البالغة من العمر 16 عامًا في بريميدون بعد تجربة غير ناجحة من الفينيتوين. بعد ذلك، بدأ ابن أخيها البالغ من العمر 15 عامًا، شقيق أخته، بسبب تاريخ العائلة.[14] تقرير الحالة الثاني، الذي نشر في ديسمبر / كانون الأول 1986 في قضية زونقاو زن زو قوان بينغ زا زي، يصف أربع حالات، رجال ونساء وبالغين ومراهقين، الذين اصيبو بمتلازمة طول فترة ال كيو - تي بسبب استخدام البريميدون [15] تركز حالة عام 2002 على نقص كلس الدم الناجم عن مثل هذا العلاج عند الذكور المراهقين. العلاج بريميدون كن الذي كان يتناوله يتسبب عنده ب قمع إطالة كيو تي التي يسببها نقص الأوكسجين في الدم.[16]
الاضطرابات النفسية
في عام 1965 ، أفاد مونرو ووايز بان استخدام بريميدون مع مضادات الذهان كالفينوثيازين والكلورديازيبوكسيد لعلاج الذهان المقاوم للعلاج .[17] ما هو معروف هو أنه بعد عشر سنوات، قام مونرو بنشر نتائج التحليل لمحاكمتين سريريتين خاضعتين للسيطرة على الأشخاص الذين يظهرون عدوانًا خارجًا عن الطابع وغير مناسب ظاهريًا، ولديهم قراءات غير طبيعية من ال اي سي جي، والذين استجابوا بشكل سيئ مضادات الذهان. وقد ذكرت واحدة من الدراسات على وجه التحديد كما تنطوي على مرضى الذهان. عندما أعطيت مضادات اختلاج مختلفة، لم تتحسن خلاياها فقط، بل كذلك العدوان.[18]
في مارس 1993، ذكرت الطالبة هايز من كلية الطب بجامعة جنوب كاليفورنيا أن تسعة من بين سبعة وعشرين شخصًا (33٪) يعانون إما من الاكتئاب المقاوم للعلاج أو من اضطراب ثنائي القطب المقاوم للعلاج كان لديهم استجابة إيجابية دائمة للبريدون. وتجدر الإشارة إلى أنه تم إعطاء مجموعة من الأشخاص أيضًا ميثل فينو باربيتال بالإضافة إلى أو بدلاً من البريميدون .[19]
بعد خمسة أشهر، نشر براون وستون وراثون تقرير حالة بعنوان (بريميدون واضطراب ركوب الدراجة السريع " يصف فيه امرأة تبلغ من العمر 62عامًا كانت تعاني من اضطراب ثنائي القطب منذ عام 1978. وبدأ علاجها ب الليثيوم بعد عامين لكنهازال فقط تقلبات الهوس، لكن نوبات الاكتئاب لم تتاثر وبقت موجودة . بين عامي 1980 و 1989 ، كان المريض يعاني من ست إلى عشر نوبات في السنة، كل منها يدوم بين 11 و 24 يومًا، مما جعل اداء المهام يبدو أكثر صعوبة مما كانت عليه بالفعل، وتقليل الشهيه، والميل للنوم أيضًا كثيرا، قلق، وبحب. لا المضادة للاكتئاب القضاء على جميع أعراضها. في سن الثامنة والخمسين، بدأت في 125 ملغ / يوم من بريميدون لرعاش اليد. إن اكتئابها، الذي كان مقاومًا لجميع مضادات الاكتئاب التي جربتها، قد تم تحويلها تدريجيًا خلال العلاج البدائي. استمرت الحلقة الاكتئابية المتوقعة ثلاثة أيام بدلاً من 13-17. بعد ثمانية أسابيع، حصلت على نوبه تدوم ثمانية وعشرين يومًا. كانت نوبتاها الأخيرتان مفصولتان عن تسعة عشر أسبوعا، واستمرت خمسة وعشرون وسبعة وعشرون يوما على التوالي. خلال النوبة الأخيرة، في منتصف عام 1990 ، استقرت جرعة البريميدون عند 500 ملغ / يوم. و قد كانت خالية من الاكتئاب لمدة عامين ونصف قبل كتابة تقرير الحالة.[20]
في عام 1999 ، قام كل من الدكاترة : سكافير، ليندا، كارليس وكاريتو بإجراء دراسة متابعة عن تلك التقارير السابقة، حيث لم يقم أي شخص آخر بذلك في السنوات الست التي أعقبت نشرها، ووجدوا أنها تقريبًا (بشكل دائم) فعالة للاضطراب ثنائي القطب الحراري كما ذكرت هايز أنها (31 ٪ مقابل 33 ٪ في هايز). جميع الأشخاص الذين لديهم استجابة علاجية دائمة وكاملة هم إما ثنائي القطب أو نوس - ثنائي القطب. في هذه الدراسة، خلافا لتقرير حالة عام 1993 ، ظهرت أعراض استخدام بريميدون - لا سيما الأرق والقلق، وأفكار السباق - وفقط على أعراض الهوس.[21]
استخدامات اخرى
على عكس الكاربامازبين، هناك عدد قليل من التقارير التي تشير إلى استخدام بريميدون في علاج التهاب العصب الثلاثي التوائم الأول، الذي نشر في عدد 10 أكتوبر 1957 من جريدة ميديكال دو فرانس، ليس له أي شكل.[22] والثاني هو تقرير حالة لامرأة تأخذ البريدون ثم الفينوباربيتال لعلاج الالتهاب العصبي الثلاثي التوائم. انها وضعت انحلال البشرة السمي، فضلا عن التهاب الشغاف ونزيف الجهاز الهضمي. التكرار الثاني، الناجم عن الفينوباربيتال، قتلها في غضون خمسة أسابيع من البداية.[23]
تم نشر تجربتين من استخدام البريميدون للكَنَع:( تحرّكات تَمَعُّجية مُستمرّة وملتوية في اليدين والقدمين) . في واحد، عالجت جرعات صغيرة من بريميدون بنجاح ثمانية عشر من أصل واحد وثلاثين طفلاً. في تجربة تجريبية لاحقة تم فيها تحويل الأطفال الذين عانوا من التحسن إلى دواء وهمي، كانت النتائج مخيبة للآمال أكثر بكثير، مع الموضوعين اللذين اختبروا التحسن الذاتي أيضاً يعانون من هذا العلاج الوهمي.[24]
وقد استخدم بريميدون في الشلل الدماغي. في عام 1953 ، وجد بلوم وسباروب أنه من أصل ثلاثة وثلاثين مريضا، كان لدى العشرين منهم استجابة مواتية أو معتدلة. ذكرت ثورن في عام 1962 أن ستة عشر مريضا ردوا بشكل إيجابي على كل من بريميدون والكلورديازيبوكسيد وأربعة على بريميدون فقط. استجاب تسعة مرضى فقط للكلورديازيبوكسيد وأربعة استجابو للمخدرات . تم الحصول على أفضل النتائج في كفاء والصلابة.[25]
يستخدم بريميدون ايضا في الاستخدامات البيطرية، بما في ذلك الوقاية من السلوك العدواني وأكل لحوم البشر في الخنازير المذهبة، وعلاج الاضطرابات العصبية في الكلاب والحيوانات الأخرى.[26][27]
الاضرار الجانبية
قالب:Medref يمكن أن يسبب بريميدون النعاس، وعدم الراحة، الترنح، واضطرابات بصرية، رأرأة، صداع، والدوخة. هذه الآثار الجانبية هي الأكثر شيوعًا، حيث تحدث في أكثر من 1٪ من المستخدمين.[28] الغثيان والقيء العابرين هي أيضا من الآثار الجانبية الشائعة.

انقباض دوبويترن، وهو مرض من اللفافة في الكف والأصابع، التي تحني بشكل دائم الأصابع (عادة الأصابع الصغيرة والرنجة) نحو راحة اليد، لوحظ أولا أنه منتشر بشكل كبير في مرض الصرع في عام 1941 من قبل الدكتور لوند، أربعة عشر عاما قبل أن يكون بريميدون في السوق. لاحظ لوند أيضًا أنه كان منتشرًا في الأفراد المصابين بالصرع مجهول السبب والأعراض وأن شدة الصرع غير مهمة. ومع ذلك، فقد تأثر ربع النساء فقط مقابل نصف الرجال.[29] بعد خمسة وثلاثين عاما، كريتشيلي وآخرون. أبلغو عن وجود علاقة بين المدة التي أصيب فيها المريض بالصرع وفرصة حصوله على تقلص دوبويترن. كانوا يشكون في أن هذا كان بسبب العلاج الفينوباربيتال، وأن الفينوباربيتال كان يحفز عوامل نمو الأنسجة الطرفية.[30] تقريب دوبويترون موجود بشكل حصري تقريبا في القوقازيين، وخاصة أولئك الذين ينحدرون من الفايكينج، ويتم الإبلاغ عن أعلى المعدلات في شمال اسكتلندا والنرويج وأيسلندا وأستراليا. وقد ارتبط أيضًا بالإدمان على الكحول، والتدخين الثقيل، وداء السكري، والصدمات الجسدية (إما اختراق في الطبيعة أو بسبب العمل اليدوي) ، والسل، وفيروس نقص المناعة البشرية. الأشخاص الذين يعانون من التهاب المفاصل الروماتويدي هم أقل احتمالا للحصول على هذا، والدكاترة. ويتكهن هارت وهوبر بأن هذا ينطبق أيضا على النقرس بسبب استخدام الوبيورينول وهذا هو عامل الحساسية الوحيد المتفق عليه عموما. لا يبدو أن مضادات الاختلاج تزيد من حدوث تقلص دوبويترن في غير البيض.[29]
يمتلك بريميدون تأثيرات قلبية وعائية أخرى في ما بعد تقصير فترة ال كيو - تي . يرتبط كل من الفينوباربيتال ومستوياته المرتفعة (سواء بالصيام أو بعد ست ساعات من تحميل الميثيونين) من الهموسيستين، وهو حمض أميني مشتق من ميثيونين. ومن المؤكد تقريبا أن هذا يرتبط بمستويات منخفضة من حمض الفوليك التي أبلغ عنها في مستخدمي بريميدون. ارتبطت مستويات مرتفعة من الهموسيستين بمرض القلب التاجي. في عام 1985 ، تم الإبلاغ عن زيادة كل من الأدوية لزيادة مستويات مصل الدم من البروتين الدهني عالي الكثافة والكولسترول الكلي، والبروتينات الشحمية أ وب .[31] تم الإبلاغ لأول مرة عن تفاقم البورفيريا الكبدية في عام 1975. في عام 1981 ، تبين أن الفينوباربيتال، وهو أحد نواتج الأيض الأولية ، أدى فقط إلى ظهور البورفيرين الكبير عند التركيزات العالية في المختبر.[32] كما يمكن أن يسبب ارتفاعات في الإنزيمات الكبدية مثل ترانسفيراز جاما-غلوتاميل والفوسفاتيز القلوي.[28]
أقل من 1٪ من مستخدمي بريميدون سيواجهون طفح جلدي. مقارنة مع الكاربامازبين ، اموتريجين ، والفينيتوين ، وهذا منخفض جدا. معدل مماثل لتلك من فيقاباترين وفيلبامات ، و توبيرامات .[33] كما يسبب بريميدون التهاب الجلد التقشري ، متلازمة ستيفنز جونسون ، وانحلال البشرة السمي.[28]
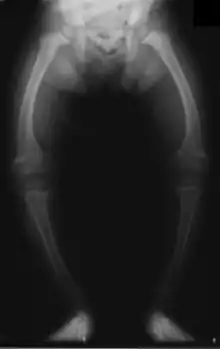
بريميدون ، جنبا إلى جنب مع الفينيتوين والفينوباربيتال ، هو واحد من مضادات الاختلاج الأكثر ارتباطا بشكل كبير بأمراض العظام مثل هشاشة العظام ، وهشاشة العظام (التي يمكن أن تسبق هشاشة العظام) ، لين العظام والكسور.[34][35][36] السكان الذين يقال عادة أنهم الأكثر عرضة للخطر هم الأشخاص المودعون في المؤسسات ، والنساء بعد سن اليأس ، والرجال الأكبر سنا ، والأشخاص الذين يتناولون أكثر من مضادات الاختلاج ، والأطفال ، الذين هم أيضا عرضة لخطر الكساح.[34] ومع ذلك ، فقد تم اقتراح أن إزالة المعادن في العظام هي الأكثر وضوحا في الشباب (25-44 سنة من العمر) [35]، ووجدت دراسة واحدة عام 1987 عن الأشخاص المؤسسين أن نسبة تلين العظام في تلك التي تأخذ مضادات الاختلاج - واحد من أصل تسعة عشر شخصًا أخذ مضادات الاختلاج (مقابل لا شيء بين الأشخاص السبعة والثلاثين الذين أخذوا لا شيء) - كان مماثلاً لتلك المتوقعة في كبار السن. وتكهن المؤلفون أن هذا كان بسبب التحسينات في النظام الغذائي والتعرض لأشعة الشمس وممارسة الرياضة ردا على النتائج السابقة ، و / أو أن هذا كان لأنه كان أكثر إشراقا في لندن مما كان عليه في بلدان أوروبا الشمالية التي كانت قد ذكرت في وقت سابق هذا التأثير.[36] على أي حال ، فإن استخدام أكثر من مضادات اختلاج واحد قد ارتبط بزيادة انتشار مرض العظام في مرضى الصرع المؤسسي مقابل الأشخاص الذين يمارسون الصفة المؤسسية والذين لم يصابوا بالصرع. وبالمثل ، فإن النساء بعد سن اليأس اللواتي يتناولن مضادات الاختلاج لديهن خطر أكبر للكسر من نظرائهن من المخدرات الساذجة.[34]
مضادات الاختلاج تؤثر على العظام بطرق عديدة. أنها تسبب وارتفاع الفوسفات ، ارتفاع الكالسيوم ، وانخفاض مستويات فيتامين (د) ، وزيادة هرمون الغدة الدرقية. تساهم مضادات الاختلاج أيضًا في زيادة معدل الكسور من خلال التسبب في النعاس والترنح والارتعاش الذي قد يتسبب في اضطراب في المشية ، مما يزيد من خطر الإصابة بالكسور أعلى الزيادة بسبب النوبات والقيود المفروضة على النشاط المصاب بالصرع. زيادة معدل الكسر كما تم الإبلاغ عن كاربامازبين وفالبروات وكلونازيبام. يكون خطر الإصابة بالكسور أعلى لدى الأشخاص الذين يتناولون مضادات التشنج التي تحفز الإنزيمات مقارنةً بالأشخاص الذين يتناولون مضادات الاختلاج غير المحفزة للانزيم.[35] بالإضافة إلى كل ما سبق ، يمكن أن يسبب البريميدون ألم مفصلي.[28]
نادراً ما يرتبط نقص المحببات ، ندرة المحببات ، نقص تنسج الخلايا الحمراء وعدم التنسج ، وفقر الدم الضخم الأرومات باستخدام البريميدون.[37] فقر الدم الضخم الأرومات هو في الواقع مجموعة من الاضطرابات ذات الصلة ذات الأسباب المختلفة التي تتشارك في الخصائص المورفولوجية - تضخم خلايا الدم الحمراء ذات النسب العالية غير الطبيعية للأنسجة السيتوبلازمية الناتجة عن تأخر النواة المتأخرة مع النضج الطبيعي للسيتوبلازم ، إلى الخلايا العملاقة غير الطبيعية وأحيانًا العدلات المتضخمة. بغض النظر عن المسببات ، فإن جميع فقر الدم الضخم الأرومات ينطوي على ضعف الحمض النووي.[38] وعادة ما يميل مستخدمو مضادات الاختلاج إلى تناول وجبات غذائية رتيبة خالية من الفواكه والخضروات.[39] لا يرجع هذا التأثير العدائي إلى تثبيط اختزال ثنائي هيدروفولات ، وهو الإنزيم المسؤول عن تقليل حمض ثنائي هيدروفوليك إلى حمض تتراهيدروفوليك ، بل إلى التمثيل الغذائي المنقص للفولات .
بالإضافة إلى زيادة خطر فقر الدم الضخم الأرومات ، فإن البِدْيدُون ، شأنه شأن غيره من مضادات الاختلاج القديمة الأخرى ، يزيد أيضًا من خطر عيوب الأنبوب العصبي ، [40] ومثل مضادات الاختلاج الأخرى التي تحفز الإنزيم ، فإنه يزيد من احتمال حدوث العيوب القلبية الوعائية والشفة المشقوقة بدون الحنك المشقوق. .[41] وينصح عمومًا نساء الصرع بتناول حمض الفوليك ، [40] ولكن هناك أدلة متضاربة بشأن فعالية مكملات الفيتامينات في الوقاية من مثل هذه العيوب.[41][42]
بالإضافة إلى ذلك ، لوحظ وجود عيب تخثر يشبه عوز فيتامين ك في حديثي الولادة للأمهات اللاتي يتناولن بريمدون.[40] وبسبب هذا ، فإن بريميدون هو دواء من الفئة د .[43]
يمكن لبيريدون ، مثل الفينوباربيتال والبنزوديازيبينات ، أن يسبب التهدئة عند الوليد وكذلك الانسحاب خلال الأيام القليلة الأولى من الحياة ؛ فينوباربيتال هو الأكثر احتمالا من كل ذلك للقيام بذلك.[40]
في أيار / مايو 2005 ، أبلغ فريق الدكتور م. لوبيز غوميز عن وجود علاقة بين استخدام الريميدون والاكتئاب في مرضى الصرع. ذكرت هذه الدراسة نفسها أن عدم كفاية السيطرة على النوبات ، والصرع ما بعد الصدمة . كما تم الربط بين المعالجة المتعددة مع سيطرة قليله على الصرع . من بين جميع عوامل الخطر ، كان استخدام البريميدون والسيطرة غير المناسبة على النوبات أكبر ؛ مع (أو ار اس ) و 4.089 و 3.084 ، على التوالي. كانوا يبحثون عن عوامل مرتبطة بالاكتئاب في مرضى الصرع. شيفر وآخرون. وأفيد عام 1999 أن أحد إخفاقاتها العلاجية ، وهي امرأة تبلغ من العمر 45 سنة تتناول 50 ملغ في اليوم إلى جانب الليثيوم 600 ملغ / يوم ، وكلوزابين 12.5 ملغ / يوم ، وترازودون 50 ملغ / يوم ، وألبرازولام 4 ملغ / يوم لثلاثة أشخاص ، شهد نصف شهر من الهلوسات السمعية التي أدت إلى وقف استخدام بريميدون [21] يمكن أن يسبب أيضا فرط النشاط عند الأطفال ؛ [44] يحدث هذا بشكل شائع عند مستويات منخفضة من المصل.[45] هناك حالة واحدة للفرد المصاب بانفصام الشخصية عندما يكون تركيزه في مصل البريميدون فوق المعدل الطبيعي.[46]
بريميدون هو واحد من مضادات الاختلاج المرتبطة بمتلازمة فرط الحساسية المضادة للاختلاج ، والبعض الآخر يكون كاربامازبين ، الفينيتوين ، والفينوباربيتال. تتكون هذه المتلازمة من الحمى والطفح الجلدي وزيادة عدد الكريات البيضاء المحيطية واعتلال العقد اللمفية والنخر الكبدي في بعض الأحيان.[47]
أبلغت كاتانو هيرويوكي من مستشفى ناجويا سيتي هيغاشي في أوائل عام 2002 عن اعتلال دماغي في مريض كان مستمراً على استخدام بريميدون لمدة خمس سنوات قبل خضوعه لعملية جراحية لعلاج ورم نجمي ، وهو نوع من ورم في المخ. بالإضافة إلى ذلك ، كانت مستويات الفينوباربيتال لها مرتفعة بشكل لا يمكن علاجه بعد الجراحة. هذا هو أكثر شيوعا مع فالبوريت من أي من الباربيتورات.[48] وجدت تجربة حية ذات شواهد نشرت نتائجها في عدد يوليو عام 1985 من مجلة نيو إنغلاند جورنال أوف ميديسين أن بريميدون كان أكثر عرضة للتسبب بالعجز من الفينيتوين ، الكاربامازبين ، أو الفينوباربيتال. مثل الفينيتوين ، نادرا ما يرتبط بريميدون باعتلال العقد اللمفية.[49] يمكن أن يسبب بريميدون ايضا القيء. يحدث هذا في 0.1 - 1 ٪ من المستخدمين.[28]
الجرعة الزائدة
الأعراض الأكثر شيوعًا لجرعة زائدة من البريميدون هي غيبوبة مع فقدان منعكسات الأوتار العميقة ، وخلال فترة الشفاء ، إذا نجا المريض ،فانه قد يصيبه مما يلي : الارتباك ، و والرأرأة ، والترنح ، [50] خمول ، نعاس ، قيء ، غثيان ، وأحيانًا ، العجز العصبي المركزي الذي يقلل مع مرور الوقت.[51] الاسترداد الكامل يأتي في غضون خمسة إلى سبعة أيام من الابتلاع.[50] تعزى عادة أعراض التسمم البريميدوني إلى تحولها الأحيائي إلى الفينوباربيتال ؛ ومع ذلك ، بريميدون له آثار سمية مستقلة عن نواتج الأيض في البشر. [[51] تؤدي البلورات الضخمة التي تحدث في بعض الأحيان إلى تحديد مظهر أعراضها بشكل منفصل عن الفينوباربيتال.[50][52][53][54] البلورات بيضاء ، [51][53] مثل الإبرة ,[52] ، متلألئة ، لوحات سداسية تتكون بشكل رئيسي من بريميدون.[51][53]
في هولندا وحدها ، كانت هناك أربع وثلاثين حالة من حالات التسمم البدائي المشتبه بها بين عامي 1978 و 1982. من هذه التسممات ، كان التسمم بالبريميدون أقل شيوعا بكثير من التسمم الفينوباربيتال. وتم إبلاغ المركز الوطني الهولندي لمراقبة السموم عن 27 حالة إصابة بالبالغين. من بين هؤلاء ، توفي شخص واحد مع الفينيتوين والفينوباربيتال ، وأصبح اثنا عشر تحت التخدير وأربعة في غيبوبة.[52]
اشتملت العلاجات على جرعة زائدة من البريميدون على حقن بالدم مع إدرار البول القسري ، [52] وهو مزيج من بيميغريد والأميبنازول ؛ [55] ومزيج من بيميغريد ، سبيرونولاكتون ، كافيين ، بنتيلنت إيزرازول ، ستروفانثين ، بنسيلين وستربتومايسين.[56]
في البالغين الثلاثة الذين تم الإبلاغ عن أنهم خضعوا ، كانت الجرعات 20-30غم.[50][55][56] ومع ذلك ، فإن اثنين من الناجين البالغين تناولوا 30جم [50] و 25 جم ، [55] و 22.5 جم.[51] عانت امرأة واحدة من أعراض التسمم بالبريميدون بعد تناول 750 ملغ من بريميدون من شريكتها في الغرفة.[57]
التفاعلات
أخذ البريميدون مع مثبطات مثبطات اكاسيد احادي الامين مثل إيزوكربوكسازيد (ماربلان)، فينيلزين (ناردل)، بروكاربازين (ماتولين)، سيليجيلين (الديبريل)، ترانيلسيبرومين (بارنات) أو في غضون أسبوعين من وقف أي واحد منهم قد يتم تحفيز آثار البريميدون .[58] ، ايزونايزايد وهو عامل مضاد للجسم مع خصائص مثبطات اكاسيد احادي الامين ، معروف أنه يمنع بشدة عملية التمثيل الغذائي لبرميدون.[59] مثل العديد من مضادات التشنج ، يتفاعل برميدون مع مضادات الاختلاج الأخرى. كلوبازام يقلل من عملية التخليص البرميدون ، [60] يزيد ميساوكسيمايد من مستويات البلازما من الفينوباربيتال في مستخدمي برميدون.[61] كل من بريميدون وفينوباربيتال يسرعان استقلاب الكاربازيبيم عبر CYP3A4 [62] ويزداد تخليق لاموتريكين الواضح بواسطة بريميدون [63] بالإضافة إلى كونها محفز من CYP3A4، بل هو أيضا محفز للCYP1A2، الذي يؤدي إلى التفاعل مع ركائز مثل فلوفوكسامين، كلوزابين، الأولانزابين، ومضادات الاكتئاب ثلاثية الحلقات.[64] كما أنه يتفاعل مع الركائز CYP2B6 مثل البوبروبيون ، ايفافيرينز ، بروميثازين ، سيليكيلين ، وسيرترالين. ركائز CYP2C8 مثل أميودارون ، باكليتاكسيل ، بيوجليتازون ، ريباغنيليد ، وروزيجليتازون. وركائز CYP2C9 مثل بوسينتان، السيليكوكسيب، الدابسون، فلوكستين، غليميبيريد، غليبيزيد، اللوسارتان، المونتيلوكاست، ناتيكنيلايد، باكليتاكسيل، الفينيتوين، السلفوناميدات، ميثوبريم، الوارفارين، وزافيرلوكاست. كما أنه يتفاعل مع هرمون الاستروجين.[58]
يمكن أن يقلل البريميدون ومضادات الاختلاج الأخرى التي تحفز الإنزيم من عمر النصف من مضادات البارين إلى النصف تقريبا (6.2 ± 1.9 h مقابل 11.2 ± 4.2 h) ، ويزيد معدل التطهير بنسبة 70٪ تقريبًا. فينوباربيتال يقلل من نصف العمر إلى 4.8 ± 1.3 ويزيد من إزالة ما يقرب من 109 ٪.[65] كما أنه يتداخل مع أيض ديكساميثازون ، وهو هرمون ستيرويد صناعي ، إلى درجة أن انسحابه من نظام طفل عمره 14 عامًا يعيش في المملكة المتحدة جعل منها فرط الكورتيزول.[66] أفاد تيمبلهوف وزملاؤه في قسم التخدير في كلية الطب بجامعة واشنطن في عام 1990 أن عقار بريميدون وغيره من الأدوية المضادة للاختلاج تزيد من كمية الفنتانيل اللازمة خلال عملية حج القحف على أساس معدل ضربات القلب للمريض.[67]
الية العمل
لا تزال الآلية الدقيقة لعمل البريميدون هي غير معروفة بعد أكثر من خمسين عاما.[68] ويعتقد أنها تعمل من خلال التفاعلات مع قنوات الصوديوم ذات البوابات الفولتية والتي تمنع إطلاق التردد المتكرر لإمكانات الفعل.[69] لا يمارس PEMA تأثير البريميدون في علاج الهزة.[70] المستقلب الرئيسي ، الفينوباربيتال ، هو أيضًا مضاد اختلاج قوي في حد ذاته ويساهم على الأرجح في تأثيرات البيدريدون في العديد من أشكال الصرع. وفقا لكتب علم الصيدلة برينر ،يعمل بريميدون أيضا على زيادة تدفق ايون الكلور بواسطه GABA : وبالتالي فرط الاستقطاب .
علم الدواء
يتحول البريميدون إلى فينوباربيتال و PEMA ؛ [71] ولا يزال من غير المعروف بالضبط أنزيمات السيتوكروم P450 المسؤولة.[59] يتم استقلاب الفينوباربيتال ، بدوره ، إلى بارا - فينوباربيتال [72] ثم يتم تسريع معدل التمثيل الغذائي لبريميدون إلى حد كبير من قبل المعالجة الفينوباربيتال ، والتي تسارعت بشكل معتدل من قبل المعالجة الأولية ، وخفضت من قبل المعالجة المسبقة [73] في عام 1983، تم اكتشاف مستقلب ثانوي جديد ،بارا - هيدروكسيبريميدون .[74]
يعتبر كل من بريميدون وكاربامازيبين وفينوباربيتال وفينيتوين من بين أكثر الإنزيمات الكبدية فعالية التي تحفز الأدوية الموجودة. يحدث هذا الاستقراء الانزيم في الجرعات العلاجية. في الواقع ، أظهر الأشخاص الذين يتناولون هذه الأدوية أعلى درجة من تحريض الإنزيمات الكبدية.[65] بالإضافة إلى كونه محفزًا لـ CYP3A4 ، فهو أيضًا محفز لـ CYP1A2 ، مما يجعله يتفاعل مع ركائز مثل فلوفوكسامين ، كلوزابين ، أولانزابين ، ومضادات الاكتئاب ثلاثية الحلقات ، بالإضافة إلى احتمال زيادة سمية منتجات التبغ. مستقلبه ، فينوباربيتال ، هو الركيزة من CYP2C9 ، [66] CYP2B6 ، [75] CYP2C8 ، CYP2C19 ، CYP2A6 ، CYP3A5 ، [64] CYP1E1 ، وفئة CYP2E.[76]] يتم تنظيم التعبير الجيني عن هذه الإنزيمات عن طريق مستقبل البوتان البشري X (PXR) والمستقبل التأسيسي androstane (CAR).يعمل فينواربيتال على تفعيل CYP2B6 من قبل كل منهما.[77] لا يقوم بريميدون بتفعيل PXR.[78] كان معدل استقلاب البريميدون في الفينوباربيتال متناسبًا مع العمر ؛ كانت أعلى المعدلات في أقدم المرضى (الحد الأقصى للعمر هو 55).[79] الأشخاص الذين تتراوح أعمارهم بين 70-81 ، بالنسبة إلى الأشخاص الذين تتراوح أعمارهم بين 18 إلى 26 عامًا ، انخفض لديهم اختفاء كلوي من البريميدون ، الفينوباربيتال ، و PEMA ، بالترتيب التصاعدي للدلالة ، وكان هناك نسبة أكبر من PEMA في البول.[80] الأهمية السريرية غير معروفة.
وقدرت نسبة البريميدون التي تم تحويلها إلى الفينوباربيتال بكونها 5٪ في الكلاب و 15٪ عند البشر. وجد العمل بعد اثني عشر عاما في وقت لاحق أن المصل الفينوباربيتال 0.111 ملغ / 100 مل لكل مغم / كغ من مبلوع البريميدون. وقدر المؤلفون المنشورون قبل عام أن 24.5٪ من البريميدون تم استقلابه إلى الفينوباربيتال. ومع ذلك ، فإن المريض الذي أبلغ عنه كابي وباكلي كان عنده مستوى مصل 44.4 مجم / 100 مل بدلاً من 8.5 ملغ / 100 مل إذا كان هذا صحيحاً بالنسبة للأفراد الذين تناولوا جرعة كبيرة. المريض الذي أبلغ عنه مورلي ووين كان لديه مستويات الباربيتورات في المصل من 50 ملغ / 100 مل ، والتي كانت ستؤدي إلى الوفاة.[50]
التاريخ
ظهرت فعالية البريميدون للصرع لأول مرة في عام 1949 من قبل يولي بوق [7] تم تقديمه بعد عام من قبل شركة الصناعات الكيميائية ، المعروفة الآن باسم AstraZeneca في المملكة المتحدة [55][81] وألمانيا.[56] في عام 1952 ، تمت الموافقة عليه في هولندا.[52] في نفس العام ، أثبت الدكاترة هاندلي وستيوارت فعاليته في علاج المرضى الذين فشلوا في الاستجابة للعلاجات الأخرى. لوحظ أنه أكثر فعالية في الأشخاص المصابين بالصرع المعمم مجهول السبب من الأشخاص الذين كان سبب الصرع معروفًا.[7] أشار الدكتور وايتتي في عام1953 إلى أنه استفاد من مرضى الصرع النفسي ، الذين كانوا في الغالب مقاومين للعلاج. تم الإبلاغ عن تأثيرات سامة لتكون خفيفة.[8] في نفس العام ، تمت الموافقة عليه في فرنسا.[82] تم تقديم بريميدون في عام 1954 تحت اسمتجاري ميزولين من قبل ويث في الولايات المتحدة.[83]
وجاء أول تقرير يربطها بفقر الدم الضخم الأرومات في عام 1954 من الدكاترة. تشالمرز وبوهيمر.[84] بين عامي 1954 و 1957 ، تم الإبلاغ عن 21 حالة من فقر الدم الضخم الأرومات المرتبطة بالبريميدون و / أو الفينيتوين.[85] كانت معظم الحالات بسبب نقص حمض الفوليك. ومع ذلك ، كان هناك واحد فقط استجاب 12 شخص للعلاج ب [84] وواحد يحتاج إلى فيتامين سي [85] ارتبطت بعض الحالات بنقص الغذائية ؛ تناول أحد المرضى في الغالب الخبز والزبدة ، [84] وتناول آخر الخبز والكعك والحلوى الصلبة ، ونادرا ما كان يتم إقناع شخص آخر بتناول الطعام في المستشفى.[85] الفكرة القائلة بأن نقص حمض الفوليك يمكن أن يسبب فقر الدم الضخم الأرومات لم يكن جديدًا. ما كان جديدا هو فكرة أن الأدوية يمكن أن تسبب هذا في الأشخاص الذين يتمتعون بتغذية جيدة دون أي تشوهات معوية.[84] في العديد من الحالات ، لم يكن من الواضح أي عقار تسبب في ذلك.[86] وقد تم التكهن بأن هذا قد يكون مرتبطا بالتشابه البنيوي بين حمض الفوليك ، الفينيتوين ، الفينوباربيتال ، والبريميدون.[87] تم العثور على حمض الفوليك للتخفيف من أعراض فقر الدم الضخم الأرومات في أربعينيات القرن العشرين ، بعد فترة وجيزة من اكتشافه ، لكن المريض النموذجي لم يحدث إلا تعافياً كاملاً - توقف أعراض الجهاز العصبي المركزي والطرفي بالإضافة إلى فقر الدم - في علاج نقص فيتامين ب 12 [88] قبل خمس سنوات ، تم ربط نقص حمض الفوليك بالعيوب الخلقية في الجرذان.[89] اعتبر البعض أن بريميدون قيِّم جدًا على حجبه اعتمادًا على الاحتمال البسيط لهذا التأثير الجانبي النادر [84] والبعض الآخر خطيرًا بما يكفي لحجبه إلا إذا فشل الفينوباربيتال أو الباربيتورات الآخر في العمل لهذا السبب ولأسباب أخرى (أي التقارير من الذهان الدائم.[90]
الاشكال الصيدلانية المتاحة
يتوفر البريميدون كمعلق 250 مجم / 5 مل ، وعلى شكل 50ملغ و 125 ملغ و 250 ملغ. وهو متوفر أيضًا على شكل حبوب قابلة للمضغ في كندا.[91]
يتم تسويقها كعلامات تجارية مختلفة بما في ذلك مايزولين (كندا ، [92] أيرلندا ، [93] اليابان ، [63] المملكة المتحدة ، [94] والولايات المتحدة[92] ، بريزولين (إسرائيل ، Rekah Pharmaceutical Products، Ltd .)، [28]] أبو-بريميدون ،[91][95] ليسكانتين (ألمانيا، Desitin)، [96] ]ريسيماتيل (ألمانيا، Sanofi-Synthélabo GmbH)، [97]]ميليبسينم (Germany، AWD.pharma GmbH & Co. ، كغ). ، [98] وسيرتان (المجر ، 250 ملغ ، ICN Pharmaceuticals Inc. [1]))
المراجع
- معرف المصطلحات المرجعية بملف المخدرات الوطني: https://bioportal.bioontology.org/ontologies/NDFRT?p=classes&conceptid=N0000146807 — تاريخ الاطلاع: 13 ديسمبر 2016
- Ochoa, Juan G; Riche, Willise. (2005). "Antiepileptic Drugs: An Overview". eMedicine. eMedicine, Inc. مؤرشف من الأصل في 19 أكتوبر 2008. اطلع عليه بتاريخ 02 يوليو 2005. الوسيط
|CitationClass=تم تجاهله (مساعدة) - CDER, U.S. DEPARTMENT OF HEALTH AND HUMAN SERVICES (2003–2005). "Primidone (Mysoline)". Pharmacology Guide for Brain Injury Treatment. Brain Injury Resource Foundation. مؤرشف من الأصل في 17 مارس 2010. اطلع عليه بتاريخ 02 يوليو 2005. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Yale Medical School, Department of Laboratory Medicine (1998). "Therapeutic Drug Levels". YNHH Laboratory Manual - Reference Documents. Yale Medical School. مؤرشف من الأصل في 20 فبراير 2009. اطلع عليه بتاريخ 13 يوليو 2005. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Acorus Therapeutics, Ltd. (2005). "Mysoline 250 mg Tablets". electronic Medicines Compendium. Datapharm Communications and the Association of the British Pharmaceutical Industry (ABPI). مؤرشف من الأصل في 16 مارس 2008. اطلع عليه بتاريخ 08 مارس 2006. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Broadley, Marissa A. (200). "Juvenile Myoclonic Epilepsy of Janz (JME)". The Childhood Seizure e-Book. Valhalla, New York. مؤرشف من الأصل في 7 أبريل 2015. اطلع عليه بتاريخ 03 يوليو 2005. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Williams, Denis (1 August 1956). "Treatment of Epilepsy with Mysoline". Proceedings of the Royal Society of Medicine. 49 (8): 589–91. PMC 1889099. PMID 13359420. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Whitty, C. W. (September 5, 1953). "Value of primidone in epilepsy". British Medical Journal. 2 (4835): 540–1. doi:10.1136/bmj.2.4835.540. PMC 2029655. PMID 13082031. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Livingston, Samuel; Don Petersen (February 16, 1956). "Primidone (mysoline) in the treatment of epilepsy; results of treatment of 486 patients and review of the literature". New England Journal of Medicine. 254 (7): 327–9. doi:10.1056/NEJM195602162540706. PMID 13288784. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Smith, Bernard H.; Francis L. McNaughton (May 1953). "Mysoline, a new anticonvulsant drug; its value in refractory cases of epilepsy.|titlhoward stern babba booey e = Mysoline, A new Anticonvulsant: Its Value in Refractory Cases of Epilepsy". Canadian Medical Association Journal. 68 (5): 464–7. PMC 1822778. PMID 13042720. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Powell, C.; Painter MJ; Pippenger CE (October 1984). "Primidone therapy in refractory neonatal seizures". Journal of Pediatrics. 105 (4): 651–4. doi:10.1016/S0022-3476(84)80442-4. PMID 6481545. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Gruber, C. M., Jr.; J. T. Brock; M. Dyken (January–February 1962). "Comparison of the effectiveness of phenobarital, mephobarbital, primidone, diphenylhydantoin, ethotoin, metharbital, and methylphenylethylhydantoin in motor seizures". Clinical Pharmacology and Therapeutics. 3: 23–8. PMID 13902356. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Practice Parameter: Therapies for essential tremor: Report of the Quality Standards Subcommittee of the American Academy of Neurology". Neurology. 64 (12): 2008–20. June 28, 2005. doi:10.1212/01.WNL.0000163769.28552.CD. PMID 15972843. مؤرشف من الأصل في 4 ديسمبر 2009. اطلع عليه بتاريخ 11 أغسطس 2007. الوسيط
|CitationClass=تم تجاهله (مساعدة) - DeSilvey DL; Moss AJ (July 1980). "Primidone in the treatment of the long QT syndrome: QT shortening and ventricular arrhythmia suppression". Annals of Internal Medicine. 93 (1): 53–4. doi:10.7326/0003-4819-93-1-53. PMID 7396315. مؤرشف من الأصل في 5 مايو 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Lan, Y. W. (December 1986). "[Primidone in the treatment of long Q-T syndrome. Clinical analysis of 4 cases]". Zhonghua Xin Xue Guan Bing Za Zhi (Chinese Journal of Cardiovascular Diseases) (باللغة الصينية). 14 (6): 330–2, 380. PMID 3582153. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Loukeris, Konstantinos; Davide Mauri; Padelis Pazarlis (October 2002). "QT length and heart function in primidone hypocalcaemia". Acta Cardiologica. 57 (5): 367–9. doi:10.2143/AC.57.5.2005455. PMID 12405576. مؤرشف من الأصل (PDF) في 20 فبراير 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Combined phenothiazine, chlordiazepoxide and primidone therapy for uncontrolled psychotic patients". American Journal of Psychiatry. 122 (6): 694–8. 1965. doi:10.1176/ajp.122.6.694. PMID 5320821. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Monroe, R. R. (February 1975). "Anticonvulsants in the treatment of aggression". Journal of Nervous and Mental Disease. 160 (2–1): 119–26. doi:10.1097/00005053-197502000-00006. PMID 1117287. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Hayes, S. G. (March 1993). "Barbiturate anticonvulsants in refractory affective disorders". Annals of Clinical Psychiatry. 5 (1): 35–44. doi:10.3109/10401239309148922. PMID 8348197. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Brown GM; Stone GH; Rathbone MP (October 9, 1993). "Primidone and rapid cycling affective disorders". ذا لانسيت. 342 (8876): 925. doi:10.1016/0140-6736(93)91972-O. PMID 8105181. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Schaffer LC; Schaffer CB; Caretto J (June 1999). "The use of primidone in the treatment of refractory bipolar disorder". Annals of Clinical Psychiatry. 11 (2): 61–6. doi:10.3109/10401239909147050. PMID 10440522. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Bergouignan, M. (October 1957). "[Recent developments in the medical treatment of essential trigeminal neuralgia: importance of various anti-epileptic medication.]". Gazette Médicale de France (باللغة الفرنسية). 64 (19): 1571–2 passim. PMID 13480440. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Stuttgen, G. (March 1973). "Toxic epidermal necrolysis provoked by barbiturates". British Journal of Dermatology. 88 (3): 291–3. doi:10.1111/j.1365-2133.1973.tb07551.x. PMID 4541299. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Lorber, John (July 26, 1958). "Primidone Treatment of Athetosis in Children". British Medical Journal. 2 (5090): 208. doi:10.1136/bmj.2.5090.208. PMC 2026118. PMID 13560827. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Thorn, I. (June 1962). "Primidone and chlordiazepoxide in cerebral palsy". Developmental Medicine and Child Neurology. 4 (3): 325–7. doi:10.1111/j.1469-8749.1962.tb03175.x. PMID 13921015. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Acorus Therapeutics, Ltd. (2005). "Mysoline 250 mg Tablets". electronic Medicines Compendium. Datapharm Communications and the Association of the British Pharmaceutical Industry (ABPI). مؤرشف من الأصل في 16 مارس 2008. اطلع عليه بتاريخ 08 مارس 2006. الوسيط
|CitationClass=تم تجاهله (مساعدة) [وصلة مكسورة] - The Pig Site. "Savaging of Piglets". مؤرشف من الأصل في 15 أبريل 2016. اطلع عليه بتاريخ 19 مارس 2007. الوسيط
|CitationClass=تم تجاهله (مساعدة) - 79 21145 00 "Prysoline Tablets" تحقق من قيمة
|مسار أرشيف=(مساعدة). The Israel Drug Registry. The State of Israel. 2005. مؤرشف من الأصل في 02 أكتوبر 2011. اطلع عليه بتاريخ 17 فبراير 2006. الوسيط|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ أرشيف=(مساعدة) - Hart, M. G.; G. Hooper (July 2005). "Clinical associations of Dupuytren's disease". Postgraduate Medical Journal. 81 (957): 425–428. doi:10.1136/pgmj.2004.027425. PMC 1743313. PMID 15998816. مؤرشف من الأصل في 12 نوفمبر 2006. اطلع عليه بتاريخ 07 مارس 2007. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Dupuytren's disease in epilepsy: result of prolonged administration of anticonvulsants". Journal of Neurology, Neurosurgery, and Psychiatry. 39 (5): 498–503. 1976. doi:10.1136/jnnp.39.5.498. PMC 492313. PMID 932769. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Schwaninger, Markus; Ringleb, P; Winter, R; Kohl, B; Fiehn, W; Rieser, PA; Walter-Sack, I (March 1999). "Elevated plasma concentrations of homocysteine in antiepileptic drug treatment" (نسق المستندات المنقولة). Epilepsia. 40 (3): 345–350. doi:10.1111/j.1528-1157.1999.tb00716.x. PMID 10080517. اطلع عليه بتاريخ 16 مارس 2007. الوسيط
|CitationClass=تم تجاهله (مساعدة)[وصلة مكسورة] - Reynolds, Jr., N. C.; Miska, R. M. (April 1981). "Safety of anticonvulsants in hepatic porphyrias". Neurology. 31 (4): 480–4. doi:10.1212/wnl.31.4.480. PMID 7194443. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Comparison and predictors of rash associated with 15 antiepileptic drugs". Neurology. 68 (20): 1701–9. May 15, 2007. doi:10.1212/01.wnl.0000261917.83337.db. PMID 17502552. مؤرشف من الأصل في 9 سبتمبر 2009. اطلع عليه بتاريخ 25 سبتمبر 2007. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Pack, A. M.; M. J. Morrell (2001). "Adverse effects of antiepileptic drugs on bone structure: epidemiology, mechanisms and therapeutic implications". CNS Drugs. 15 (8): 633–42. doi:10.2165/00023210-200115080-00006. PMID 11524035. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Valsamis, Helen A; Surender K Arora; Barbara Labban; Samy I McFarlane (September 6, 2006). "Antiepileptic drugs and bone metabolism". Nutrition & Metabolism. 3 (36): 36. doi:10.1186/1743-7075-3-36. PMC 1586194. PMID 16956398. مؤرشف من الأصل في 25 سبتمبر 2015. اطلع عليه بتاريخ 28 مارس 2007. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Harrington, M. G.; H. M. Hodkinson (July 1987). "Anticonvulsant drugs and bone disease in the elderly". Journal of the Royal Society of Medicine. 80 (7): 425–427. PMC 1290903. PMID 3656313. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Mysoline". RxList. صفحة 3. مؤرشف من الأصل في 10 أكتوبر 2008. اطلع عليه بتاريخ 11 مارس 2007. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Schick, Paul (2005). "Megaloblastic Anemia". eMedicine. مؤرشف من الأصل في 01 ديسمبر 2008. اطلع عليه بتاريخ 15 أغسطس 2005. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ أرشيف=(مساعدة) - Reynolds, E. H.; J. F. Hallpike; B. M. Phillips; D. M. Matthews (September 1965). "Reversible absorptive defects in anticonvulsant megaloblastic anaemia". Journal of Clinical Pathology. 18 (5): 593–598. doi:10.1136/jcp.18.5.593. PMC 473011. PMID 5835440. الوسيط
|CitationClass=تم تجاهله (مساعدة) - O'Brien, M. D.; S. K. Gilmour-White (2005). "Management of epilepsy in women". Postgraduate Medical Journal. 81 (955): 278–285. doi:10.1136/pgmj.2004.030221. PMC 1743264. PMID 15879038. مؤرشف من الأصل في 18 مايو 2008. اطلع عليه بتاريخ 16 سبتمبر 2007. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Hernandez-Diaz S, S; Werler MM; Walker AM; Mitchell AA. (2000). "Folic acid antagonists during pregnancy and the risk of birth defects". New England Journal of Medicine. 343 (22): 1608–14. doi:10.1056/NEJM200011303432204. PMID 11096168. مؤرشف من الأصل في 22 فبراير 2009. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Biale, Y; H. Lewenthal (1984). "Effect of folic acid supplementation on congenital malformations due to anticonvulsive drugs". European Journal of Obstetrics, Gynecology, and Reproductive Biology. 18 (4): 211–6. doi:10.1016/0028-2243(84)90119-9. PMID 6519344. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Bruno, M. K.; C. L. Harden (January 2002). "Epilepsy in Pregnant Women". Current Treatment Options in Neurology. 4 (1): 31–40. doi:10.1007/s11940-002-0003-7. PMID 11734102. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Stores, G. (October 1975). "Behavioural effects of anti-epileptic drugs". Developmental Medicine and Child Neurology. 17 (5): 647–58. doi:10.1111/j.1469-8749.1975.tb03536.x. PMID 241674. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Herranz, J. L.; J. A. Armijo; R. Arteaga (November–December 1988). "Clinical side effects of phenobarbital, primidone, phenytoin, carbamazepine, and valproate during monotherapy in children". Epilepsia. 29 (6): 794–804. doi:10.1111/j.1528-1157.1988.tb04237.x. PMID 3142761. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Sher, A.; J. M. Andersen; S. C. Bhatia (July–August 1983). "Primidone-induced catatonic schizophrenia". Drug Intelligence & Clinical Pharmacy. 17 (7–8): 551–2. PMID 6872851. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Schlienger, Raymond G.; Shear, Neil H. (1998). "Antiepileptic drug hypersensitivity syndrome" (PDF). Epilepsia. 39 (Suppl 7): S3–7. doi:10.1111/j.1528-1157.1998.tb01678.x. PMID 9798755. اطلع عليه بتاريخ 20 يناير 2007. الوسيط
|CitationClass=تم تجاهله (مساعدة)[وصلة مكسورة] - "Primidone-induced hyperammonemic encephalopathy in a patient with cerebral astrocytoma" (PDF). Journal of Clinical Neuroscience. 9 (1): 79–81. 2002. doi:10.1054/jocn.2001.1011. PMID 11749025. مؤرشف من الأصل (PDF) في 21 فبراير 2009. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Langlands, A. O.; N. Maclean; J. G. Pearson; E. R. Williamson (January 28, 1967). "Lymphadenopathy and megaloblastic anaemia in patient receiving primidone". British Medical Journal. 1 (5534): 215–217. doi:10.1136/bmj.1.5534.215. PMC 1840532. PMID 4959849. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Kappy, Michael S.; Jerome Buckley (April 1969). "Primidone intoxication in a child". Archives of Disease in Childhood. 44 (234): 282–4. doi:10.1136/adc.44.234.282. PMC 2020038. PMID 5779436. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Brillman, J.; B. B. Gallagher; R. H. Mattson (March 1974). "Acute primidone intoxication". Archives of Neurology. 30 (3): 255–8. doi:10.1001/archneur.1974.00490330063011. PMID 4812959. الوسيط
|CitationClass=تم تجاهله (مساعدة) - van Heijst, A. N.; W. de Jong; R. Seldenrijk; A. van Dijk (June 1983). "Coma and crystalluria: a massive primidone intoxication treated with haemoperfusion". Journal of Toxicology. Clinical Toxicology. 20 (4): 307–18. doi:10.3109/15563658308990598. PMID 6655772. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Bailey, D. N.; P. I. Jatlow (November 1972). "Chemical analysis of massive crystalluria following primidone overdose". American Journal of Clinical Pathology. 58 (5): 583–9. PMID 4642162. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Turner, C. R. (October 1980). "Primidone intoxication and massive crystalluria". Clinical Pediatrics. 19 (10): 706–7. doi:10.1177/000992288001901015. PMID 7408374. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Dotevall, Gerhard; Birger Herner (August 24, 1957). "Treatment of Acute Primidone Poisoning with Bemegride and Amiphenazole". British Medical Journal. 2 (5042): 451–2. doi:10.1136/bmj.2.5042.451. PMC 1961943. PMID 13446511. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Fazekas, I. Gy.; B. Rengei (January 1960). "Tödliche Vergiftung (Selbstmord) mit Mysoline und Phenobarbiturat" (PDF). Archives of Toxicology (باللغة الألمانية). 18 (4): 213–23. doi:10.1007/BF00577226. PMID 13698457. اطلع عليه بتاريخ 05 نوفمبر 2007. الوسيط
|CitationClass=تم تجاهله (مساعدة)[وصلة مكسورة] - Ajax, E. T. (October 1966). "An unusual case of primidone intoxication". Diseases of the Nervous System. 27 (10): 660–1. PMID 5919666. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Primidone". The Merck Manual's Online Medical Library. Lexi-Comp. مؤرشف من الأصل في 28 أكتوبر 2010. اطلع عليه بتاريخ 04 أكتوبر 2007. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Desta, Zeruesenay; Nadia V. Soukhova; David A. Flockhart (February 2001). "Inhibition of Cytochrome P450 (CYP450) Isoforms by Isoniazid: Potent Inhibition of CYP2C19 and CYP3A". Antimicrobial Agents and Chemotherapy. 45 (2): 382–92. doi:10.1128/AAC.45.2.382-392.2001. PMC 90302. PMID 11158730. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Interactions of clobazam with conventional antiepileptics in children". Journal of Child Neurology. 12 (3): 208–13. 1997. doi:10.1177/088307389701200311. PMID 9130097. مؤرشف من الأصل في 20 فبراير 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Browne, Thomas R.; Robert G. Feldman; Robert A. Buchanan RA; Nancy C. Allen; L. Fawcett-Vickers; GK Szabo; GF Mattson; SE Norman; DJ Greenblatt (April 1983). "Methsuximide for complex partial seizures: efficacy, toxicity, clinical pharmacology, and drug interactions". Neurology. 33 (4): 414–8. doi:10.1212/WNL.33.4.414. PMID 6403891. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Spina, Edoardo; Francesco Pisani; Emilio Perucca (September 1996). "Clinically significant pharmacokinetic drug interactions with carbamazepine. An update". Clinical Pharmacokinetics. 31 (3): 198–214. doi:10.2165/00003088-199631030-00004. PMID 8877250. الوسيط
|CitationClass=تم تجاهله (مساعدة) - GlaxoSmithKline (2005). "LAMICTAL Prescribing Information" (PDF). مؤرشف من الأصل (PDF) في 14 مارس 2014. اطلع عليه بتاريخ 14 مارس 2006. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Spina, Edoardo; Emilio Perucca (February 2002). "Clinical Significance of Pharmacokinetic Interactions Between Antiepileptic and Psychotropic Drugs". Epilepsia. 43 (Suppl 2): 37–44. doi:10.1046/j.1528-1157.2002.043s2037.x. PMID 11903482. اطلع عليه بتاريخ 07 أكتوبر 2007. الوسيط
|CitationClass=تم تجاهله (مساعدة)[وصلة مكسورة] - Perucca, E.; A. Hedges; K. A. Makki; M. Ruprah; J. F. Wilson; A. Richens (1984). "A comparative study of the relative enzyme inducing properties of anticonvulsant drugs in epileptic patients" (PDF). British Journal of Clinical Pharmacology. 18 (3): 401–10. doi:10.1111/j.1365-2125.2004.02311.x. PMC 1463658. PMID 6435654. اطلع عليه بتاريخ 23 مارس 2007. الوسيط
|CitationClass=تم تجاهله (مساعدة)[وصلة مكسورة] - "Loss of therapeutic control in فرط تنسج الكظرية الخلقي due to interaction between dexamethasone and primidone". Acta Paediatrica Scandinavica. 80 (1): 120–4. 1991. doi:10.1111/j.1651-2227.1991.tb11744.x. PMID 2028784. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Anticonvulsant therapy increases fentanyl requirements during anaesthesia for craniotomy". Canadian Journal of Anesthesia. 37 (3): 327–32. 1990. doi:10.1007/BF03005584. PMID 2108815. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Mysoline: Clinical Pharmacology". RxList. مؤرشف من الأصل في 11 أكتوبر 2007. اطلع عليه بتاريخ 07 أكتوبر 2007. الوسيط
|CitationClass=تم تجاهله (مساعدة) - MacDonald, R. L.; K. M. Kelly (1995). "Antiepileptic drug mechanisms of action". Epilepsia. 36 (Suppl 2): S2–12. doi:10.1111/j.1528-1157.1995.tb05996.x. PMID 8784210. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Calzetti, S.; L. J. Findley; F. Pisani; A. Richens (October 1981). "Phenylethylmalonamide in essential tremor. A double-blind controlled study". Journal of Neurology, Neurosurgery, and Psychiatry. 44 (10): 932–934. doi:10.1136/jnnp.44.10.932. PMC 491180. PMID 7031184. مؤرشف من الأصل في 7 أغسطس 2020. اطلع عليه بتاريخ 12 فبراير 2007. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Gatti, G.; M. Furlanut; E. Perrucca (2001-07-01). "Interindividual variability in the metabolism of anti-epileptic drugs and its clinical application". In Gian Maria Pacifici and Olavi Pelkonen (eds.) (المحرر). Interindividual Variability in Human Drug Metabolism. CRC Press. صفحات 168. ISBN 0-7484-0864-9. الوسيط
|CitationClass=تم تجاهله (مساعدة)صيانة CS1: نص إضافي: قائمة المحررون (link) - Nau H; Jesdinsky D; Wittfoht W (1980). "Microassay for primidone and its metabolites phenylethylmalondiamide, phenobarbital and p-hydroxyphenobarbital in human serum, saliva, breast milk and tissues by gas chromatography—mass spectrometry using selected ion monitoring". Journal of Chromatography B. 182 (1): 71–9. doi:10.1016/S0378-4347(00)81652-7. PMID 7380904. مؤرشف من الأصل في 2 يونيو 2020. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Alvin J; Goh E; Bush MT (July 1975). "Study of the hepatic metabolism of primidone by improved methodology". Journal of Pharmacology and Experimental Therapeutics. 194 (1): 117–25. PMID 1151744. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Hooper WD; Treston AM; Jacobsen NW; Dickinson RG; Eadie MJ (November–December 1983). "Identification of p-hydroxyprimidone as a minor metabolite of primidone in rat and man". Drug Metabolism and Disposition. 11 (6): 607–10. PMID 6140148. مؤرشف من الأصل في 26 فبراير 2009. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Lee, Anna M.; Sharon Miksys; Rachel F. Tyndale (July 2006). "Phenobarbital increases monkey in vivo nicotine disposition and induces liver and brain CYP2B6 protein". British Journal of Pharmacology. 148 (6): 786–4. doi:10.1038/sj.bjp.0706787. PMC 1617079. PMID 16751792. مؤرشف من الأصل في 20 فبراير 2009. اطلع عليه بتاريخ 07 أكتوبر 2007. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Effects of Prototypical Microsomal Enzyme Inducers on Cytochrome P450 Expression in Cultured Human Hepatocytes". Drug Metabolism and Disposition. 31 (4): 421–31. April 2003. doi:10.1124/dmd.31.4.421. PMID 12642468. مؤرشف من الأصل في 26 فبراير 2009. اطلع عليه بتاريخ 07 أكتوبر 2007. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Li, Chien-Chun; Chong-Kuei Lii; Kai-Li Liu; Jaw-Ji Yang; Haw-Wen Chen (August 23, 2007). "DHA down-regulates phenobarbital-induced cytochrome P450 2B1 gene expression in rat primary hepatocytes by attenuating CAR translocation". Toxicology and Applied Pharmacology. 225 (3): 329–36. doi:10.1016/j.taap.2007.08.009. PMID 17904175. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Kobayashi, Kaoru; Saeko Yamagami; Tomoaki Higuchi; Masakiyo Hosokawa; Kan Chiba (April 2004). "Key structural features of ligands for activation of human pregnane X receptor". Drug Metabolism and Disposition. 32 (4): 468–72. doi:10.1124/dmd.32.4.468. PMID 15039302. مؤرشف من الأصل في 26 فبراير 2009. اطلع عليه بتاريخ 07 أكتوبر 2007. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Plasma levels of primidone and its metabolite phenobarbital: effect of age and associated therapy". Therapeutic Drug Monitoring. 5 (1): 73–9. 1983. doi:10.1097/00007691-198303000-00006. PMID 6845402. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "The disposition of primidone in elderly patients". British Journal of Clinical Pharmacology. 30 (4): 607–11. 1990. doi:10.1111/j.1365-2125.1990.tb03820.x. PMC 1368252. PMID 2291873. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Morley, D.; N. A. Wynne (January 12, 1957). "Acute Primidone Poisoning in a Child". المجلة الطبية البريطانية. 1 (5010): 90. doi:10.1136/bmj.1.5010.90. PMC 1974075. PMID 13383203. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Loiseau, Pierre Jean-Marie (June 1999). "Clinical Experience with New Antiepileptic Drugs: Antiepileptic Drugs in Europe" (نسق المستندات المنقولة). Epilepsia. 40 (Suppl 6): S3–8. doi:10.1111/j.1528-1157.1999.tb00925.x. PMID 10530675. اطلع عليه بتاريخ 26 مارس 2007. الوسيط
|CitationClass=تم تجاهله (مساعدة)[وصلة مكسورة] - وايث. "Wyeth Timeline". About Wyeth. مؤرشف من الأصل في 07 يناير 2009. اطلع عليه بتاريخ 11 نوفمبر 2007. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Newman, M. J. D.; D. W. Sumner (February 1957). "Megaloblastic anemia following the use of primidone". Blood. 12 (2): 183–8. PMID 13403983. مؤرشف من الأصل (PDF) في 29 سبتمبر 2007. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Kidd, Patrick; David L. Mollin (October 26, 1957). "Megaloblastic Anaemia and Vitamin-B12 Deficiency After Anticonvulsant Therapy". British Medical Journal. 2 (5051): 97–976. doi:10.1136/bmj.2.2689.97. PMC 1962638. PMID 13472024. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Fuld, H.; E. H. Moorhouse (May 5, 1956). "Observations on Megaloblastic Anaemias After Primidone". British Medical Journal. 1 (4974): 1021–3. doi:10.1136/bmj.1.4974.1021. PMC 1979778. PMID 13304415. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Girdwood, R. H.; J. A. R. Lenman (January 21, 1956). "Megaloblastic Anaemia Occurring During Primidone Therapy". British Medical Journal. 1 (4959): 146–7. doi:10.1136/bmj.1.4959.146. PMC 1978898. PMID 13276653. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Meyer, Leo M. (1 January 1947). "Folic Acid In The Treatment Of Pernicious Anemia". Blood. 2 (1): 50–62. PMID 20278334. مؤرشف من الأصل (PDF) في 29 سبتمبر 2007. اطلع عليه بتاريخ 27 أغسطس 2007. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Nelson, Marjorie M.; C. Willet Asling; Herbert M. Evans (1 September 1952). "Production of multiple congenital abnormalities in young by maternal pteroylglutamic acid deficiency during gestation". Journal of Nutrition. 48 (1): 61–79. PMID 13000492. مؤرشف من الأصل (نسق المستندات المنقولة) في 21 فبراير 2009. اطلع عليه بتاريخ 06 يناير 2008. الوسيط
|CitationClass=تم تجاهله (مساعدة) نسخة محفوظة 21 فبراير 2009 على موقع واي باك مشين. - Garland, Hugh (August 1957). "Drugs used in the management of epilepsy". Proceedings of the Royal Society of Medicine. 50 (8): 611–5. PMC 1889058. PMID 13465742. الوسيط
|CitationClass=تم تجاهله (مساعدة) - Schachter, Steven C. (February 2004). "Mysoline". Epilepsy.com. Epilepsy Therapy Development Project. مؤرشف من الأصل في 06 أكتوبر 2008. اطلع عليه بتاريخ 10 يناير 2007. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Valeant Pharmaceuticals International: Products". مؤرشف من الأصل في 01 يونيو 2005. اطلع عليه بتاريخ 03 يوليو 2005. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Service List". مؤرشف من الأصل في 15 مايو 2006. اطلع عليه بتاريخ 13 مارس 2006. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Acorus Therapeutics Ltd. - Ordering - UK". acorus-therapeutics.com. Acorus Therapeutics. مؤرشف من الأصل في 07 أبريل 2005. اطلع عليه بتاريخ 04 يوليو 2005. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "APO-PRIMIDONE". Apotex. 2007-01-10. مؤرشف من الأصل في 06 أكتوبر 2008. اطلع عليه بتاريخ 10 يناير 2007. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Liskantin". Desitin. مؤرشف من الأصل في 04 مارس 2010. اطلع عليه بتاريخ 03 يوليو 2005. الوسيط
|CitationClass=تم تجاهله (مساعدة); تحقق من التاريخ في:|تاريخ أرشيف=(مساعدة) - "Resimatil Tabletten". Deutsche Krankenversicherung AG. مؤرشف من الأصل في 11 مايو 2020. اطلع عليه بتاريخ 03 يوليو 2005. الوسيط
|CitationClass=تم تجاهله (مساعدة) - "Mylepsinum Tabletten". Deutsche Krankenversicherung AG. مؤرشف من الأصل في 26 مايو 2020. اطلع عليه بتاريخ 03 يوليو 2005. الوسيط
|CitationClass=تم تجاهله (مساعدة)
قراءة متعمقة
- "TR-476 Toxicology and Carcinogenesis Studies of Primidone (CAS No. 125-33-7) in F344/N Rats and B6C3F1 Mice (Feed Studies)". Department of Health and Human Services National Toxicology Program. مؤرشف من الأصل في 07 فبراير 2012. اطلع عليه بتاريخ 02 يوليو 2005. الوسيط
|CitationClass=تم تجاهله (مساعدة)
روابط خارجية
قالب:Channel blockers قالب:GABAAR PAMs
- بوابة الكيمياء
- بوابة صيدلة
- بوابة طب
 صور وملفات صوتية من كومنز
صور وملفات صوتية من كومنز
